嵌合抗原受体(CAR)修饰的γδT细胞的制备方法、产品、抗肿瘤药物及其应用与流程
嵌合抗原受体(car)修饰的
γδ
t细胞的制备方法、产品、抗肿瘤药物及其应用
技术领域
1.本发明涉及细胞免疫治疗领域。具体地,本发明涉及基因修饰的过继性免疫细胞的制备方法、产品、抗肿瘤药物及其应用。
背景技术:
2.过继细胞治疗(act)领域发展迅速,针对多种疾病的新疗法不断创新,其里程碑包括对表达工程嵌合抗原受体(car)的t细胞、肿瘤浸润淋巴细胞、骨髓浸润淋巴细胞和体外扩增的nk细胞的治疗。
3.γδt细胞占成人外周血t淋巴细胞的5%左右,是先天免疫和适应性免疫之间的桥梁。γδt细胞在人脐带血(cb)中较少出现,仅占cb t淋巴细胞的1%左右。γδt细胞作为身体的第一道防线之一,它们具有靶向和破坏癌细胞和感染细胞的固有能力。通过感应癌细胞特异性表达的应激信号,γδt细胞可以将癌细胞与健康细胞区分开,从而避免了脱靶毒性。恶性细胞株可以特异性地过度产生一种称为磷酸化抗原的小分子,而γδt细胞可以感应到这种过度生产,而被激活并杀死癌细胞。除了直接杀死癌细胞和感染的细胞外,γδt细胞也可以产生化学介质,以提高局部或全身免疫细胞的功能。
4.与此同时,γδt细胞作为免疫治疗的价值已经在研究中得到了证实,对来自39种不同恶性肿瘤的18,000个个体肿瘤的基因表达进行的分析表明,γδt细胞浸润肿瘤相对于其他免疫细胞浸润肿瘤的患者,预后最好。此外,与常规的癌症疗法(如化疗、放疗)不同,迄今为止,尚没有与γδt细胞疗法相关的严重的不良反应,并且临床结果显示是有希望的。γδt细胞表面受体(γδt tcr)不受组织相容性复合物(mhc)限制,这意味着如果供体的γδt细胞转移到患者身上,患者的身体不会将γδt细胞识别为外来物并且不会引起移植物抗宿主病(gvhd)。这使它们成为同种异体疗法的理想选择——可以从健康的捐赠者中采集,扩展到非常高的数量,储存和冷冻,为制造多种产品提供易于获得的起始材料。
5.将car的靶向能力和γδtcr的选择性组合为car
‑
γδt细胞,具有以下优点:a.细胞杀伤的效力是相加的,因此天然的γδt细胞杀伤能力显著增强;b.没有附带损伤或过度刺激并且通过使用天然t细胞信号传导途径,发生与细胞因子释放相关的严重副作用的可能性降低;c.如果保留健康细胞,那么与常规car
‑
t相比,在实际car
‑
t治疗之前和之后的治疗负担可以显著降低,例如,健康b细胞可以与cd19靶向的car
‑
t共存;d.由于可以耐受在健康细胞上的表达,因此可以极大地扩展靶抗原的选择;e.由于先天性杀伤,抗原逃逸发生概率较低,并且可以通过与靶向单克隆抗体组合来对抗,以影响adcc介导的靶细胞杀伤。
6.虽然γδt细胞具有的天然优势使其成为car
‑
t优良的载体,但由于细胞含量低、体外大规模扩增技术难、转染率低等限制使其很难实现产业化。
技术实现要素:
7.本发明提供了一种重组car基因,所述重组car基因依次包含u6启动子、靶向β2m的
shrna的编码基因、car基因。
8.可选地,靶向β2m的shrna的编码基因序列如seq id no.1
‑
8中任意一种所示。例如,靶向β2m的shrna的编码基因序列如seq id no.9中第252
‑
310位所示。
9.可选地,u6启动子的核苷酸序列如seq id no.9中第1
‑
249位所示。
10.可选地,所述car基因依次包含mnd启动子、信号肽编码基因、抗原结合结构域、铰链区及跨膜区的编码基因、共刺激信号转导结构域的编码基因、初级信号传导结构域的编码基因、连接序列的编码基因、安全开关的编码基因、wpre。
11.可选地,抗原结合结构域包括针对cd19的单链抗体。例如,针对cd19的单链抗体的编码基因序列如seq id no.9中第791
‑
1525位所示。
12.可选地,共刺激信号转导结构域选自以下共刺激分子的胞内信号传导结构域:cd3ζ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b、cd66d、cd2、cd4、cd5、cd28、cd134、cd137、icos、cd154、4
‑
1bb、ox40。例如,共刺激信号转导结构域是4
‑
1bb的胞内信号传导结构域;可选地,4
‑
1bb的胞内信号传导结构域的核苷酸序列如seq id no.9中第1736
‑
1861位所示。
13.进一步,初级信号传导结构域可包含信号转导基序,其已知是基于免疫受体酪氨酸的激活基序(itam),具有itam的初级信号传导结构域的实例包括具有衍生自以下分子的胞内信号传导结构域:cd3ζ、fcrγ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b和cd66d。
14.可选地,初级信号传导结构域是cd3ζ的胞内信号传导结构域。例如,cd3ζ的胞内信号传导结构域的核苷酸序列如seq id no.9中第1862
‑
2191位所示。
15.进一步,信号肽可为集落刺激因子信号肽。可选地,信号肽编码基因的核苷酸序列如seq id no.9中第725
‑
790位所示。
16.进一步,铰链区及跨膜区可选自以下分子的铰链区及跨膜区:cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd134、cd137、icos和cd154。可选地,所述铰链区及跨膜区是cd8a的铰链区及跨膜区。例如,cd8a的铰链区及跨膜区的核苷酸序列如seq id no.9中第1526
‑
1735位所示。
17.可选地,连接序列是t2a。例如,t2a的核苷酸序列如seq id no.9中第2207
‑
2260位所示。
18.可选地,安全开关包括自杀基因tegfr、icas
‑
9、cd20。例如,tegfr的核苷酸序列如seq id no.9中第2261
‑
3334位所示。
19.可选地,mnd启动子的核苷酸序列如seq id no.9中第311
‑
710位所示。
20.可选地,所述car基因的核苷酸序列如seq id no.9中第725位
‑
3334位所示。
21.可选地,所述重组car编码基因的核苷酸序列如seq id no.9所示。
22.本发明还提供了与前述的重组car基因相关的生物材料,所述生物材料为下述a1)
‑
a6)中的任一种:
23.a1)含有权利要求1所述的重组car基因的重组载体;a2)含有权利要求1所述的重组car基因的重组微生物;a3)由a1)所述重组载体制备的重组微生物;a4)含有a1)所述重组载体的重组微生物;a5)含有权利要求1所述的重组car基因的重组细胞;a6)含有a1)所述重组载体的重组细胞。
24.所述重组载体可包括病毒载体、非病毒载体。可用于本发明的病毒载体包括逆转录病毒载体(包括致癌逆转录病毒载体、慢病毒载体和假型载体)、腺病毒载体、腺相关病毒
(aav)载体、猿猴病毒载体、痘苗病毒载体或仙台病毒载体、epstein
‑
barr病毒(ebv)载体和hsv载体。作为病毒载体,优选使用缺乏复制能力因而无法在感染细胞中自我复制的病毒载体。在本发明的具体实施方式中,所述病毒载体是慢病毒载体。可选地,所述慢病毒载体包括plenti的载体。
25.所述重组微生物可为重组慢病毒。
26.所述重组细胞可为重组t细胞(即car
‑
t细胞),例如,重组γδt细胞、重组αβt细胞。可选地,所述重组细胞低表达hla
‑
a、hla
‑
b、hla
‑
c。
27.本发明还提供了前述的生物材料的构建方法,其包括:将前述的重组car基因导入出发生物材料,所述出发生物材料为载体、微生物或细胞。
28.所述出发生物材料为载体,所述构建方法可包括如下步骤:将上述的重组car基因克隆到载体中,获得重组载体。可选地,所述构建方法包括如下步骤:1)合成所述重组car基因;2)将所述重组car基因克隆到载体的多克隆位点的限制性内切酶的识别位点间,获得重组载体。
29.所述出发生物材料为微生物,所述构建方法可包括如下步骤:将所述重组car基因或前述的重组载体导入微生物,获得重组微生物。可选地,所述构建方法包括如下步骤:1)合成所述重组car基因;2)将所述重组car基因克隆到载体的多克隆位点的限制性内切酶的识别位点间,获得重组载体;3)将所述重组载体导入微生物中,获得重组微生物。
30.所述出发生物材料为细胞,所述构建方法可包括如下步骤:将所述重组car基因,或前述的重组载体,或前述的重组微生物导入或感染细胞,获得重组细胞。可选地,所述构建方法包括如下步骤:1)合成所述重组car基因;2)将所述重组car基因克隆到载体的多克隆位点的限制性内切酶的识别位点间,获得重组载体;3)将所述重组载体导入微生物中,获得重组微生物;4)将所述重组微生物感染细胞获得重组细胞。
31.本发明所使用的细胞(即出发生物材料)可以是来自哺乳动物的细胞(例如人细胞)或来自非人哺乳动物(例如猴、小鼠、大鼠、猪、马或狗)的细胞。用于本发明方法的细胞不受具体限制,任何细胞都可使用。例如,可使用采集、分离、纯化或诱导自体液、组织或器官例如血(外周血、脐带血等)或骨髓的细胞。可使用外周血单核细胞(pbmc)、免疫细胞(树突细胞、b细胞、造血干细胞、巨噬细胞、单核细胞、nk细胞或造血细胞(嗜中性粒细胞、嗜碱性粒细胞))、脐带血单核细胞、成纤维细胞、脂肪细胞前体、肝细胞、皮肤角质细胞、间充质干细胞、脂肪干细胞、多种癌细胞株或神经干细胞。在本发明中,尤其是,使用t细胞、t细胞的前体细胞(造血干细胞、淋巴细胞前体细胞等)或含有它们的细胞群是优选的。t细胞的实例包括cd8阳性t细胞、cd4阳性t细胞、调节性t细胞、细胞毒性t细胞和肿瘤浸润的淋巴细胞。含t细胞和t细胞前体细胞的细胞群包括pbmc。上述细胞可采集自活体,经采集自活体的细胞培养物扩繁而获得,或建立为细胞株。
32.在本发明的具体实施方式中,所述使用的细胞包括t细胞,例如γδt细胞、αβt细胞。
33.可选地,上述构建方法中使用的细胞是γδt细胞,γδt细胞的培养方法如下:1)从脐带血或外周血获得γδt细胞;2)采用活化培养基培养γδt细胞,所述活化培养基包括基础培养基、ok432、ifn
‑
γ、il
‑
2、il
‑
15、il
‑
21、10%自体血浆;3)采用扩增培养基培养经活化培养基培养的γδt细胞,所述扩增培养基包括所述基础培养基、il
‑
2、5%自体血浆。可选
地,所述基础培养基选自aly、kbm581和x
‑
vivo中的一种或多种。
34.可选地,γδt细胞的培养方法如下:1)采用活化培养基在培养板上培养所述γδt细胞,所述活化培养基包括基础培养基、ok432、ifn
‑
γ、il
‑
2、il
‑
15、il
‑
21、10%自体血浆,例如培养5
‑
6天;2)采用扩增培养基培养经活化培养基培养的γδt细胞,所述扩增培养基包括所述基础培养基、il
‑
2、5%自体血浆。
35.可选地,所述基础培养基选自aly、kbm581和x
‑
vivo中的一种或多种。
36.ok432在所述活化培养基中的含量可为80
‑
120ng/ml(如100ng/m1),ifn
‑
γ在所述活化培养基中的含量可为800
‑
1200iu/ml(如1000iu/ml),il
‑
2在所述活化培养基中的含量可为500
‑
1500iu/ml(如1000iu/ml),il
‑
15在所述活化培养基中的含量可为80
‑
120ng/ml(如100ng/ml),il
‑
21在所述活化培养基中的含量可为80
‑
120ng/ml(如100ng/ml),自体血浆(灭活)在所述活化培养基中的含量可为10体积%。
37.上述步骤1)和/或步骤2)的培养可为在培养板上培养所述γδt细胞,所述培养板包被抗γδtcr抗体。所述抗γδtcr抗体具体可为biolegend的purified anti
‑
human g/d tcr,货号为331204。
38.il
‑
2在所述扩增培养基中的含量可为1000iu/ml。自体血浆(灭活)在所述扩增培养基中的含量可为5体积%。
39.可选地,上述相关生物材料的构建方法包括通过慢病毒转染将重组car基因导入γδt细胞,其步骤包括:将pbmc和/或cbmc中获取到的γδt细胞采用活化培养基在培养板上培养6天;将所述活化培养基更换为转染培养基并加入慢病毒培养1天;再将所述转染培养基更换为扩增培养基培养,获得所述表达car的重组t细胞。或者,所述通过慢病毒转染将重组car基因导入t细胞也可包括:将pbmc和/或cbmc中获取到的γδt细胞采用活化培养基在培养板上培养6天;将所述活化培养基更换为所述扩增培养基培养1
‑
2天;再将所述扩增培养基更换为转染培养基并加入慢病毒培养1天;最后将所述转染培养基更换为扩增培养基培养,获得所述表达car的重组t细胞。
40.本发明还提供了一种药物,所述药物包括前述的重组car基因、前述的相关生物材料,或前述的γδt细胞。
41.本发明的所述药物还可包括冻存试剂serum
‑
free freezing medium,货号为05
‑
065
‑
1b,厂家为biological industries。
42.本发明还提供了前述的重组car基因、前述的相关生物材料或前述的γδt细胞在制备抗肿瘤或治疗自身免疫性疾病或抗免疫排斥的药物中的应用。
43.前述的γδt细胞可具有nk细胞的天然杀伤能力。
44.进一步,本发明的肿瘤包括非实体瘤、实体瘤。非实体瘤可包括血液学肿瘤,例如白血病和淋巴瘤。血液学肿瘤包括血液或骨髓的癌症。血液学(或血原性)癌症的例子包括白血病,包括急性白血病(诸如急性淋巴细胞白血病、急性髓细胞白血病、急性骨髓性白血病和成髓细胞性、前髓细胞性、粒
‑
单核细胞型、单核细胞性和红白血病)、慢性白血病(诸如慢性髓细胞(粒细胞性)白血病、慢性骨髓性白血病和慢性淋巴细胞白血病)、真性红细胞增多症、淋巴瘤、霍奇金氏疾病、非霍奇金氏淋巴瘤(无痛和高等级形式)、多发性骨髓瘤、瓦尔登斯特伦氏巨球蛋白血症、重链疾病、骨髓增生异常综合征、多毛细胞白血病和脊髓发育不良。
no.1
‑
8中任意一种。
53.可选地,根据上述的制备方法,所述重组car基因的核苷酸序列如seq id no.9所示。
54.上文中,所述t细胞可为γδt细胞或αβt细胞。
55.所述γδt细胞可按照包括如下步骤的方法制备:
56.(1)采用活化培养基在培养板上培养所述γδt细胞,所述活化培养基包括基础培养基、ok432、ifn
‑
γ、il
‑
2、il.15、il
‑
21、10%自体血浆,例如培养5
‑
6天;
57.(2)采用扩增培养基培养经活化培养基培养的γδt细胞,所述扩增培养基包括所述基础培养基、il
‑
2、5%自体血浆;
58.所述基础培养基选自aly、kbm581和x
‑
vivo中的一种或多种。
59.上述步骤(1)和/或步骤(2)的培养可为在培养板上培养所述γδt细胞,所述培养板包被抗γδtcr抗体。所述抗γδtcr抗体具体可为biolegend的purified anti
‑
human g/d tcr,货号为331204。
60.所述活化培养基可由基础培养基、ok432、ifn
‑
γ、il
‑
2、il
‑
15、il
‑
21、10%自体血浆(灭活)组成。ok432在所述活化培养基中的含量可为80
‑
120ng/ml(如100ng/m1),ifn
‑
γ在所述活化培养基中的含量可为800
‑
1200iu/ml(如1000iu/ml),il
‑
2在所述活化培养基中的含量可为500
‑
1500iu/ml(如1000iu/ml),il
‑
15在所述活化培养基中的含量可为80
‑
120ng/ml(如100ng/ml),il
‑
21在所述活化培养基中的含量可为80
‑
120ng/ml(如100ng/ml),自体血浆(灭活)在所述活化培养基中的含量可为10体积%。
61.扩增培养基可由基础培养基、il
‑
2、5%自体血浆组成。il
‑
2在所述扩增培养基中的含量可为1000iu/ml,自体血浆(灭活)在所述扩增培养基中的含量可为5体积%。
62.上述γδt细胞可来源于脐带血或外周血。
63.在一些实施例中,通过慢病毒转染将重组car基因导入t细胞。该慢病毒具体可为下述实施例中所制备的u6
‑
sr1
‑
mnd1904、u6
‑
sr2
‑
mnd1904、u6
‑
sr3
‑
mnd1904、u6
‑
sr4
‑
mnd1904、u6
‑
sr5
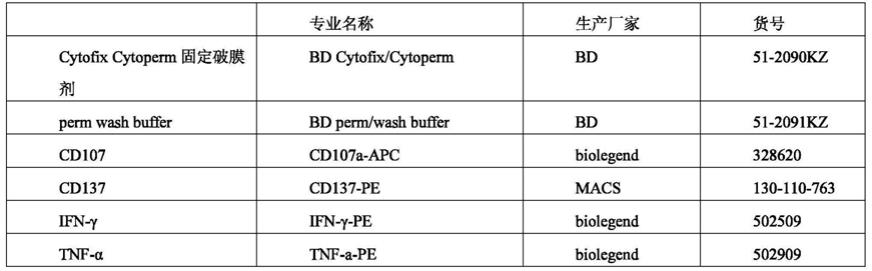
‑
mnd1904、u6
‑
sr6
‑
mnd1904、u6
‑
sr7
‑
mnd1904、u6
‑
sr8
‑
mnd1904中的任意一种。
64.例如,所述通过慢病毒转染将重组car基因导入t细胞包括:将pbmc和/或cbmc中获取到的γδt细胞采用活化培养基在培养板上培养6天;将所述活化培养基更换为转染培养基并加入慢病毒培养1天;再将所述转染培养基更换为扩增培养基培养,获得所述表达car的重组t细胞。或者,所述通过慢病毒转染将重组car基因导入t细胞也可包括:将pbmc和/或cbmc中获取到的γδt细胞采用活化培养基在培养板上培养6天;将所述活化培养基更换为所述扩增培养基培养1
‑
2天;再将所述扩增培养基更换为转染培养基并加入慢病毒培养1天;最后将所述转染培养基更换为扩增培养基培养,获得所述表达car的重组t细胞。
65.本发明还提供了一种产品,所述产品为上述的重组car基因或含有所述重组car基因的生物材料。所述生物材料为含有所述重组car基因的重组载体、含有所述重组car基因的重组微生物或含有所述重组car基因的重组细胞。
66.上文中,所述重组载体可为慢病毒表达载体,例如下述实施例制备的u6
‑
sr1
‑
mnd1904质粒、u6
‑
sr2
‑
mnd1904质粒、u6
‑
sr3
‑
mnd1904质粒、u6
‑
sr4
‑
mnd1904质粒、u6
‑
sr5
‑
mnd1904质粒、u6
‑
sr6
‑
mnd1904质粒、u6
‑
sr7
‑
mnd1904质粒以及u6
‑
sr8
‑
mnd1904质粒。
67.上文中,所述重组微生物可为重组慢病毒,所述重组慢病毒包括上述的重组car基因转录出的rna。
68.上文中,所述重组细胞可为重组t细胞。例如,所述重组细胞为采用上述car
‑
t细胞的制备方法制备的重组t细胞。
69.本发明还提供了一种抗肿瘤药物,包括上述制备方法制备的car
‑
t细胞或上述本发明所保护的产品或上述的γδt细胞。
70.该抗肿瘤药物还可包括冻存试剂serum
‑
free freezing medium,货号为05
‑
065
‑
1b,厂家为biological industries。
71.上述制备方法制备的car
‑
t细胞、上述的产品、上述的γδt细胞在制备抗肿瘤药物中的应用也属于本发明的保护范围之内。
72.上文中,肿瘤可选自淋巴细胞肿瘤、慢性髓原白血病和急性淋巴细胞白血病中的一种或多种。
73.上文中,γδt细胞可具有nk细胞的天然杀伤能力。
74.本发明提供的car
‑
t细胞的制备方法制备的car
‑
t细胞表达靶向于人β
‑
2m基因的shrna,使hla
‑
a,b,c在car
‑
t细胞表面的表达水平降低,能有效减弱宿主免疫系统对car
‑
t细胞的免疫排异,从而延长car
‑
t细胞在宿主体内的存活时间。
75.本发明的一些实施例通过抗体包被和细胞因子联合刺激脐带血中较为年轻化的γδt细胞,选择合适的转染时机,实现慢病毒的高效转染,完成car
‑
γδt细胞的产业化生产。
附图说明
76.图1为实施例1的单位数量pbmc/cbmc中获得γδt细胞的数量。
77.图2为实施例1的pbmc和cbmc中γδt细胞比例对比。
78.图3为实施例2的采用培养条件一培养pbmc和cbmc来源的γδt细胞扩增倍数对比。
79.图4a为实施例2的培养基优化中对照组的实验结果。
80.图4b为实施例2的培养基优化中优化组的实验结果。
81.图5为实施例3的采用优化条件培养γδt细胞扩增倍数对比。
82.图6为实施例3的采用优化条件培养γδt细胞扩增数量对比。
83.图7为实施例3的采用优化条件培养γδt细胞亚型检测。
84.图8为实施例3的γδt终产品流式检测图。
85.图9为实施例3的γδt终产品gd+αβ
‑
所占比例统计。
86.图10为实施例4的转染时间优化实验结果图。
87.图11为实施例5的慢病毒具体结构示意图。
88.图12为实施例5的srb2m
‑
1至srb2m
‑
8 hlamfi值下调水平对比图。
89.图13为实施例6的三种启动子在αβt和γδt细胞的转染率。
90.图14为实施例7的pbmc和cbmc来源的γδt细胞转染率对比。
91.图15为实施例7的cbmc来源的γδt转染率统计。
92.图16为实施例8的效靶比3∶1的流式图。
93.图17为实施例8的体外杀伤能力检测。
94.图18为实施例8的胞内染色检测生物活性。
95.图19为实施例8的胞外细胞因子分泌检测。
96.图20为实施例9的冻存试剂筛选实验结果。
97.图21为实施例9的不同来源γδt细胞冻存实验结果。
98.图22为实施例9的复苏的ugd19细胞体外杀伤检测结果。
99.图23为实施例9的冻存前后,各亚型所占比例变化情况。
100.图24为实施例9的冻存前后,各亚型细胞转染率变化情况。
101.图25为实施例10的动物实验流程图。
102.图26为实施例10的小鼠体重变化。
103.图27为实施例10的小鼠体内肿瘤负荷变化情况。
104.图28为实施例10的小鼠生存曲线分析。
105.图29为实施例11的γδt细胞对k562和k562
‑
cd19细胞杀伤流式图。
106.图30为实施例11的γδt细胞对k562和k562
‑
cd19细胞体外杀伤能力检测。
107.图31为实施例所使用的试剂来源。
108.如无特别说明,图中*表示p<0.05,**表示p<0.01,***表示p小于0.001。
具体实施方式
109.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
110.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。采用:graphpad prism8统计软件对数据进行处理,采用t test检验。
111.下述实施例中使用的k562
‑
cd19制备流程如下:
112.1.通过提取人pbmc细胞rna,反转录获得cdna,通过pcr获得cd19全长序列(genbank id:nm_001178098)
113.2.将cd19全长序列连接入载体plv
‑
puro(本实验保存),获得重组质粒cd19
‑
puro;
114.3.经过慢病毒包装,获得cd19
‑
puro慢病毒;
115.4.将该病毒转染k562细胞(购买于南京科佰生物科技有限公司),通过嘌呤霉素(puro)筛选,并通过流式验证,最终获得cd19100%阳性的k562细胞系,命名为k562
‑
cd19。
116.下述实施例中所使用的的αβt通过如下方法制备:
117.αβt细胞的获得:
118.将血液与淋巴细胞分离液按照2∶1比例加入,2000rpm(相当于872g),升7降4,20℃,离心20min。离心结束后将单核细胞层转移至新的50ml离心管中。加入pbs缓冲液定容至50ml,混匀后2000rpm,升9降9,4℃离心10min。加入pbs缓冲液定容至50ml,2000rpm,升9降9,4℃离心5min。每1
×
10
7 pbmc加入20ulcd3微磁珠(mcas),混匀后放入4℃冰箱避光孵育15分钟。孵育完成后每1
×
107pbmc加入1~2ml pbs缓冲液,2000rpm,升9降9,4℃离心5min。离心结束后按1
×
108pbmc加入500μl缓冲液,吹吸混匀细胞沉淀层。用磁力柱将阳性细胞冲
洗至15ml离心管中,得到cd3+t细胞,即为αβt细胞。
119.αβt细胞的接种:
120.将装有阳性细胞的离心管上下颠倒、混匀后移入台式低速冷冻离心机2000rpm,升9降9,20℃离心5min。离心结束后将上清液弃掉,并先用2ml完全培养基冲悬混匀。然后按照阳性细胞与活化磁珠1∶1的比例加入cd3/cd28活化磁珠,然后按照5
×
105个/孔铺24孔板,每孔500μl体积。
121.下述实施例中流式检测所采用的抗体具体如下。
122.检测γδt细胞:一抗bi;二抗cd3
‑
apc、tcrαβpe
‑
cy7、7aad、sa
‑
pe;
123.检测γδt细胞亚型:cd3
‑
apc
‑
cy7、tcrαβpe
‑
cy7、7aad、vδ1
‑
fitc、vδ2
‑
pe;
124.检测慢病毒对γδt细胞的转染率:cd3
‑
apc
‑
cy7、tcrαβpe
‑
cy7、egfr
‑
apc、7aad、vδ1
‑
fitc、vδ2
‑
pe;
125.检测慢病毒对αβt细胞的转染率:cd3
‑
apc
‑
cy7、cd4
‑
fitc、cd8
‑
pb、7aad、egfr
‑
apc;
126.检测β
‑
2m基因的敲低效率:cd3
‑
fitc、cd4
‑
pe
‑
cy7、hla
‑
abc
‑
pe、egfr
‑
apc、7aad。
127.实施例1.γδt的获得
128.(1)获得自体血浆并灭活
129.获得15位健康人(供者)的外周血和脐带血,将血液带入无菌离心管,升9降7,750g离心15min。收集上层血浆于50ml离心管中,56℃孵育30min,4℃放置30min,1000g离心10min,收集上清4℃留存备用。
130.(2)分离脐带血单个核细胞(cbmc)或外周血单个核细胞(pbmc)
131.将步骤(1)离心后的血细胞沉淀用等体积的生理盐水重悬混匀以获得稀释血,将稀释血缓缓加入到淋巴细胞分离液的上层,稀释血和淋巴细胞分离液体积比为2∶1。然后升6降4,2000rpm离心20min,收集白膜层细胞,即为cbmc或pbmc。
132.(3)γδt的分选
133.采用miltenyi biotec的tcrg/d+t cell isolation kit进行γδt分选,具体分选方法如下。
134.a.配置0.5%hsa缓冲液,配方为12.5mlhsa+48.75mldpbs;
135.b.将步骤(2)获得的cbmc或pbmc 2000r/min,离心5min,弃上清,加入80ul/1
×
1070.5%hsa缓冲液重悬cbmc或pbmc;加入20ul/1
×
10
7 biotin
‑
antibody cocktail,混匀,4℃孵育10min,每5min摇匀一次;加入1
‑
2ml/1
×
1070.5%hsa缓冲液清洗细胞,2000r/min,离心5min,弃上清;加入80ul/1
×
1070.5%hsa缓冲液重悬细胞后,加入20ul/1
×
107anti
‑
biotinmicrobeads,混匀后,4℃孵育15min,每5min摇匀一次;加入1
‑
2ml/1
×
1070.5%hsa缓冲液清洗细胞,2000r/min,离心5min,弃上清;细胞数量低于1
×
108加入500ul0.5%hsa缓冲液,数量高于1
×
108,按比例增加0.5%hsa缓冲液,重悬细胞以获得细胞悬液。
136.c.准备磁力分选柱,用3ml 0.5%hsa缓冲液润洗柱子2次,加入500ul步骤b的细胞悬液分选细胞,再加入3ml 0.5%hsa缓冲液清洗柱子,分选阴性细胞即为γδt细胞。
137.d.将步骤c获得的γδt细胞混匀,取样进行台盼蓝染色计数,取2
×
105个来源于cbmc或pbmc的γδt细胞进行流式检测,剩余细胞进行培养。
138.(4)γδt的流式检测
139.染色步骤:取待测细胞于1.5ml ep管中,加入1ml清洗缓冲液(配方:98%pbs+2%fbs)清洗细胞,2000rpm离心3.5min,弃上清;加入一抗,4℃孵育10min;再次加入清洗缓冲液清洗细胞;加入二抗,4℃孵育10min;再次加入清洗缓冲液清洗细胞,弃上清后加入200ul清洗缓冲液重悬细胞,上机检测。
140.流式检测γδt细胞数量时重复7次,流式检测γδt细胞比例时重复15次,数据处理采用平均值
±
标准差。
141.结果如图1所示,单位数量(1
×
107个)pbmc和cbmc中分别得到2.24
×
105个和1.4
×
105个γδt细胞,外周血可获得的γδt细胞数量明显高于脐带血。
142.流式检测pbmc和cbmc中γδt细胞比例,结果统计如图2所示,pbmc和cbmc中γδt细胞比例分别为3.91%和0.75%,外周血中γδt细胞比例明显高于脐带血。
143.实施例2.γδt细胞的高效培养
144.一、培养条件构建
145.(1)抗体包被:
146.二抗包被;anti
‑
mouse lgg工作浓度为10ug/ml,96孔板每孔100ul抗体稀释液,37℃孵育1h,弃掉二抗,加入dpbs清洗96孔板。
147.一抗包被:purified anti
‑
human g/d tcr(bi)工作浓度为100ng/ml,96孔板每孔100ul抗体稀释液,室温孵育1h,弃掉一抗,加入200ul/孔dpbs浸泡96孔板备用。
148.(2)培养基配置:
149.培养条件一:aly/x
‑
vivo/kbm581+5%habs+il
‑
2(200iu/ml)+il
‑
21(30ng/ml)
150.培养条件二:
151.活化培养基(slam):aly/kbm581/x
‑
vivo+ok432(100ng/ml)+ifn
‑
γ(1000iu/ml)+il
‑
2(1000iu/ml)+il
‑
15(100ng/ml)+il
‑
21(100ng/ml)+10%自体血浆(灭活)(即实施例1(1)中制备的上清灭活)
152.扩增培养基(slem):aly/kbm581/x
‑
vivo+il
‑
2(1000iu/ml)+5%自体血浆(灭活)(即实施例1(1)中制备的上清灭活)
153.培养前6天使用活化培养基,第7天以后全部使用扩增培养基。
154.二、bi优化
155.分为两个处理组,对照组(bi
‑
)和实验组(bi+)。
156.对照组、实验组分别为将分选得到的γδt细胞按照1.5
×
105个/200μl/孔接种于96孔板中。在上述培养条件一(aly+5%habs+200iu/ml il
‑
2+il
‑
21(30ng/ml))的培养基,37℃5%co2培养箱中培养,分别培养外周血和脐带血来源的γδt细胞,培养至细胞生长后期,对细胞扩增倍数对比。对照组和实验组的不同之处仅在于对照组γδt细胞接种于空白96孔板,而实验组γδt细胞接种于上述包被好的96孔板。
157.在培养过程中,将细胞混合均匀,取样,经台盼蓝染色,进行计数以计算细胞扩增倍数。
158.结果如图3所示,在培养条件一,基础培养基为aly时,无bi包被,pbmc和cbmc来源的γδt细胞扩增倍数分别为4.4倍、5.97倍;有bi包被时,pbmc和cbmc来源的γδt细胞扩增倍数分别为42倍、81倍。由结果可见,bi抗体包被可提高γδt细胞扩增效率。同时,在bi包被,培养基相同时,cbmc来源的γδt细胞扩增效率明显高于pbmc来源的γδt细胞。
159.三、培养基优化
160.将分选得到脐带血来源的的γδt细胞按照1.5
×
105个/200μl/孔接种于上述包被好的96孔板中。在上述培养条件一或上述培养条件二下,37℃5%co2培养箱中培养,培养至细胞生长后期,对细胞扩增倍数进行对比。
161.以上述培养条件一为对照组,以上述培养条件二为优化组,其中对照组、优化组分别使用aly、x
‑
vivo、kbm581为基础培养基。
162.在培养过程中,将细胞混合均匀,取样,经台盼蓝染色,进行计数以计算细胞扩增倍数。
163.对照组的扩增情况如图4a所示,结果显示:培养基中只添加il
‑
2、il
‑
21和5%habs时,基础培养基为aly、x
‑‑
vivo、kbm581时,在d20(培养20天)时扩增倍数最多,分别为:81.74、102倍、257.6倍。优化组的扩增情况如图4b所示,来源于脐带血的γδt细胞,经固相包被的抗γδtcr抗体(bi)和slam培养基活化;培养到7天后更换为slem培养基,传入g
‑
rex 100m
‑
cs全封闭式细胞培养瓶,可以使γδt细胞的体外持续扩增时间显著延长,培养24天细胞平均扩增倍数可达2307.4倍,优化组细胞扩增范围为2178.4
‑
2530.9倍。上述结果说明ok432(100ng/ml)+ifn
‑
γ(1000iu/ml)+il15(100ng/ml)具有促进细胞扩增的作用。
164.实施例3.采用优化条件培养γδt细胞
165.根据实施例1的方法,分别从1
×
108个pbmc和cbmc中获取γδt细胞,采用实施例2“三、培养基优化”的方法进行培养检测,其中采用最优培养条件为:活化培养基(slam)由kbm581、ok432、ifn
‑
γ、il
‑
2、il
‑
15、il
‑
21、10%自体血浆(灭活)组成。ok432在所述活化培养基中的含量为100ng/ml,ifn
‑
γ在所述活化培养基中的含量为1000iu/ml,il
‑
2在所述活化培养基中的含量为1000iu/ml,il
‑
15在所述活化培养基中的含量为100ng/ml,il
‑
21在所述活化培养基中的含量为100ng/ml,自体血浆(灭活)在所述活化培养基中的含量为10体积%。扩增培养基(slem)由kbm581、il
‑
2、5%自体血浆组成。il
‑
2在所述扩增培养基中的含量为1000iu/ml,自体血浆(灭活)在所述扩增培养基中的含量为5体积%。
166.扩增情况结果如图5所示,pbmc来源的γδt细胞,培养至d14扩增倍数达到峰值为350倍;cbmc来源的γδt细胞,培养至d24扩增倍数达到峰值为2543倍。因此在相同的培养条件下,脐带血来源的γδt细胞扩增能力更强。细胞数量结果如图6所示,外周血来源的γδt细胞(1
×
108个pbmc)最多可获得7.7
×
108个γδt细胞,脐带血来源的γδt细胞(1
×
108个cbmc)最多可获得3.5
×
109个γδt细胞,数量显著高于外周血。
167.在上述培养条件下,分别在培养初期d0,中期d11和培养后期d24,检测脐带血来源的γδt细胞亚型的变化情况。同时,检测培养至14天的外周血来源的γδt细胞亚型。检测方法为流式检测,具体方法与实施例1所述方法相同。
168.结果如图7所示。图7左侧为脐带血来源的脐带血来源的γδt细胞亚型的变化情况,γδt细胞在培养后期主要为vδ1细胞,约占60%。图7右侧为外周血来源的γδt细胞亚型,外周血来源的γδt细胞在培养后期主要为vδ2细胞,约占70%以上。v52细胞可提高γδt的肿瘤浸润能力,但是造血干细胞移植(hsct)与供体来源的v51细胞频率增加相关,在非v52细胞在肿瘤免疫治疗方面的作用迄今还没有明确,因此对脐带血来源的γδt细胞的研究更有意义。
169.在细胞培养后期,αβ阳性细胞的污染是造成gvhd的罪魁祸首,因此对上述扩增的
多个不同供者的脐带血来源的γδt细胞进行流式检测,代表性流式图如图8所示,培养后期细胞中cd3+细胞所占比例为99.3%,cd3+细胞中γδt细胞的比例高达99.8%。细胞纯度达99%以上,数据统计如图9所示。培养后期,细胞纯度均值达99.64%(范围:99.10%
‑
99.92%)(图9),可充分保证引起gvhd的αβ阳性细胞的污染控制在极低水平(<0.1%)。
170.实施例4.γδt细胞转染时间的优化
171.一、慢病毒制备
172.慢病毒plv_m1904是河北森朗生物利用贴壁四质粒系统生产的,具体的制备方法可参照发明专利申请《一种慢病毒转导滴度的测定方法》(专利号:cn201910987462.x)公布文本(cn110669871a)说明书0038段
‑
0050段。
173.二、转染时间优化
174.分别收集培养5、6、7、8、9天的γδt细胞,γδt细胞的获得如同实施例1,细胞的培养如同实施例3。更换为转染培养基(kbm581+200iu/ml il
‑
2);按照1
×
106个/ml的浓度接种细胞,加入助转染试剂pge2,使用浓度1μm,按照moi=50的用量加入慢病毒plv
‑
m1904,32℃2000rpm离心2h;次日,将培养基更换为实施例3所述扩增培养基;转染后第四天进行采样流式检测转染率。
175.实验重复次数为3,数据处理为平均值
±
标准差。
176.结果如图10所示,γδt细胞分别在培养的d5、d6、d7、d8、d9进行转染,其平均转染率分别为5.1%、34.2%、27.87%、22.03%、9.4%,故d6为γδt细胞转染的最适时间。
177.实施例5.重组car基因的优化—plv_m1904结构优化
178.一、慢病毒构建
179.本实施例构建的重组car基因的结构如图11所示,由u6启动子、β2m shrna的编码基因、mnd启动子、leader(集落刺激因子信号肽的编码基因)、vl19
‑
1inker
‑
vl19(抗cd19的单链抗体的编码基因,简称scfv(cd19)的编码基因)
‑
hingecd8tm(cd8a铰链区及跨膜区的编码基因)、4
‑
1bb的编码基因、cd3ζ的编码基因、t2a的编码基因和tegfr的编码基因、wpre连接而成。wpre表示土拨鼠肝炎病毒转录后调控元件,它可增强mrna转录的稳定性,提高载体的表达,提高慢病毒的转导效率。重组car基因中,除了u6启动子和β2m shrna的编码基因外的结构是car基因。该car基因编码的蛋白质是seq id no.9第725位
‑
3334位编码的蛋白质。其中,u6启动子为β2m shrna的启动子,β2m shrna为靶向于人β
‑
2m基因的shrna结构(srb2m);mnd启动子用于启动下游基因转录,抗cd19单链抗体为主要的功能元件,用于抗原抗体结合;cd8a铰链区及跨膜区用于内外信号的连接,将scfv上连接的信号传递到胞内产生活化信号;4
‑
1bb和cd3ζ主要用于t细胞的活化;t2a用于连接上游和下游的序列,tegfr是检测的标签。srb2m1
‑
8编码基因为备选shrna序列,分别用于构建慢病毒。再将构建的慢病毒转染至αβt细胞。本实施例提供了8种β2m shrna的编码基因,其名称分别为srb2m
‑
1、srb2m
‑
2、srb2m
‑
3、srb2m
‑
4、srb2m
‑
5、srb2m
‑
6、srb2m
‑
7、srb2m
‑
8。
180.β2m shrna编码基因的核苷酸序列具体如下:
181.srb2m
‑
1:5
′
‑
ctggtctttctatctcttgtactcgagtacaagagatagaaagaccag
‑3′
(seq id no.1),
182.srb2m
‑
2:5
′
‑
aggtttgaagatgccgcatttctcgagaaatgcggcatcttcaaacct
‑3′
(seq id no.2),
183.srb2m
‑
3:5
′
‑
ttcaatctcttgcactcaaagctcgagctttgagtgcaagagattgaa
‑3′
(seq id no.3),
184.srb2m
‑
4:5
′
‑
ttcagcaaggactggtctttcctcgaggaaagaccagtccttgctgaa
‑3′
(seq id no.4),
185.srb2m
‑
5:5
′
‑
agttaagcgtgcataagttaactcgagttaacttatgcacgcttaac
‑3′
(seq id no.5),
186.srb2m
‑
6:5
′
‑
tccgacattgaagttgacttactcgagtaagtcaacttcaatgtcgga
‑3′
(seq id no.6),
187.srb2m
‑
7:5
′
‑
ccgtgtgaaccatgtgacttrctcgagaaagtcacatggttcacacgg
‑3′
(seq id no.7),
188.srb2m
‑
8:5
′
‑
cagcagagaatggaaagtcaactcgagttgactftccattctctgctg
‑3′
(seq id no.8)。
189.慢病毒构建方法具体如下:
190.1、细胞铺板:
191.a.将含有10%胎牛血清的dmem、pbs及trypletm express放于37℃5%co2的细胞培养箱中预热30min。
192.b.将已长到80%
‑
90%的293ft,用pbs清洗细胞一次,每个t175的细胞培养瓶中加入2mltrypletm express,让其充分平铺于细胞表面,盖好瓶盖,将其放在显微镜下观察,直至细胞变圆,加入4ml含有10%胎牛血清的dmem培养基终止消化,用移液管将瓶壁细胞吹下,将细胞液转移至15ml无菌离心管中,1500rpm离心5min,弃上清,重悬细胞并计数。
193.c.293ft细胞以9
×
106个/145mm平皿接种,每个145mm平皿加20mldmem完全培养基,摇晃均匀,放置37℃5%co2的细胞培养箱中继续培养。
194.2、质粒包装:铺板第二天进行质粒包装。
195.a.将buffer、四种质粒pmd2.g、pmdlg/prre、prsv/rev、目的质粒恢复室温。其中,pmd2.g、pmdlg/prre、prsv/rev三种辅助质粒从武汉淼灵公司购买。目的质粒是按照如下方法构建得到的:以表达srb2m
‑
8的目的质粒为例,将seq id no.9的序列用基因合成的方式依次拼接后,克隆到plenfi的载体(addgene)的多克隆位点的限制性内切酶cla i和spe i的识别位点间,即得u6
‑
sr8
‑
mnd1904质粒。seq id no.9中,第1
‑
249位是u6启动子的核苷酸序列,第252
‑
310位是srb2m
‑
8编码基因的核苷酸序列,第311
‑
710位是mnd启动子的核苷酸序列,第711
‑
718位为限制性内切酶pac i的识别位点序列,第719
‑
724位为kozak序列,,第725
‑
790位是集落刺激因子信号肽序列,第791
‑
1525位是抗cd19的单链抗体(anti
‑
cd19vh
‑
linker
‑
anti
‑
cd19vl)的核苷酸序列,第1526
‑
1735位是cd8a铰链区及跨膜区的核苷酸序列,第1736
‑
1861位是4
‑
1bb的核苷酸序列,第1862
‑
2191位是cd3ζ的核苷酸序列,第2207
‑
2260位是t2a的核苷酸序列,第2261
‑
3334位是tegfr的核苷酸序列。u6
‑
sr1
‑
mnd1904质粒、u6
‑
sr2
‑
mnd1904质粒、u6
‑
sr3
‑
mnd1904质粒、u6
‑
sr4
‑
mnd1904质粒、u6
‑
sr5
‑
mnd1904质粒、u6
‑
sr6
‑
mnd1904质粒以及u6
‑
sr7
‑
mnd1904质粒是分别将seq id no.9中的srb2m
‑
8编码基因序列替换为srb2m
‑1‑
7编码基因序列所制备的目的质粒。
196.b.按每个145mm平皿1.25mlbuffer、3.75μg pmd2.g、15μg pmdlg/prre、3.75μg prsv/rev、15μg目的质粒的量将以上溶液混合均匀。向混合液中加入62.5
μl/145mm平皿,再次混合均匀,室温静置10min。
197.c.将用于包装质粒的293ft细胞从37℃5%℃o2的细胞培养箱中取出,将上述混合液平均分配到145mm平皿的培养基中,轻轻摇匀,放入37℃5%co2培养箱中。
198.3、换液
199.包装4h后,弃旧培养基,加入5ml已预热的pbs清洗细胞,再加入20ml新鲜的已预热的含10%胎牛血清的dmem培养基,放入37℃5%co2培养箱中。
200.4、收集病毒
201.包装后48h
‑
72h收取病毒原液。将原液收集到50ml离心管中,18300g离心2h,用dmem基础培养基重悬病毒沉淀。
202.将病毒悬液进行分装,
‑
80℃冰箱保存。分别制备出慢病毒u6
‑
sr1
‑
mnd1904(表达srb2m
‑
1)、u6
‑
sr2
‑
mnd1904(表达srb2m
‑
2)、u6
‑
sr3
‑
mnd1904(表达srb2m
‑
3)、u6
‑
sr4
‑
mnd1904(表达srb2m
‑
4)、u6
‑
sr5
‑
mnd1904(表达srb2m
‑
5)、u6
‑
sr6
‑
mnd1904(表达srb2m
‑
6)、u6
‑
sr7
‑
mnd1904(表达srb2m
‑
7)、u6
‑
sr8
‑
mnd1904(表达srb2m
‑
8)。
203.二、慢病毒转染
204.1、配制培养基
205.配制感染培养基:texmacs+200iu/ml il
‑
2+1μm pge2。
206.配制完全培养基:texmacs+200iu/ml il
‑
2。
207.2、收集生长状态良好的αβt细胞并计数。
208.3、αβt细胞按照5
×
105个/孔的细胞量,接种24孔细胞培养板,采用完全培养基培养48h。
209.4、更换为感染培养基,选择上述制备的慢病毒u6
‑
sr1
‑
mnd1904、u6
‑
sr2
‑
mnd1904、u6
‑
sr3
‑
mnd1904、u6
‑
sr4
‑
mnd1904、u6
‑
sr5
‑
mnd1904、u6
‑
sr6
‑
mnd1904、u6
‑
sr7
‑
mnd1904、u6
‑
sr8
‑
mnd1904,以moi=2的量分别加入已铺好的24孔中。
210.5、提前预热离心机至32℃,将24孔板放入离心机,2000rpm(相当于872g)离心2h,离心结束后,放入37℃5%co2培养箱中培养。
211.6、培养24h后,每孔补加步骤1配制的完全培养基500μl,37℃5%co2培养箱中继续培养。
212.7、再培养48h,然后取样,检测β
‑
2m基因的敲低效率和慢病毒转染率。
213.β
‑
2m基因的敲低效率通过pe anti
‑
humanhla
‑
a,b,c单抗染色的方法进行鉴定,car阳性细胞中细胞会表达hla抗原,会使car阳性的平均荧光强度(mfi)值下降,计算公式为:hla下调幅度(%)=(car阴性的mfi值
‑
car阳性的(mfi)值)/car阴性的mfi值。
214.鉴定结果如图12所示,其中,srb2m
‑
1、srb2m
‑
2、srb2m
‑
3、srb2m
‑
4、srb2m
‑
5、srb2m
‑
6、srb2m
‑
7、srb2m
‑
8分别表示上述被慢病毒u6
‑
sr1
‑
mnd1904、u6
‑
sr2
‑
mnd1904、u6
‑
sr3
‑
mnd1904、u6
‑
sr4
‑
mnd1904、u6
‑
sr5
‑
mnd1904、u6
‑
sr6
‑
mnd1904、u6
‑
sr7
‑
mnd1904、u6
‑
sr8
‑
mnd1904转染的αβt细胞。图12中,srb2m
‑
1、srb2m
‑
2、srb2m
‑
3、srb2m
‑
4、srb2m
‑
5、srb2m
‑
6、srb2m
‑
7、srb2m
‑
8 hla的mfi下调幅度依次为40.89%、42.43%、29.96%、0.00%、27.87%、13.02%、0.00%、56.50%。其中0.00%表示没有hla下调作用。srb2m
‑
8(sr8)是从众多shrna序列中筛选到的敲低效率最高的序列,具体为使用u6
‑
sr8
‑
mnd1904转染的αβt细胞转染率(即cd19scfv阳性细胞所占总细胞的比例)达82.4%,car阳性的(mfi)值为1614,
car阴性的mfi值为3708,hla的mfi下调幅度达到56.5%。hla
‑
a,b,c在细胞表面的表达水平降低能有效减弱宿主免疫系统对car
‑
t细胞的免疫排异,从而延长car
‑
t细胞在宿主体内的存活时间。
215.实施例6.验证u6
‑
sr8
‑
mnd1904结构的优越性
216.分别将以ef1α、mnd和u6
‑
mnd为启动子的cd19car转染αβt和γδt细胞。ef1α为启动子的cd19car(ef1α)是河北森朗生物利用贴壁四质粒系统生产的,具体的制备方法可参照发明专利《一种慢病毒转导滴度的测定方法》(专利号:cn201910987462.x)公布文本(cn110669871a)说明书0038段
‑
0050段,其中,不同之处仅在于将目的质粒plv_m1904中的mnd启动子替换为ef1α启动子。mnd为启动子的cd19car(mnd)为实施例4的慢病毒plv_m1904。u6
‑
mnd为启动子的cd19car(u6
‑
mnd)为实施例5制备的慢病毒u6
‑
sr8
‑
mnd1904。γδt细胞的转染材料及方法与实施例4相同,转染时间为培养第6天;αβt细胞的转染材料及方法与实施例5相同。
217.采用流式检测慢病毒转染率。试验结果如图13所示,图13中(a)为car
‑
γδt(慢病毒转染γδt细胞),图13中(b)为car
‑
t(慢病毒转染αβt细胞),以ef1α、mnd和u6
‑
mnd为启动子的cd19car在γδt上的转染率范围依次为5%
‑
10%、30%
‑
40%和50
‑
60%;同样的,三种启动子的cd19car在αβt细胞上的转染率范围依次为10%
‑
20%、60%
‑
70%和85
‑
100%。因此,无论在αβt还是γδt细胞上,在提高转染率方面均为u6
‑
mnd>mnd>ef1α。
218.实施例7.不同来源的γδt细胞的转染率比较
219.脐带血(cb)和外周血(pb)来源的γδt细胞,均来源于健康供者,制备方法与实施例1相同,培养方式与实施例3相同。
220.慢病毒为实施例5所构建的慢病毒u6
‑
sr8
‑
mnd1904,将慢病毒u6
‑
sr8
‑
mnd1904分别转染脐带血来源的γδt细胞和外周血(pb)来源的γδt细胞,转染材料、方法与实施例4相同,转染时间为培养第6天。
221.采用流式检测转染率。实验结果如图14和图15,脐带血来源的γδt细胞平均转染率达到58.7%,转染率范围为43.6%
‑
67.3%,显著高于pb来源的γδt。因此无论是免疫幼稚性、扩增倍数还是转染难易,脐带血均优于外周血。
222.实施例8.senl_ugd19细胞的杀伤活性检测
223.为了检测senl_ugd19细胞(即用实施例5所构建的慢病毒u6
‑
sr8
‑
mnd1904转染的γδt细胞,制备方法与实施例7相同,采用cb来源的γδt细胞制备,下述简称ugd19细胞)对cd19阳性肿瘤细胞系的杀伤能力,senl_ugd19细胞和未转染的γδt细胞(cb来源的γδt细胞)作为效应细胞,用cd19+肿瘤细胞系nalm6作为靶细胞,在不同效靶比下(e∶t=i∶1、3∶1、10∶1)进行混合,共孵育。
224.1.采用annexin
‑
v和7
‑
aad进行标记,流式细胞术检测细胞杀伤比例。
225.具体方法如下。
226.(1)靶细胞的cfse染色
227.a.收集对数生长期的靶细胞,2000rpm离心5min,dpbs重悬计数,按照2
×
106个细胞对应100ul 2μm cfse工作液的比例加入适量的2μm cfse工作液,轻轻搅拌混匀,在37℃下避光孵育20min。
228.b.孵育结束后,在15ml离心管中原体积基础上加入5倍体积(可大于5倍)的完全培
养基(含10%fbs的1640)终止染色。
229.c.2000rpm,升9降9,20℃,离心5min,弃去上清,下层细胞用2ml预热后的完全培养基重悬,在37℃避光孵育10min。
230.d.孵育结束后,2000rpm,升9降9,20℃,离心5min,弃去上清,下层细胞用2ml预热的完全培养基清洗2次。
231.e.清洗后,弃去上清,下层细胞用合适的完全培养基制成细胞悬液。取50μl的细胞悬液在流式细胞仪488nm激发光下检测染色情况。
232.(2)效应细胞与靶细胞混合培养
233.a.染色成功后,调整靶细胞数量1
×
106个/ml进行相关实验,加入96孔板中,每孔100μl,孔密度为1
×
105个/孔。
234.b.收集效应细胞计数,调整细胞密度为1
×
107个/ml,按照设定的效靶比1∶1、3∶1、10∶1计算出所需的细胞数,依次加入效应细胞悬液10ul、30ul、100ul,补加1640空白培养基至每孔终体积为200μl,加入已含有靶细胞的96孔板中,37℃细胞培养箱中孵育4h,取样进行流式检测。
235.c.向待测细胞中加入适量冷的cell staining buffer,2000rpm,离心4min,离心结束后弃掉上清液,重复此步骤。
236.d.用100μl1
×
binding buffer重悬细胞,加入2μl annexinvapc,2μl 7aad,涡旋混匀,室温(25℃)避光孵育15min。
237.e.孵育结束后加100μl 1
×
binding buffer,涡旋混匀,上机检测。
238.(3)流式检测
239.a.画出cfse标记的靶细胞,该细胞表达7aad+annexin v apc+、7aad+annexin vapc
‑
、7aad
‑
annexin vapc+的细胞比例即为杀伤率。
240.结果表明(图16和图17),在效靶比为1∶1时,senl_ugd19细胞杀伤率为80%,在效靶比为3∶1或10∶1时,senl_ugd19细胞杀伤效率可达90%以上。senl_ugd19细胞均对cd19抗原阳性的肿瘤细胞具有高效特异杀伤。
241.2.采用胞内染色检测senl_ugd19细胞的生物活性
242.所使用试剂具体如下
[0243][0244]
具体方法如下。
[0245]
收集共培养4h后的效靶细胞(效靶比为3∶1),离心弃上清,进行胞膜染色;离心清洗,弃上清,向洗净的细胞中加入250ul cytofix cytoperm固定破膜剂,4度避光孵育20min;取出后,加入1ml perm wash buffer(保持细胞透化),离心,500g,5min;离心,弃上
清,向管中分别加入胞内抗体(cd107、cd137、ifn
‑
γ、tnf
‑
α),混合于perm wash buffer中,最终体积100ul,将其混匀置于4度,避光孵育30min;取出后,加入1ml perm wash buffer(保持细胞透化),离心,500g,5min。弃掉上清液,加入200ul perm wash buffer,流式仪检测。
[0246]
应用数据处理软件legendplex,对检测结果进行处理,计算出各细胞因子的浓度。
[0247]
结果显示(图18)senl_ugd19细胞具有更高的生物学活性。与相同的靶细胞混合,senl_ugd19细胞内的活化指标(cd107a、cd137、ifn
‑
γ、tnf
‑
α)表达水平均较空白γδt有所提高,因此,senl_ugd19细胞具有更高的生物学活性。
[0248]
3.胞外细胞因子分泌检测
[0249]
取senl_ugd19细胞和γδt细胞与nalm6靶细胞按照效靶比3∶1进行细胞混合,共同孵育18小时的上清检测ifn
‑
γ和tnf
‑
α的分泌。
[0250]
检测试剂盒名称:legendplex
tm human inflammation panel 1(13
‑
plex)货号:cat.no.740118生产厂家:biolegend,供应商:惠友生物科技有限公司
[0251]
具体方法如下。
[0252]
a.准备工作:取50μl样品上清与50μl assay buffer混匀稀释一倍;matrix b准备:向lyophilized matrix b中加入5ml assay buffer,吹打溶解后室温静置15min,分装后于
‑
80℃保存,避免反复冻融;
[0253]
b.检测流程
[0254]
将所需试剂室温平衡30min按标准品及待测样编号标记1.5ml离心管;添加25μl matrix b至标准品检测管;添加25μl assay buffer至样品检测管;按编号添加25μl梯度稀释的标准品至对应的标准品检测管;添加25μl稀释样本至对应的样品检测管;添加25μl微珠混合液至各检测管;添加25μl检测抗体至各检测管;400rpm室温避光振荡孵育2h;孵育结束,直接添加25μl sa
‑
pe至各检测管,400rpm室温避光振荡孵育30min;孵育结束,1000g离心5min,弃上清;加入200μl1
×
wash buffer洗涤一次,1000g离心5min,弃上清;加入200μl 1
×
wash buffer重悬微珠;
[0255]
c.流式细胞仪检测。
[0256]
结果显示(图19)senl_ugd19细胞具有更高的生物学活性。senl_ugd19组和γδt组ifn
‑
γ的平均分泌量分别为467.8pg/ml和214.81pg/mi;tnf
‑
α的平均分泌量分别为21.83pg/ml和10.85pg/ml,由此可见,senl_ugd19组ifn
‑
γ和tnf
‑
α的分泌量均比γδt组高。
[0257]
实施例9.细胞冻存
[0258]
本实施例采用5种冻存液进行细胞冻存,从中筛选最有利于senl_ugd19细胞高效复苏的处方工艺。
[0259]
一、冻存试剂筛选
[0260]
1、冻存步骤:收集待冻存细胞(即实施例8所制备的senl_ugd19细胞),使用冻存液重悬细胞,重悬浓度为1
×
107个/ml,冻存体积1ml/管,放入冻存盒中,放入
‑
80℃冰箱过夜,次日转移至液氮中。
[0261]
2、冻存试剂:
[0262]
cs10货号:17195,全称cryostor;
[0263]
cs货号:c40010,全称cellsaving;
[0264]
bi货号:05
‑
065
‑
1b,商品名:semm
‑
free freezing medium,厂家全称:biological industries,简写bi;
[0265]
cb
‑
1:自配,配方为:5%habs+9%dmso+完全培养基
[0266]
(参照文献:ex vivo expanded patient
‑
derivedγδt
‑
cell immunotherapy enhances neuroblastoma tumor regression in a murine model)
[0267]
cb
‑
2:自配,配方为:31.25%转化糖电解质+20%25%人血白蛋白+31.25%生理盐水+10%右旋糖酐+7.5%dmso
[0268]
3、复苏步骤:
[0269]
冻存一周后,从液氮中取出冻存细胞,37℃水浴锅中快速融化,将细胞转移至已37℃预热30min的培养基中,取样台盼蓝染色计数和流式检测。
[0270]
结果显示(图20),五种冻存液cs10、cs、bi、cb
‑
1、cb
‑
2的细胞得率分别为80.44%、76.24%、95.81%、56.64%、81.45%;细胞活率分别为:86.00%、80.78%、94.42%、82.93%、71.38%;细胞制剂复苏后检测,采用bi冻存液的细胞制剂的细胞活率和得率均在90%以上。由此,bi冻存液为senl_ugd19细胞的最优冻存液。
[0271]
二、不同来源γδt细胞冻存
[0272]
使用上述最优冻存液bi分别冻存pbmc和cbmc来源的γst细胞,具体冻存步骤以及复苏步骤如“一、冻存试剂筛选”所述。
[0273]
结果如图21所示,经bi冻存液冻存解冻后,pbmc来源的γδt细胞平均活率仅为21.33%,cbmc来源的γδt细胞为91.67%,pbmc来源的γδt细胞很难实现冻存。
[0274]
综上所述,无论是细胞幼稚性、细胞扩增能力、亚型功能、转染率还是冻存,脐带血相比于外周血具有无可比拟的优越性,故选择脐带血作为γδt细胞的最适来源。
[0275]
三、复苏的senl_ugd19细胞体外杀伤检测
[0276]
采用“一、冻存液筛选”所复苏的senl_ugd19细胞(冻存试剂为bi)和“二、不同来源γδt细胞冻存”所复苏的cbmc来源的γδt细胞进行杀伤活性检测,检测方法具体与实施例8“1.采用annexin
‑
v和7
‑
aad进行标记,流式细胞术检测细胞杀伤比例”中的检测方法相同。
[0277]
结果显示(图22),在效靶比为3∶1时,复苏的senl_ugd19细胞对cd19抗原阳性的naml6的杀伤率为93.5%;在效靶比为10∶1时,杀伤率高达96.5%。冻存一周后复苏的senl_ugd19细胞对cd19抗原阳性的nalm6细胞仍然具有高效特异杀伤,同新鲜制剂一样,在效靶比为3∶1时杀伤效率可达90%以上。
[0278]
四、冻存前后senl_ugd19细胞亚型及各亚型转染率
[0279]
检测了冻存前后senl_ugd19细胞各亚型所占比例以及各亚型转染率,亚型检测方法具体和实施例3相同,转染方法及检测方法具体和实施例7相同。
[0280]
实验结果如图23和图24,ugd19细胞各亚型vδ1+、vδ2+、vδ1
‑
vδ2
‑
在冻存前(新鲜细胞)所占比例分别为61.63%、8.11%、29.13%,复苏后(复苏细胞)所占比例分别为59.07%、7.85%、32.47%;各亚型vδ1+、vδ2+、vδ1
‑
vδ2
‑
在冻存前(新鲜细胞)转染率分别为:57.43%、39.57%、53.43%;复苏后(复苏细胞)各亚型转染率依次为:54.93%、40.10%、51.63%;冻存前总的转染率为56.1%,复苏后总的转染率为53.4%。结果表明,冻存对ugd19细胞各亚型所占比例以及各亚型转染率没有明显影响。
[0281]
实施例10.senl_ugd19在淋巴瘤小鼠模型中的作用
[0282]
采用15只约5
‑
6周龄的ncg小鼠进行,所有动物尾静脉注射5
×
105raji
‑
luc cells/只建立b淋巴细胞肿瘤动物模型,于3天后分组进行尾静脉注射给药,剂量组分为senl_ugd19组、γδt组和溶媒组(每组5只小鼠),分别给予senl_ugd19细胞(1
×
107个/只)、未转染的cbmc来源γδt细胞(1
×
107个/只)和溶媒生理盐水+1%hsa(200μl/只)。如图25所示,所有动物分别给予三次实验药物,分别于d3、d15和d22给药。试验期间,根据设定观察周期,通过活体成像法,观察肿瘤细胞在小鼠体内的含量及分布情况。此外,观察动物临床症状、体重,并记录试验过程中动物的死亡情况。
[0283]
分别在分组后d0(即图25中的day3)、d4、d7、d10、d14、d17、d21、d24进行小鼠体重观察,结果发现senl_ugd19组与γδt组和溶媒组在体重上均无明显差异,如图26。分别在分组后d0、d4、d10、d14、d17、d24,通过活体成像法,观察小鼠体内肿瘤细胞的含量。结果显示(图27),d24时检测,senl_ugd19组和γδt组小鼠体内raji
‑
luc细胞荧光强度值分别为16800
±
4810 p/s/cm2/sr和36700
±
4890 p/s/cm2/sr,senl_ugd19组小鼠体内肿瘤负荷显著低于γδt组,ugd19可有效杀死小鼠体内肿瘤细胞,并且显著延长小鼠生存时间(图28),其中各剂量组中位存活期(ms)分别为:γδt组:21天;senl_ugd19组:>33天;溶媒组:18天。
[0284]
实施例11.γδt细胞的天然nk杀伤能力
[0285]
未转染的γδt细胞(cb来源的γδt细胞)作为效应细胞,用k562细胞或k562
‑
cd19细胞作为靶细胞,在不同效靶比下(e:t=1∶1、3∶1、10∶1)进行混合,共孵育。
[0286]
具体检测方法与实施例8的“1.采用annexin
‑
v和7
‑
aad进行标记,流式细胞术检测细胞杀伤比例。”相同。
[0287]
结果如图29和图30,在效靶比为3∶1时,γδt细胞对k562细胞具有94.45%的天然杀伤;在效靶比为10∶1时,γδt细胞对k562
‑
cd19细胞具有92.57%的天然杀伤。γδt与nk细胞类似,均属于天然免疫系统。作为身体的第一道防线,它们具有识别和破坏肿瘤细胞的固有能力,故γδt具有部分nk的天然杀伤能力。
[0288]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本申请欲包括任何变更、用途或对本发明的改进,包括脱离了本申请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1