一种犊牛瘤胃上皮细胞分离培养的方法
1.本发明属于细胞分离培养技术领域,具体涉及一种犊牛瘤胃上皮细胞分离培养的方法。
背景技术:
2.随着现代生物技术的发展,动物细胞体外培养方法在动物生命研究领域起着举足轻重的作用。动物细胞培养与在体动物试验相比具有成本小、条件易控制、影响因素少、易操作等优点,且动物细胞培养是在人工条件下进行,便于调控和观察,是现今研究动物的物质代谢过程以及遗传物质的表达调控等领域既便利又有效的新方法,现已成为研究动物生命规律的重要研究手段。
3.瘤胃是反刍动物特有的消化器官,其中生长着大量微生物,能有效的降解消化粗纤维含量高的粗饲料。瘤胃功能的健康与否直接关系着反刍动物能否健康成长以及有较好的生产性能。反刍动物采食的饲料在瘤胃微生物的作用下消化降解为挥发性脂肪酸,挥发性脂肪酸为反刍动物提供80%以上的能量,瘤胃产生的挥发性脂肪酸通过瘤胃上皮细胞转运、吸收和代谢供机体使用,因此深入了解瘤胃上皮结构和功能有助于增强饲料在瘤胃内的利用率和提高反刍动物的生产性能。瘤胃上皮细胞体外培养,可对细胞的增殖特性、胃肠功能、营养物质的吸收转运及机制等进行研究。现有培养瘤胃的方法通常是采用胰蛋白酶和edta消化瘤胃上皮组织,然后采用青链霉素、庆大霉素、链霉素或两性霉素等去除贴附瘤胃的微生物并使用dmem完全培养基进行培养,该方法虽然能在一定程度上培养瘤胃上皮细胞,但获取的瘤胃上皮细胞的活性较差,含有一定比例的成纤维细胞瘤胃上皮,且经冻存复苏后使用活性较差。此外,现有的瘤胃上皮细胞培养时间普遍在细胞3
‑
6d开始贴壁,8
‑
10d才能完成铺层,说明细胞发育比较缓慢。
4.目前瘤胃上皮细胞的体外培养技术并不成熟,普遍存在瘤胃上皮细胞活性较差,贴壁时间长,生长较慢且易污染和出现较多成纤维细胞的问题。所以改进和优化瘤胃上皮细胞体外培养条件和方法有助于深入了解瘤胃上皮细胞的功能及营养物质在瘤胃上皮中的代谢。
技术实现要素:
5.有鉴于此,本发明旨在提供一种犊牛瘤胃上皮细胞分离培养的方法以解决上述问题。该方法可以获得纯度高、活性强和生长快的瘤胃上皮细胞。本发明的技术方案为:一种犊牛瘤胃上皮细胞分离培养的方法,包括以下步骤:(1)选取瘤胃腹囊处瘤胃组织,采用温度为4
‑
8℃的灭菌水清洗;(2)将瘤胃上皮组织剥离后依次采用灭菌水、pbs溶液一和pbs溶液二清洗,清洗后剪碎并采用消化液多次消化;(3)将消化后的瘤胃上皮组织过滤并离心、洗涤,得到瘤胃上皮细胞团;(4)将瘤胃上皮细胞团采用完全培养基培养。
6.进一步地,所述pbs溶液一ph值为7.4,含有终浓度为0.1mol/l的磷酸二氢钾和0.1mol/l的磷酸氢二钠。
7.进一步地,所述pbs溶液二含有体积浓度为2%的青霉素
‑
链霉素
‑
两性霉素b混合液(100
×
三抗)(即含2%abam(v/v)的pbs溶液),所述青霉素
‑
链霉素
‑
两性霉素b混合液(100
×
三抗)中青霉素含量10ku/ml,链霉素含量10 mg/ml, 两性霉素b含量25 μg/ml。
8.进一步地,所述消化液按照终浓度的组成为:胰蛋白酶 2.5~5%(w/v),cacl
2 1.08 mm,hepes25mm,abam 2%(v/v),溶剂为krebs
‑
ringer缓冲液。
9.进一步地,所述将瘤胃上皮细胞团采用完全培养基培养的控制参数为:于37℃、含5%co2、95%湿度条件下培养4~5天,期间每隔1~3d更换一次完全培养基继续培养,待完成85%以上细胞铺层后即得。
10.进一步地,所述完全培养基为mem基础培养基。
11.与现有技术相比,本发明可以获得包括以下技术效果:本发明改进和优化了瘤胃上皮细胞分离培养技术,通过此方法可以获得纯度高、活力强、生长快的瘤胃上皮细胞,还可以有效降低瘤胃上皮细胞体外培养污染的可能性,并能培养时间缩短为2
‑
3d开始贴壁,4
‑
5d完成铺层,普遍在4天左右完成。
附图说明
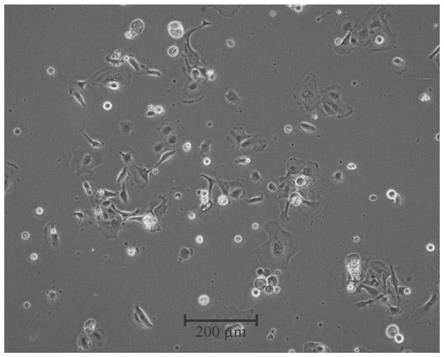
12.此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:图1为本发明实施例1分离方法培养24h的犊牛瘤胃上皮细胞状态图。
13.图2为本发明实施例1分离方法培养48h的犊牛瘤胃上皮细胞状态图。
14.图3为本发明实施例1分离方法培养72h后的犊牛瘤胃上皮细胞状态图。
15.图4为本发明实施例1分离方法培养96h后的犊牛瘤胃上皮细胞状态图。
16.图5为本发明实施例2分离方法培养96 h后的犊牛瘤胃上皮细胞状态图。
17.图6为本发明实施例3中实施例1的犊牛瘤胃上皮细胞传代3次后的细胞状态图。
18.图7为本发明实施例3中实施例1的犊牛瘤胃上皮细胞冻存
‑
复苏12h后的细胞状态图。
19.图8为本发明实施例3中实施例1的犊牛瘤胃上皮细胞冻存
‑
复苏24h后的细胞状态图。
20.图9为本发明实施例3中实施例1的犊牛瘤胃上皮细胞冻存
‑
复苏48h后的细胞状态图。
21.图10为本发明实施例1 分离培养的犊牛瘤胃上皮细胞经冻存和复苏后生长曲线。
具体实施方式
22.在本发明的描述中,需要说明的是,实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
23.下面结合附图和具体的实施例对本发明做进一步详细说明,所述是对本发明的解释而不是限定。
24.实施例1本实施例提供一种犊牛瘤胃上皮细胞分离培养的方法,包括以下步骤:(1)犊牛屠宰后剖腹选取瘤胃腹囊处瘤胃组织,使用冷藏灭菌水冲洗瘤胃内容物和瘤胃组织后,将获取的瘤胃组织浸泡在冷藏的pbs溶液中带回实验室;(2)使用钝性器具将瘤胃上皮层从肌肉层中剥离,并使用灭菌水冲洗获取的瘤胃上皮层;(3)将获取的瘤胃上皮层在灭菌水和灭菌的pbs溶液一中依次涮洗,反复3次;(4)涮洗后的瘤胃上皮组织用含2%abam的pbs溶液二漂洗,漂洗后剪碎使用消化液多次消化组织至变白变黏;(5)消化后组织过滤离心获取降解的瘤胃上皮细胞团;(6)悬浮收集瘤胃上皮细胞团转移至mem基础培养基的培养瓶中进行贴壁培养;(7)细胞贴壁培养24h后更换培养液,然后每隔2d更换培养液继续培养细胞铺层,待完成85%以上铺层后收取培养的瘤胃上皮细胞或用于传代。
25.步骤(1)所述的pbs溶液一ph值为7.4,含有终浓度为0.1mol/l的磷酸二氢钾和0.1mol/l的磷酸氢二钠。
26.步骤(2)使用的钝性器械需要灭菌并要将黏附的浆膜层和肌肉层分离干净。
27.步骤(3)使用的灭菌水和pbs需要每次更换不能重复使用。
28.步骤(4)使用的pbs溶液二为含体积浓度为2%的青霉素
‑
链霉素
‑
两性霉素b混合液(100
×
三抗)的pbs溶液,青霉素
‑
链霉素
‑
两性霉素b混合液(100
×
三抗)中青霉素含量10ku/ml,链霉素含量10 mg/ml, 两性霉素b含量25 μg/ml。该溶液用pbs配制,在此细胞培养液中使用的青霉素工作浓度为100u/ml,链霉素工作浓度为0.1mg/ml,两性霉素b工作浓度为0.25μg/ml。
29.步骤(4)中剪碎组织大小建议为<1 cm2的组织小块。剪碎的瘤胃上皮组织小块使用的消化液按照终浓度的组成为:2.5%(w/v)胰蛋白酶+1.08 mm cacl2+ 25mm hepes溶液+2%(v/v) abam,溶剂为krebs
‑
ringer缓冲液,每次消化时间约为15min。
30.步骤(5)过滤离心条件为4℃下70
×
g离心6min。
31.步骤(6)离心后获取的瘤胃上皮细胞团使用完全培养基冲洗后转移培养彭中贴壁培养。取用完全培养基重悬后获取的瘤胃上皮细胞团在显微镜下观察细胞形态是均一性,调节细胞密度大于106/ml,台盼蓝染色检测细胞活率达95%以上后接种至含完全培养基的培养瓶中置于37℃,含5%co2培养箱培养4d。培养过程中观察24h、48h、72h和96h的犊牛瘤胃上皮细胞状态图,分别如图1~4所示,表明瘤胃上皮细胞在体外培养体系中活力强、生长快。
32.步骤(6)和(7)使用完全培养基为mem基础培养基。
33.实施例2本实施例提供一种犊牛瘤胃上皮细胞分离培养的方法,包括以下步骤:(1)犊牛屠宰后剖腹选取瘤胃腹囊处瘤胃组织,使用冷藏灭菌水冲洗瘤胃内容物和瘤胃组织后,将获取的瘤胃组织浸泡在冷藏的pbs溶液中带回实验室;(2)使用钝性器具将瘤胃上皮层从肌肉层中剥离,并使用灭菌水冲洗获取的瘤胃上皮层;(3)将获取的瘤胃上皮层在灭菌水和灭菌的pbs溶液一中依次清洗,反复3次;
(4)清洗后的瘤胃上皮组织用含2%abam的pbs溶液二漂洗,漂洗后剪碎使用消化液多次消化组织至变白变黏;(5)消化后组织过滤离心获取降解的瘤胃上皮细胞团;(6)悬浮收集瘤胃上皮细胞团转移至含完全培养基的培养瓶中进行贴壁培养;(7)细胞贴壁培养24h后更换培养液,然后每隔2d更换培养液继续培养细胞铺层,待完成85%以上铺层后收取培养的瘤胃上皮细胞或用于传代。
34.步骤(1)所述的pbs溶液一ph值为7.4,含有终浓度为0.1mol/l的磷酸二氢钾和0.1mol/l的磷酸氢二钠混合液。
35.步骤(2)使用的钝性器械需要灭菌并要将黏附的浆膜层和肌肉层分离干净。
36.步骤(3)使用的灭菌水和pbs需要每次更换不能重复使用。
37.步骤(4)使用的pbs溶液二为含体积浓度为2%的青霉素
‑
链霉素
‑
两性霉素b混合液(100
×
三抗)的pbs溶液,青霉素
‑
链霉素
‑
两性霉素b混合液(100
×
三抗)中青霉素含量10ku/ml,链霉素含量10 mg/ml, 两性霉素b含量25μg/ml。该溶液用pbs配制,在此细胞培养液中使用的青霉素工作浓度为100u/ml,链霉素工作浓度为0.1mg/ml,两性霉素b工作浓度为0.25μg/ml。
38.步骤(4)中剪碎组织大小建议为<1 cm2的组织小块。剪碎的瘤胃上皮组织小块使用的消化液按照终浓度的组成为:5%(w/v)胰蛋白酶+ 1.08 mm cacl2+ 25mm hepes溶液+2%(v/v) abam,溶剂为krebs
‑
ringer缓冲液,消化时间约为15min。
39.步骤(5)过滤离心条件为4℃下70
×
g离心6min。
40.步骤(6)离心后获取的瘤胃上皮细胞团使用完全培养基冲洗后转移培养彭中贴壁培养。取用完全培养基重悬后获取的瘤胃上皮细胞团在显微镜下观察细胞形态是均一性,调节细胞密度大于106/ml,台盼蓝染色检测细胞活率达95%以上后接种至含完全培养基的培养瓶中至于37℃,含5%co2培养箱培养4d。
41.步骤(6)和(7)使用完全培养基为mem基础培养基。图5提供了本实施例培养96h后的犊牛瘤胃上皮细胞状态图,可以清楚的观察到瘤胃上皮细胞在体外培养体系中分布均匀,数量多且活力强。
42.实施例3将实施例1获得的犊牛瘤胃上皮细胞依次进行传代
‑
冻存
‑
复苏,具体操作如下:1、细胞传代将实施例1获得的犊牛瘤胃上皮细胞的培养基倒掉,加入预热的pbs清洗两次,按照添加培养基体积的1/10加入0.25%胰蛋白酶37℃培养箱5
‑
8min,后再利用显微镜观察消化情况,保证没有明显的还贴壁的细胞(如有还可以继续37℃孵育1
‑
2min,还可以用手拍打培养瓶皿),保证消化完全后,及时加入等体积的含血清的培养基终止消化(保证既消化下来细胞,又尽量少的损伤细胞的细胞膜结构),使用移液枪吸取悬液,再加入2
‑
3ml的pbs润洗重复1
‑
2次将瓶中的细胞尽量多的收集。细胞悬液1200rpm,5min离心,得到细胞沉淀去上清加入培养基重悬后移入新的培养瓶皿中(细胞传代一般为1:3即一瓶皿细胞传三个瓶皿),按照上述步骤传代3次,传代后的细胞状态如图6所示,可以清楚的观察到瘤胃上皮细胞分布均匀,数量多且活力强。
43.2、细胞冻存
将步骤1得到的传代细胞进行消化,该消化步骤和步骤1中消化并获取细胞沉淀的过程相同,获得细胞沉淀后去上清加入适量的冻存液(10%的dmso:三甲基亚枫,90%的含有10%fbs:胎牛血清的培养基;一般一个培养瓶的细胞冻存一管)。将冻存管放入冻存细胞专用的冻存盒中,
‑
80℃过夜然后液氮长期保存,本实施例的传代细胞可以保存至少1年以上。
44.3、细胞复苏将液氮中冻存的细胞从液氮中取出,然后37℃水浴复苏,在超净台将冻存管中的细胞悬液移入离心管中同传代和冻存相同使用pbs将管中剩余的细胞尽量多的收集,离心去上清,加入适量的培养基分瓶皿培养箱培养(一般复苏后细胞的存活率为70%,一般复苏后一管可以分2
‑
3个瓶皿进行培养)。图7~9分别提供了实施例1的犊牛瘤胃上皮细胞冻存
‑
复苏12h、24h、48h后的细胞状态图。实施例1的犊牛瘤胃上皮细胞经冻存和复苏的生长曲线如图10所示。结合图7~10,可以说明冻存复苏后细胞活性呈s状,证明细胞活性较好,满足体外培养瘤胃上皮细胞的需要。也证明了本发明可以成功体外培养瘤胃上皮细胞并传代
‑
冻存
‑
复苏。
45.对比例1与实施例1的区别在于,步骤(6)和(7)使用的培养基为dmem培养基。结果显示培养过程中成纤维细胞贴壁率高。此外,mem基础培养基较dmem完全培养基的组分更为简单、成本低、操作方便。
46.对比例2与实施例2的区别在于,步骤(6)和(7)使用的培养基为dmem培养基。结果显示培养过程中成纤维细胞贴壁率高。此外,mem基础培养基较dmem完全培养基的组分更为简单、成本低、操作方便。
47.综上,本发明设计出一种简单可行的瘤胃上皮细胞分离培养技术,通过此方法可以获得纯度高、活力强、生长快的瘤胃上皮细胞,还可以有效降低瘤胃上皮细胞体外培养污染的可能性,并能培养时间缩短为2
‑
3d开始贴壁,4
‑
5d完成铺层,培养过程便捷且快速。
48.以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1