一种具有抗病毒活性的多核苷酸及其用途的制作方法
snrna associates with tfiih and regulates transcriptional initiation.nat struct biol(2002)9:800-805.
9.[2]o'reilly d,dienstbier m,cowley sa,et al.differentially expressed,variant u1 snrnas regulate gene expression in human cells[j].genome res,2013,23(2):281-291.
[0010]
[3]vazquez-arango p,vowles j,browne c,et al.variant u1 snrnas are implicated in human pluripotent stem cell maintenance and neuromuscular disease[j].nucleic acids res,2016,44(22):10960-10973.
[0011]
[4]baralle d,buratti e.rna splicing in human disease and in the clinic.clin sci(lond)(2017)131:355-368.
[0012]
[5]hales cm,dammer eb,diner i,yi h,seyfried nt,gearing m et al.aggregates of small nuclear ribonucleic acids(snrnas)in alzheimer's disease.brain pathol(2014)24:344-351.
[0013]
[6]shuai s,suzuki h,diaz-navarro a,nadeu f,kumar sa,gutierrez-fernandez a et al.the u1 spliceosomal rna is recurrently mutated in multiple cancers.nature(2019)574:712-716.
技术实现要素:
[0014]
发明要解决的问题
[0015]
鉴于现有技术存在的问题,例如,需要开发小核rna新的生物学功能,以为更多疾病的预防或治疗提供依据。为此,本公开提供了具有抗病毒活性的多核苷酸,所述多核苷酸为包含如seq id no:1所示序列的多核苷酸,或是包含如seq id no:1所示序列的多核苷酸的突变体。本公开发现包含如seq id no:1所示序列的多核苷酸或其突变体具有明显的抗病毒活性,可在机体抗病毒免疫反应中发挥作用。
[0016]
在一些具体的实施方式中,本公开中具有抗病毒活性的多核苷酸,为包含如seq id no:1所示序列的小核rna,或者小核rna的突变体。本公开首次发现了小核rna能够抑制病毒复制,发挥抗病毒作用,在病毒感染疾病的预防和治疗中具有重要的临床应用前景。
[0017]
用于解决问题的方案
[0018]
本公开首先提供了一种多核苷酸,所述多核苷酸具有抗病毒活性,其中,所述多核苷酸选自如下(i)-(iv)组成的组中的任一项:
[0019]
(i)包含如seq id no:1所示序列的多核苷酸;
[0020]
(ii)包含如seq id no:1所示序列的多核苷酸的突变体,所述突变体在seq id no:1所示序列的一个或多个位置处包含取代、缺失、重复或添加一个或多个核苷酸,且所述突变体具有抗病毒感染活性;
[0021]
(iii)包含在高严格性杂交条件或非常高严格性杂交条件下,能够与(i)或(ii)所示的核苷酸序列杂交的序列的反向互补序列,且具有抗病毒感染活性的多核苷酸;
[0022]
(iv)与(i)或(ii)任一项所示的核苷酸序列具有至少90%,可选至少95%,优选至少97%,更优选至少98%,最优选至少99%的序列同一性,且具有抗病毒感染活性的多核苷酸。
[0023]
在一些实施方式中,根据本公开所述的多核苷酸,其中,所述多核苷酸为包含如seq id no:1所示序列的小核rna,或者包含如seq id no:1所示序列的小核rna的突变体。
[0024]
在一些实施方式中,根据本公开所述的多核苷酸,其中,所述突变体在seq id no:1所示序列一个或多个位置处缺失一个或多个核苷酸;优选地,所述多核苷酸的突变体的长度为50bp以上。
[0025]
在一些实施方式中,根据本公开所述的多核苷酸,其中,所述突变体包含如seq id no:11所示的核苷酸序列。
[0026]
在一些实施方式中,根据本公开所述的多核苷酸,其中,所述多核苷酸中的一个或多个核苷酸为修饰的核苷酸;可选地,所述修饰选自硫代修饰、甲氧基修饰、甲基化修饰、巯基修饰、锁核酸修饰或胆固醇修饰。
[0027]
在一些实施方式中,根据本公开所述的多核苷酸,其中,所述病毒选自rna病毒或dna病毒;可选地,所述病毒为rna病毒;可选地,所述rna病毒选自流感病毒、水疱性口炎病毒或仙台病毒。
[0028]
在一些实施方式中,根据本公开所述的多核苷酸在如下(a)-(b)至少一种中的用途:
[0029]
(a)制备预防或治疗病毒感染的药物,
[0030]
(b)制备免疫治疗剂。
[0031]
本公开还提供了一种药物组合物,其中,所述药物组合物包括根据本公开所述的多核苷酸;可选地,所述药物组合物还包括一种或多种药学上可接受的载体。
[0032]
在一些实施方式中,根据本公开所述的药物组合物,其中,所述药学上可接受的载体包括溶剂、增溶剂、助溶剂、乳化剂、矫味剂、矫嗅剂、着色剂、粘合剂、崩解剂、填充剂、润滑剂、润湿剂、渗透压调节剂、ph调节剂、稳定剂、表面活性剂和防腐剂中的一种或两种以上的组合。
[0033]
本公开还提供了一种免疫治疗剂,其中,所述免疫治疗剂包括根据本公开所述的多核苷酸。
[0034]
本公开还提供了一种预防或治疗病毒感染的方法,包括向受试者施用治疗有效量的根据本公开所述的多核苷酸。
[0035]
发明的效果
[0036]
在一些实施方式中,本公开提供了具有抗病毒活性的多核苷酸,其包含如seq id no:1所示序列,或包含如seq id no:1所示序列的多核苷酸的突变体。本公开发现包含如seq id no:1所示序列的多核苷酸或其突变体具有抗病毒活性,可抵抗病毒侵染,在病毒感染疾病的预防和治疗中发挥作用。
[0037]
在一些具体的实施方式中,具有抗病毒活性的多核苷酸为包含如seq id no:1所示序列的小核rna。本公开首次发现了小核rna的抗病毒活性,包含如seq id no:1所示序列的小核rna能够有效抑制病毒复制,在机体抗病毒免疫反应中发挥作用,为病毒感染疾病的治疗或预防提供有效手段,具有重要的临床应用前景。
[0038]
在一些具体的实施方式中,具有抗病毒活性的多核苷酸为包含如seq id no:1所示序列的小核rna的突变体,本公开发现将包含如seq id no:1所示序列的小核rna截短后,在序列长度保持在50bp以上时,小核rna截短的突变体仍能有效抑制病毒,发挥抗病毒侵染
的作用。
[0039]
在一些实施方式中,本公开提供的具有抗病毒活性的多核苷酸,在一个或多个位置处具有修饰的核苷酸,通过引入核苷酸修饰,可以提高多核苷酸的稳定性,使其能够在临床中施用。
[0040]
在一些实施方式中,本公开提供了包含seq id no:1所示序列的多核苷酸的免疫治疗剂,包含如seq id no:1所示序列的多核苷酸可作为免疫治疗剂中的免疫增强剂,提高机体的抗病毒免疫。
附图说明
[0041]
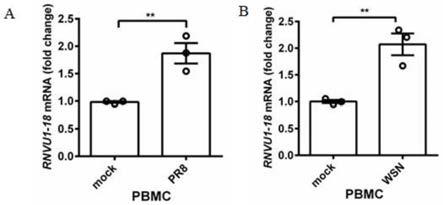
图1示出了qrt-pcr检测pbmc中,感染与不感染pr8、wsn中的rnvu1-18的表达水平。其中a为pr8组,mock为不感染组;b为wsn组,mock为不感染组。
[0042]
图2示出了qrt-pcr检测rnvu1-18在7例健康人和7例感染rsv的病人的pbmc中的表达水平。
[0043]
图3示出了rnvu1-18的a549高表达细胞系验证以及该细胞系对不同病毒感染的影响。图3中的a为rnvu1-18的a549高表达细胞系验证;b-e为rnvu1-18高表达后对不同病毒感染的影响。其中,vec为对照细胞系,rnvu1-18为高表达rnvu1-18的a549细胞系,mock为不感染病毒组。
[0044]
图4示出了rnvu1-18高表达细胞系与对照细胞系在感染vsv-gfp后的荧光照片。左为两种细胞系感染vsv-gfp后的白光照片,右为两种细胞系感染vsv-gfp后的绿色荧光照片。其中,vec为对照细胞系,rnvu1-18为高表达rnvu1-18的a549细胞系。
[0045]
图5示出了流式细胞术检测rnvu1-18高表达细胞系与对照细胞系在感染vsv-gfp后的荧光强度。其中,vec为对照细胞系,rnvu1-18为高表达rnvu1-18的a549细胞系,mock为不感染病毒组。
[0046]
图6示出了rnvu1-18沉默后对不同病毒感染的影响。图6中的a为qrt-pcr检测rnvu1-18沉默后a549细胞中rnvu1-18的表达率;b-e为rnvu1-18沉默后对不同病毒感染的影响。其中,sinc为对照组,siu1-18为rnvu1-18沉默组,mock为不感染病毒组。
[0047]
图7示出了rnvu1-18沉默后感染sev-gfp的荧光照片。左为白光,右为绿色荧光。其中,sinc为对照组,siu1-18为rnvu1-18沉默组。
[0048]
图8示出了流式细胞术检测rnvu1-18沉默后再感染sev-gfp的荧光强度。其中,sinc为对照组,siu1-18为rnvu1-18沉默组,mock为不感染病毒组。
[0049]
图9示出了rnvu1-18敲除后对不同病毒感染的影响。a-d为rnvu1-18敲除后对不同病毒感染的影响。其中,wt为对照细胞系,rnvu1-18 ko为rnvu1-18的a549敲除细胞系,mock为不感染病毒组。
[0050]
图10示出了rnvu1-18的截短体rna对不同病毒感染的影响。图10中的a为rnvu1-18全长(fl)与截短体(jd)的示意图;b和c为rnvu1-18的截短体rna对不同病毒感染的影响。其中,nc为对照rna,rnvu1-18(jd)为rnvu1-18的截短体rna,mock为不感染病毒组。
[0051]
图11示出了在体内沉默rnvu1-18后对pr8感染的影响。图11中的a为qrt-pcr检测体内rnvu1-18沉默后的表达率;b为qrt-pcr检测体内沉默rnvu1-18后对pr8感染的影响。其中,sinc为对照组,siu1-18为rnvu1-18沉默组,mock为不感染病毒组。
[0052]
图12示出了tcid
50
检测体内沉默rnvu1-18后再感染pr8的病毒载量。其中,sinc为对照组,siu1-18为rnvu1-18沉默组。
[0053]
图13示出了体内沉默rnvu1-18后再感染pr8的肺组织切片he染色图。其中,sinc为对照组,siu1-18为rnvu1-18沉默组,mock为不感染病毒组。
具体实施方式
[0054]
定义
[0055]
当在权利要求和/或说明书中与术语“包含”联用时,词语“一(a)”或“一(an)”可以指“一个”,但也可以指“一个或多个”、“至少一个”以及“一个或多于一个”。
[0056]
如在权利要求和说明书中所使用的,词语“包含”、“具有”、“包括”或“含有”是指包括在内的或开放式的,并不排除额外的、未引述的元件或方法步骤。
[0057]
在整个申请文件中,术语“约”表示:一个值包括测定该值所使用的装置或方法的误差的标准偏差。
[0058]
虽然所公开的内容支持术语“或”的定义仅为替代物以及“和/或”,但除非明确表示仅为替代物或替代物之间相互排斥外,权利要求中的术语“或”是指“和/或”。
[0059]
当用于权利要求书或说明书时,选择/可选/优选的“数值范围”既包括范围两端的数值端点,也包括相对于前述数值端点而言,所述数值端点中间所覆盖的所有自然数。
[0060]
如本公开所使用的,术语“小核rna”又称核内小rna(small nuclear rna,snrna),是一类非编码rna。术语“rnvu1-18”是u1 snrna的突变体,其ncbi gene id:26863。
[0061]
需要说明的是,本领域中已知有多条小核rna中包含如seq id no:1所示序列,例如,rnvu1-18、rnu1-1等。本公开中对于小核rna的名称不作具体限定,只要其包含如seq id no:1所示的核苷酸序列即可。
[0062]
如本公开所使用的,术语“多核苷酸”指由核苷酸组成的聚合物。多核苷酸可以是单独片段的形式,也可以是更大的核苷酸序列结构的一个组成部分,其是从至少在数量或浓度上分离一次的核苷酸序列衍生而来的,能够通过标准分子生物学方法(例如,使用克隆载体)识别、操纵以及恢复序列及其组分核苷酸序列。当一个核苷酸序列通过一个dna序列(即a、t、g、c)表示时,这也包括一个rna序列(即a、u、g、c),其中“u”取代“t”。换句话说,“多核苷酸”指从其他核苷酸(单独的片段或整个片段)中去除的核苷酸聚合物,或者可以是一个较大核苷酸结构的组成部分或成分,如表达载体或多顺反子序列。多核苷酸包括dna、rna和cdna序列。
[0063]
在一些实施方式中,本公开中的多核苷酸为包含如seq id no:1所示序列的小核rna。在一些实施方式中,本公开中的多核苷酸为包含如seq id no:1所示序列的小核rna的突变体。在另外一些实施方式中,多核苷酸还可以是包含如seq id no:1所示序列的其他类型的dna或rna片段。具体而言,只要其核苷酸序列中包含如seq id no:1所示序列,均在本公开所述的具有抗病毒活性的多核苷酸的范围内。
[0064]
如本公开所使用的,术语“野生型的”指在自然界中可以找到的对象。例如,一种存在于生物体中,可以从自然界的一个来源中分离出来并且在实验室中没有被人类有意修改的多肽或多核苷酸序列是天然存在的。如本公开所用的,“天然存在的”和“野生型的”是同义词。在一些实施方式中,本公开中的野生型的多核苷酸是指包含seq id no:1所示序列的
小核rna。
[0065]
如本公开所使用的,术语“突变体”是指相对于“野生型”,或者“相比较的”多核苷酸或多肽,在一个或多个(例如,若干个)位置处包含改变(即,取代、插入和/或缺的多核苷酸,其中,取代是指用不同的核苷酸置换占用一个位置的核苷酸。缺失是指去除占据某一位置的核苷酸。插入是指在邻接并且紧随占据位置的核苷酸之后添加核苷酸。
[0066]
在一些实施方式中,本公开中的“突变”为“缺失”,是指在多核苷酸的序列中的一个或多个位置处缺失一个或多个核苷酸。进一步的,本公开中的突变体在seq id no:1所示序列的一个或多个位置处缺失一个或多个核苷酸。在一些实施方式中,本公开中的突变体的核苷酸序列长度为50bp以上。在一些优选的实施方式中,本公开中的突变体为小核rna的突变体,小核rna的突变体的核苷酸序列为如seq id no:11所示的序列。
[0067]
如本公开所使用的,术语“序列同一性”和“同一性百分比”指两个或更多个多核苷酸或多肽之间相同(即同一)的核苷酸或氨基酸的百分比。两个或更多个多核苷酸或多肽之间的序列同一性可通过以下方法测定:将多核苷酸或多肽的核苷酸或氨基酸序列对准且对经对准的多核苷酸或多肽中含有相同核苷酸或氨基酸残基的位置数目进行评分,且将其与经对准的多核苷酸或多肽中含有不同核苷酸或氨基酸残基的位置数目进行比较。多核苷酸可例如通过含有不同核苷酸(即取代或突变)或缺失核苷酸(即一个或两个多核苷酸中的核苷酸插入或核苷酸缺失)而在一个位置处不同。多肽可例如通过含有不同氨基酸(即取代或突变)或缺失氨基酸(即一个或两个多肽中的氨基酸插入或氨基酸缺失)而在一个位置处不同。序列同一性可通过用含有相同核苷酸或氨基酸残基的位置数目除以多核苷酸或多肽中氨基酸残基的总数来计算。举例而言,可通过用含有相同核苷酸或氨基酸残基的位置数目除以多核苷酸或多肽中核苷酸或氨基酸残基的总数且乘以100来计算同一性百分比。
[0068]
示例性的,当使用序列比较算法或通过目视检查测量以最大的对应性进行比较和比对时,两个或多个序列或子序列具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%核苷酸的“序列同一性”或“同一性百分比”。在某些实施方案中,所述序列在任一或两个相比较的生物聚合物(例如,多核苷酸)的整个长度上基本相同。
[0069]
如本公开所使用的,术语“病毒感染”是指病毒通过多种途径侵入机体,并在易感的宿主细胞中增殖的过程,病毒致病是由侵入宿主、感染细胞开始的,致病作用表现在机体整体和细胞两个方面。本公开中的感染机体的病毒包括dna病毒和rna病毒。在一些实施方式中,本公开中的病毒为rna病毒。示例性的,rna病毒选自流感病毒、水疱性口炎病毒、仙台病毒组成的组。此外,rna病毒还可以是其他种类的rna病毒。
[0070]
如本公开所使用的,术语“免疫治疗剂”是指具有预防或治疗病毒感染效果的任何制剂。其涵盖抗体、核酸药物、抗感染活性剂、免疫调节剂等等。
[0071]
如本公开所使用的,术语“治疗”是指:在罹患疾病之后,使受试者接触(例如给药)本公开的多核苷酸、免疫治疗剂、药物组合物,从而与不接触时相比使该疾病的症状部分或完全减轻、改善、缓解、抑制、延迟发作、降低严重程度和/或降低特定疾病、障碍和/或病症的一种或多种症状或特征的发生率,并不意味着必需完全抑制疾病的症状。罹患疾病是指:身体出现了疾病症状。
[0072]
如本公开所使用的,术语“预防”是指:在罹患疾病之前,通过使受试者接触(例如
给药)本公开的多核苷酸、免疫治疗剂、药物组合物等,从而与不接触时相比减轻罹患疾病后的症状,并不意味着必需完全抑制患病。
[0073]
如本公开所使用的,术语“有效量”是指将本公开的多核苷酸、免疫治疗剂、药物组合物等以单一或多次剂量向受试者施用后,在需要治疗或预防的受试者中产生预期效果的量。有效量可以根据多种因素如疾病状态、个体的年龄、性别和重量,和多核苷酸、疫苗、药物组合物等在个体中激发所需反应的能力而变动。
[0074]
如本公开所使用的,术语“受试者”可以被怀疑感染有病毒,或者可以被怀疑患有由病毒感染引起的疾病,“受试者”包括哺乳动物,哺乳动物包括但不限于,家养动物(例如,牛,羊,猫,狗和马),灵长类动物(例如,人和非人灵长类动物如猴),兔,以及啮齿类动物(例如,小鼠和大鼠)。在一些实施方案中,个体或受试者是人。
[0075]
具有抗病毒活性的多核苷酸
[0076]
本公开通过实验发现,包含如seq id no:1所示序列的小核rna具有能够有效抑制病毒复制,降低病毒滴度,在抗病毒免疫中发挥作用。且该小核rna对多种rna病毒均能起到有效的抑制作用,为病毒感染疾病的临床治疗提供了重要依据。本公开首次发现了小核rna具有抑制病毒侵染的效果,小核rna分布广泛、安全性高,在预防和治疗病毒感染性疾病中具有重要的临床应用前景。
[0077]
在一些实施方式中,本公开中具有抗病毒活性的多核苷酸包含如seq id no:1所示序列,或是包含如seq id no:1所示序列的突变体。
[0078]
在一些具体的实施方式中,本公开中具有抗病毒活性的多核苷酸为包含如seq id no:1所示序列的小核rna,包括但不限于rnvu1-18、rnu1-1等。
[0079]
在一些具体的实施方式中,本公开中具有抗病毒活性的多核苷酸的突变体,为包含如seq id no:1所示序列的小核rna的突变体。小核rna的突变体在seq id no:1所示序列的一个或多个位置处取代、缺失、重复或添加一个或多个核苷酸,且具有抗病毒活性。
[0080]
在另外一些实施方式中,本公开中具有抗病毒活性的多核苷酸或多核苷酸的突变体,还可以是包含如seq id no:1所示序列的其他类型的dna或rna片段,只要其具有抗病毒活性即可。
[0081]
在一些具体的实施方式中,小核rna的突变体是在seq id no:1所示序列的一个或多个位置处缺失一个或多个核苷酸的截短的小核rna。
[0082]
在一些具体的实施方式中,小核rna的突变体的核苷酸序列长度为50p以上。
[0083]
本公开发现,当对包含seq id no:1所示序列的小核rna截短后,得到的截短的突变体仍具有抗病毒活性,提示小核rna的突变体可同样参与机体的抗病毒免疫,发挥抑制病毒侵染的效果。
[0084]
在一些实施方式中,小核rna的突变体可以在seq id no:1所示序列的1个、2个、3个、4个、5个、6个等等的位置处缺失核苷酸。在一些实施方式中,小核rna的突变体在其中一个位置处缺失的核苷酸的数量可以是至少1个、3个、5个、10个、15个、20个、30个、40个、50个等。在一些实施方式中,本公开中小核rna的突变体的序列长度为50bp以上时,可发挥良好的抗病毒侵染的效果。
[0085]
在一些优选的实施方式中,小核rna的突变体的核苷酸序列为如seq id no:11所示的序列。
[0086]
对于小核rna或小核rna的突变体抑制的病毒类型,可以是dna病毒或rna病毒。在一些优选的实施方式中,病毒为rna病毒。在一些具体的实施方式中,rna病毒选自流感病毒、水疱性口炎病毒、仙台病毒中的至少一种。示例性的,流感病毒为甲型流感病毒,具体为h1n1。此外,rna病毒还可以是本领域中可能的对机体进行侵扰的其他种类的病毒。本公开中小核rna或小核rna的突变体抑制病毒复制具有广谱性,能够适用于对多类型病毒的抗病毒免疫反应中。
[0087]
在一些实施方式中,具有抗病毒活性的多核苷酸中一个或多个核苷酸为修饰的核苷酸。通过对核苷酸进行修饰,可提高小核rna或小核rna的突变体的稳定性,使其适合向受试者体内施用,发挥有效的抗病毒感染的作用效果。对于修饰,可以选择本领域中任意一种的用于核苷酸修饰的方法。在一些实施方式中,修饰选自硫代修饰、甲氧基修饰、甲基化修饰、巯基修饰、锁核酸修饰、胆固醇修饰中的任意一种。
[0088]
在一些实施方式中,本公开提供了具有抗病毒活性的多核苷酸在制备预防或治疗病毒感染的药物中的用途。利用抗病毒活性的多核苷酸对病毒复制的抑制作用,能够起到有效的防御病毒侵染的效果,在预防和治疗病毒感染疾病中具有重要的应用前景。
[0089]
药物组合物
[0090]
本公开中的药物组合物包括具有抗病毒活性的多核苷酸,以及任选存在的一种或多种药学上可接受的载体,在抑制病毒复制、防御病毒侵染,预防或治疗病毒感染性疾病中具有重要前景。
[0091]
在本公开中,术语“药学上可接受的载体”是指适于与人体或动物体的细胞、组织或器官相容,且不会诱发毒性、刺激性、变态反应性等毒副作用的辅料成分。在一些实施方式中,药学上可接受的载体是本领域所熟知的,包括溶剂、增溶剂、助溶剂、乳化剂、矫味剂、矫嗅剂、着色剂、粘合剂、崩解剂、填充剂、润滑剂、润湿剂、渗透压调节剂、ph调节剂、稳定剂、表面活性剂和防腐剂中的至少一种。
[0092]
在一些优选的实施方式中,药学上可接受的载体为稳定剂。通过将稳定剂与具有抗病毒活性的多核苷酸共同组合,可使多核苷酸具有临床上可施用的药物稳定性。
[0093]
在一些实施方式中,具有抗病毒活性的多核苷酸与一种或多种药学上可接受的载体混合后被制作为固体制剂、半固体制剂或液体制剂。其中,适用的固体制剂形式主要包括片剂、胶囊剂、颗粒剂、丸剂等;适用的半固体制剂形式主要包括凝胶剂、栓剂、膏剂等;适用的液体制剂形式主要包括乳剂、合剂、混悬剂、溶液剂、注射剂等。
[0094]
免疫治疗剂
[0095]
本公开中的免疫治疗剂包括具有抗病毒活性的多核苷酸。
[0096]
在一些实施方式中,免疫治疗剂为核酸药物。在一些更为具体的实施方式中,通过基因工程技术,将小核rna或小核rna的突变体与治疗性的核酸分子可操作性地连接,形成重组的核酸分子。重组的核酸分子在导入受试者体内后,具有抗病毒活性的多核苷酸可以作为免疫增强元件,发挥增强机体免疫的作用。
[0097]
在一些实施方式中,免疫治疗剂为抗体、细胞因子等蛋白类药物。具有抗病毒活性的多核苷酸可以与蛋白类药物共同施用,在受试者体内产生抗病毒免疫。
[0098]
实施例
[0099]
本公开的其他目的、特征和优点将从以下详细描述中变得明显。但是,应当理解的
是,详细描述和具体实施例(虽然表示本公开的具体实施方式)仅为解释性目的而给出,因为在阅读该详细说明后,在本公开的精神和范围内所作出的各种改变和修饰,对于本领域技术人员来说将变得显而易见。
[0100]
以下结合具体的实施例进行说明,其中试剂以及样品等均有商品供应或以别的途径能为公众所得,它们仅作举例,对本发明不是唯一的,可分别用其它适合的工具和生物材料来代替。所涉及的实验操作可按照《分子克隆实验指南(第三版)》(科学出版社,2002)中所述条件和方法进行,并可按照商业化的酶、试剂盒的厂商说明来进行。其它未详细描述的试验方法如无特殊说明,均为本领域的技术人员所熟知的常规方法。
[0101]
下述实施例中c57bl/6小鼠获取于北京维通利华实验动物技术有限公司。
[0102]
pr8,来源病毒株influenza virus strain a/puerto rico/1981h1n1(pr8);wsn,来源病毒株influenza virus strain a/wsn/33;vsv-gfp,来源病毒株indiana strain;sev-gfp来源病毒株为z strain。
[0103]
下述实施例中的小核rna以“rnvu1-18”的名称示出,需要说明的是,下述实施例中的实验结果并不仅针对于“rnvu1-18”所示名称的小核rna,对于基因组中具有如seq id no:1所示序列的其他小核rna,同样适用下述实施方式。
[0104]
实施例1:实施例2-7中涉及的实验方法
[0105]
1.1细胞培养
[0106]
一般实验细胞置于37℃、10%(v/v)co2恒温培养箱培养,培养基为含10%(v/v)fbs,1%(v/v)双抗(青霉素和链霉素)的dmem培养基,待细胞长到80%左右时,按1:3到1:6的比例进行传代。
[0107]
1.2细胞转染
[0108]
(1)lipofectamine 2000转染:以12孔板的细胞为例,转染前细胞换液(0.9ml),分别在离心管中配制50μl opti-mem加1μg质粒,50μl opti-mem加相应比例的lipofectamine2000(lipofectamine 2000与质粒的比例为2.5:1),轻轻混匀分别放置5min。二者混合轻轻混匀,室温静置20min,将混合液小心滴入细胞培养液中。转染完约4-6h后换液,使细胞正常生长。
[0109]
(2)interfer in转染(用于sirna):以12孔板的细胞为例,转染前细胞换液(0.9ml),在离心管中加入100μl opti-mem,再加入20nm的sirna以及相应比例的interfer in(interfer in与sirna的体积比例为2.5:1),涡旋混匀并瞬时离心收集,室温静置15min,用移液枪将混合液小心滴入细胞培养液中。转染完约8h后换液(1ml),使细胞正常生长。
[0110]
1.3高表达细胞系的构建
[0111]
(1)逆转录病毒包装(以pbabe为例)
[0112]
a.hek293t细胞以每孔2
×
105铺于十二孔板,置于细胞培养箱中过夜;
[0113]
b.待每孔细胞密度长至60-80%,:目的质粒(1:1)进行pei转染,室温静置15min,然后将混合液均匀滴入每孔,置于细胞培养箱中培养。12h后换液,培养72h后收集上清培养液,过滤膜,0.5ml/管分装,-80℃冰箱保存。
[0114]
(2)包装好的病毒感染a549细胞
[0115]
a.a549细胞以2
×
105个每孔接种于十二孔板,置于细胞培养箱中过夜;
[0116]
b.待细胞密度为50%,按病毒液:opti-mem=1:1的比例换液,同时加入polybrene
使其终浓度为8μg/ml;
[0117]
c.24h更换培养液,继续培养48-72h;
[0118]
d.显微镜下观察绿色荧光,估算病毒感染率,如若感染率低于60%,考虑二次病毒感染以提高感染效率。
[0119]
1.4敲除细胞系的构建
[0120]
(1)利用在线sgrna设计软件设计rnvu1-18的sgrna序列;
[0121]
(2)酶切载体质粒lenticrisprv2(用bsmbi酶),反应体系见下表,37℃酶切1-2h,琼脂糖凝胶电泳进行验证,胶回收目的片段;
[0122]
表1 lenticrisprv2酶切反应体系
[0123][0124]
(3)将设计好的sgrna序列加上bsmbi酶的酶切位点后,合成dna片段;
[0125]
(4)将合成的dna片段进行磷酸化,磷酸化的反应程序见下表,再将磷酸化的dna片段与酶切好的lenticrisprv2进行连接,连接反应见下表;
[0126]
表2磷酸化反应程序
[0127][0128]
表3连接反应体系
[0129][0130]
(5)将连接产物进行转化,挑选单菌落测序进行验证;
[0131]
(6)将测序正确的单菌落的菌液扩大培养,进行质粒的中抽;
[0132]
(7)准备好细胞(密度60-80%),将中抽好的质粒进行转染,12h后换液;
[0133]
(8)转染48h后,加入一定量的puromycin开始筛选敲除掉的细胞;
[0134]
(9)筛选一段时间后换成一半浓度的puromycin进行维持,将细胞扩大培养。
[0135]
1.5rna的提取
[0136]
(1)用吸液泵吸弃培养基,用pbs将残余的培养基洗干净,按照一定的比例加入trizol(一般12孔板每孔加入500μl的trizol)。可放置于-80℃冻存,也可以放置于室温,待细胞裂解1min后,将细胞吹打混匀,转移到1.5ml的离心管中。
[0137]
(2)按一定的体积比例加入氯仿(trizol:氯仿=5:1),将细胞上下震荡100次,室温静置2-3min,放置于4℃离心机,12000rpm离心15min。
[0138]
(3)提前准备好新的离心管,并做好标记,将离心好的最上层的透明水相转移到新的离心管中(一般吸取200μl),然后加入同等量的异丙醇,轻轻的上下颠倒混匀,放置于室温中静置10min,之后放置于4℃离心机,12000rpm离心10min。
[0139]
(4)用吸液泵将上清吸掉,加入0.5ml预冷75%乙醇洗涤沉淀,放置于4℃离心机,12000rpm离心5min,然后将上清弃掉,风干5-10min。
[0140]
(5)加入40μl左右的depc水,振荡混匀,放置于60℃金属浴上,溶解rna沉淀;
[0141]
(6)nanodrop 2000定量,记录rna浓度。
[0142]
1.6rna逆转录及荧光定量pcr反应
[0143]
(1)逆转录反应:用5
×
primescript
tm
rt master mix试剂盒在冰上配置反应液,反应体系见下表:
[0144]
表4逆转录反应体系
[0145][0146]
逆转录500ng的rna,用普通pcr仪进行反应,设置的反应条件为37℃,15min;85℃,5s;4℃,∞。
[0147]
(2)荧光定量pcr反应:
[0148]
所有的检测都用相同的反应体系,见下表,并且在冰上配置反应液。
[0149]
表5荧光定量pcr反应体系
[0150][0151]
将反应液加入特定的用于荧光定量pcr的96孔板,设置至少两个平行管反应,在检
测目的基因的同时,通常还要进行内参基因的检测。用实时荧光定量pcr仪进行反应,仪器设置的反应条件为95℃10min(运行1个循环);95℃10s,60℃30s(运行45个循环)。
[0152]
1.7小鼠体内沉默rnvu1-18
[0153]
将多肽(p7f7)
[7]
(10mg/ml)和经过甲氧基修饰的sirna(1mg/ml)分别溶解在depc处理过的水中。将多肽溶液以重量比(15:1)添加到sirna溶液中,涡旋10秒钟并在37℃孵育30分钟后形成p7f7/sirna多聚体。然后以200μg sirna/kg的剂量向c57bl/6小鼠鼻内递送p7f7/sirna多聚体。
[0154]
实施例2:检测rnvu1-18在病毒感染后的表达情况
[0155]
为检测rnvu1-18在病毒感染后的表达情况,首先根据rnvu1-18的基因序列,设计出特异性引物对,f链的核苷酸序列为seq id no:2所对应的序列,r链的核苷酸序列为seq id no:3所对应的序列。
[0156]
按照ficoll-paque plus试剂说明分离pbmc,将pbmc按1
×
105个细胞/孔接种于48孔板中,然后分别感染pr8(moi=1),wsn(moi=1),感染8h后,收集细胞,提取rna,qrt-pcr检测rnvu1-18的表达情况。结果如图1所示,病毒感染后,pbmc中rnvu1-18的表达上调。
[0157]
除上述之外,本公开还利用了健康人和感染rsv的病人的临床样本分离的pbmc,提取rna,qrt-pcr检测rnvu1-18的表达情况。结果如图2所示,感染rsv的病人的pbmc中rnvu1-18的表达较高。
[0158]
以上结果说明rnvu1-18与病毒感染相关。
[0159]
实施例3:检测高表达rnvu1-18后对不同病毒感染的影响
[0160]
利用分子克隆的实验技术构建rnvu1-18的表达质粒,先设计rnvu1-18的扩增引物对,f链的核苷酸序列为seq id no:4所对应的序列,r链的核苷酸序列为seq id no:5以及seq id no:6所对应的序列,通过pcr反应将rnvu1-18扩增出来,再与酶切好的载体质粒pbabe-puro进行连接,连接产物进行转化,最后进行测序,测序结果完全正确后,抽提质粒。然后利用逆转录病毒包装技术构建rnvu1-18的a549高表达细胞系,并通过qrt-pcr进行验证。结果如图3中的a所示,rnvu1-18在细胞中高表达。之后用不同病毒pr8(moi=1),wsn(moi=1),vsv-gfp(moi=0.1),sev-gfp(moi=0.1)感染rnvu1-18的a549高表达细胞系以及对照细胞系,qrt-pcr检测病毒载量,荧光显微镜观察荧光,流式细胞术检测荧光强度。结果如图3,图4,图5所示,病毒感染后,rnvu1-18的高表达细胞系与对照细胞系相比,病毒载量较少,病毒的荧光强度较弱。说明高表达rnvu1-18能够抑制病毒复制。
[0161]
实施例4:检测rnvu1-18沉默后对不同病毒感染的影响
[0162]
首先根据rnvu1-18的基因序列,设计出干扰rnvu1-18的sirna,序列为seq id no:7所对应的序列。然后通过转染sirna来沉默rnvu1-18,并通过qrt-pcr进行验证。结果如图6a所示,rnvu1-18沉默后表达降低。在rnvu1-18沉默后再感染不同病毒pr8(moi=1),wsn(moi=1),vsv-gfp(moi=0.1),sev-gfp(moi=0.1),qrt-pcr检测病毒载量,荧光显微镜观察荧光,流式细胞术检测荧光强度。结果如图6,图7,图8所示,病毒感染后,rnvu1-18沉默组与对照组相比,病毒载量较多,病毒的荧光强度较强。说明rnvu1-18沉默后促进病毒复制。
[0163]
实施例5:检测敲除rnvu1-18后对不同病毒感染的影响
[0164]
首先根据rnvu1-18的基因序列,设计出sgrna,其靶序列为seq id no:8以及seq id no:9所对应的序列。然后利用分子克隆的实验技术将设计好的sgrna序列加上bsmbi酶
的酶切位点后,合成dna片段,再将磷酸化的dna片段与酶切好的lenticrisprv2进行连接,连接产物进行转化,最后进行测序,测序结果完全正确后,抽提质粒。将两个质粒共同转染a549细胞来构建rnvu1-18的a549敲除细胞系,之后在敲除细胞系中挑单克隆细胞提取基因组dna,pcr后再进行测序验证。之后用不同病毒pr8(moi=1),wsn(moi=1),vsv-gfp(moi=0.1),sev-gfp(moi=0.1)感染rnvu1-18的a549敲除细胞系以及对照细胞系,qrt-pcr检测病毒载量。结果如图9所示,病毒感染后,rnvu1-18的敲除细胞系与对照细胞系相比,病毒载量较多。说明rnvu1-18敲除后能够促进病毒复制。
[0165]
实施例6:检测rnvu1-18的截短体rna对不同病毒感染的影响
[0166]
由吉玛公司合成rnvu1-18的截短体rna,序列为seq id no:1所示的转录序列的截短序列,截短体rna的序列如seq id no:11所示。在不同细胞中转染rnvu1-18的截短体rna后再感染不同病毒vsv-gfp(moi=0.1),sev-gfp(moi=0.1),qrt-pcr检测病毒载量。结果如图10所示,病毒感染后,rnvu1-18的截短体rna与对照rna相比,病毒载量较少。说明rnvu1-18的截短序列也能够抑制病毒复制。
[0167]
实施例7:检测体内沉默rnvu1-18后对pr8感染的影响
[0168]
鼠源rnvu1-18序列与seq id no.1所示的转录序列的同源性约为98%,不低于90%。根据鼠源rnvu1-18序列,设计出沉默鼠源rnvu1-18的sirna,序列为seq id no:10所对应的序列。使用氟化α-螺旋多肽(p7f7)经鼻内递送甲氧基修饰的sirna来沉默rnvu1-18,结果如图11中的a所示,经鼻内递送siu1-18的小鼠与递送sinc的小鼠相比,rnvu1-18的表达降低。在体内沉默rnvu1-18后再经滴鼻感染pr8(200pfu/只),感染3天后取肺组织进行检测。肺组织匀浆液直接提取rna,经qrt-pcr检测病毒载量,结果如图11中的b所示,pr8感染后,rnvu1-18沉默组与对照组相比,病毒载量较多。肺组织匀浆液离心后的上清,经tcid50检测病毒滴度,结果如图12所示,pr8感染后,rnvu1-18沉默组与对照组相比,病毒滴度较高。肺组织的石蜡切片经he染色,结果如图13所示,pr8感染后,rnvu1-18沉默组与对照组相比,组织损伤更为严重。说明体内沉默rnvu1-18后促进病毒复制。
[0169]
由上述可知,具有seq id no:1所示的转录序列或seq id no:1所示的转录序列的同源序列或seq id no:1所示的转录序列的截短序列或seq id no:1所示的转录序列的修饰序列的小核rna与病毒免疫相关,能够有效抑制多种病毒的复制,在预防或治疗感染性疾病中具有应用前景。
[0170]
引用文献:
[0171]
[7]ge c,yang j,duan s,liu y,meng f,yin l.fluorinatedα-helical polypeptides synchronize mucus permeation and cell penetration toward highly efficient pulmonary sirna delivery against acute lung injury.nano lett.2020mar 11;20(3):1738-1746.doi:10.1021/acs.nanolett.9b04957.epub 2020feb 10.pmid:32039603.
[0172]
本说明书公开的所有技术特征都可以任何组合方式进行组合。本说明所公开的每个特征也可以被其它具有相同、相等或相似作用的特征所替换。因此,除非特殊说明,所公开的每一特征仅仅是一系列相等或相似特征的实例。
[0173]
上述实施例为本公开较佳的实施方式,但本公开的实施方式并不受上述实施例的限制,其他任何未背离本公开的实质和原理下所作的技术改动、修饰、替代、组合以及简化
等,均应为等效的置换方式,都包含在本公开的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1