一种葛仙米寡糖及其制备方法与应用
本发明属于天然药物技术领域,具体涉及一种葛仙米寡糖及其制备方法与应用。
背景技术:
葛仙米是药食两用的一种蓝藻。因东晋医学家、炼丹家、道教学者葛洪而得名,在末代皇帝溥仪的回忆录《我的前半生》也有记载。《本草纲目拾遗》、《药性考》及《全国中草药汇编》都记录着葛仙米具有明目益气、治夜盲症、解热清隔、久食延年、消除疲劳等功效。葛仙米在2018年获批国家新资源食品。
天然多糖类物质不仅是人体的重要供能物质还具有特殊的生理活性和功能,参与人体营养与健康状态的维持。葛仙米在生长过程中,可分泌大量的多糖,在极端环境中起到保护生物体的作用。尽管藻类多糖的生物活性广为报道,具有较大的开发潜力,但由于藻类多糖结构的复杂性,其开发利用受到了限制。
技术实现要素:
本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种葛仙米寡糖的制备方法。
本发明还提出一种上述方法制备的葛仙米寡糖。
本发明还提出一种上述葛仙米寡糖的应用。
根据本发明的第一方面,提出了一种葛仙米寡糖的制备方法,所述方法包括以下步骤:将葛仙米多糖经酸解、干燥和透析分离得到葛仙米寡糖。
在本发明的一些实施方式中,所述酸解包括在葛仙米多糖溶液中加入酸溶液,在90~100℃条件下反应2~5h。
在本发明的一些实施方式中,所述酸解包括在葛仙米多糖溶液中加入酸溶液,在100℃条件下反应3h。
在本发明的一些实施方式中,所述酸溶液选自盐酸、三氟乙酸、硫酸的一种。
在本发明的一些实施方式中,所述酸解采用盐酸、三氟乙酸的一种。
在本发明的一些实施方式中,所述三氟乙酸的浓度为0.5m。
在本发明的一些实施方式中,所述浓缩采用减压浓缩,所述减压浓缩为将上述反应液40~50℃条件下进行减压浓缩,至干燥后加入甲醇进行减压浓缩,重复步骤2~5次。
在本发明的一些实施方式中,所述干燥采用冷冻干燥,将减压浓缩后的得到的溶液0-20℃冷冻后进行冻干。
在本发明的一些实施方式中,所述冻干采用冷冻干燥装置,-70℃进行冻干。
在本发明的一些实施方式中,所述透析采用截留分子量为300-10000da的透析袋。
在本发明的一些实施方式中,所述透析包括将1份重量多糖降解物溶于去100~200份重量的水中,使用透析袋中对多糖降解物溶液水透析1~3天。
在本发明的一些实施方式中,所述葛仙米多糖的制备方法包括如下步骤:将葛仙米粉碎后,经过水提,浓缩,醇沉,干燥后得到葛仙米多糖。
在本发明的一些实施方式中,所述水提为将1份重量的葛仙米粉末于提取器中,加入100-200份重量的水,升温至85~95℃并搅拌,提取1~4h后,固液分离收集第一次提取液,在提取后的固体组分中加入100-200份重量的水,进行第二次提取,升温至85~95℃并搅拌,提取1~2h后,固液分离得到第二次提取液后合并两次提取液。
在本发明的一些实施方式中,所述水提为将1份重量的葛仙米粉末于提取器中,加入200份重量的水,升温至90℃并搅拌,提取2h后,固液分离收集第一次提取液,在提取后的固体组分中加入100份重量的水,进行第二次提取,升温至90℃并搅拌,提取1h后,固液分离得到第二次提取液后合并两次提取液。
在本发明的一些实施方式中,多糖提取液浓缩采用减压浓缩,所述减压浓缩方法包括以下步骤:取合并后的提取液,于40~50℃条件下进行减压浓缩,浓缩至原体积的三分之一时停止浓缩,得浓缩液.
在本发明的一些实施方式中,所述醇沉采用乙醇。
在本发明的一些实施方式中,所述乙醇的体积比为80~95%。
根据本发明的第二方面,提出了一种葛仙米寡糖,所述葛仙米寡糖由上述方法制备得到。
在本发明的一些实施方式中,所述葛仙米寡糖的分子量为300da~10000da。
在本发明的一些实施方式中,所述葛仙米寡糖的分子量为300da~3000da。
在本发明的一些实施方式中,所述葛仙米寡糖的分子量为300da~2000da。
根据本发明的第三方面,提出了一种葛仙米寡糖的应用,所述应用为葛仙米寡糖在制备抗氧化活性药物或食品中的应用。
在本发明的一些实施方式中,所述应用为葛仙米寡糖在制备神经系统疾病辅助药物中的应用。
在本发明的一些实施方式中,所述应用为葛仙米寡糖在制备具有神经保护功效的保健食品中的应用。
一种试剂,所述试剂中包括葛仙米多糖或寡糖与药学上可接受的辅料。
根据本发明方案制备的葛仙米寡糖,至少具有以下有益效果:本发明制备葛仙米寡糖的方法简单合理、稳定高效,适合规模化生产,同时,本发明方案制备得到的葛仙米多糖和寡糖均可以延长氧化胁迫条件下秀丽隐杆线虫的生存时间,提高其存活率,具有体内抗氧化作用,葛仙米寡糖还能提高亨延顿舞蹈病疾病模型秀丽隐杆线虫的化学避化指数,具有一定的神经保护作用,可应用于神经系统疾病的辅助治疗药物和具有神经保护功效的保健食品中,从而为神经系统疾病防治和健康老龄化提供新策略,并能促进天然多糖产品的深入开发和应用。
附图说明
下面结合附图和实施例对本发明做进一步的说明,其中:
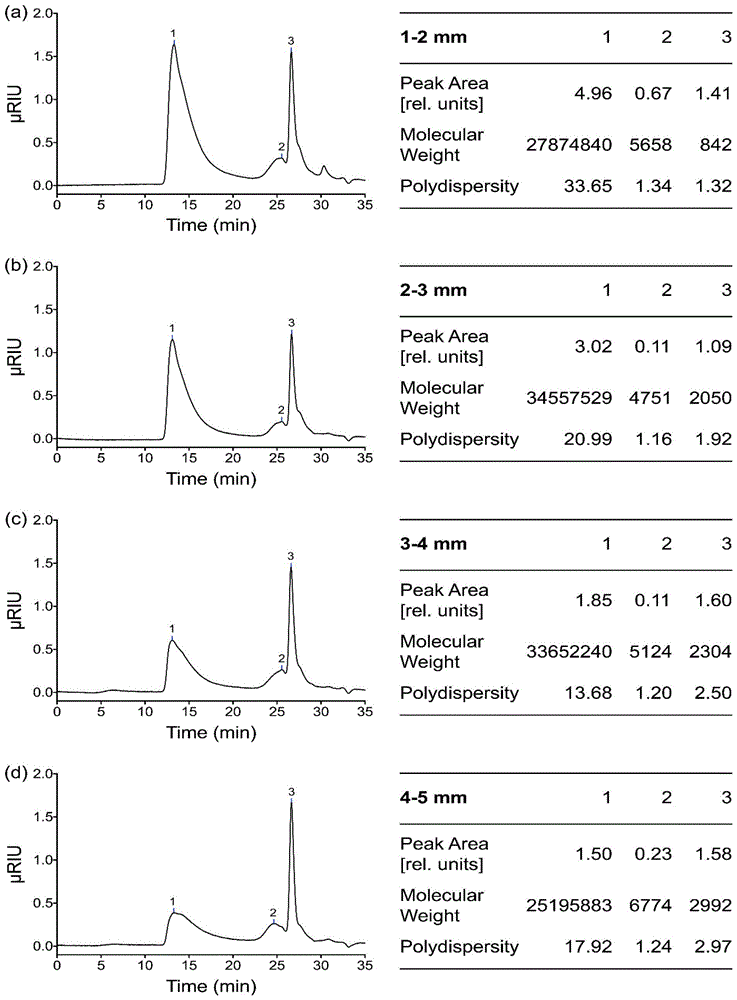
图1为本发明测试例中的群体不同生长阶段葛仙米寡糖的理化特征图,其中a为1-2mm生长阶段葛仙米的理化特征图,b为2-3mm生长阶段葛仙米的理化特征图,c为3-4mm生长阶段葛仙米的理化特征图,d为4-5mm生长阶段葛仙米的理化特征图;
图2为本发明测试例中的群体不同生长阶段葛仙米寡糖的红外光谱图;
图3为本发明测试例中的群体不同生长阶段葛仙米寡糖的abts清除效果结果图;
图4为本发明测试例中的群体不同生长阶段葛仙米寡糖的dpph清除效果结果图;
图5为本发明测试例中的不同酸解溶液制备的葛仙米寡糖对秀丽线虫的存活率的影响结果图,其中,nos-hca代表经盐酸酸解得到的葛仙米寡糖,nos-tfa是三氟乙酸酸解得到的寡糖;
图6为本发明测试例中的群体不同生长阶段葛仙米寡糖的对秀丽线虫的存活率的影响结果图;
图7为本发明测试例中的葛仙米多糖、及采用不同酸解溶液制备的葛仙米寡糖对亨延顿舞蹈病疾病模型秀丽隐杆线虫避化行为的影响图,其中,nos-hca代表经盐酸酸解得到的葛仙米寡糖,nos-tfa是三氟乙酸酸解得到的寡糖;
图8为本发明测试例中的不同分子量的盐酸溶液酸解制备得到的葛仙米寡糖对亨延顿舞蹈病疾病模型秀丽隐杆线虫避化行为的影响图,其中,nos-hca代表经盐酸酸解得到的葛仙米寡糖,nos-tfa是三氟乙酸酸解得到的寡糖;
图9为本发明测试例中的不同分子量的三氟乙酸酸溶液酸解制备得到的葛仙米寡糖对亨延顿舞蹈病疾病模型秀丽隐杆线虫避化行为的影响图,其中,nos-hca代表经盐酸酸解得到的葛仙米寡糖,nos-tfa是三氟乙酸酸解得到的寡糖。
具体实施方式
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,均可从商业途径得到的试剂和材料。
实施例1葛仙米多糖的制备
本实施例制备了一种葛仙米多糖,具体过程为:
(1)采收:采集不同生长阶段的葛仙米藻体(大小分别为1-2mm、2-3mm、3-4mm、4-5mm)进行清洗并晒干,得到群体不同生长阶段的葛仙米原料;
(2)预处理:将不同大小来源的葛仙米干品进行粉碎,得到葛仙米粉末;
(3)热水浸提:称取1份重量的葛仙米粉末于提取器中,加入200份重量的水,升温至90℃并不停搅拌,提取2h后,离心收集得到第一次提取液。往提取物中加入100份重量的水,进行第二次提取,升温至90℃并不停搅拌,提取1h后,离心收集得到第二次提取液后合并两次提取液;
(4)减压浓缩:取合并后的提取液,于40℃条件下进行减压浓缩,浓缩至原体积的三分之一时停止浓缩,得浓缩液;
(5)醇沉:往浓缩液中,缓慢加入95%乙醇并不停搅拌,直至乙醇终浓度至80%,停止加入乙醇并放置过夜,随后离心收集沉淀,在抽滤装置中,使用95%乙醇对沉淀进行洗涤;
(6)冷冻干燥:取洗涤后的沉淀加入适量的水,使沉淀完全溶解,再转移至烧杯中并封膜,将烧杯放置于-20℃冰箱进行冷冻,冷冻完成后,用针头将密封膜扎出细小的洞,再置于-70℃真空冷冻干燥机中冻干得到多糖粉末。
实施例2葛仙米寡糖的制备
本实施例制备了一种葛仙米寡糖,具体过程为:
(1)多糖降解:取1份重量的实施例1制备的不同生长阶段的葛仙米多糖粉末加入100份重量水溶解后,加入三氟乙酸(浓度分别为1mg/ml、0.5mg/ml),在100℃条件下反应3h。
(2)减压浓缩:取多糖反应溶液于40℃条件下进行减压浓缩,直至干燥。随后加入5ml甲醇,同样40℃条件下进行减压浓缩,直至干燥,并重复此步骤3次。
(3)冷冻干燥:往干燥后的多糖解物中加入30ml的水,使降解物溶解。再转移至烧杯中并封膜,将烧杯放置于-20℃冰箱进行冷冻,冷冻完成后,用针头将密封膜扎出细小的洞,再置于-70℃真空冷冻干燥机中冻干成多糖降解物粉末,将多糖降解物粉末放于干燥器中储存备用;
(4)透析分离:将1份重量多糖降解物溶于去100份重量的水中,使用分子量截留为300da、3000da、10000da的透析袋中对多糖降解物溶液进行透析。
(5)减压浓缩:收集透析袋外的溶液于40℃条件下进行减压浓缩,浓缩至原体积的四分之一时停止浓缩,得葛仙米寡糖浓缩液。
(6)冷冻干燥:将葛仙米寡糖浓缩液倒于烧杯中并放置于-20℃冰箱进行冷冻,冷冻完成后,用针头将密封膜扎出细小的洞,再置于-70℃真空冷冻干燥机中冻干得到葛仙米寡糖粉末,将葛仙米寡糖粉末放于干燥器中储存备用。
实施例3
一种葛仙米寡糖的制备方法,与实施例2的区别仅在于,酸解采用盐酸(浓度分别为1mg/ml、0.5mg/ml)。
测试例
1、不同生长阶段葛仙米原料制备的寡糖的理化性质测定
将实施例2中采用不同生长阶段葛仙米原料制得的葛仙米寡糖进行理化性质测定,结果如图1-2所示,从图中可以看出,1-2mm生长阶段的葛仙米原料的葛仙米多糖活性成分含量最大。
2、葛仙米多糖及寡糖体外抗氧化活性测定
工作液配制:7mm2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(abts)溶液,称取abts192mg,溶于50ml水中;
2.45mm过硫酸钾溶液:称取k2s2o33mg,溶于50ml水中。
100μm1,1-二苯基-2-三硝基苯肼(dpph)溶液:称取1.9715mg的dpph,溶于50ml甲醇中。
样品配置:使用一级水配置成2mg/ml样品母液,随后进行梯度稀释。
样品采用实施例2的不同生长阶段的葛仙米(分别为1-2mm、2-3mm、3-4mm、4-5mm组)制备的葛仙米寡糖。
(1)abts自由基清除实验
将abts溶液与过硫酸钾溶液等体积混合,室温避光静置16h,然后用pbs稀释至溶液在734nm处的吸光值为0.7±0.02左右,得到abts+工作液。
样品组(a1):20μl样品溶液+abts+200μl;样品空白组(a2):20μl样品溶液+pbs200μl;对照组(a0):pbs20μl+abts+200μl。每组3孔,室温25℃)避光静置6min,然后用酶标仪检测在734nm处的吸光值。清除率公式:abts清除率=100-(a样品-a对照)/a空白×100。
实验结果如图3所示,从图中可以看出,葛仙米寡糖和多糖均具有清除abts自由基的能力。
(2)dpph自由基清除能力的测定:
将100μl样品溶液与等体积的100μm的dpph溶液在96孔板中混合,在室温(25℃)下避光反应30min后,用酶标仪测定517nm处反应液的吸光值。样品组(a1):样品溶液+dpph溶液;样品空白组(a2):样品溶液+甲醇;对照组(a0):水+dpph溶液。清除率公式:dpph清除率=[1-(a1-a2)/a0]×100%。
实验结果如图4所示,从图中可以看出,葛仙米寡糖具有清除dpph能力。
(3)氧化胁迫条件下秀丽隐杆线虫存活率的影响
百草枯是一种联吡啶阳离子类除草剂,在体内能诱导产生活性氧自由基,从分子水平上氧化多种生命物质,使机体处于氧化胁迫环境,进而出现早衰现象。将实施例2和3制得的葛仙米寡糖,按照浓度为0.5mg/ml、1mg/ml分别加入到成虫初期的野生型秀丽线虫中,对照组加入等体积的smedium,置于20℃培养24h后,加入终浓度为70mmol/l的百草枯对秀丽线虫进行氧化胁迫造模,并开始定时统计秀丽线虫存活的比率,直至全部虫子死亡。存活率以生存曲线表示,比较寡糖组和对照组的差异性。
实验结果如图5所示,从图中可以看出,当葛仙米寡糖能够延长氧化胁迫条件下秀丽线虫的生存时间,提高存活率,说明葛仙米寡糖能够有效缓解由氧化胁迫引起的早衰现象。
(4)不同生长阶段的葛仙米制备的葛仙米寡糖对秀丽隐杆线虫存活率的影响
将实施例2的不同生长阶段的葛仙米(分别为1-2mm、2-3mm、3-4mm、4-5mm组)制备的葛仙米寡糖,对照组加入等体积的smedium,实验方法同(3)氧化胁迫条件下秀丽隐杆线虫存活率的影响一致。
实验结果如图6所示,从图中可以看出,采用1-2mm生长阶段的葛仙米提取的寡糖的秀丽线虫的生存时间更长,存活率更高,说明1-2mm生长阶段的葛仙米提取的寡糖的抗氧化效果更好。
2、葛仙米寡糖神经保护功效研究
为了验证本发明提供的葛仙米寡糖具有神经保护功效,本实施例利用实施例1的制得的葛仙米寡糖进行了秀丽隐杆线虫实验。
首先设置对照组和葛仙米多糖组(1mg/ml、0.5mg/ml)、盐酸酸解制得的葛仙米寡糖组,三氟乙酸酸解制得的葛仙米寡糖组(1mg/ml、0.5mg/ml):对照组、葛仙米多糖组和葛仙米寡糖组均采用l1期ha759秀丽线虫。
实验步骤如下:
(1)趋化固体板的制备:在直径为90mm的ngm板中间用划1条含有30μl8m甘油(glycerol)直线,将板分为两个半圆区域,分别标记为p和q。在p区距离平板边缘1cm处的红点滴上2μl1%双乙酰,在距离甘油线1cm处用15μl20mmnan3溶液划一条平行直线。在q区距离甘油线1cm处的平行线上均匀标记a、b、c和d4个虫液点。
(2)ha759秀丽线虫准备:同步化后将ha759培养至l1期,用smedium调节虫密度为50-60条/20μl,按20μl的体积加入每孔含有10μlod值为0.5的na22、60μlsmedium溶液的96孔板中,给药组分别加入10μl各级分溶的na22、60μls培养基溶液的96孔板中,给药组分别加入10μl各级分溶液,使其终浓度为1mg/ml,对照组加入10μlsmedium,每组12个复孔。用封口膜密封96孔板后置于15℃,120rpm摇床下培养3天。
(3)趋化避化实验:分别收集各组虫液,并用smedium清洗3次以去除大肠杆菌,洗干净后,用50μlsmedium溶液重悬,用移液枪吸取虫液置于q大肠杆菌区的虫液点上。随后将板转移入23℃的培养箱中任其自由活动1.5h,然后统计回避率p区和q区的秀丽线虫数目。按计算公式计算回避率:ai(%)=[nq/(np+no)]x100
式中,np和no分别表示p区和q区的秀丽线虫数目。
秀丽线虫的ash神经元控制其高渗回避行为能力,因此在受到引诱和高渗溶液阻拦时,ash神经元未衰亡的ha759秀丽线虫具有趋向引诱剂后回避高渗溶液的双重行为特征;而ash神经元死亡的ha759秀丽线虫仅具有趋向引诱剂的趋化行为,丧失对高渗溶液的回避能力。按上述实验步骤进行实验,计算秀丽线虫对高渗溶液的回避率。
结果如图7所示,从图中可以看出,未经处理的对照组有45.5%的秀丽线虫在甘油线附近折返回避,采用葛仙米多糖处理后,ha759秀丽线虫的回避率提高至49.8%,用三氟乙酸酸解制得的葛仙米寡糖的回避指数为52.3%,用盐酸酸解制得的葛仙米寡糖的回避指数为64.6%,表明葛仙米多糖及葛仙米寡糖对ash神经元具有保护作用,也说明其具有良好的体内神经保护作用。
3、葛仙米寡糖分子量大小对秀丽隐杆线虫趋化避化实验的影响
将实施例2制备的不同分子量的寡糖溶液(即葛仙米寡糖分子量<3000da;葛仙米寡糖分子量为3000da-10000da组;葛仙米寡糖分子量为>10000da组);实施例3制备的不同分子量的寡糖溶液(即葛仙米寡糖分子量<3000da;葛仙米寡糖分子量为3000da-10000da组;葛仙米寡糖分子量为>10000da组),按上述秀丽隐杆线虫趋化避化实验方法研究葛仙米寡糖分子量大小对秀丽隐杆线虫趋化避化实验的影响。
实验结果如图8-9所示,从图8中可以看出,未经处理的对照组有45.5%的秀丽线虫在甘油线附近折返回避,采用葛仙米寡糖分子量<3000da处理后,ha759秀丽线虫的回避率为64.6%;葛仙米寡糖分子量为3000da-10000da组,ha759秀丽线虫的回避率为58.3%,葛仙米寡糖分子量为>10000da组,ha759秀丽线虫的回避率为55.6%,采用盐酸酸解得到的分子量<3000da的葛仙米寡糖,ha759秀丽线虫的回避率最高;从图9中可以看出,采用三氟乙酸酸解得到的分子量<3000da的葛仙米寡糖,ha759秀丽线虫的回避率最高。
综上所述,本发明方案制备得到的葛仙米多糖和寡糖均可以延长氧化胁迫条件下秀丽隐杆线虫的生存时间,提高其存活率,具有体内抗氧化作用,但是葛仙米寡糖的抗氧化效果更好,同时葛仙米寡糖还能提高亨延顿舞蹈病疾病模型秀丽隐杆线虫的化学避化指数,具有一定的神经保护作用。
上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
- 还没有人留言评论。精彩留言会获得点赞!