一种黄绿木霉的抗菌活性及其应用
本发明涉及生物技术领域,具体涉及一株黄绿木霉trichodermasp.qtyc44菌株的抗菌活性应用。
背景技术:
木霉属(trichodermaspp.)真菌归于半知菌亚门、丝孢纲、丝孢目、丛梗孢科、木霉属。木霉属真菌种类丰富,广泛存在于土壤和植物周围等环境中。木霉是一类多功能环境友好型真菌,广泛应用于农业、植保、环保等领域。
本发明黄绿木霉来自黄蜻幼虫肠道,昆虫肠道是微生物最重要的定殖场所,昆虫肠道一系列特征有利于微生物的定殖,包括有利于与摄食相关的微生物的定殖,肠道的营养可用性强,没有外部环境那样的压力(比如干燥、紫外线等)。不同的昆虫肠道形态和理化性质差异很大,这些因素对微生物群落结构有很大影响。肠道共生菌在与宿主昆虫密切共生,在长期自然选择和协同进化中,形成了其独特的特点
近年来,化学农药的大量使用造成坏境污染和致病菌的耐药性。为了避免人类的健康受到威胁,寻找具有新结构特征或新作用特点的药源化合物成为应对病原菌快速变化的主要方法。昆虫共生菌在与宿主长期的进化过程中,具备了特殊的代谢途径,是新型生物农药研发的宝贵资源库。因此,从昆虫肠道共生菌中分离得到结构新颖的抗菌活性物质则是当前绿色农业的手段之一。
技术实现要素:
本文提供了的黄绿木霉trichodermasp.qtyc44菌株的抗菌活性应用。
本发明所述黄绿木霉(trichodermasp.)qtyc44菌株保藏于中国典型培养物保藏中心,保藏编号:cctccm2014267,地址:湖北省武汉市武昌区八一路299号。
本发明所述黄绿木霉trichodermasp.qtyc44的基本培养形态为:在pda培养基上菌株qtyc44在pda平板上25℃培养三天后菌落直径大于65mm,完全覆盖培养皿,最佳生长温度为25℃-36℃,培养基上有浅黄绿色色素生成,7天后转变为绿色。无明显气味,无扩散色素。菌丝稀少,分生孢子3天后形成。首先生出细小分枝,接着长出浅绿色细小颗粒。分生孢子梗无色,二级分支,分生细胞特化为瓶颈状。分生孢子单孢,无色,圆形至椭圆形,3-4×2-2.5μm。菌丝无色,有隔,约1.5-3μm宽。厚垣孢子2周后出现,终端着生,光滑,球形或哑铃型,6-6.5×5-6μm。
本发明提供了黄绿木霉trichodermasp.qtyc-44的抗菌活性成分几丁质酶。
本发明提供了黄绿木霉trichodermasp.qtyc-44的抗菌活性应用。
培养基配方如下
pda/pd:土豆200.0g,葡萄糖20.0g,琼脂粉15-20g,1l蒸馏水。不加琼脂粉为pd液体培养基。
myg:葡萄糖10g,麦芽糖5g,酵母膏5g,1l蒸馏水。
几丁质酶诱导培养基:硝酸铵3g,磷酸二氢钾3g,硫酸镁0.65g,硫酸亚铁0.15g,胶体几丁质9g,加蒸馏水至1l。
几丁质酶诱导培养基中的胶体几丁质的制备方法:称取几丁质粉末12g倒入在三角瓶中,在通风厨中缓缓向三角瓶倒入100ml浓盐酸,三角瓶放置在冰盒中进行降温,用玻璃棒搅拌30min,在4℃冰箱中静置24h,将样品加入到3l无菌水中,4℃冰箱内静置12h后用盐酸和氢氧化钠调ph值为7,然后用布什漏斗过滤出上清液,再用无菌水清洗三遍,获得约9g胶体几丁质。
本发明具有如下有益效果:
1.本发明首次分离获得菌株黄绿木霉qtyc44。
2.本发明提供的菌株黄绿木霉qtyc44发酵液具有较好的几丁质酶活性。
3.本发明提供的菌株黄绿木霉qtyc44具有对黄瓜枯萎病菌、小麦赤霉菌和烟草赤星病菌等多种植物致病菌具有很好的拮抗作用。
4.本发明提供的菌株黄绿木霉qtyc44对黄瓜枯萎病有很好的防治效果。
5.本发明提供的菌株黄绿木霉qtyc44用于植物土传病害的防治对环境无污染。
附图说明
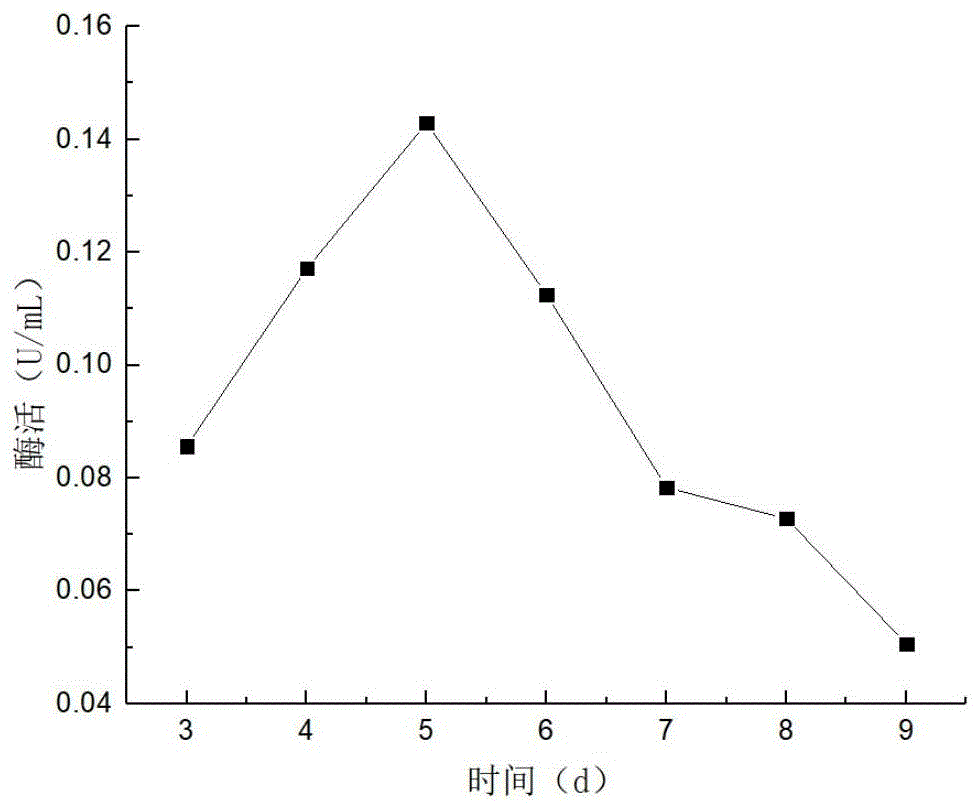
图1黄绿木霉qtyc44几丁质酶活性随发酵时间的变化曲线;
图2黄绿木霉qtyc44对三种植物致病菌的对峙培养效果
a、b、c分别为qtyc44与黄瓜枯萎病菌、小麦赤霉菌和烟草赤星病菌对峙实验;
d、e、f分别为黄瓜枯萎病菌、小麦赤霉菌和烟草赤星病菌对照组;
图3黄绿木霉qtyc44对黄瓜枯萎病菌防治效果。
具体实施方式
1.本发明所述黄绿木霉qtyc44的几丁质酶的制备和酶活测定方法,包括如下步骤:
(1)活化:取保藏号cctccm2014267的黄绿木霉qtyc44接种于pda固体培养基上,在28℃活化培养4-7d,制得活化菌株;
(2)将步骤(1)制得的活化菌株接种到myg液体培养基中发酵,28℃、ph7.0条件下,培养3-4d,制得种子液;
(3)将步骤(2)制得的种子液接种到几丁质酶诱导培养基中发酵,28℃、ph7.0条件下,培养6-9d,制得发酵液;
(4)取步骤(3)制得的发酵液,经8000r/min离心10min,第3-9d,每天取其上清液作为粗酶液。
在试管中加入粗酶液0.5ml,加入0.5mmph7.8磷酸缓冲液1.5ml,加入胶体几丁质溶液1.0ml,振荡混匀后,在40℃水浴锅中反应90min。然后8000r/min离心10min,取上清液3ml加入dns试剂1.5ml,振荡混匀后沸水浴10min。待冷却后每支试管加入蒸馏水至10ml,用分光光度计于540nm处测定吸光度。对照为待测酶液加入几丁质胶质之前沸水浴10min使酶失活。每个样品重复三次,取平均值记作od515nm,然后减去对照组的吸光值,它们的差值记作△a515nm。根据样品的吸光值差值计算出粗酶液的几丁质酶活性。
几丁质酶酶活:一个几丁质酶酶活单位(1u)定义为在40℃,ph7.8条件下,每分钟酶催化胶体几丁质进行反应所释放的1μmolnag所需的酶量。
黄绿木霉qtyc44几丁质酶活性随发酵时间的变化情况,如图1所示。几丁质酶活在第3d到第5d为上升趋势,第5d达到最高,最大值为0.1429u/ml。
2.黄绿木霉qtyc44对植物病原菌的离体拮抗活性
采用琼脂法测定黄绿木霉trichodermasp.qtyc44对植物致病真菌的离体拮抗活性测试。将黄绿木霉qtyc44对植物致病真菌接种到pda培养基中活化培养3-4d。用直径6mm的打孔器取黄绿木霉qtyc44和植物致病真菌的菌饼,将菌饼相距4cm对称贴在pda平板两侧,空白对照组为只接植物致病真菌。每组重复三次,28℃培养5d,测量植物致病菌的直径数据,并计算抑菌率。
trichodermasp.qtyc44与植物致病真菌的对峙试验结果如表1所示,对峙效果如图2所示,trichodermasp.qtyc44对黄瓜枯萎病菌、小麦赤霉病菌、烟草赤星病菌都表现出良好的抑制作用,抑制率分别为80.3%、94.3%和87.6%。
表1trichodermasp.qtyc44对植物致病真菌的抑制半径(mm)
3、黄绿木霉qtyc44对黄瓜枯萎病菌的防治效果
采用灌根法,测试trichodermasp.qtyc44对黄瓜枯萎病菌的活体活性。取健康的黄瓜种子(津研四号,酒泉昌丰农业开发有限公司)表面消毒:依次2%的naclo溶液浸泡3min,75%酒精浸泡2min,无菌水洗3遍。然后铺在潮湿无菌滤纸上进行催芽,2d后选取长势一样萌芽的黄瓜种子移栽到培养钵中,放在光照培养箱中培养。光照培养箱设置28℃,10h光照,14h黑暗循环,每两天浇一次水。
待黄瓜苗生长至两叶一心期时,用20ml106cfu/ml的黄瓜枯萎病菌孢子悬浮液浇灌黄瓜苗的根部,2d后再浇灌20ml107cfu/ml的黄绿木霉qtyc44孢子悬浮液,空白对照组用无菌水灌根。每盆2株幼苗,每个处理12盆作为重复。定期观察黄瓜苗生长和发病情况,20d后进行生物防治效果统计分析。黄瓜枯萎病分级标准如表2所示。根据统计结果和下面公式计算病情指数和防效。
表2黄瓜枯萎病的分级标准
黄绿木霉qtyc44孢子液对黄瓜枯萎病菌的盆栽试验结果如图3所示,经20d的盆栽调查,trichodermasp.qtyc44孢子液对黄瓜枯萎病的防治效果明显,对照组的病情指数为64.58%;而实验组的病情指数为17.71%,trichodermasp.qtyc44孢子液对黄瓜枯萎病的防效高达72.58%。
- 还没有人留言评论。精彩留言会获得点赞!