骨形成蛋白在促进人皮肤成纤维细胞分化成脂肪细胞中的应用
本发明涉及生物技术领域,尤其涉及骨形成蛋白在促进人皮肤成纤维细胞分化成脂肪细胞中的应用。
背景技术:
骨形态发生蛋白(bonemorphogeneticprotein,bmp)又称骨形成蛋白,是一组具有类似结构的高度保守的功能蛋白,属于tgf-β家族。骨形成蛋白可以刺激间充质细胞定向分化为成骨细胞,是体内诱导骨和软骨形成的主要因子,对骨骼的发育和再生修复起重要作用。骨形成蛋白广泛地存在于存在于猪、牛、羊、兔、鼠及人的胚胎、血细胞、肾和脾脏等组织中,其不仅参与骨骼的调节,而且对肾脏、肝脏、骨骼及神经系统发育也起到一定作用。
现有技术存在有通过各种试剂组合促使人皮肤成纤维细胞分化为脂肪细胞的方法,但是这些方法中的人皮肤成纤维细胞分化为脂肪细胞的效率相对较低,很难在临床上广泛用于创伤修复、疤痕修复以及脂营养不良症治疗等。
技术实现要素:
为了解决现有技术存在的问题,本发明提供骨形成蛋白在促进人皮肤成纤维细胞分化成脂肪细胞中的应用。
第一方面,本发明提供骨形成蛋白在促进人皮肤成纤维细胞分化成脂肪细胞中的应用。
本发明发现在诱导人皮肤成纤维细胞分化为脂肪细胞之前,采用骨形成蛋白进行预处理可以有效提高人皮肤成纤维细胞分化为脂肪细胞的效率。
第二方面,本发明提供一种促进人皮肤成纤维细胞分化成脂肪细胞的方法,包括:
在诱导人皮肤成纤维细胞分化为脂肪细胞之前,采用骨形成蛋白预处理所述人皮肤成纤维细胞;
所述骨形成蛋白的浓度为50~400ng/ml,处理时间为12~48h。
进一步地,所述骨形成蛋白的浓度为100~200ng/ml,处理时间为12~24h。
进一步地,所述骨形成蛋白为骨形成蛋白2或骨形成蛋白4。
进一步地,在所述人皮肤成纤维细胞汇合度达到50-70%时进行所述预处理流程。
进一步地,所述诱导人皮肤成纤维细胞分化为脂肪细胞为:
将预处理后的人皮肤成纤维细胞置于分化培养基一中培养6~10天;后置于分化培养基二中培养2~4天;后置于基础培养基中培养8~12天;
所述分化培养基一为额外添加了地塞米松、胰岛素、罗格列酮或1-甲基-3-异丁基黄嘌呤中至少两种的基础培养基;
所述分化培养基二为额外添加胰岛素的基础培养基。
进一步地,所述基础培养基为包括:10%~20%胎牛血清、50~150u/ml青霉素和50~150u/ml链霉素的高糖dmem培养基。
进一步地,所述分化培养基一为额外添加了0.5~1μm地塞米松、10~20μg/ml胰岛素、1~2μm罗格列酮和0.5~1mm1-甲基-3-异丁基黄嘌呤的基础培养基;
所述分化培养基二为额外添加了10~20μg/ml胰岛素的基础培养基。
进一步地,所述人皮肤成纤维细胞的代数≤10。
本发明进一步提供所述方法制备得到的脂肪细胞。
本发明具备如下有益效果:
本发明在对人皮肤成纤维细胞进行诱导分化之前,先对细胞进行骨形成蛋白预处理,然后再按照“6+2+8”分化模式进行诱导分化。这种“先骨形成蛋白预处理,再诱导分化”的模式,极大地提高了人皮肤成纤维细胞分化成脂肪细胞的效率,提升100%左右。
本发明提供的诱导方法高效地将人皮肤成纤维细胞诱导分化成脂肪细胞,为临床上的创伤修复、疤痕修复以及脂营养不良症的治疗提供新思路、新方法。
附图说明
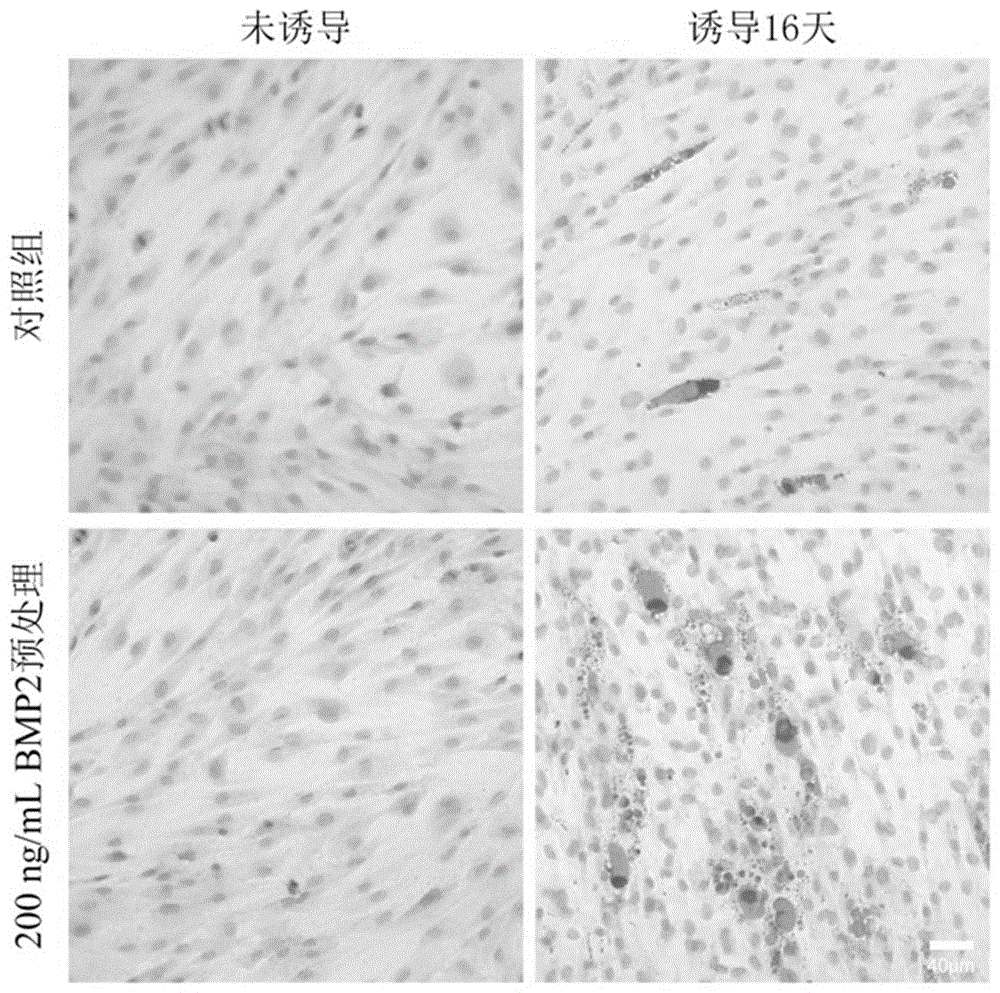
图1为本发明实施例1提供的油红染色结果。
图2为本发明实施例1提供的油红染色统计结果;**表示p<0.01,***表示p<0.001,****表示p<0.0001,不同处理组之间的差异具有统计学意义。
图3为本发明实施例1提供的成熟脂肪细胞标志基因检测结果;**表示p<0.01,***表示p<0.001,****表示p<0.0001,不同处理组之间的差异具有统计学意义。
图4为本发明实施例2提供的油红染色结果。
图5为本发明实施例2提供的油红染色统计结果;**表示p<0.01,***表示p<0.001,****表示p<0.0001,不同处理组之间的差异具有统计学意义。
图6为本发明实施例2提供的成熟脂肪细胞标志基因检测结果;**表示p<0.01,***表示p<0.001,****表示p<0.0001,不同处理组之间的差异具有统计学意义。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
实施例1
本实施例提供一种促进人皮肤成纤维细胞分化成脂肪细胞的方法:
1、原代人皮肤成纤维细胞(humandermalfibroblasts,hdf)的获取
(1)从志愿者身上取下直径为1mm的皮肤组织,用磷酸盐缓冲溶液(pbs)冲洗3次;
(2)在细胞间的超净工作台中,用眼科剪去除多余的脂肪组织,并且剪碎剩下的组织,用pbs清洗3次,放入10cm的细胞培养皿中;
(3)吸掉pbs,加入1-2ml0.25%的胰酶,浸没所有的组织块,放在含有5%co2的细胞培养箱中,37℃消化5-10分钟;
(4)消化结束后,加入1ml普通培养基终止消化,然后用移液枪轻轻反复吹吸,将细胞团吹散;
(5)将细胞悬液分别转移到35mm培养皿中,加入4ml普通培养基,放在细胞培养箱中,在5%co2,37℃的条件下培养4-6天;
(6)随着培养的进行,可以根据培养皿内培养基的量,适当补加培养基。最后,分离出的细胞就是原代人皮肤成纤维细胞;
待细胞长满后,进行传代培养;
在整个细胞分离过程中,确保无菌操作,避免污染。待细胞分离出来后进行支原体检测,确认没有支原体污染后,进行后续实验。
本实施例通过多次诱导分化实验发现,用于诱导分化的hdf细胞代数较高时hdf细胞诱导分化效率比较低,并且细胞代数越高,诱导分化越难,分化效率越低。因此,本实施例中采用10代以内的hdf细胞进行后续诱导分化实验。
2、细胞的诱导分化
2.1诱导分化
(1)取出泡在75%酒精中的盖玻片,在酒精灯上灼烧灭菌,然后铺在35mm的培养皿中,每个培养皿铺4个盖玻片;
(2)往培养皿中加入4ml普通培养基,并用镊子将重叠的盖玻片铺开,以备后面细胞传代使用。
(3)待10cm培养皿里的原代hdf细胞长满后,吸掉培养皿中的培养基,用磷酸盐缓冲溶液(pbs)洗2次,每次2ml;然后吸掉pbs,加入1ml浓度为0.25%的胰酶,双手反复晃动培养皿,使胰酶均匀浸润培养皿底部;最后放在含有5%co2的细胞培养箱中,37℃消化1-2min;
(4)取出消化的细胞,往培养皿中加入0.5ml基础培养基,终止消化;然后用移液器反复吹吸,将细胞吹匀,并切转移到1.5ml离心管中,1000rpm/min离心4分钟;
(5)吸掉上清,加入1ml基础培养基,轻轻反复吹吸,将细胞混匀;然后按1:4的传代比例,将细胞悬液平均分到4个铺有盖玻片的35mm培养皿中,双手反复晃动培养皿,使细胞混匀,然后放在细胞培养箱中培养;
(6)待细胞汇合度达到50-70%后,加入终浓度为200ng/ml的骨形成蛋白2,对细胞预处理24小时;
(7)吸掉基础培养基,加入3ml分化培养基一,放回细胞培养箱中连续诱导培养6天,每两天更换一次新鲜培养基;在更换培养基时,将轻轻地沿着培养皿壁添加培养基;
(8)吸掉分化培养基一,加入3ml分化培养基二,诱导培养2天;随着诱导分化的进行,在10倍显微镜下会发现细胞内逐渐出现亮闪闪的圆形脂肪滴;
(9)吸掉分化培养基二,加入3ml基础培养基,继续培养8天,每两天更换一次新鲜培养基;在显微镜下会发现,含有脂肪滴的细胞越来越多,并且细胞内的脂肪滴越来越大;
(10)诱导分化结束后,取出培养皿中的盖玻片进行油红染色,检测诱导分化效果;另外,提取培养皿剩余细胞的rna,进行荧光定量pcr,检测成熟脂肪细胞的标志基因adiponectin,fabp4和leptin的表达,进一步验证诱导分化的结果。
基础培养基:高糖dulbecco’smodifiedeaglemedium(dmem)+20%胎牛血清+100u/ml青霉素+100μg/ml链霉素;
分化培养基一:在基础培养基中,加入dexamethasone(地塞米松),insulin(胰岛素),rosiglitazone(罗格列酮),3-isobutyl-1-methylxanthine(1-甲基-3-异丁基黄嘌呤),终浓度分别为1μm,20μg/ml,2μm,0.5mm;
分化培养基二:在基础培养基中,加入终浓度为20μg/ml的insulin。
3、诱导分化结果分析
3.1油红染色
油红o是一种很强的脂溶剂和染脂剂,能够与甘油三酯结合,因此经常被用于脂肪染色。本实施例对诱导分化后的细胞进行油红染色,来检测成熟脂肪细胞内的脂肪滴。具体操作如下:
(1)将盖玻片用pbs洗3次,然后用4%多聚甲醛(pfa)固定20分钟;
(2)用pbs洗3次后,用60%异丙醇平衡5分钟;
(3)用浓度为3g/l的油红o(溶解在60%异丙醇中)密闭染色10分钟;
(4)用60%异丙醇洗3次;
(5)用苏木精染色2分钟;
(6)用pbs洗3次,晾干后封片进行成像;
(7)统计油红染色呈阳性的细胞数;
3.2成熟脂肪细胞标志基因检测
adiponectin,fabp4和leptin是成熟脂肪细胞的标志基因,经常被用来衡量脂肪细胞诱导分化的效果。本实施例用trizol从诱导分化后的细胞中提取总rna,反转录后进行荧光定量pcr,检测adiponectin,fabp4和leptin这三个基因的表达水平。
所用pcr引物序列如下:
adiponectin:5’-gatggcagagatggcac-3’
5’-gctgagcggtatacatagg-3’
fabp4:5’-acgagaggatgataaactggtgg-3’
5’-gcgaacttcagtccaggtcaac-3’
leptin:5’-caccaaaaccctcatcaagaca-3’
5’-ctttctgtttggaggagactgact-3’
4、检测结果分析
油红染色结果如图1所示,深色部分是染色的脂肪,未诱导的hdf细胞没有脂肪累积,而诱导分化16天的hdf细胞有明显的脂肪累积。并且相对于对照组,200ng/mlbmp2预处理24小时后再诱导能明显促进脂肪细胞分化;
油红染色统计结果如图2所示,未诱导的hdf细胞中油红染色呈阳性的细胞数为0,诱导分化16天的hdf细胞中油红染色呈阳性的细胞数分别为:对照组475个/cm2,200ng/mlbmp2预处理组950个/cm2,预处理组相较于对照组提高了100%左右;
成熟脂肪细胞标志基因检测如图3所示,本实施例通过定量pcr(quantitativepcr),检测了adiponectin,fabp4,leptin三个成熟脂肪细胞的标志基因。200ng/mlbmp2预处理组fabp4、leptin的表达明显高于对照组。
实施例2
本实例涉及到的培养基以及具体实验步骤同实例1,同样采用“6+2+8”诱导分化模式。不同之处在于,预处理改为200ng/mlbmp4预处理24小时。
诱导分化结束后,通过油红染色和成熟脂肪细胞标志基因检测来检测诱导分化的结果。结果如下:
油红染色结果如图4所示,深色部分是染色的脂肪,未诱导的hdf细胞没有脂肪累积,而诱导分化16天的hdf细胞有明显的脂肪累积。并且相对于对照组,200ng/mlbmp4预处理24小时后再诱导能明显促进脂肪细胞分化;
油红染色统计结果如图5所示,未诱导的hdf细胞中油红染色呈阳性的细胞数为0,诱导分化16天的hdf细胞中油红染色呈阳性的细胞数分别为:对照组260个/cm2,200ng/mlbmp4预处理组446个/cm2;
成熟脂肪细胞标志基因检测结果如图6所示,本实施例通过定量pcr(quantitativepcr),检测了adiponectin,fabp4,leptin三个成熟脂肪细胞的标志基因。200ng/mlbmp4预处理组adiponectin,fabp4,leptin的表达明显高于对照组。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110>北京大学
<120>骨形成蛋白在促进人皮肤成纤维细胞分化成脂肪细胞中的应用
<130>khp211113314.7
<160>6
<170>siposequencelisting1.0
<210>1
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>1
gatggcagagatggcac17
<210>2
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>2
gctgagcggtatacatagg19
<210>3
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>3
acgagaggatgataaactggtgg23
<210>4
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>4
gcgaacttcagtccaggtcaac22
<210>5
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>5
caccaaaaccctcatcaagaca22
<210>6
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>6
ctttctgtttggaggagactgact24
- 还没有人留言评论。精彩留言会获得点赞!