一种左旋烟碱的制备方法与流程
1.本发明涉及化学合成技术领域,具体涉及一种左旋烟碱的制备方法。
背景技术:
2.烟碱的化学名:3-(1-甲基吡咯-2-基)吡啶,通用名是尼古丁,是一种天然生成的液态生物碱,具有强烈的生理活性。烟碱通常主要存在于天然烟草中,在农业、医药中间体以及电子烟领域具有广泛的用途。
3.当前商业化的烟碱主要从烟草等植物中提取纯化,天然烟碱主要是左旋体,由于烟叶中含有种类繁多的生物碱,且不易相互分离,因此提取法制备的左旋尼古丁纯度较低,通常纯度不到95%,含有很多对人体系统不健康,并且许多已经证明致癌的其它烟碱杂质。同时从烟草等植物中提取纯化尼古丁还会受到原材料、气候、土地资源以及周期等多方面因素的影响,因此,利用化学法定向合成左旋尼古丁是当前的一个研究热点,能够避免传统提取工艺中产品纯度低、原料受限性大等缺点。
4.文献journal of labelled compounds and radiophrmaceuticals,1977,9(4),461-469;报道了一条从吡啶为起始原料,与三甲基硅基保护的吡咯烷酮反应制备烟碱的方法:
[0005][0006]
该方法需要用到易燃有机金属锂且需要在-78℃下操作,且该路线中吡咯烷酮用三甲基硅保护氮原子,物料成本相对较高。
[0007]
文献organic syntheses,[j],1998,215-218公开了一条使用烟酸甲酯为起始原料的合成路线,经四步反应制备消旋尼古丁的方法:
[0008]
[0009]
该专利路线前两步合成麦斯明的反应收率为40%左右且有大量焦油影响后续成品的纯度和外观。
[0010]
专利us2013030188a1、cn102633773b公开了一条使用烟酸甲酯和n-丁烯吡咯烷酮为起始原料的合成路线,经四步反应制备消旋尼古丁的方法:
[0011][0012]
该路线中的n-丁烯吡咯烷酮需要自制,物料成本较高,且采用危险性较高的氢化钠做碱,反应过程中会产生大量氢气,放大生产有安全隐患。
[0013]
专利ep2484673、us0197022、wo121644、cn1124093293中公开了以消旋的烟碱为起始物料通过廉价的手性酸进行拆分得到左旋烟碱的制备方法。
[0014][0015]
该路线中用廉价的手性酸拆分消旋体得到左旋烟碱,单步拆分收率40%左右。拆分工艺成本高,拆分母液中损失60%烟碱;且拆分需要两次倒酸碱,因此产生的三废多。
[0016]
专利cn112409327公开了一种以烟酸酯为起始物料,在碱的作用下生成β-酮酸酰胺,然后在酸性条件下合环得到麦斯明,再通过生物发酵法得到左旋去甲尼古丁,最后上甲基得到目标左旋烟碱的制备方法。
[0017][0018]
该方法通过酶催化得到左旋烟碱,成本比拆分低50%,但是发酵工艺会引入微量蛋白残留,属于生物制品非全合成产品。
[0019]
现有技术中制备得到的烟碱大多为消旋烟碱,要得到光学纯度高的单一手性烟
碱,需要采用化学拆分法分离提纯,工艺过于繁琐;或者采用生物酶催化制备得到左旋烟碱,该方法会引入微量蛋白残留,而对残留蛋白得检测定量比较困难。
[0020]
因此,为满足目前市场对高纯度没有其它有害化合物污染的左旋尼古丁的需求,需要开发效率较高、产品纯度较高且适合大规模的工业化生产的人工合成左旋烟碱的方法。
技术实现要素:
[0021]
为解决现有技术中存在的问题,本发明提供一种左旋烟碱的制备方法,采用如下合成路线:
[0022][0023]
所述制备方法包括如下步骤:
[0024]
(1)式i化合物还原得到式ii化合物;
[0025]
(2)式ii化合物经成环反应得到左旋去甲尼古丁;
[0026]
(3)左旋去甲尼古丁经甲基化得到左旋烟碱;
[0027]
所述式i、式ii化合物中,r为h,甲酰基,乙酰基,丙酰基,叔丁氧羰基,苄氧羰基。
[0028]
根据本发明的实施方案,所述步骤(1)中,在配体和金属催化剂存在下还原;在一些实施方案中,所述配体和金属催化剂原位生成手性催化剂。根据本发明的实施方案,所述原位生成的反应温度范围是:10~100℃,优选的为20~80℃,例如,选自30℃、40℃、50℃、60℃、70℃。
[0029]
根据本发明的实施方案,所述步骤(1)中采用如下试剂中的一种或多种作为反应溶剂:甲苯、四氢呋喃、乙醇、2-甲基四氢呋喃、甲基叔丁基醚、二氯甲烷、乙酸乙酯;
[0030]
根据本发明的实施方案,所述步骤(1)中,所述金属催化剂选自:rh(cod)cl2、ir(cod)cl2、ru(cod)cl2、pdcl(pph3)3、pdcl2(pph3)2、ni(acac)2、nicl2、ni(cod)2。
[0031]
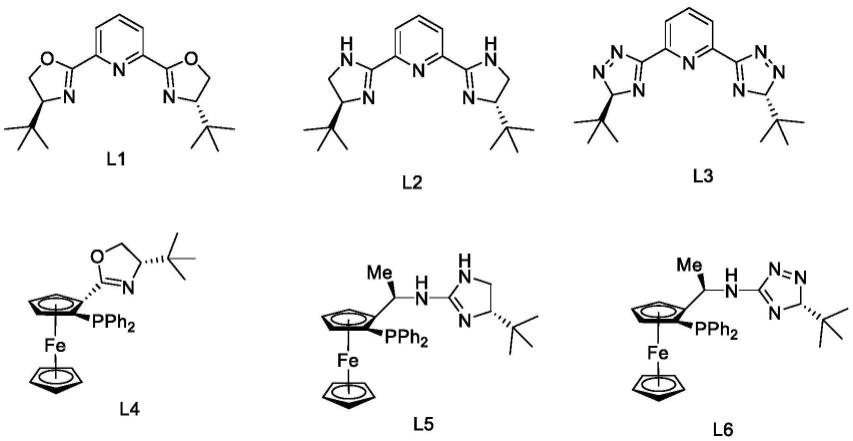
根据本发明的实施方案,所述步骤(1)中,所述配体选自如下结构:
[0032]
[0033]
根据本发明的实施方案,所述步骤(1)中,反应温度范围是:10~150℃,优选的,为20~100℃,例如,选自30℃、40℃、50℃、60℃、70℃、80℃、90℃,更优选的,为30~40℃。
[0034]
根据本发明的实施方案,所述步骤(1)中,所述反应溶剂和式i化合物的投料质量比为20:1~3:1,优选的,为10:1~3:1,例如为5:1。
[0035]
根据本发明的实施方案,所述步骤(1)中,所述配体与金属催化剂的投料质量比为10:1~1:1,例如为10:1,9:1,8:1,7:1,6:1,5:1,4:1,3:1,2:1。
[0036]
根据本发明的实施方案,所述步骤(1)中,所述还原反应为氢化还原,反应中通入氢气,所述反应压力为0.5~2.0mpa,例如为1.0mpa,1.5mpa。
[0037]
根据本发明的实施方案,所述步骤(1)还包括后处理步骤,所述后处理步骤包括减压浓缩,向浓缩液中加入有机溶剂析出式ii化合物,所述有机溶剂可选自小极性溶剂,例如正己烷、正庚烷等。
[0038]
根据本发明的实施方案,所述步骤(1)中,室温下向高压釜中加入乙酸乙酯、式i化合物;同时在氮气保护下向另一容器中加入配体和金属催化剂,体系在20~40℃下搅拌0.5~1.5h用氮气把原位生成的催化剂转移到高压釜中。所述高压釜用氮气置换3次再压入0.9~1.2mpa氢气,体系在30~40℃下反应4h,经后处理反应得到式ii化合物。
[0039]
根据本发明的实施方案,所述步骤(2)中,采用如下试剂中的一种或多种作为反应溶剂:乙酸乙酯、二氯甲烷、四氢呋喃、甲苯、2-甲基四氢呋喃、正己烷、甲基叔丁基醚。
[0040]
根据本发明的实施方案,所述步骤(2)中,将式ii化合物在碱作用下发生成环反应;所述碱选自氢氧化钾、氢氧化钠、叔丁醇钾、乙醇钠、碳酸钾、氢化钠、三乙胺中的一种或多种。
[0041]
根据本发明的实施方案,所述步骤(2)中,向反应容器中加入反应溶剂、所述式ii化合物和所述碱后,进一步加入试剂i;所述试剂i选自对甲苯磺酰氯、甲基磺酰氯、三氟甲磺酸酐等;优选的,上述步骤后滴加酸进行酸化后再加入碱性试剂调节ph值。所述酸可选自盐酸,硫酸,三氟乙酸等;所述碱性试剂选自氢氧化钠水溶液。
[0042]
根据本发明的实施方案,所述步骤(2)中,所述反应溶剂和式ii化合物的投料质量比为20:1~3:1,优选的,为10:1~3:1,例如为5:1。
[0043]
根据本发明的实施方案,所述步骤(2)中,所述碱与式ii化合物的投料质量比为5:1~1:5,优选的,为3:1~1:3,例如为1:1。
[0044]
根据本发明的实施方案,所述步骤(2)中,所述试剂i与式ii化合物的投料质量比为5:1~1:5,优选的,为3:1~1:3,例如为1:1,1:1.1,1:1.2。
[0045]
根据本发明的实施方案,所述步骤(2)中,还包括成环反应后,经后处理步骤得到左旋去甲尼古丁;所述后处理步骤为萃取并浓缩;
[0046]
根据本发明的实施方案,所述步骤(2)中,室温下向反应容器中加入反应溶剂、式ii化合物和碱,滴加试剂i,滴加完毕体系在20~40℃反应1~3h,滴加盐酸并搅拌1~3h,再加入氢氧化钠水溶液,体系在20~40℃下反应1~3h,经后处理得到左旋去甲尼古丁
[0047]
根据本发明的实施方案,所述步骤(3)中,左旋去甲尼古丁与甲基化试剂反应,用碱性试剂调节ph后得到左旋烟碱;所述碱性试剂选自氢氧化钠水溶液;所述ph值大于等于8,可选自9,10,11,12。
[0048]
进一步的,所述步骤(3)还包括后处理步骤,所述后处理步骤为经萃取得到左旋烟
碱粗品,减压蒸馏得到纯品。
[0049]
根据本发明的实施方案,所述步骤(3)中,采用如下试剂中的一种或多种作为甲基化反应溶剂:水、1,4-二氧六环、四氢呋喃、甲醇、乙二醇二甲醚、乙醇等。
[0050]
根据本发明的实施方案,所述步骤(3)中,甲基化试剂选自:甲醛(例如甲醛水溶液)、多聚甲醛、碘甲烷、硫酸二甲酯中的一种或多种。
[0051]
根据本发明的实施方案,所述步骤(3)中,反应温度范围是:40~120℃,优选的为50~100℃,例如,选自60℃、70℃、80℃、90℃。
[0052]
根据本发明的实施方案,所述步骤(3)中,采用甲基化试剂体系,所述甲基化试剂体系除甲醛(例如甲醛水溶液)、多聚甲醛、碘甲烷、硫酸二甲酯中的一种或多种以外,还进一步包括甲酸;优选的,采用的甲基化试剂体系包括多聚甲醛和甲酸;更优选的,所述甲基化试剂体系中,多聚甲醛和甲酸的投料质量比为0.8:1~1:0.8,例如为0.9:1,1:1。根据本发明的实施方案,反应中的萃取溶剂(例如步骤(2)、步骤(3)中后处理采用)可选自如下试剂中的一种或多种:乙酸乙酯、甲叔醚、二氯甲烷等。
[0053]
根据本发明的实施方案,所述步骤(3)中,所述甲基化试剂和左旋去甲尼古丁的投料质量比为5:1~1:5,优选的,为2:1~1:2,例如为1:1,1:1.1,1:1.2,1:1.3;所述反应溶剂和左旋去甲尼古丁的投料质量比为2:1~1:5,例如为1:1,1:2,1:3,1:4。
[0054]
根据本发明的实施方案,所述步骤(3)中,室温下向反应容器中加入反应溶剂、左旋去甲尼古丁和多聚甲醛、甲酸体系,回流反应3~6h,体系浓缩除去有机溶剂,用氢氧化钠水溶液调ph=10~11,经后处理得到左旋烟碱。
[0055]
本发明还提供一种催化剂,所述催化剂由配体和金属催化剂原位生成,其中,所述金属催化剂选自:rh(cod)cl2、ir(cod)cl2、ru(cod)cl2、pdcl(pph3)3、pdcl2(pph3)2、ni(acac)2、nicl2、ni(cod)2;所述配体选自如下结构:
[0056][0057]
本发明还提供所述催化剂在还原反应中的应用,优选的,应用于羰基还原反应,更优选的,应用于羰基不对称还原反应,例如,可应用于前文所述步骤(1)的反应中。
[0058]
有益效果
[0059]
1)本发明的合成工艺最终可得到光学纯度高达99.7%的左旋烟碱,合成的总收率达到60~70%,整个制备过程中反应物料廉价易得,操作简单,环境友好,适合大规模的工
业化生产。
[0060]
2)本发明采用特定配体和金属催化剂进行还原反应能够显著提高反应质量。
附图说明
[0061]
图1为本发明左旋烟碱的质谱图;
[0062]
图2为本发明左旋烟碱的核磁图;
[0063]
图3为本发明左旋烟碱的光学纯度图。
具体实施方式
[0064]
下文将结合具体实施例对本发明的技术方案做更进一步的详细说明。应当理解,下列实施例仅为示例性地说明和解释本发明,而不应被解释为对本发明保护范围的限制。凡基于本发明上述内容所实现的技术均涵盖在本发明旨在保护的范围内。
[0065]
除非另有说明,以下实施例中使用的原料和试剂均为市售商品,或者可以通过已知方法制备。
[0066]
光学检测仪器以及方法:检测仪器a(紫外检测器);采用手性色谱柱大赛路od-h柱子,流动相为:异丙醇/正庚烷=5/95,流速0.9ml/min,进样量10微升,检测波长254nm,柱温25℃。
[0067]
通用反应路线:
[0068][0069]
实施例1:中间体式ii化合物的制备
[0070]
20℃下向20l的高压釜中加入10kg乙酸乙酯、2kg的式i化合物(r为叔丁氧羰基,即(4-氧代-4-(吡啶-3-基)丁基)氨基甲酸叔丁酯),体系混合均匀;同时氮气保护下向500ml三口瓶中加入10g配体l3和5g ni(cod)2,体系在30℃下搅拌1h用氮气把原位生成的催化剂转移到20l高压釜中。20l高压釜用0.2mpa的氮气置换3次再压入1.0mpa氢气,体系在30~40℃下反应4h,tlc确认原料完全转化。体系排空后并用0.2mpa氮气置换2次再减压浓缩除去6kg的乙酸乙酯并降温到20℃,向浓缩液中滴加5kg的正己烷析出2kg的目标中间体式ii化合物(r为叔丁氧羰基,即(s)-(4-羟基-4-(吡啶-3-基)丁基)氨基甲酸叔丁酯)。液相纯度为99.2%,光学纯度99.5%e.e,收率99%,可直接用于下一步反应。1hnmr(cdcl3,400m)δ:8.71(d,j=8.0hz,1h),8.52(d,j=8.2hz,1h),7.41(d,j=8.0hz,1h),7.37~7.30(m,1h),6.87(s,1h),4.51(t,j=4.0hz,1h),3.01~2.93(m,1h),3.06(t,j=4.2hz,2h),1.56~1.50(m,4h),1.43(s,9h);lc-ms calc:266.34,detec.m+1:267.3。
[0071]
实施例2:左旋去甲尼古丁的制备
[0072]
25℃下向50l的三口瓶中加入15kg二氯甲烷、3kg的中间体3和3kg三乙胺,体系控温20℃,滴加2.5kg对甲苯磺酰氯,滴加完毕体系在30℃反应2h,tlc确认中间体3完全消耗滴加2kg 6n的盐酸并搅拌2h,再加入4kg 20%的氢氧化钠水溶液反应液。体系在30℃下反应2h,用二氯甲烷萃取三次,每次用9kg,合并有机相浓缩得到1.42kg目标中间体2,即左旋
去甲尼古丁。液相纯度为98%,光学纯度99.5%e.e,收率85.1%,可直接用于下一步反应。1hnmr(cdcl3,400m)δ:8.58(d,j=8.0hz,1h),8.47(d,j=8.2hz,1h),7.70~7.66(m,1h),7.24~7.20(m,1h),4.12(t,j=4.5hz,1h),3.21(m,1h),3.06(t,j=4.2hz,2h),2.20~2.18(m,1h),1.81~1.66(m,3h);lc-ms calc:148.24,detec.m+1:149.2。
[0073]
实施例3:左旋烟碱的制备
[0074]
25℃下向50l的三口瓶中加入5kg甲醇、10kg中间体2和8kg多聚甲醛、8kg甲酸体系,90℃回流反应5h。体系浓缩除去有机溶剂,用氢氧化钠水溶液调ph=11,用乙酸乙酯萃取三次,每次用10kg,合并有机相浓缩得到烟碱粗品再减压蒸馏得到纯品左旋烟碱,产物为无色透明液体,光学纯度99.6%e.e。纯品的馏分重量为9.29kg,收率84.9%,化学纯度99.7%。1hnmr(400mhz,cdcl3)δ:8.47~8.44(br,2h),7.61(d,j=8.0hz,1h),7.20~7.16(m,1h),3.18(t,j=8.0hz,1h),3.11(t,j=8.0hz,1h),2.25~2.19(m,1h),2.13~2.09(m,1h),2.08(s,3h),1.89~1.87(m,1h),1.76~1.66(m,2h)。lc-ms calc:162.24,detec.m+1:163.20。所得纯品左旋烟碱经光学检测(检测器a,254nm),结果如图3以及如下表所示:
[0075][0076][0077]
以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1