检测SNF5基因表达的试剂在制备动脉粥样硬化诊断产品中的应用
本发明涉及本发明属于医学技术领域,具体涉及检测snf5基因表达的试剂在制备动脉粥样硬化诊断产品中的应用。
背景技术:
动脉粥样硬化(atherosclerosis)是由损伤或生化刺激等因素作用于动脉管壁引起的、涉及多细胞、多因素、多环节的慢性全身性疾病,主要累及大、中动脉,受累血管壁出现脂质积聚、细胞外基质蛋白沉积、动脉内膜钙化,导致动脉弹性下降、管腔狭窄,还可能导致动脉血栓的形成甚至破裂,严重危害着人类的身体健康。概括起来,研究人员关于动脉粥样硬化发病机制的观点主要有炎症反应学说、平滑肌克隆增殖学说、血管损伤反应学说、血栓镶嵌学说以及其他学说等。目前已有大量证据支持炎症反应在动脉粥样硬化发病机制中的重要地位,然而炎症反应具体环节的整体协调及其相互作用机制仍未阐明。
动脉粥样硬化是工业化社会中死亡和严重疾病的主要原因之一,它正在成为全球性的健康问题。同型半胱氨酸(hcy)是动脉粥样硬化的独立危险因素,它通过多种机制的协同作用参与炎症反应。动脉粥样硬化的发病机理与炎症分子有关,包括细胞因子白介素-1β(il-1β),细胞因子白介素6(il-6)和肿瘤坏死因子-α(tnf-α)。其中,il-1β在广泛的炎性疾病(包括动脉粥样硬化及其并发症)中起关键作用。然而,在由hcy引起的动脉粥样硬化发生和发展过程中引起il-1β水平升高的机制仍不清楚。
开关/不可发酵蔗糖(swi/snf)是一种进化上保守的多亚基染色质重塑复合物,可调节表观遗传结构和细胞特性。最近,swi/snf复合物在癌症中的作用变得更加明显,并已被确定为癌症中最频繁突变的染色质调节复合物。人类对各种癌细胞的基因组测序显示出swi/snf因子特别是snf5的频繁突变,swi5是swi/snf复合体的亚基之一,通过控制染色质动力学在调节基因表达中起着关键作用。作为一种有效的,真正的肿瘤抑制基因,许多研究表明,snf5在多种癌症中的表达突变或缺失,包括横纹肌瘤,前列腺癌,透明细胞肾细胞癌和结肠癌。此外,研究表明snf5可以调控众多与癌症相关的基因。例如,snf5可以通过rb介导的e2f靶基因(包括细胞周期蛋白a和e2f113)的阻遏来调节细胞周期。这些发现共同强调了snf5的抑癌作用,并说明了swi/snf在维持人类肿瘤中的致癌基因表达程序中的功能。但是目前针对snf5在动脉粥样硬化的发生机制中的作用尚未阐明。
技术实现要素:
为了弥补现有技术的不足,本发明的目的之一是提供检测snf5基因表达的试剂在制备动脉粥样硬化诊断产品中的应用。
进一步的,所述试剂包括:通过qrt-pcr、westernblot和免疫荧光法检测snf5基因表达水平的试剂。
更进一步的,所述qrt-pcr检测snf5基因表达水平的试剂至少包括一对特异性扩增snf5基因的引物。
本发明的目的之二是提供利用所述的snf5基因评价基于炎症反应的抗动脉粥样硬化药效的方法,其包括如下步骤:
s1、用hcy处理人thp-1单核源性巨噬细胞;
s2、hcy处理的人thp-1单核源性巨噬细胞的培养体系中加入受试药物,培养48h;
s3、检测以下项目作为受试药物药效评价指标:检测snf5的mrna及蛋白表达水平。
本发明的目的之三是提供利用所述的snf5基因制备的基于炎症反应的抗动脉粥样硬化的药物,所述药物包括snf5基因的抑制剂,所述炎症反应的致炎细胞因子为il-1β。
进一步的,所述抑制剂为snf5基因的rna干扰载体,小rna干扰片段,snf5的抗体及其他能够抑制snf5表达的抑制剂中的一种。
与现有技术相比,本发明具有如下有益效果:
1、本发明发现了snf5基因的新功能,即snf5基因在动脉粥样硬化血管斑块中高表达,可作为动脉粥样硬化诊断的标志物。
2、基于snf5基因在促进动脉粥样硬化中的作用,为研制治疗动脉粥样硬化提供靶标。
3、snf5基因的抑制剂可用制备预防和治疗动脉粥样硬化的药物。
附图说明
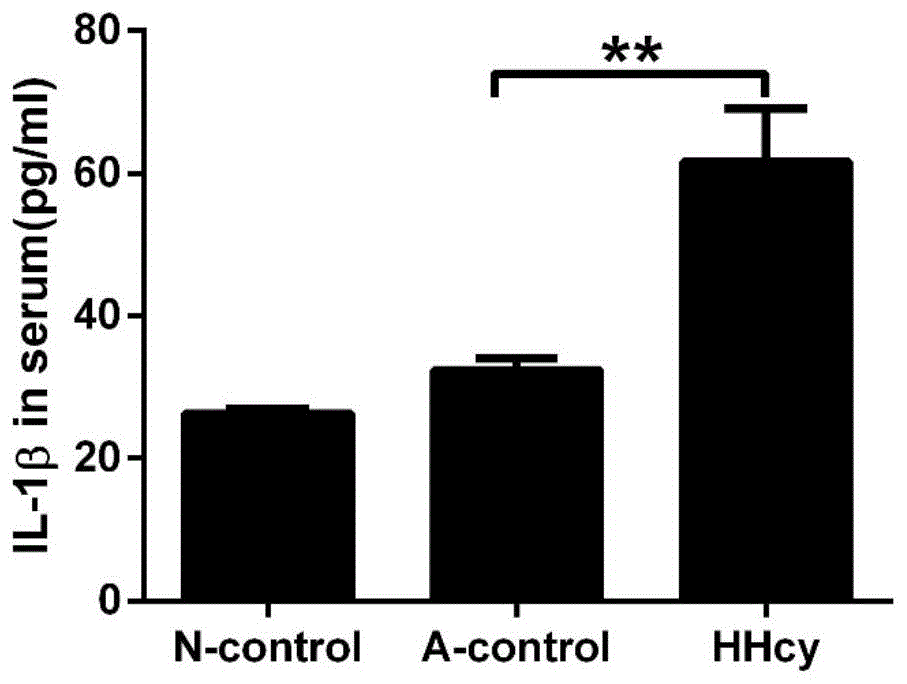
图1为elisa分别检测apoe-/-不同饮食处理组小鼠血清中il-1β的含量,**p<0.01。
图2为elisa和qrt-pcr分别检测hcy作用下人thp-1单核源性巨噬细胞中il-1β的含量(a)和mrna表达(b),**p<0.01。
图3为qrt-pcr(a)、westernblot(b)和免疫荧光染色(c)观察apoe-/-不同饮食处理组小鼠血管中snf5的表达,**p<0.01。
图4为qrt-pcr和westernblot分别检测人thp-1单核源性巨噬细胞中snf5的mrna(a)和蛋白表达(b),**p<0.01。
图5为在人thp-1单核源性巨噬细胞中分别转染过表达snf5慢病毒(lv-snf5)和小rna干扰片段(si-snf5-1/2/3),qrt-pcr和westernblot分别检测snf5的mrna和蛋白表达,*p<0.05,**p<0.01。
图6为转染过表达snf5慢病毒(lv-snf5)后,人thp-1单核源性巨噬细胞中il-1β的含量(a)、mrna表达(b)和蛋白表达(c),**p<0.01。
图7为转染snf5小rna干扰片段(si-snf5-1/2)后,人thp-1单核源性巨噬细胞中il-1β的含量(a)、mrna表达(b)和蛋白表达(c),*p<0.05,**p<0.01。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明,但不应理解为本发明的限制。如未特殊说明,下述实施例中所用的技术手段为本领域技术人员所熟知的常规手段,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
以下技术方案中涉及的小鼠snf5基因的geneid:6598,人snf5基因的geneid:20587。
本发明的具体技术方案为:
(1)建立apoe-/-小鼠动脉粥样硬化模型:按随机数法将apoe-/-小鼠随机分为模型对照组(apoe-/-小鼠+普通饲料,a-control组,n=10)与高同型半胱氨酸血症组(apoe-/-小鼠+高蛋氨酸饲料,hhcy组,n=10);另设正常对照组(c57bl/6j小鼠+普通饲料,n-control组,n=10)。
(2)眼球取血,分离血清,elisa检测apoe-/-不同饮食处理组小鼠血清中il-1β的含量。
(3)建立人thp-1单核源性巨噬细胞细胞系,elisa和qrt-pcr分别检测hcy作用下il-1β的含量和mrna表达。
(4)qrt-pcr、westernblot和免疫荧光分别检测snf5在小鼠血管和人thp-1单核源性巨噬细胞中的表达。
(5)在人thp-1单核源性巨噬细胞中转染过表达snf5慢病毒(lv-snf5)和小rna干扰片段(si-snf5-1/2/3),检测其对il-1β含量和表达的影响。其中,snf5慢病毒(lv-snf5)由上海吉凯基因有限公司设计,载体为gv492,目的基因geneid:6598。
小rna干扰片段(si-snf5-1/2/3)的序列如下:
si-snf5-1:5’-gcuccgaggugggaaacuatt-3’,seqidno:5;
si-snf5-2:5’-gcaacgaugagaaguacaatt-3’,seqidno:6;
si-snf5-3:5’-ccaccaucgcauacagcautt-3’,seqidno:7。
本发明进一步通过以下实验阐明snf5在动脉粥样硬化炎症过程中的作用。
1实验对象
1.1实验动物
雄性apoe-/-小鼠购自北京维通利华实验动物技术有限公司。
1.2细胞株
thp-1细胞系(人急性单核细胞白血病细胞,atcc)
2仪器设备与实验试剂
2.1主要试剂
无菌细胞培养瓶、吸管、滤器(corning公司,美国);胎牛血清、rpmi1640培养基(gibco,美国);佛波酯(promega,美国);同型半胱氨酸(sigma,美国);血液/细胞/组织基因rna提取试剂(北京天根生化科技有限公司,中国);逆转录试剂盒(takara公司,日本);qrt-pcrmix(qiagen,德国);snf5抗体(abcam,美国);超敏ecl发光液、蛋白提取及bca试剂盒(凯基,中国);pbs粉末、小鼠β-actin抗体、山羊hrp标记二抗、山羊hrp标记二抗(中杉金桥,中国);内源性过氧化氢酶阻断工作液、山羊血清工作液和抗荧光淬灭剂(中杉金桥,中国);荧光二抗(proteintech,美国);elisa试剂盒(云克隆,信裕);snf5和gapdh引物由生工生物工程(上海)股份有限公司合成等。
2.2主要仪器
恒温细胞培养箱(thermofisherscientific,美国);超净工作台(安泰技术有限公司,中国苏州);激光共聚焦荧光显微镜(olympus,日本);5415d型微量台式离心机(eppendorf,德国);精密电子天平(sartorius,德国);制冰机(af10scotsman,美国);荧光定量pcr仪(funglyn,上海);普通pcr仪(bio-rad,美国;透射电子显微镜(日本,jeol);微量移液器(eppendorf,德国);纯水仪(healforce);全自动酶标仪(bio-tek);恒温冰冻切片机(leica);离心机(thermofisher,eppendorf,大龙);涡旋混匀仪(大龙);化学发光凝胶成像仪、稳压电源、电泳仪、电转仪(bio-rad);恒温金属浴(卡尤迪);负压吸引器(rocker)等。
3方法
3.1小鼠主动脉根部冰冻切片的制备
滴适量oct包埋剂于主动脉根部组织,调整组织角度以便进行后续操作,置于冷冻台上令其速冻后,固定于支撑架、调整角度、修去上层多余包埋剂、暴露组织,作适量切片并于镜下观察,确保待切平面到达动脉根部附近,以4μm左右的厚度连续切片,防脱载玻片贴片后放入片盒,-80℃保存。
3.2免疫荧光染色
1)用4%多聚甲醛(细胞)或10%丙酮(组织)固定20inrt
2)pbs5min×3次rt
3)0.5%triton-x1005minrt
4)山羊血清封闭2h滤纸吸尽剩余液体rt
5)加入一抗(过夜)4℃
6)复温30minrt
7)pbs5min×3次rt
8)加入二抗,1h37℃避光
9)pbs5min×3次rt避光
10)dapi染色5minrt避光
11)pbs5min×3次rt避光
12)抗荧光淬灭剂封片并于共聚焦显微镜下拍照rt避光
操作全程防止干片。
3.3荧光定量pcr(qrt-pcr)检测snf5的表达
3.3.1rna的提取
按照试剂盒说明书提取rna,将冻存的组织和细胞取出置于冰上并加入1ml裂解液rz,用匀浆器进行匀浆处理,然后将裂解样品转移到1.5ml无rnase离心管中;在超净台(经紫外照射杀毒20~30min)内静置裂解样品5min左右,根据样品裂解情况,可适当延长时间,使核酸-蛋白复合物分离完全;4℃12,000rpm高速离心5min除去组织中的蛋白、脂肪等,将上清转入到一个新的1.5ml无rnase离心管中;加入氯仿200μl/样品,漩涡器震荡仪振荡15sec后室温静置3min,4℃12,000rpm高速离心10min,rna包含在无色的水相中,小心吸取400μl无色的水相转移到新的1.5ml无rnase离心管中;缓慢加入200μl无水乙醇,轻轻颠倒离心管将无色水相和无水乙醇混匀,转入到吸附柱中后12,000rpm离心30sec(4℃),倒掉废液;向吸附柱中加入500μlrd去蛋白液,4℃12,000rpm离心30sec,倒掉废液;垂直加入700μlrw漂洗液到吸附柱中,室温条件下静置2min,4℃12,000rpm离心30sec,弃掉废液,此步操作共进行2次;再次离心2min(4℃12,000rpm)后,将吸附柱从收集管中取出,置于常温静置5~10min,去除遗留的漂洗液;准备新的1.5ml无rnase的离心管,做好标记,将已经晾干的吸附柱放到离心管中,垂直悬空在吸附膜中央滴加无rnase的水70μl,室温放置等待2min,4℃12,000rpm离心2min,即得到rna,为防止rna降解,将其应保存在-80℃。
3.3.2逆转录
此步操作在紫外灯照过的超净工作台内完成,操作过程中均使用无rnase的枪头,将200μl无rnase的离心管置于冰上,然后依次分别加入以下表1中的成分:
表1逆转录体系
以上体系混匀后,瞬时离心,进行rt反应,反应程序为:37℃15min,85℃5s,4℃保温。反应后的产物短时间内保存在-20℃,长时间则保存在-80℃,切忌反复冻融。
3.3.3qrt-pcr检测snf5的表达
将以下表2中体系依次分别加到200μl无rnase离心管中:
表2qrt-pcr体系
检测人snf5的上游引物序列如seqidno:1所示,下游引物序列如seqidno:2所示,检测小鼠snf5的上游引物序列如seqidno:3所示,下游引物序列如seqidno:4所示。所有样品加样完成后,涡旋震荡混匀,瞬时离心后将样品放到荧光定量pcr仪进行反应,反应程序:95℃2min,95℃5s,60℃10s,反应进行45个循环,将gapdh作为内参对照。根据
3.4酶联免疫吸附实验(elisa)
准备标准品,配制试剂,处理待测样本;加样后封板,37℃温箱孵育1h;甩板,加入检测液a,37℃温箱孵育1h;洗涤液洗3次;加入检测液b,37℃温箱孵育30min;洗涤液洗5次;加入tmb底物,37℃温箱孵育10min;加入终止液,酶标仪检测(450nm)。
3.5病毒感染
感染前24小时,将细胞按一定浓度重新接种于新的培养瓶中,确保细胞汇合度在第二天可以达到70%左右;吸掉培养瓶中原来的培养基,加入pbs清洗两次;再次加入2ml不含血清的培养基逐滴缓慢加入阴性对照(lv-gfp)、过表达snf5慢病毒(lv-snf5)各15μl(病毒感染条件在前期已经通过实验确定),轻轻晃动培养瓶以充分混匀,置于恒温37℃、含5%co2的细胞孵育箱中培养6小时后,换液;48小时后在倒置荧光显微镜下观察感染效率。经嘌呤霉素筛选后,镜下观察感染效率达到要求后,收集细胞用于后续实验操作。
3.6小rna感染片段的转染
①感染前24小时,将细胞按一定浓度重新接种于新的培养瓶中,确保细胞汇合度在第二天可以达到70%左右;
②按比例在50μl无血清的1640培养基中加入200pmolsirna,柔和混匀;
③混匀lipofectamin试剂,用50μl无血清的1640培养基稀释1μllipofectamin试剂,轻轻混匀,室温放置5min;
④将稀释好的sirna和lipofectamin试剂混匀,室温放置20min,以便形成sirna/lipofectamin混合物;
⑤将混合好的sirna/lipofectamin混合物加入到含有细胞和培养基的培养瓶中,来回轻柔摇晃细胞培养瓶;
⑥细胞在co2培养箱中37℃温育48h后,进行hcy干预,收集细胞用于后续实验。
3.7westernblot
(1)实验原理建立在分子生物学、生物化学和免疫遗传学基础上,通过特异性抗体对凝胶电泳处理过的细胞或生物组织样品进行着色,将聚丙烯酰胺凝胶上着色的蛋白质转移到硝酸纤维素膜上,然后与第一抗体孵育。再用辣根过氧化物酶连接的山羊二抗igg检测已结合上去的抗体。室温2h或4℃过夜。
(2)实验步骤
①实验准备:将配胶所用的薄、厚玻璃板用纯净水清洗干净并放入60℃的烤箱中烤干,直至玻璃板表面无任何水分及水渍即可使用,使用配胶架将一块薄板与一块厚板组装好,再确认配胶板已夹好无误后(防止因为配胶板没有密封导致漏胶),可进行制备凝胶。
②制备sds-page凝胶:根据已知目的基因的分子量大小选择最适浓度的sds-page凝胶,如表3所示。
表3sds-page凝胶配制表(1.5mm/每块)
按照以上配方比例配制凝胶,分别加入相应量的以上液体后,使用巴氏吸管充分混匀,在加入相应体积的液体后,充分混匀。将混匀后的分离胶液体缓慢加入到配胶板的指示位置处后,匀速加入适量蒸馏水,目的是为了将多余气泡排出,将分离胶压平,待分离胶与蒸馏水出现肉眼可见的明显分界线完全凝固时,将配胶架立起来,使得蒸馏水流尽,用滤纸吸干剩余水分。然后将相应比例的浓缩胶液体混匀后,缓慢加入至分离胶上,立即将洁净的梳子迅速插入至浓缩胶内,插梳子的同时,需注意不能有气泡。
③蛋白上样及电泳
a.将配制好的两块凝胶与电泳槽架组装在一起,放到电泳槽中(注意:电泳槽架的电极与电泳槽电极必须对应(黑色对应黑色,红色对应红色)不要放反(正对正,负对负),向电泳槽中加入足够量的电泳液,依次按照顺序向孔内加入3μl的蛋白marker和10μl的相应组别的蛋白样品。
b.电泳:电压80v使得蛋白样品跑过约浓缩凝胶和分离凝胶的分界点后,将电压升至120v接着电泳,直至marker溴酚蓝部分跑到胶板最底处的绿线处,立即停止电泳。
④转膜
a.准备转膜物品:选择适合分子大小的pvdf膜(0.22μm或0.45μm),将厚滤纸、无水乙醇、牛奶封闭液等都准备好。
b.裁剪大小合适的pvdf膜(做好标记,以便于识别不同分子量的基因),提前浸泡在无水乙醇激活5min,使用前放置到电转液中,浸泡3min,准备好的滤纸提前浸泡在电转液中直至滤纸中不再有干湿夹层后备用。
c.缓慢取出电泳槽,卸下玻璃板,使用切胶板将玻璃板轻轻撬开,按照marker提示,将多余的凝胶去除,把所需凝胶放入提前准备好的电转液中,从“正极”开始,依次为海绵垫片→厚滤纸一层→pvdf膜→样品胶→厚滤纸一层→海绵垫片(注意:使用滚子将膜与胶滚平,各层中间不可有气泡),扣紧转膜夹板后放入电泳槽中,加满电转液,将电泳槽放入4℃冰箱中,0.30a恒流电转120min。
⑤封闭:两小时后电转结束,取出pvdf膜,将膜置于预先配制好的5%脱脂奶粉封闭4h左右。
⑥孵育一抗:pbst洗pvdf膜,10min/次×3。用pbst配制一抗,稀释比例参考说明书,将配制好的一抗稀释液倒入抗体孵育盒中(稀释液必须完全覆盖pvdf膜),4℃水平摇床上过夜。
⑦孵育二抗:将孵育过夜的一抗回收,pbst洗pvdf膜,10min/次×3(目的是将未结合的一抗完全洗去)。按照抗体说明推荐的稀释比例配制二抗(稀释比通常为1:5000),将相应的鼠源/兔源的二抗配制好后加入到抗体孵育盒中,室温孵育2h。
⑧曝光及凝胶图像分析:提前半小时打开成像仪预热,按照程序操作并打开imagelab软件;根据二抗的质量回收抗体(一般使用三次即可),pbst洗10min/次×3。按照a∶b=1∶1配制ecl发光液,充分混匀后避光备用,将洗好的pvdf膜平整的放置到曝光板上(结合蛋白的一面朝上),使用移液器将配制的发光液均匀的滴在pvdf膜上,立即曝光(注意:曝光全过程均需避光进行)。
⑨在曝光完成后,利用bio-rad5.0凝胶成像仪分析曝光结果,将分析得到的灰度值以excel表格导出并进行统计,即以每个泳道目的蛋白所对应的灰度值/对应泳道内参蛋白的灰度值,将两者比值输入prism5.0软件绘制统计图并分析。
4.统计学处理
所有数据类型均为定量资料,统计结果以均数±标准差
5结果
5.1不同饮食处理组小鼠血清中il-1β的含量
elisa检测apoe-/-不同饮食处理组小鼠血清中il-1β的含量,结果如图1所示:与a-control组小鼠比较,hhcy组小鼠血清中il-1β的含量明显升高(p<0.01),差异具有显著性。
5.2hcy对巨噬细胞中il-1β表达的影响
为了进一步证实hcy对il-1β表达的影响,采用hcy处理thp-1单核源性巨噬细胞48h后,elisa和qrt-pcr检测巨噬细胞中il-1β的含量和表达。结果如图2所示:与control组比较,hcy组il-1β的含量和mrna表达水平明显升高(p<0.01),差异具有显著性。
5.3apoe-/-小鼠动脉粥样硬化斑块中snf5的表达情况
qrt-pcr和westernblot分别检测apoe-/-小鼠血管中snf5的mrna和蛋白表达水平,结果如图3所示:与a-control组小鼠比较,hhcy组小鼠中snf5的表达明显升高(p<0.01),差异具有显著性。随后,我们对小鼠主动脉根部切片进行了snf5、moma-2免疫荧光染色,结果显示小鼠主动脉斑块巨噬细胞中snf5表达明显增多。
5.4hcy促进thp-1单核源性巨噬细胞中snf5的表达
hcy处理thp-1单核源性巨噬细胞后,qrt-pcr和westernblot分别检测snf5表达,结果如图4所示:hcy处理后巨噬细胞中snf5的mrna和蛋白水平明显增加(p<0.01),差异具有显著性。
5.5snf5过表达载体及小干扰片段效率验证
为了揭示snf5在hcy导致的动脉粥样硬化中的作用,我们用snf5过表达慢病毒及小干扰片段转染细胞后,荧光倒置显微镜观察慢病毒的感染效率,然后分别用qrt-pcr和westernblot验证其过表达/干扰效率,结果如图5所示:在过表达/干扰snf5后巨噬细胞中snf5mrna和蛋白表达水平均明显升高/降低(p<0.01),说明载体及小干扰片段可用于后续实验。
5.6过表达snf5对il-1β表达的影响
采用elisa检测巨噬细胞培养基上清液中il-1β的含量,结果如图6所示:过表达snf5后培养基上清液中il-1β的含量明显升高(p<0.01);同时,采用qrt-pcr和westernblot分别检测过表达snf5后巨噬细胞中il-1β的表达水平,结果提示:snf5过表达后巨噬细胞中il-1β的mrna和蛋白水平明显上升(p<0.01),差异具有显著性。
5.7干扰snf5对il-1β表达的影响
采用elisa检测巨噬细胞培养基上清液中il-1β的含量,结果如图7所示:干扰snf5后培养基上清液中il-1β的含量明显降低(p<0.01);同时,采用qrt-pcr和westernblot分别检测过表达snf5后巨噬细胞中il-1β的表达水平,结果提示:干扰snf5后巨噬细胞中il-1β的mrna和蛋白水平明显降低(p<0.01),差异具有显著性。
6结论
hcy通过上调snf5的表达促进巨噬细胞中il-1β的水平,进而促进动脉粥样硬化的形成。
本发明用高蛋氨酸饲料饲养apoe-/-小鼠复制高同型半胱氨酸血症动脉粥样硬化模型,观察炎症因子il-1β的水平,并观察hcy促进动脉粥样硬化炎症过程中snf5的作用,为今后临床上预防和治疗动脉粥样硬化炎症提供新的理论依据,具有十分重要的意义。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
序列表
<110>宁夏医科大学
<>
<120>检测snf5基因表达的试剂在制备动脉粥样硬化诊断产品中的应用
<>
<160>7
<>
<170>siposequencelisting1.0
<>
<210>1
<211>26
<212>dna
<213>人工序列
<>
<400>1
tgaatgagaagttgatgacgcctgag26<>
<>
<210>2
<211>25
<212>dna
<213>人工序列
<>
<400>2
taggactcgatctgctgtctgatgg25<>
<>
<210>3
<211>22
<212>dna
<213>人工序列
<>
<400>3
tctgtacaagagatacccctca22<>
<>
<210>4
<211>22
<212>dna
<213>人工序列
<>
<400>4
catgtgacgatgccactatttt22<>
<>
<210>5
<211>19
<212>dna/rna
<213>人工序列
<>
<400>5
gcuccgaggugggaaacua19<>
<>
<210>6
<211>21
<212>dna/rna
<213>人工序列
<>
<400>6
gcaacgaugagaaguacaatt21<>
<>
<210>7
<211>21
<212>dna/rna
<213>人工序列
<>
<400>7
ccaccaucgcauacagcautt21<>
<>
<>
<>
- 还没有人留言评论。精彩留言会获得点赞!