一种产阿魏酸酯酶的短小芽孢杆菌及其应用
本发明属于微生物领域,尤其是涉及一种产阿魏酸酯酶的短小芽孢杆菌及其应用。
背景技术:
尽管阿魏酸酯酶能够被多种微生物合成,但是由于野生菌株的产酶能力有限,目前还未能直接用于大规模生产。利用分子生物学手段构建基因工程菌株,从而获得稳定性及产量更高的生产菌株成为了研究热点。现有技术中已经有多个阿魏酸酯酶编码基因被克隆并进行异源表达,其中以大肠杆菌(escherichiacoli)、毕赤酵母(pichiapastoris)和黑曲霉(aspergillusniger)为最常见的表达系统。大肠杆菌表达系统是最常用的表达体系,但是也有其缺陷之处,缺少真核基因表达所必须的翻译后修饰,蛋白表达后往往不能正确折叠,容易形成无活性的包涵体,虽然可以通过亲和色谱法变性和纯化,但这些操作会导致蛋白质的损失,使酶活性降低,这些缺陷一定程度上限制了大肠杆菌表达系统的应用。
技术实现要素:
有鉴于此,本发明旨在克服现有技术中的缺陷,提出一种产阿魏酸酯酶的短小芽孢杆菌及其应用。
为达到上述目的,本发明的技术方案是这样实现的:
一种产阿魏酸酯酶的短小芽孢杆菌,所述的产阿魏酸酯酶的短小芽孢杆菌在中国普通微生物菌种保藏管理中心的保藏编号为:cgmccno.21581。上述的产阿魏酸酯酶的短小芽孢杆菌的名称为短小芽孢杆菌(bacilluspumilus),其保藏信息:保藏单位:中国微生物菌种保藏管理委员会普通微生物中心(cgmcc),保藏日期为2021年01月04日,保藏地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号:cgmccno.21581。
进一步,所述的短小芽孢杆菌的发酵产物为阿魏酸酯酶。
进一步,所述的发酵温度为45-60℃,时间为100-150小时;所述的阿魏酸酯酶的最适温度为45-50℃。
所述的产阿魏酸酯酶的短小芽孢杆菌的制备方法,包括如下步骤:
(1)提取黑曲霉的总rna,然后合成cdna,经pcr扩增得到阿魏酸酯酶基因片段;
(2)通过阿魏酸酯酶基因片段制得目的基因片段;
(3)对目的基因片段进行酶切,得到阿魏酸酯酶片段和线性质粒片段;
(4)将阿魏酸酯酶片段和线性质粒片段连接,得到重组表达载体;
(5)将重组表达载体转入短小芽孢杆菌中表达后即成。
进一步,所述的步骤(7)中的短小芽孢杆菌的发酵产物为纤维素酶与半纤维素酶。
进一步,所述的步骤(2)中的目的基因片段的制备方法如下:在阿魏酸酯酶基因片段上游连接启动子、下游连接终止子,构成完整的表达元件,在表达元件后端加上xbaⅰ酶切位点,构成目的基因片段。
进一步,所述的步骤(3)中的阿魏酸酯酶片段和线性质粒片段的制备方法如下:采用xbaⅰ限制性内切酶对目的基因片段进行酶切,采用avrⅱ和snabⅰ限制性内切酶对质粒ppic9k进行酶切,得到阿魏酸酯酶片段和线性质粒片段。
所述的产阿魏酸酯酶的短小芽孢杆菌的应用,所述的产阿魏酸酯酶的短小芽孢杆菌在制备微生物菌肥中的应用。
相对于现有技术,本发明具有以下优势:
本发明所述的产阿魏酸酯酶的短小芽孢杆菌可发酵得到的阿魏酸酯酶,该阿魏酸酯酶在45-60℃仍能保持80%以上的酶活力。
附图说明
图1为本发明实施例2所述的不同发酵时间的酶活力的曲线图;
图2为本发明实施例2所述的毕赤酵母产faea的最适温度的曲线图;
图3为本发明实施例2所述的毕赤酵母产faea的温度稳定性的曲线图;
图4为本发明实施例2所述的毕赤酵母产faea的最适ph及ph稳定性的曲线图;
图5为本发明实施例3所述的短小芽孢杆菌产faea的最适作用温度的曲线图;
图6为本发明实施例3所述的短小芽孢杆菌产faea的温度稳定性的曲线图;
图7为本发明实施例3所述的短小芽孢杆菌产faea的最适ph及ph稳定性的曲线图。
具体实施方式
除有定义外,以下实施例中所用的技术术语具有与本发明所属领域技术人员普遍理解的相同含义。以下实施例中所用的试验试剂,如无特殊说明,均为常规生化试剂;所述实验方法,如无特殊说明,均为常规方法。
下面结合实施例来详细说明本发明。
实施例1
将黑曲霉(aspergillusniger)cicimf0215接种到pda培养基中,在28℃下进行摇瓶发酵,24h后取发酵后的上清液及菌丝体,测定黑曲霉中阿魏酸酯酶的酶活力。取10l粗酶液与400l阿魏酸甲酯中(50mol/l,ph5.0),在40℃中反应30min,在340nm出测定吸光度,对照组在测定前加入等量的酶液,其余与实验组相同。测得黑曲霉中阿魏酸酯酶的酶活力为32.5u/ml。
实施例2
将黑曲霉(aspergillusniger)cicimf0215接种到pda培养基中,在28℃摇床中培养24h,用灭菌纱布过滤培养完成的菌体,并用无菌水冲洗3次,收集菌体。将收集到的新鲜菌体放入盛有液氮的无菌研钵中,顺时针研磨至均匀的粉末状。
采用thermofisher公司的
上游引物:gtagcctccacgcaaggcatctc;
下游引物:tgctctagactactcgctggtctattgtcaatcac。
在faea基因片段上游连接启动子、下游连接终止子,构成完整的表达元件;在表达元件后端加上xbaⅰ酶切位点,构成目的基因片段;采用xbaⅰ限制性内切酶对目的基因片段进行酶切,采用avrⅱ和snabⅰ限制性内切酶对质粒ppic9k进行酶切,得到783bp的faea片段和9276bp的线性质粒片段;将此783bp的faea片段和9276bp的线性质粒片段经dna连接酶连接,得到表达载体ppic9k-faea;将重组表达载体ppic9k-faea电转化到毕赤酵母gs115中整合表达,以遗传霉素作为筛选标记。
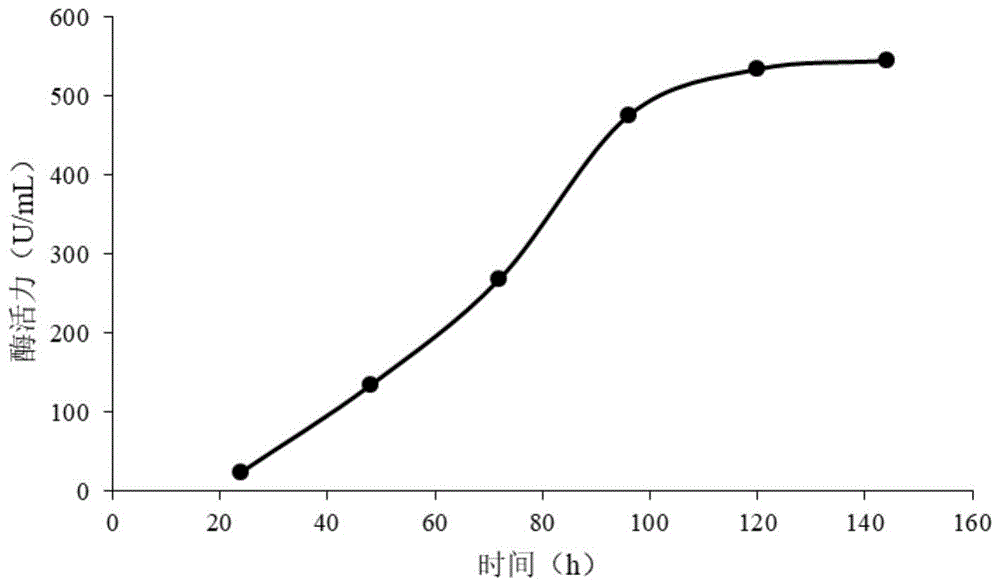
采用thermofisher(invitrogen)公司提供的毕赤酵母操作手册对重组的毕赤酵母gs115进行发酵验证制备酶液,对不同发酵天数的酶液进行酶活力测定,并对其酶学性质进行分析。摇瓶发酵天数共6天,对不同发酵时间得到的酶液进行酶活力测定,结果如图1所示,从图1中可以看出,当发酵时间在120h时,阿魏酸酯酶的酶活力达到534.4u/ml,当发酵时间在144h时,酶活力稍有增长但增加为545.2u/ml。
对阿魏酸酯酶的酶学性质进行分析,如图2所示,反应温度在45-60℃范围时,阿魏酸酯酶faea具有较高的酶活力,其最适作用温度为50℃,在45-50℃范围内较稳定,50℃下保温2h后仍有50%的酶活力,高于55℃稳定性较差,结果如图3所示。
实施例3
以筛选获得的目标转化子的氨基酸序列作为依据,参考枯草芽孢杆菌的密码子偏好性,将经过密码子优化后转入短小芽孢杆菌中的阿魏酸酯酶进行摇瓶发酵,制得粗酶液,测定粗酶液的酶活力,测定方法与同实施例1-2。测得短小芽孢杆菌中阿魏酸酯酶的酶活力为1132u/ml。对重组短小芽孢杆菌发酵得到的阿魏酸酯酶进行酶学性质分析,结果如图5所示,阿魏酸酯酶在50℃时酶活力达到最大,在45℃-60℃均能保持80%以上的酶活力。进一步对其温度稳定性进行了测定,如图6所示,阿魏酸酯酶在45℃下保温两小时后依然能够保持90%以上的酶活力,在50℃下保温两小时后能够保持60%以上的酶活力,高于55℃时酶的热稳定性较差。
实施例4
将重组短小芽孢杆菌b39-faea在5l发酵罐中进行发酵实验,发酵培养基为玉米浆粉5-7%,豆粕6-9%,葡萄糖10-30%,乳糖1-5%,发酵工作体积为2.5l,发酵温度37℃,发酵过程中维持溶氧20%以上,发酵12h后,通过流加50%葡萄糖溶液,维持葡萄糖浓度为5-10g/l;发酵过程中用硫酸或氨水控制ph为7.0;发酵时间为50-80h。按上述发酵流程进行了5次发酵实验,平均产酶水平可达到8857.9u/ml。
表1短小芽孢杆菌b39-faea5次发酵酶活力
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!