一种编码分泌性野生型GAA蛋白的核苷酸组合物、腺相关病毒载体及其药物和应用
本发明属于基因工程技术领域,具体涉及一种编码分泌性野生型gaa蛋白的核苷酸组合物、腺相关病毒载体及其药物和应用。
背景技术:
糖原累积病ⅱ型又称pompe病,由荷兰病理学家pompe在1932年首次报道,是一种罕见的常染色体隐性遗传病,是由于酸性α-葡萄糖苷酶(gaa)基因缺陷所致。gaa是溶酶体中糖原降解所必需的酶,能够使低聚糖和糖原分解成葡萄糖。该酶活性降低时,糖原不能分解,导致溶酶体内糖原蓄积引起溶酶体的破裂,溶酶体是分解蛋白质、核酸、多糖等生物大分子的细胞器,内含许多水解酶,如果溶酶体破裂,释放的水解酶可破坏细胞,导致细胞死亡,从而引起骨骼肌、心肌、肝脏等组织损伤。临床可表现为肌肉无力、心肌肥大、心功能不全等症状,严重者可因呼吸循环衰竭而死亡。
gaa基因定位于17q25.2-q25.3,全长约28kb,包括20个外显子;其中1号外显子不参与编码蛋白,cdna全长约3.6kb,gaa蛋白是由952个氨基酸组成。至今,已经发现了gaa基因的近300种致病突变,突变位置主要集中在基因的3个功能区域。致病突变主要导致gaa不同程度的活性丧失,gaa活性越低,发病年龄越早,临床表现越严重。
目前,人重组酸性α-葡萄糖苷酶(rhgaa)替代疗法是能够有效治疗糖原累积症ii型的唯一疗法。赛诺菲公司开发的rhgaa(品牌名:lumizyme)于2014年8月获fda批准上市,该疗法需患者每1周静脉输注一次rhgaa酶(lumizyme20mg/kg)。rhgaa虽然疗效显著,但病人需要终身治疗,并且费用昂贵(50万人民币/年),绝大多数患者家庭难以承受,而且由于rhgaa是一种有活性的酶,其保存,运输,以及使用(1mg/kg/hr,一次静脉注射需要20小时)均有严格要求,且还存在rhgaa对骨骼肌的靶向性较差、机体对外源蛋白质的免疫排斥反应等缺点而影响疗效。因此,研发一种安全长效、持续稳定的给患者提供有活性的gaa是治疗gsdⅱ的迫切临床需要。
安全高效地将目的基因导入人体靶细胞是成功进行基因治疗的关键之一。经典的基因导入方式(显微注射、电穿孔、磷酸钙转染等)虽然曾在科研中起了一定的作用,但由于不能很好地解决转染率、靶向性、安全性等问题而限制了它们的应用。随着病毒学等相关学科的发展,目前基因治疗已广泛使用各种病毒作载体,腺相关病毒(aav)载体就是最近二十年发展起来的一类新型载体。作为病毒载体的重要一员,aav无明显的细胞毒性效应,并且不会像其他病毒载体那样引起细胞强烈的免疫反应,因而其在基因治疗中的应用潜力引起了人们越来越多的兴趣和关注,目前唯一可用于人类的以aav为载体的人类基因治疗药物已经开始面世。
abigailwexner研究所基因治疗中心的首席研究员jerrymendell医学博士在基因治疗脊髓性肌萎缩症1型(sma1)(两岁内必须终身使用呼吸机维持生命)症状的第一次临床试验中,给与带突变的sma1基因(thesmngene)的患儿静脉注射zolgensma(改良腺相关病毒血清型9(aav9)为载体能够导入人野生型smn基因功能)传递给患者细胞。研究中几乎所有接受一次性静脉注射高剂量的患者运动功能快速提高,不用其他药物实现了与儿童运动发育相关的主要里程碑,包括吞咽、翻滚、独立坐、跑和跳,进一步验证了以aav作为载体的人类基因治疗药物是切实可行的。
腺相关病毒属于细小病毒科的依赖性病毒属,是最小和最简单的动物病毒,aav的基因组结构短小(4.7kb)而且简单,但足以完成其生活周期的全部功能。aav基因组编码两大开放阅读框架(openreadingframes,ore)rep和cap,它们位于两侧的末端倒转重复序列(invertedterminalrepeats,itrs)之间,包含对目的基因组进行包装、复制、整合及病毒基因组环化所需的顺式作用元件,并具有增强子和/或较弱的转录启动子功能。aav的复制蛋白rep和衣壳蛋白cap通常由携带它们基因的包装质粒反式提供。
技术实现要素:
针对现有技术中的上述不足,本发明提供一种编码分泌性野生型gaa蛋白的核苷酸组合物、腺相关病毒载体及其药物和重组腺相关病毒构建方法,从根本上解决了重组gaa酶替代治疗在血液中半衰期短和需要终身治疗的缺点。
为实现上述目的,本发明解决其技术问题所采用的技术方案是:
一种编码分泌性野生型gaa蛋白的核苷酸组合物,包括如seqidno.1所示的核苷酸序列。
包括如seqidno.1所示表达野生型gaa蛋白的核苷酸序列,以及使gaa具有分泌功能的核苷酸序列。
进一步地,使gaa蛋白具有分泌功能的核苷酸序列如seqidno.2所示,其能表达使gaa蛋白具有分泌功能的tpa蛋白。
进一步地,seqidno.1与seqidno.2所示的核苷酸序列之间插入有具有切割肽功能的核苷酸序列。
进一步地,具有切割肽功能的氨基酸序列包括编码sq两个氨基酸的序列。
一种表达分泌性野生型gaa蛋白的重组腺相关病毒载体,包括上述核苷酸组合物。
上述表达人类分泌性野生型gaa蛋白的重组腺相关病毒载体的构建方法,包括以下步骤:
(1)人工合成seqidno:1及seqidno:2所示的核苷酸序列,并将其插入到插入到paav-cmv-lacz.bgh载体中构建得到paav-cmv-tpa-gaa载体;
(2)将步骤(1)构建的paav-cmv-tpa-gaa载体与rcvectorpaav2/9n(serotype9,addgene112865)和helperplasmidpaddeltaf6(addgene112867)包装载体共转染293t细胞后进行培养,制得。
一种药物组合物,包括上述核苷酸组合物表达产生的蛋白,或重组腺相关病毒载体,及其在药学上可接受的载体/辅助成分。
一种表达分泌性野生型gaa蛋白的表达盒,包括上述可与表达控制元件操作连接的核苷酸组合物。
上述核苷酸组合物、重组腺相关病毒载体和/或药物组合物在制备用于预防和/或治疗gsdⅱ病症的药物中的应用。
本发明的有益效果:
1、本申请通过以腺相关病毒(aav)为载体将目的基因导入细胞内,达到细胞持续表达并分泌野生型gaa的目的,本申请设计并制备重组腺相关病毒(raav),通过raav感染患者的骨骼肌细胞,在肌细胞内持续表达并分泌野生型gaa,达到持续升高体内野生型gaa的目的。
2、本申请通过以腺相关病毒(aav)为载体将目的基因导入细胞内,利用患者自身的骨骼肌细胞分泌具有正常功能的gaa,避免了静脉注射人重组gaa的较高的技术要求和昂贵的经济负担。
3、由于糖原累积症的主要靶器官是骨骼肌,利用raav注射到肌肉中表达正常活性gaa可以提高肌肉功能,减轻肌肉病症;同时,肌肉持续表达可分泌的野生型gaa可以较长时间的提供有效的酶到身体的各个器官(一般只需要骨骼肌1次多点注射治疗即可),从根本上解决了重组gaa酶替代治疗在血液中半衰期短和需要终身治疗的缺点。
附图说明
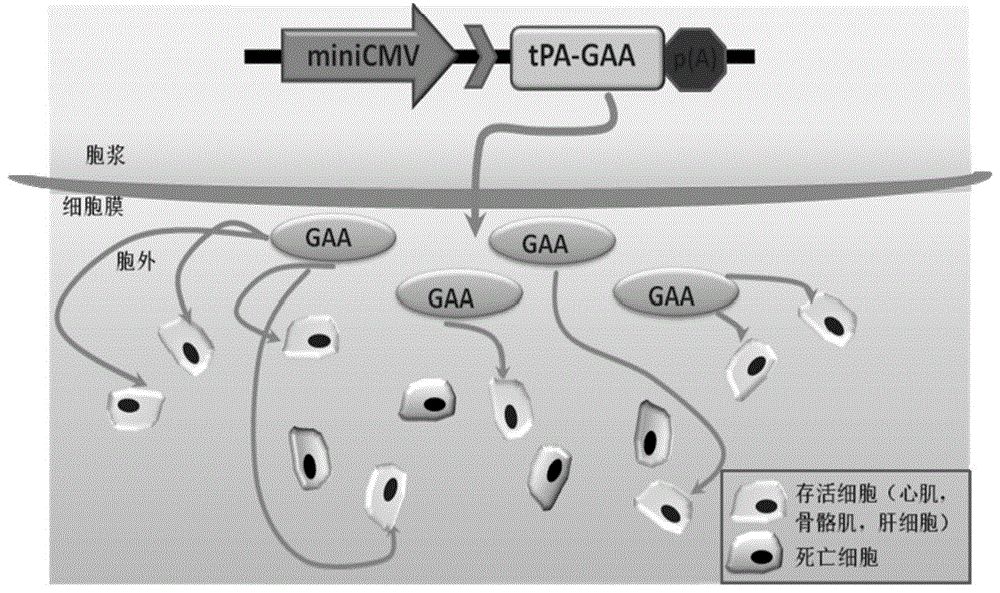
图1为腺相关病毒(aav)为载体导入分泌性野生型gaa(tpa-gaa)基因的过程;
图2为载体结构图;其中,a为paav-cmv-lacz.bgh载体图谱;b为构建的paav-cmv-tpa-gaa载体结构图谱;
图3为boydenchamber实验;
图4为dunnchamber实验;
图5为gsdⅱ型动物模型基因治疗实验示意图;
图6为gsdⅱ先证者尿中肾上皮细胞;
图7为正常人尿中肾上皮细胞;
图8为正常人及gsdⅱ先证者尿中肾上皮细胞系糖原染色;
图9为正常人及gsdⅱ先证者尿中肾上皮细胞系生长曲线;
图10为载体图谱;其中,a为phblv-cmv-mcs-3flag-ef1-zsgreen-t2a-puro载体图谱;b为lv-hgaa载体质粒的结构图谱;
图11为制备的慢病毒形成的荧光嗜斑结果图;
图12为aav为载体导入分泌型mg53基因治疗豚鼠进行性肌营养不良结果;
图13为慢病毒为载体导入分泌型mg53基因治疗豚鼠外周血mg53蛋白表达;
图14为腺病毒(av)为载体crispr/cas9基因编辑技术基因治疗患进行性肌营养不良的小鼠的结果。
具体实施方式
下面对本发明的具体实施方式进行描述,以便于本技术领域的技术人员理解本发明,但应该清楚,本发明不限于具体实施方式的范围,对本技术领域的普通技术人员来讲,只要各种变化在所附的权利要求限定和确定的本发明的精神和范围内,这些变化是显而易见的,一切利用本发明构思的发明创造均在保护之列。
实施例1重组腺相关病毒载体的构建
表达人类野生型gaa蛋白(hgaa蛋白)的氨基酸序列的核苷酸序列见seqidno:1,表达使人类野生型gaa蛋白具有分泌功能的氨基酸序列(tpa蛋白)的核苷酸序列见seqidno:2,同时,在tpa蛋白和hgaa蛋白之间添加sq氨基酸。
根据上述氨基酸序列,人工设计能够表达tpa和hgaa蛋白的核苷酸序列,该核苷酸序列见seqidno:1及seqidno:2。设计好的核苷酸序列由汉恒生物科技(上海)有限公司合成,将合成的序列插入到paav-cmv-lacz.bgh(图2a)载体的5’用noti和3’用blpi酶切位点之间,构建好的载体命名为paav-cmv-tpa-gaa,其结构图见图2b。
实施例2重组腺相关病毒的制备
按照常规方法传代293t细胞至100mmdish中,传代后观察细胞密度,达到70~80%的汇合率即可进行转染,使用转染试剂(lipofitertm转染试剂,购于汉恒生物科技(上海)有限公司)转染paav-cmv-tpa-gaa载体质粒与rcvectorpaav2/9n(serotype9,addgene112865)和helperplasmidpaddeltaf6(addgene112867)包装载体质粒,脂转complex为转染试剂使用75μl,paav-cmv-tpa-gaa质粒10μg,paav-rc质粒10μg和phelper质粒5μg。脂转complex混匀后在室温下温育15min后缓慢滴加至293t细胞中,于37℃、5%co2细胞培养箱中培养。每日观察细胞状态。
转染后16小时,更换含10%胎牛血清fbs的新鲜完全培养基,转染后48h和72h分别收集两次病毒上清(48h收集后置换新鲜完全培养基)。在48h收毒时,将100mmdish中的培养基倒入50ml离心管中,注意培养皿壁不要接触离心管口,以防出现细菌污染,随后补入10ml含10%胎牛血清fbs的新鲜完全培养基,平稳置于37℃,5%co2的恒温培养箱中继续培养。在72h收毒时,直接将100mmdish中的培养基倒入50ml离心管中,同样注意培养皿壁不要接触离心管口,以防出现细菌污染;将50ml离心管中的病毒上清,4℃,2000g,离心10min,去除细胞碎片;然后收集病毒原液上清置于超速离心管中,4℃,82700g,离心120min,完全培养基重悬病毒沉淀,最后将超离重悬液分装到灭菌处理的病毒管中,计为重组腺相关病毒(aavtpa/hrgaa,raav1)。分装病毒,标记(病毒名称,年-月-日),-80℃冰箱保存。
实施例3重组腺相关病毒(aavtpa/hrgaa,raav1)的质量检测
1、无菌检测
检测方法:取10μl病毒加入96孔板的hela细胞进行验证,培养24h后显微镜镜检:培养基需澄清透明,细胞间隙无明显颗粒,无任何细菌及真菌污染。
2、支原体检测
检测方法:取10μl病毒,96℃水浴15min后于超净台中配置pcr反应体系。pcr反应后电泳确定是否含有支原体污染。pcr胶图应无明显支原体条带。
3、滴度检测
病毒滴度检测采用稀释计数测定法:
滴度单位:tu/ml,指每毫升中含有的具有生物活性的病毒颗粒数。“tu”为“transducingunits”的缩写,中文为“转导单位”,表示可以感染并进入到靶细胞中的病毒基因组数。iu/ml,指每毫升中含有的整合活性的病毒颗粒数。“iu”为integrationunits的缩写,中文为整合单位。
ⅰ.细胞准备
将生长状态良好的293t细胞消化计数后稀释至1×105/ml,加入96孔板,100μl/孔,为每个病毒准备6个孔。放入37℃,5%co2培养箱中培养。
ii.加病毒
第二天,准备6个1.5mlep管,第一个ep管中加入10μl病毒液,然后做3倍梯度稀释,共6个稀释度。
iii.追加培养液
第三天,有需要加puromycin筛选的孔,先吸去100ml含病毒培养基,加入100μl含1.5μg/mlpuromycin的10%fbs完全培养基。
iv.观察结果并计算滴度
第五天,使用prime-a-gene标记试剂盒(promega,madison,wi,美国)产生的生物素标记探针进行southern印迹法测定病毒原液的滴度。根据nih发布的《生物危害安全性2级指南》处理病毒载体库。
滴度(tu/ml)=细胞数×阳性克隆百分比×moi(1)×病毒稀释倍数×103tu/ml。
实施例4aavtpa/hrgaa(raav1)基因治疗gsdⅱ型患者细胞后的效果测定
1、按照赛贝生物提供的urineasy尿液细胞扩增培养试剂盒方法,从正常人和先证者尿中扩增培养获取大量肾上皮细胞。
2、在人类细胞模型上导入分泌性野生型gaa基因治疗的有效性及安全性
raav1感染正常人和先证者的肾上皮细胞,测定培养液野生型gaa的活性,细胞中糖原含量,观察比较正常人和先证者的肾上皮细胞基因治疗前后形态及功能上的变化。为明确野生型gaa的具有分泌功能可同时将表达可分泌gaa(tpa-gaa)的细胞和未表达tpa-gaa的细胞共同培养,进行boydenchamber实验(见图3)或dunnchamber实验(见图4),检测未表达tpa-gaa细胞的生长及功能。
(1)细胞病毒载体拷贝数的测定
使用wizard基因组dna纯化试剂盒(promega,麦迪逊,威斯康星州,美国)提取表达可分泌gaa(tpa-gaa)的细胞中dna。使用sybrgreen(瑞士巴塞尔的罗氏公司)的引物对50-agtgcccacacagagtgcgacgt-30和50-cctcgtagcgcctgttagctg-30对hgaa进行实时定量pcr检测。使用aavtpa/hrgaa质粒dna形成计算病毒载体拷贝数的曲线。
(2)细胞生长情况:观察正常人和先证者表达和未表达tpa-gaa的肾上皮细胞的生长情况,显微镜下拍照,使用accutase消化需要细胞5min后终止,200g离心5min后弃上清液,使用原培养液重悬细胞,显微镜下计数。
(3)gaa活性测定:测定正常人和先证者表达和未表达tpa-gaa的肾上皮细胞及其培养液的gaa活性。使用匀浆器将收集的细胞在蒸馏水(1mg/20ml)中匀浆,然后超声处理15s,并在4℃下以1800g的速度离心15分钟。对于gaa活性测定,将0.2m乙酸钠缓冲液(ph4.3)中的20ml2.2mm4-甲基伞形抗-a-d-葡萄糖苷(sigma-aldrich,st.louis,mo,usa)添加到10ml的上述上清液和培养皿中的原培养液收集离心后放入另一试管中上清液同时测定gaa活性。将混合物在37℃下温育1小时,并通过添加0.5m碳酸盐缓冲液(ph10.5)来终止反应。在victorx多标记板读数器上测量荧光量(360nm激发,465nm发射)。并以4-甲基伞形酮(sigma-aldrich,美国密苏里州圣路易斯)为标准。
(4)测量糖原含量:将1:5稀释的正常人和先证者表达和未表达tpa-gaa的肾上皮细胞裂解物煮沸3分钟(以灭活内源酶),并与0.175u/ml(反应中的最终浓度)淀粉葡糖苷酶(sigma-aldrich,圣路易斯,密苏里州,美国)在37℃下混合放置90分钟。然后将反应混合物再次煮沸3分钟以终止反应。将30ml混合物与1mlpointescientific葡萄糖(己糖激酶)液体试剂(fisher,汉普顿,新罕布什尔州,美国)一起在室温(rt)下温育至少10分钟。在shimadzuuv-1700pharmaspecuv-vis分光光度计上读取340nm处的吸光度。通过bca测定法确定蛋白质浓度并用于标准化数据。
(5)微量蛋白印迹实验(westernblot):正常人和先证者表达和未表达tpa-gaa的肾上皮细胞,测定hgaa的量。使用玻璃均化器在ripa缓冲液(pbs含有1%np40、0.5%脱氧胆酸钠,0.1%sds以及蛋白酶和磷酸酶抑制剂混合物[cellsignalingtechnology,danvers,ma,usa])中的冰块上将收集的细胞均质化。在4℃下以18,000g离心15分钟来清除裂解物。使用双辛可宁酸(bca)测定法测量上清液中的蛋白质浓度。将等量的蛋白质在sds-page凝胶上电泳,然后转移到硝酸纤维素膜上。用tween20(pbst)在含3%bsa的磷酸盐缓冲液中阻塞该膜,与一抗在4℃下孵育过夜,洗涤,再与二抗一起孵育,再次洗涤,然后使用ecl试剂盒(bio-rad,hercμles,ca,美国)显影。图像是通过图像分析仪(biorad,hercμles,ca,usa)获得。使用了以下抗体:自sigma-aldrich(美国密苏里州圣路易斯)的抗hgaa。
(6)pas染色:将正常人和先证者表达和未表达tpa-gaa的肾上皮细胞浸泡在10%中性缓冲剂福尔马林(nbf)中固定48小时。初次浸没固定后,再在4℃的10%的nbf中将样品与1%高碘酸(pa)混合固定48小时。然后将样品用pbs洗涤,用高纯度的酒精脱水,用二甲苯清洗。用新鲜制得的0.5%pa氧化5分钟,然后用蒸馏水冲洗1分钟。然后再用schiff试剂染色15分钟,并用自来水洗涤10分钟。用苏木精复染色并用自来水冲洗,与上蓝剂一起浸泡1分钟,脱水并固定。图像是在bzx710显微镜下拍摄,观察糖原累积的区域。
实施例5在gaaknockout转基因小鼠动物模型水平验证aavtpa/hrgaa(raav1)基因治疗的有效性和安全性
购买现成的gaaknockout转基因小鼠(gaako76小鼠)雌雄种鼠及正常野生型小鼠(c57bl/6jwt小鼠)雌雄种鼠,培育繁殖至实验所需个数(gaako76小鼠40只,c57bl/6jwt小鼠20只)。将raav1感染gaaknockout转基因小鼠骨骼肌(raav1直接多点注射gaako76小鼠骨骼肌),genotyping检测目的基因是否成功导入到gaako76小鼠骨骼肌细胞中及其效率,采用westernblot检测血液及组织中野生型gaa表达量及测定gaa活性,观察转基因小鼠血液中的野生型gaa是否稳定表达,观察经raav1基因治疗后、空载aav感染的、人源重组gaa处理的(lumizyme静脉注射)和未经任何处理的gaako76小鼠和raav1感染的c57bl/6jwt小鼠临床表现(精神、食欲、体重、活动状态、交配情况等)及实验室和辅助检查的改善(各种代谢指标,毒性实验,小鼠加速旋转试验等,并送检彩超检查心脏、肝脏及肾脏器官状况等)(见图5)。
(1)根据重庆医科大学附属儿童医院动物护理和使用委员会批准的准则进行动物护理和实验。
2周龄的雌性和雄性gaako76小鼠接受剂量为5×1012矢量基因组(vg)/kg的raav1和空载aav的单次多点肌肉内注射(通过后腿骨骼肌)及人源重组gaa酶(lumizyme20mg/kg)2周1次静脉内注射(通过眶后窦)和性别和年龄相匹配的c57bl/6jwt小鼠接受剂量为5×1012矢量基因组(vg)/kg的raav1单次多点肌肉内注射(通过后腿骨骼肌)。将性别和年龄相匹配的未经治疗的gaako和c57bl/6jwt(来自jackson实验室)小鼠作为对照。测试小鼠需观测的所有指标,然后在4月龄时(注射raav1后14周)处死以收集组织和血液。将新鲜的组织标本立即用干冰冷冻保存并维持在负80℃,直到用于生化分析或组织学检查,血液可直接送检查肝肾功能,心肌酶谱等。
(2)骨骼肌组织病毒载体拷贝数的测定
使用wizard基因组dna纯化试剂盒(promega,麦迪逊,威斯康星州,美国)提取表达tpa-gaa的骨骼肌组织中dna。使用sybrgreen(瑞士巴塞尔的罗氏公司)的引物对50-agtgcccacacagagtgcgacgt-30和50-cctcgtagcgcctgttagctg-30对hgaa进行实时定量pcr检测。使用aavtpa/hrgaa质粒dna形成计算病毒载体拷贝数的曲线。
(3)pas染色:同前,将细胞换成实验小鼠不同部位的组织。图像是在bzx710显微镜下拍摄的。
(4)gaa活性测定:同前,将细胞换成实验小鼠不同部位的组织。
(5)测量糖原含量:同前,将细胞换成实验小鼠不同部位的组织。
(6)微量蛋白印迹实验(westernblot):同上,将细胞换成实验小鼠不同部位的组织。
(7)加速旋转试验:通过旋转体来训练小鼠(env-577m,medassociates,费尔法克斯,美国佛蒙特州),首先使它们在以每分钟4转的恒定速度旋转(等待模式)的转鼓上停留3分钟。然后在逐渐加速的旋转脚架上(4.0-40rpm)对小鼠进行两次训练。然后使用加速的旋转方案分别在三个环节中对训练有素的小鼠进行测试,并记录跌倒的潜伏期。在每次练习之间至少提供5分钟的休息时间。
(8)圆柱体试验:将小鼠置于800ml玻璃烧杯中,并记录每只动物3分钟的垂直探索运动。在圆柱体后方放置一面镜子,以记录所有的背面活动(一个或两个前肢接触圆柱体壁的垂直运动)。记录垂直勘探期间的后身活动数量。通过一对一的前肢使用量比率来计算自发性前肢使用量的不对称。
(9)光束行走试验:对前所描述的光束行走测试做了一些修改。简而言之,将小鼠放在光束的一端(宽12毫米),测量小鼠横越黑盒(800毫米)到达另一端所需的时间。在测试之前,对小鼠进行了两次训练。平均两次小鼠不会在光束上失速即为成功。
(10)基因治疗的安全性检查:观察基因治疗的小鼠表现(精神、食欲、体重、活动状态、交配情况等),检查各实验小鼠外周血肝肾功能、心肌酶谱,送检动物彩超检查心脏、肝脏等)有无异常。
实施例6先证者临床资料收集
先证者于5个月大时因尿少,伴大汗、烦躁就诊,发现肝脾肿大,心肌肥厚,心功能不全,误诊为肥厚性心肌病并治疗,2岁多时进行基因检测,在gaa基因外显子区域意外发现一处纯合突变点:c.2015g>a(鸟嘌呤>腺嘌呤),导致氨基酸改变p.r672q(精氨酸>谷氨酰胺),为14号外显子中错义突变。故采用干血片法(dbs)收集患儿外周血标本并检测患儿白细胞酸性gaa活性明显低于正常值;又对其家系中父母,祖父母,外祖父母进行了gaa基因的检测,发现其家系中外公,母亲,爷爷,父亲为此致病基因杂合子携带者,符合常染色体基因隐性遗传规律。明确诊断为gsdⅱ。先证者4岁时,再次来我院就诊,追问病史:患儿1岁半时可以独自行走,2岁半左右还能够扶栏杆上下楼梯,下蹲后手支撑膝盖能够自行站立,但现只可走平路,不能够上下楼梯,下蹲后不能自行站立,易摔跤,双上肢不能够持较重物体,口齿不清不能讲句子,反复呼吸道感染,咳嗽无力,反复面部及双下肢浮肿。体检:体重15kg,有特殊面容(眼距宽,鼻梁塌,口唇稍厚),呼吸平稳,双肺呼吸音稍粗,心前区可闻及ⅱ/ⅱsm,肝肋下3.0cm,质软,边缘锐。双下肢肌力4级,肌张力稍低,双侧腓肠肌有假性肥大。复查心肌酶谱、心肌标志物、肝功能异常、心电图异常,心脏彩超异常,心脏核磁共振(mri)异常。复查双下肢肌电图无异常发现,空腹血糖正常。患儿病情缓慢进展,符合非经典婴儿型gsdⅱ诊断。
实施例7正常人和先证者尿肾上皮细胞系的建立
①正常人和先证者的尿液细胞分离培养:
按照赛贝生物提供的urineasy尿液细胞分离培养试剂盒方法:采样者排出陈尿后,大量饮水,尽量排出100ml以上尿液。按试剂盒方法分离出尿中细胞,主要是肾上皮细胞。
②先证者和正常人的尿液细胞扩增培养:
按照赛贝生物提供的urineasy尿液细胞扩增培养试剂盒方法,扩增培养获取大量肾上皮细胞(见图6,图7)。
实施例8正常人和gsdⅱ先证者尿肾上皮细胞系糖原染色
正常人和gsdⅱ先证者尿肾上皮细胞系糖原染色,可见gsdⅱ先证者肾上皮细胞较正常人肾上皮细胞明显肥大,细胞内糖原含量高(见图8)。
实施例9正常人和先证者尿肾上皮细胞系生长曲线
正常人和先证者尿肾上皮细胞系生长曲线,可见gsdⅱ先证者肾上皮细胞较正常人肾上皮细胞生长明显缓慢(见图9)
实施例10h-gaa慢病毒载体构建和病毒包装
1、目的载体信息
phblv-cmv-mcs-3flag-ef1-zsgreen-t2a-puro载体图谱(见图10a):
2、载体酶切
根据如下表中顺序依次加入每种试剂,轻轻吸打混匀,置于37℃水浴锅中反应1-2h;酶切结束之后进行琼脂糖凝胶电泳,回收目的片段;载体酶切体系如下表1所示。
表1载体酶切体系
3、目的片段的获取、引物设计以及pcr扩增目的片段均按常规手段进行。
4、目的片段与载体连接
使用hbinfusiontm一步克隆连接体系:于冰水浴中配制如下反应体系。如果不慎将液体粘在管壁,可通过短暂离心使其沉入管底。连接反应液在50℃反应30min后,置于冰上5min,立即转化,连接体系如表2所示。
表2连接体系
5、转化
(1)dh5α感受态细胞从-80℃冰箱拿出来之后,要立刻放到冰上融化,感受态分装过程操作轻柔,减轻对其机械破坏;
(2)待感受态融化后,以每管50μl的体积分装(对于质粒转化,20μl就足够了),分装之后以不超过感受态体积1/10的量加入连接产物(目前加5μl连接产物),冰上放置20-30min;
(3)42℃热激90s(这个时间要非常严格),热激完之后立刻插入冰上冰育2-3min;
(4)在超净台中,加入500μllb培养基(注意一定是无抗的lb培养基),轻柔的上下颠倒3-5次;
(5)37℃、230rpm震荡培养45-60min;
(6)将菌液涂到相应抗性的固体平板上,涂布均匀,然后将板子倒放37℃恒温箱培养12-16h;
6、进行菌液pcr鉴定。
7、测序
将筛选出来的阳性克隆,选择两个克隆进行测序,测序结果与目的序列一致,则该目的质粒构建成功。
8、质粒抽提
测序成功之后,进行菌液扩增,质粒抽提纯化,质粒抽提方案按照常规抽提试剂盒的说明书为准。抽提的质粒需要qc验证合格之后用于转染细胞。构建成功的lv-hgaa载体的结构图谱(见图10b)
9、慢病毒包装及浓缩纯化
(1)提前传代293t细胞用于转染(前提是细胞已经培养到可以满足后续转染实验需要)。操作完毕后置于37℃,5%co2的培养箱中;
(2)转染前观察细胞密度,达到70~80%的汇合率即可进行转染;三质粒系统,pspax2、pmd2g和携带目的基因的lv-hgaa穿梭质粒(提前用大肠杆菌菌株dh5-α扩增慢病毒载体和辅助包装载体质粒)
(3)做脂转complex,转染100mm皿的complex成分如表3所示。
表3complex成分
注:lipofitertm转染试剂为汉恒生物产品,使用说明参考lipofitertm说明书。穿梭质粒即含目的基因片段的lv-hgaa载体质粒。
脂转complex混匀后在室温下温育15min后缓慢滴加至293t细胞中,于37℃、5%co2细胞培养箱中培养;
(4)转染后16h更换含10%胎牛血清fbs的新鲜完全培养基;
(5)收毒:转染后48h和72h分别收集两次病毒上清(48h收集后置换新鲜完全培养基)。在48h收毒时,将100mmdish中的培养基倒入50ml离心管中,注意培养皿壁不要接触离心管口,以防出现细菌污染,随后补入10ml含10%胎牛血清fbs的新鲜完全培养基,平稳置于37℃,5%co2的恒温培养箱中继续培养。在72h收毒时,直接将100mmdish中的培养基倒入50ml离心管中,同样注意培养皿壁不要接触离心管口,以防出现细菌污染;
(6)超速离心:将50ml离心管中的病毒上清,4℃,2000g,离心10min,去除细胞碎片;然后收集病毒原液上清置于超速离心管中,4℃,82700g,离心120min,完全培养基重悬病毒沉淀,最后将超离重悬液分装到灭菌处理的病毒管中。
(7)病毒保存:分装病毒,标记(病毒名称,年-月-日),-80℃冰箱保存。
10、慢病毒质量检测
(1)无菌检测
检测方法:取10μl病毒加入96孔板的hela细胞进行验证,培养24h后显微镜镜检:
qc标准:培养基需澄清透明,细胞间隙无明显颗粒,无任何细菌及真菌污染。
(2)支原体检测
检测方法:取10μl病毒,96℃水浴15min后于超净台中配置pcr反应体系。pcr反应后电泳确定是否含有支原体污染。
qc标准:pcr胶图无明显条带
(3)滴度检测
慢病毒滴度检测采用稀释计数测定法:
滴度单位:tu/ml,指每毫升中含有的具有生物活性的病毒颗粒数。“tu”为“transducingunits”的缩写,中文为“转导单位”,表示可以感染并进入到靶细胞中的病毒基因组数。iu/ml,指每毫升中含有的整合活性的病毒颗粒数。“iu”为integrationunits的缩写,中文为整合单位。
i.细胞准备
将生长状态良好的293t细胞消化计数后稀释至1×105/ml,加入96孔板,100μl/孔,为每个病毒准备6个孔。放入37℃,5%co2培养箱中培养。
ii.加病毒
第二天,准备6个1.5mlep管,第一个ep管中加入10μl病毒液,然后做3倍梯度稀释,共6个稀释度。
iii.追加培养液
第三天,有需要加puromycin筛选的孔,先吸去100ml含病毒培养基,加入100μl含1.5μg/mlpuromycin的10%fbs完全培养基。
iv.观察结果并计算滴度
第五天,在荧光显微镜下观察结果,在观察结果前6h需更换新鲜10%fbs完全培养基,从孔中吸出80μl培养基,然后加入80μl新鲜10%fbs完全培养基,放入37℃,5%co2培养箱中培养。6h后荧光显微镜下观察结果(见图11),荧光百分比在10~50%的孔计算病毒滴度。
滴度(tu/ml)=细胞数×阳性克隆百分比×moi(1)×病毒稀释倍数×103tu/ml
实施例11以病毒为载体导入可分泌的mg53基因治疗豚鼠进行性肌营养不良
一、aav为载体导入可分泌的mg53基因治疗进行性肌营养不良豚鼠
1、苏木精-伊红(h&e)染色评价组织学改善。在新生鼠注射aav-mg53(1×1013vg/kg)后2个月,对to-2仓鼠进行分析。标线条=100μm。
2、步骤(1)中所述的处理后肌纤维的中央定位核百分率(cn)显著降低。显示上述各组肌纤维中cn的百分比。数值代表平均值±标准差。*p<0.01,与未经治疗的to-2相比(n=5/组,每肌肉分析300个纤维)(见图12最左侧两幅附图)。
3、masson三色染色证明骨骼肌和心肌纤维化减少。在新生仓鼠治疗(1×1013vg/kg)后4.5个月和7.5个月采集样本。标线条=100μm。
4、新生仓鼠(1×1013vg/kg)或成年仓鼠(2×1013vg/kg)处理的to-2仓鼠(ms,月)左心室缩短百分率(%lvfs)增加所显示的心功能改善。*p<0.05与未经治疗的to-2相比(n=5)。(见图12中间部位两幅附图)
5、新生仓鼠(1×1013vg/kg)(ms,月)治疗的to-2患病仓鼠左室收缩末期和舒张末期内径(lvid;s和lvid;d)减少,显示心功能改善。*p<0.05与未经治疗的to-2相比(n=5)。数值代表平均值±标准差;所有仓鼠均为雄性。(见图12最右侧两幅附图)
如图12所示,本申请利用aav为载体导入可分泌的mg53基因治疗豚鼠进行性肌营养不良,可见明显改善损害的肌细胞及肌肉间纤维化及肌肉功能,表明以aav为载体导入mg53基因系统可改善肌营养不良to-2仓鼠骨骼肌及心肌退行性变和纤维化和改善心功能。(见图12,图中每组数据中的柱形图从左至右依次为wt-f1b、to-2、to-2+aav,其中,wtf1b为野生型正常对照组仓鼠;to-2为肌营养不良组仓鼠;to-2+aav为腺相关病毒组仓鼠)。
二、本申请利用慢病毒为载体导入分泌型mg53基因治疗豚鼠进行性肌营养不良外周血mg53蛋白测定,可见野生型豚鼠外周血mg53蛋白很低,而慢病毒为载体导入可分泌的mg53基因治疗豚鼠外周血mg53蛋白表达量很高,慢病毒为载体导入分泌型mg53基因是成功的(见图13)。
实施例12利用以腺病毒(av)为载体的crispr/cas9基因编辑技术基因治疗患进行性肌营养不良的小鼠
本申请以腺病毒(av)为载体的crispr/cas9基因编辑技术基因治疗患进行性肌营养不良的小鼠,成功使已经无力行走的进行性肌营养不良小鼠恢复了行走,其结果见图14。
图14中,a为小鼠x染色体的基因组位置图以及grna靶点,突变的外显子23以黄色突出显示(图中未显);b为用或不用grna和cas9构建体处理的c2c12细胞提取基因组dna的聚合酶链反应(pcr)分析;c为c2c12细胞中肌营养不良蛋白转录物表达的rt-pcr分析;d为以腺病毒导入和不导入grna(ad-i20/i23)和cas9构建体后mdx成肌细胞基因组dna的pcr分析;e为rt-pcr分析在d中处理mdx成肌细胞中肌营养不良蛋白转录本的表达;f为在c和e中较小rt-pcr产物(475bp)的dna测序分析;箭头表示基因编辑后的预期条带。所有数据均至少来至三个实验。
序列表
<110>重庆医科大学附属儿童医院
<120>一种编码分泌性野生型gaa蛋白的核苷酸组合物、腺相关病毒载体及其药物和应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>2859
<212>dna
<213>人工序列(artificialsequence)
<400>1
atgggagtgaggcacccgccctgctcccaccggctcctggccgtctgcgccctcgtgtcc60
ttggcaaccgctgcactcctggggcacatcctactccatgatttcctgctggttccccga120
gagctgagtggctcctccccagtcctggaggagactcacccagctcaccagcagggagcc180
agcagaccagggccccgggatgcccaggcacaccccggccgtcccagagcagtgcccaca240
cagtgcgacgtcccccccaacagccgcttcgattgcgcccctgacaaggccatcacccag300
gaacagtgcgaggcccgcggctgttgctacatccctgcaaagcaggggctgcagggagcc360
cagatggggcagccctggtgcttcttcccacccagctaccccagctacaagctggagaac420
ctgagctcctctgaaatgggctacacggccaccctgacccgtaccacccccaccttcttc480
cccaaggacatcctgaccctgcggctggacgtgatgatggagactgagaaccgcctccac540
ttcacgatcaaagatccagctaacaggcgctacgaggtgcccttggagaccccgcatgtc600
cacagccgggcaccgtccccactctacagcgtggagttctccgaggagcccttcggggtg660
atcgtgcgccggcagctggacggccgcgtgctgctgaacacgacggtggcgcccctgttc720
tttgcggaccagttccttcagctgtccacctcgctgccctcgcagtatatcacaggcctc780
gccgagcacctcagtcccctgatgctcagcaccagctggaccaggatcaccctgtggaac840
cgggaccttgcgcccacgcccggtgcgaacctctacgggtctcaccctttctacctggcg900
ctggaggacggcgggtcggcacacggggtgttcctgctaaacagcaatgccatggatgtg960
gtcctgcagccgagccctgcccttagctggaggtcgacaggtgggatcctggatgtctac1020
atcttcctgggcccagagcccaagagcgtggtgcagcagtacctggacgttgtgggatac1080
ccgttcatgccgccatactggggcctgggcttccacctgtgccgctggggctactcctcc1140
accgctatcacccgccaggtggtggagaacatgaccagggcccacttccccctggacgtc1200
cagtggaacgacctggactacatggactcccggagggacttcacgttcaacaaggatggc1260
ttccgggacttcccggccatggtgcaggagctgcaccagggcggccggcgctacatgatg1320
atcgtggatcctgccatcagcagctcgggccctgccgggagctacaggccctacgacgag1380
ggtctgcggaggggggttttcatcaccaacgagaccggccagccgctgattgggaaggta1440
tggcccgggtccactgccttccccgacttcaccaaccccacagccctggcctggtgggag1500
gacatggtggctgagttccatgaccaggtgcccttcgacggcatgtggattgacatgaac1560
gagccttccaacttcatcaggggctctgaggacggctgccccaacaatgagctggagaac1620
ccaccctacgtgcctggggtggttggggggaccctccaggcggccaccatctgtgcctcc1680
agccaccagtttctctccacacactacaacctgcacaacctctacggcctgaccgaagcc1740
atcgcctcccacagggcgctggtgaaggctcgggggacacgcccatttgtgatctcccgc1800
tcgacctttgctggccacggccgatacgccggccactggacgggggacgtgtggagctcc1860
tgggagcagctcgcctcctccgtgccagaaatcctgcagtttaacctgctgggggtgcct1920
ctggtcggggccgacgtctgcggcttcctgggcaacacctcagaggagctgtgtgtgcgc1980
tggacccagctgggggccttctaccccttcatgcggaaccacaacagcctgctcagtctg2040
ccccaggagccgtacagcttcagcgagccggcccagcaggccatgaggaaggccctcacc2100
ctgcgctacgcactcctcccccacctctacacactgttccaccaggcccacgtcgcgggg2160
gagaccgtggcccggcccctcttcctggagttccccaaggactctagcacctggactgtg2220
gaccaccagctcctgtggggggaggccctgctcatcaccccagtgctccaggccgggaag2280
gccgaagtgactggctacttccccttgggcacatggtacgacctgcagacggtgccagta2340
gaggcccttggcagcctcccacccccacctgcagctccccgtgagccagccatccacagc2400
gaggggcagtgggtgacgctgccggcccccctggacaccatcaacgtccacctccgggct2460
gggtacatcatccccctgcagggccctggcctcacaaccacagagtcccgccagcagccc2520
atggccctggctgtggccctgaccaagggtggggaggcccgaggggagctgttctgggac2580
gatggagagagcctggaagtgctggagcgaggggcctacacacaggtcatcttcctggcc2640
aggaataacacgatcgtgaatgagctggtacgtgtgaccagtgagggagctggcctgcag2700
ctgcagaaggtgactgtcctgggcgtggccacggcgccccagcaggtcctctccaacggt2760
gtccctgtctccaacttcacctacagccccgacaccaaggtcctggacatctgtgtctcg2820
ctgttgatgggagagcagtttctcgtcagctggtgttag2859
<210>2
<211>66
<212>dna
<213>人工序列(artificialsequence)
<400>2
atggatgcaatgaagagagggctctgctgtgtgctgctgctgtgtggagcagtcttcgtt60
tcgccc66
- 还没有人留言评论。精彩留言会获得点赞!