OsAPL蛋白及其编码基因在调控植物产量中的应用
osapl蛋白及其编码基因在调控植物产量中的应用
技术领域
1.本发明属于生物技术领域,具体涉及osapl蛋白及其编码基因在调控植物产量中的应用。
背景技术:
2.植物在适应陆生生活的过程中,进化出了贯穿于整个植物体内的维管系统。维管系统负责植物体内水分、无机盐和光合产物的长距离运输,而这种运输的速率决定了作物的产量。因此,通过调控植物营养物质运输机制来提高作物产量一直是育种学家进行农业科学技术研究的主要目标之一。水稻(oryza sativa l.)是重要的粮食作物之一,对水稻产量相关基因的挖掘对培育高产水稻品种并提高水稻产量具有重要意义。
技术实现要素:
3.第一方面,本发明保护osapl蛋白的新用途。
4.本发明保护osapl蛋白在如下p1)-p4)任一种中的应用:
5.p1)调控植物产量;
6.p2)调控植物籽粒大小;
7.p3)培育产量提高的转基因植物;
8.p4)培育籽粒变大的转基因植物;
9.所述osapl蛋白为a1)或a2)或a3)或a4):
10.a1)氨基酸序列是序列1所示的蛋白质;
11.a2)在序列1所示的蛋白质的n端或/和c端连接标签得到的融合蛋白质;
12.a3)将序列1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与植物产量和/或籽粒大小相关的蛋白质;
13.a4)与序列1所示的氨基酸序列具有90%同一性、来源于水稻且与植物产量和/或籽粒大小相关的蛋白质。
14.其中,序列1由355个氨基酸残基组成。
15.上述a2)所述的蛋白质中,所述标签是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述标签可为flag标签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
16.上述a3)所述的蛋白质中,所述一个或几个氨基酸残基的取代和/或缺失和/或添加为不超过10个氨基酸残基的取代和/或缺失和/或添加。
17.上述a4)所述的蛋白质中,“同一性”包括与本发明的序列1所示的氨基酸序列具有90%或更高,或91%或更高,或92%或更高,或93%或更高,或94%或更高,或95%或更高,或96%或更高,或97%或更高,或98%或更高,或99%或更高同源性的氨基酸序列。
18.上述a1)或a2)或a3)或a4)所述的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
19.第二方面,本发明保护与osapl蛋白相关的生物材料的新用途。
20.本发明保护与osapl蛋白相关的生物材料在如下p1)-p4)任一种中的应用:
21.p1)调控植物产量;
22.p2)调控植物籽粒大小;
23.p3)培育产量提高的转基因植物;
24.p4)培育籽粒变大的转基因植物;
25.所述生物材料为下述a1)至a12)中的任一种:
26.a1)编码osapl蛋白的核酸分子;
27.a2)含有a1)所述核酸分子的表达盒;
28.a3)含有a1)所述核酸分子的重组载体;
29.a4)含有a2)所述表达盒的重组载体;
30.a5)含有a1)所述核酸分子的重组微生物;
31.a6)含有a2)所述表达盒的重组微生物;
32.a7)含有a3)所述重组载体的重组微生物;
33.a8)含有a4)所述重组载体的重组微生物;
34.a9)含有a1)所述核酸分子的转基因植物细胞系;
35.a10)含有a2)所述表达盒的转基因植物细胞系;
36.a11)含有a3)所述重组载体的转基因植物细胞系;
37.a12)含有a4)所述重组载体的转基因植物细胞系。
38.上述应用中,a1)所述核酸分子为如下b1)或b2)或b3)或b4)所示的基因:
39.b1)序列2或序列4所示的基因组dna分子;
40.b2)序列3所示的cdna分子;
41.b3)与b1)或b2)限定的核苷酸序列具有75%或75%以上同一性,且编码上述osapl蛋白的cdna分子或基因组dna分子;
42.b4)在严格条件下与b1)或b2)或b3)限定的核苷酸序列杂交,且编码上述osapl蛋白的cdna分子或基因组dna分子。
43.其中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
44.本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码osapl蛋白的核苷酸序列进行突变。那些经过人工修饰的,具有编码osapl蛋白的核苷酸序列75%或者更高同一性的核苷酸,只要编码osapl蛋白且具有相同功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
45.这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码序列1所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
46.上述75%或75%以上同一性,可为80%、85%、90%或95%以上的同一性。
47.上述应用中,所述严格条件是在2
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜
2次,每次5min,又于0.5
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次15min;或,0.1
×
sspe(或0.1
×
ssc)、0.1%sds的溶液中,65℃条件下杂交并洗膜。
48.上述应用中,a2)所述的含有编码osapl蛋白的核酸分子的表达盒(osapl基因表达盒),是指能够在宿主细胞中表达osapl基因的dna,该dna不但可包括启动osapl基因转录的启动子,还可包括终止osapl基因转录的终止子。进一步,所述表达盒还可包括增强子序列。可用于本发明的启动子包括但不限于:组成型启动子;组织、器官和发育特异的启动子及诱导型启动子。启动子的例子包括但不限于:花椰菜花叶病毒的组成型启动子35s:来自西红柿的创伤诱导型启动子,亮氨酸氨基肽酶("lap",chao等人(1999)plant physiol 120:979-992);来自烟草的化学诱导型启动子,发病机理相关1(pr1)(由水杨酸和bth(苯并噻二唑-7-硫代羟酸s-甲酯)诱导);西红柿蛋白酶抑制剂ii启动子(pin2)或lap启动子(均可用茉莉酮酸甲酯诱导);热休克启动子(美国专利5,187,267);四环素诱导型启动子(美国专利5,057,422);种子特异性启动子,如谷子种子特异性启动子pf128(cn101063139b(中国专利200710099169.7)),种子贮存蛋白质特异的启动子(例如,菜豆球蛋白、napin,oleosin和大豆beta conglycin的启动子(beachy等人(1985)embo j.4:3047-3053))。它们可单独使用或与其它的植物启动子结合使用。此处引用的所有参考文献均全文引用。合适的转录终止子包括但不限于:农杆菌胭脂碱合成酶终止子(nos终止子)、花椰菜花叶病毒camv 35s终止子、tml终止子、豌豆rbcs e9终止子和胭脂氨酸和章鱼氨酸合酶终止子(参见,例如:odell等人(i
985
)nature 313:810;rosenberg等人(1987)gene,56:125;guerineau等人(1991)mol.gen.genet,262:141;proudfoot(1991)cell,64:671;sanfacon等人genes dev.,5:141;mogen等人(1990)plant cell,2:1261;munroe等人(1990)gene,91:151;ballad等人(1989)nucleic acids res.17:7891;joshi等人(1987)nucleic acid res.,15:9627)。
49.可用现有的表达载体构建含有所述osapl基因表达盒的重组载体。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等。如pahc25、pbin438、pcambia1302、pcambia2301、pcambia1301、pcambia1300、pbi121、pcambia1391-xa或pcambia1391-xb等。所述植物表达载体还可包含外源基因的3
′
端非翻译区域,即包含聚腺苷酸信号和任何其它参与mrna加工或基因表达的dna片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mrna前体的3
′
端,如农杆菌冠瘿瘤诱导(ti)质粒基因(如胭脂碱合成酶基因nos)、植物基因(如大豆贮存蛋白基因)3
′
端转录的非翻译区均具有类似功能。使用本发明的基因构建植物表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是atg起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合物的基因(gus基因、萤光素酶基因等)、抗生素的标记基因(如赋予对卡那霉素和相关抗生素抗性的nptii基因,赋予对除草剂膦丝菌素抗性的bar基因,赋予对抗生素潮霉素抗性的hph基因,和赋予对氨甲喋呤抗性的dhfr基因,赋予对草甘磷抗性的epsps基因)或是抗化学试剂标记基因等(如抗除莠剂基因)、提供代谢甘露糖能力的甘露糖-6-磷酸异构酶基因。从转基因植物的安全性考虑,可不加任何选择性标记基因,直接以逆境筛选转化植株。
50.上述应用中,所述载体可为质粒、黏粒、噬菌体或病毒载体。
51.上述应用中,所述微生物可为酵母、细菌、藻或真菌,如农杆菌。
52.上述应用中,所述调控为提高,具体体现为:植物中osapl蛋白蛋白含量和/或活性越高或osapl基因表达量越高,植物籽粒越大、产量越高。
53.第三方面,本发明保护m1或m2所示的物质在如下q1)-q4)任一种中的应用:
54.q1)降低植物产量;
55.q2)降低植物籽粒大小;
56.q3)培育产量降低的转基因植物;
57.q4)培育籽粒变小的转基因植物;
58.m1、抑制或降低植物中osapl蛋白活性或者含量的物质;
59.m2、抑制或干扰植物中osapl蛋白编码核酸表达的物质或敲除植物中osapl蛋白编码核酸的物质。
60.第四方面,本发明保护一种培育产量提高和/或籽粒变大的转基因植物的方法。
61.本发明保护的培育产量提高和/或籽粒变大的转基因植物的方法包括如下步骤:提高受体植物中osapl蛋白的含量和/或活性,得到转基因植物;所述转基因植物的产量和/或籽粒大于所述受体植物。
62.进一步的,所述提高受体植物中osapl蛋白的含量和/或活性的方法为在受体植物中过表达osapl蛋白;所述过表达的方法为将osapl蛋白的编码基因导入受体植物中。
63.所述转基因植物的产量大于所述受体植物具体体现为所述转基因植物种子的百粒重大于所述受体植物;
64.所述转基因植物的籽粒大于所述受体植物具体体现为所述转基因植物籽粒的宽度和/或厚度大于所述受体植物。
65.更进一步的,所述osapl蛋白的编码基因为序列表中序列3所示的dna分子。
66.第五方面,本发明保护一种培育产量降低和/或籽粒变小的转基因植物的方法。
67.本发明保护的培育产量降低和/或籽粒变小的转基因植物的方法包括如下步骤:降低受体植物中osapl蛋白的含量和/或活性,得到转基因植物;所述转基因植物的产量和/或籽粒小于所述受体植物。
68.进一步的,所述降低受体植物中权利要求1中所述osapl蛋白的含量和/或活性的方法为将干扰osapl蛋白的编码基因表达的物质导入受体植物中。
69.所述转基因植物的产量小于所述受体植物具体体现为所述转基因植物种子的百粒重小于所述受体植物;
70.所述转基因植物的籽粒小于所述受体植物具体体现为所述转基因植物籽粒的长度和/或宽度和/或厚度小于所述受体植物。
71.更进一步的,所述干扰osapl蛋白的编码基因表达的物质为序列5第1-323位所示的dna分子或含有序列5第1-323位所示的dna分子的载体。
72.上述任一所述应用或方法中,所述植物为双子叶植物或单子叶植物;进一步的,所述单子叶植物为禾本科植物;更进一步的,禾本科植物为水稻。在本发明具体实施例中,所述水稻品种具体为粳稻品种kitaake(oryza sativa l.cv.kitaake)。
73.上述序列5第1-323位所示的dna分子或含有序列5第1-323位所示的dna分子的载
体也属于本发明的保护范围。
74.实验证明,将含序列表中序列3所示的osapl基因cds序列的重组载体p3301ubi-r转化水稻,得到的t3代转基因水稻株系在正常条件下,水稻产量上升9.1%,在统计学上表现为极显著高于野生型水稻。而将含序列表中序列5所示的部分cds序列的重组载体ptck303转化水稻,得到的t3代转基因水稻株系在正常条件下,水稻产量降低43.5%,在统计学上表现为极显著低于野生型水稻。说明osapl蛋白具有调控植物产量的功能,在调控作物产量的分子育种和理论研究中具有重要意义。
附图说明
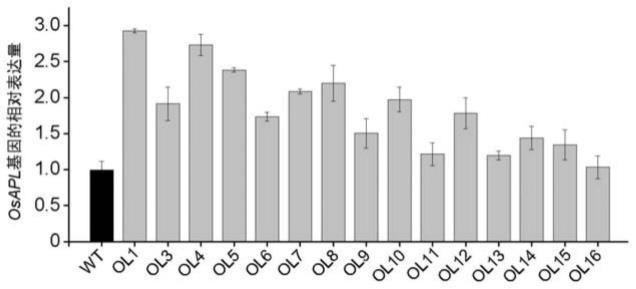
75.图1为本发明中导入了p3301ubi-r载体后不同水稻株系中osapl基因的表达量。
76.图2为本发明中导入了ptck303-r载体后不同水稻株系中osapl基因的表达量。
77.图3为本发明中导入了p3301ubi-r载体后osapl基因表达量最高的水稻株系与导入了ptck303-r载体后osapl基因表达量最低的水稻株系的产量表型及统计数据。
具体实施方式
78.以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的试验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
79.下述实施例中的生物材料信息如下:
80.p3301ubi-gfp/flag载体为将gfp标签插入带有ubi promoter的pcambia3301载体的bamhi和saci酶切位点间,且保持带有ubi promoter的pcambia3301载体的其它序列不变后得到的载体。带有ubi promoter的pcambia3301载体记载于文献“mingda luan,miaoyun xu,yunming lu,lan zhang,yunliu fan,lei wang,expression of zma-mir169 mirnas and their target zmnf-ya genes in response to abiotic stress in maize leaves,gene,volume 555,issue 2,2015,pages 178-185,issn 0378-1119,”中,公众可从中国科学院植物研究所获得。该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
81.ptck303载体记载于文献“wang z,chen cb,xu yy,jiang rx,han y,xu zh&chong k.(2004)a practical vector for efficient knockdown of gene expression in rice(oryza sativa l.).plant molecular biology reporter 22:409-417.”中,公众可从中国科学院植物研究所获得。该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
82.根癌农杆菌eha105菌株记载于文献“qu lq,xing yp,liu wx,xu xp,song yr.(2008)expression pattern and activity of six glutelin gene promoters in transgenic rice.journal of experimental botany 59:2417
–
2424.”中,公众可从中国科学院植物研究所获得。该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
83.水稻野生型材料为粳稻品种“kitaake”(oryza sativa l.cv.kitaake)记载于文
献“qu lq,xing yp,liu wx,xu xp,song yr.(2008)expression pattern and activity of six glutelin gene promoters in transgenic rice.journal of experimental botany 59:2417
–
2424.”中,公众可从中国科学院植物研究所获得。该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
84.实施例1、蛋白osapl及其编码基因的获得
85.1、取水稻kitaake的种子,在水中室温浸泡吸胀48小时后置于28℃培养箱中催芽24小时,将出芽的水稻种子转移到营养土中培养两周。取全株于液氮中速冻、研磨提取总rna,进行反转录,并获得cdna。
86.2、以步骤1获得的cdna为模板,以5'-gtagacgcgtggatccatgtgcgtgcagggcgact-3'为正向引物,以5'-ccatggtaccggatcccccgtaggataggttcctcgt-3'为反向引物进行pcr扩增,得到pcr产物。
87.3、将扩增后的pcr产物进行琼脂糖凝胶电泳,分离并纯化长约1.1kb的dna片段并进行测序。测序结果表明,该dna片段的核苷酸序列如序列表中的序列3第1-1068位所示。
88.4、以步骤2获得的pcr产物为模板,以5'-ggggtaccactagtaagacctccacatgtacggc-3'为正向引物,以5'-cgggatccgagctccttcgtctcgtagacgtcgg-3'为反向引物进行pcr扩增。
89.5、将扩增后的pcr产物进行琼脂糖凝胶电泳,分离并纯化长约300bp的dna片段并进行测序。测序结果表明,该dna片段的核苷酸序列如序列表中的序列5第1-323位所示。
90.序列表中的序列3为水稻自交系kita中编码序列表中的序列1所示蛋白osapl的全长编码区序列。将编码蛋白osapl的基因命名为基因osapl,序列5为osapl基因的表达干扰序列。
91.实施例2、osapl蛋白在调控水稻产量中的应用
92.一、重组过表达载体p3301ubi-r和重组农杆菌r1的构建
93.1、p3301ubi-r重组过表达载体的构建
94.将序列表中的序列3第1-1068位所示的dna片段克隆至载体p3301ubi-gfp/flag的bamhi酶切位点之间(该多克隆酶切位点位于玉米ubiquitin启动子下游),后经测序并比对后,获得重组过表达载体p3301ubi-r。
95.重组过表达载体p3301ubi-r为将序列表中的序列3第1-1068位所示的dna片段插入载体p3301ubi-gfp/flag的bamhi酶切位点之间,且保持载体p3301ubi-gfp/flag的其它序列不变后得到的载体。
96.2、p3301ubi-r重组根癌农杆菌的获得
97.将重组过表达载体p3301ubi-r转化根癌农杆菌eha105菌株,经pcr检测后,获得含有重组载体p3301ubi-r的重组农杆菌r1。
98.二、重组干扰载体ptck303-r和重组农杆菌r2的构建
99.1、ptck303-r重组干扰载体的构建
100.将序列表中的序列5第1-323位所示的dna片段经两次酶切并克隆至载体ptck303的saci和bamhi酶切位点之间(该多克隆位点位于35s启动子下游),后经测序并比对后,获得重组干扰载体ptck303-r。
101.重组干扰载体ptck303-r为将序列表中的序列5第1-323位所示的dna片段插入载体ptck303的saci和bamhi酶切位点之间,且保持载体ptck303的其它序列不变后得到的载
体。
102.2、ptck303-r重组农杆菌的获得
103.将重组载体ptck303-r转化根癌农杆菌eha105菌株,经pcr检测后,获得含有ptck303-r重组载体的重组农杆菌r2。
104.三、不同osapl基因表达量转基因水稻株系的获得
105.分别将重组农杆菌r1和r2用胚性愈伤侵染法转化野生型水稻kitaake,收获t0代水稻株系并收获t1代种子;将各自的t1代种子萌发后,获得抗性苗进行后续的种植收种,获得t2代种子;将t2代种子萌发后,随机选取不同的转基因株系进行rt-pcr检测,确定过表达osapl的水稻株系和干扰osapl表达的水稻株系。选取osapl基因表达量最高、最低的转基因水稻株系进行产量测定,并分别命名为trh和trl。
106.t0代表示转化当代的植株,t1代表示t0代自交产生的种子及由它长成的植株,t2代表示由t1代自交产生的种子及由它长成的植株。
107.上述农杆菌介导的水稻转基因过程具体操作步骤如下:
108.(1)水稻成熟胚诱导愈伤的获得:取水稻成熟后晾干的种子,去壳后置于无菌100ml三角瓶中。在超净台中加入70%酒精,表面消毒45s,期间不断晃动三角瓶。之后将种子转于2.5%的次氯酸钠溶液中,加入一滴triton x-100后,将种子置于28℃摇床中,200rpm震荡消毒15min,之后再将种子转于2.5%的次氯酸钠溶液中,于28℃摇床中,200rpm震荡消毒15min。弃去消毒液后,用无菌蒸馏水反复冲洗多次,直至冲洗后的溶液澄清无异物。将种子倒出置于铺好无菌滤纸的培养皿上,超净台晾干45min。将种子依次摆放于n6d固体培养基上,置于28℃培养箱中,培养4周。挑取嫩黄,光滑的胚性愈伤继代于新的n6d固体培养基上,培养5天,即可用于农杆菌的转化。
109.(2)农杆菌的培养:取储存于-80℃的转化后的农杆菌,涂布于含有相应抗生素的yeb固体培养基上进行划线活化,之后将农杆菌置于28℃培养箱中培养3天。挑取生长良好的单克隆菌株,在含有相应抗生素的yeb固体培养基上再次划线活化。28℃培养1天后,用无菌药勺刮取火柴头大小的固体菌株,悬浮于30ml aam(乙酰丁香酮的终浓度为40mg/l)液体培养基中,以备转化。
110.(3)农杆菌的转化和共培养:将继代后生长旺盛的小颗粒愈伤组织从n6d培养基上刮下,置于100ml三角瓶中。用悬浮有农杆菌菌株的aam培养基将愈伤悬起,浸泡20min后,弃去aam培养基。将愈伤置于铺好无菌滤纸的培养皿上,于超净台中吹风晾干30min后,将其置于铺好一层滤纸的2n6as共培养基上。将愈伤置于23℃培养箱中,暗培养4天。
111.(4)农杆菌的清除和筛选培养:将共培养结束的愈伤组织用无菌药勺刮入无菌三角瓶中,用无菌蒸馏水冲洗多次,直至冲洗后的水清澈。再次加入一定体积的无菌蒸馏水,于超净台内静置15min,之后用含有终浓度为400mg/l羧苄青霉素的无菌蒸馏水浸泡两次,每次15min。将浸泡结束的愈伤组织倒在铺有无菌滤纸的培养皿中,置于超净台中吹风3h晾干后,将愈伤铺在含有相应抗生素(培养r1侵染后愈伤的培养基上的抗生素及浓度为2.5mg/l的双丙胺膦,而r2则为50mg/l潮霉素;下同)的n+培养基上。置于30℃培养箱进行暗培养,每两周继代一次,继代两次。
112.(5)侵染后抗性愈伤的再分化:将筛选继代后的愈伤组织按照不同的转基因株系,依次转接于高渗培养基上,置于30℃光照培养箱中,光照培养2周至愈伤呈现绿色。将绿色
愈伤再次转接于低渗培养基上,直至长出嫩芽。将嫩芽按不同的克隆依次转接于三角瓶装的生根培养基上,置于30℃光照培养箱中,光照培养2周,获得抗性幼苗。
113.(6)抗性幼苗的水培及移栽:待抗性小苗长至三角瓶顶部时,摘掉顶部的滤膜,将幼苗置于空气中。同时向三角瓶中加入无菌蒸馏水,在光照培养箱中进行驯化。待幼苗叶子挺直后,将幼苗从三角瓶中拔出,洗去幼苗根部的培养基,移栽于温室大棚中,进行栽培管理。待植株在正常的温室条件下开花授粉后,收获种子。
114.农杆菌介导的水稻愈伤转化过程中使用到的培养基配方:
115.n6d固体培养基1l:蔗糖,30g;nb basal medium,4.1g;casein,0.3g;l-proline,2.875g;2,4-d,0.2g;gelrite,4g;ph=5.8。
116.aam农杆菌活化培养基1l:aa-1,1ml;aa-2,1ml;aa-3,1ml;aa-4,10ml;aa-5,1ml;aa-6,5ml;aa-sol,10ml;casein,0.5g;葡萄糖,36g;蔗糖,68.5g;天冬氨酸,0.3g;l-谷氨酰胺,0.9g;肌醇,0.1g;kcl,3g;乙酰丁香酮,40mg;ph=5.2。
117.aa-1 100ml:mnso4·
6h2o,1g;h3bo4,300mg;znso4·
7h2o,200mg;ki,75mg;namoo4·
2h2o,25mg;cuso4·
5h2o,2.5mg;cocl2·
6h2o,2.5mg。
118.aa-2 100ml:cacl2·
2h2o,15g。
119.aa-3 100ml:mgso4·
7h2o,25g。
120.aa-4 100ml:feso4·
7h2o,278mg;na2edta,373mg。
121.aa-5 100ml:nah2po4
·
2h2o,15g。
122.aa-6 100ml:烟酸,20mg;维生素b1,20mg;维生素b6,20mg;肌醇,2g。
123.aa-sol 100ml:精氨酸,176.67mg;甘氨酸,75mg。
124.n6d筛选培养基1l:蔗糖,30g;nb basal medium,4.1g;casein,0.3g;l-proline,2.875g;2,4-d,0.2g;gelrite,4g;ph=5.8;潮霉素50mg或者双丙胺膦2mg;羧苄200mg;头孢250mg。
125.高渗分化培养基1l:蔗糖,30g;山梨醇,30g;ms medium,4.43g;casein,0.5g;gelrite,4g;ph=5.8;潮霉素,50mg或者双丙胺膦,2mg;羧苄,200mg;头孢,250mg;naa,0.3mg;6-ba,3mg。
126.低渗分化培养基1l:蔗糖,30g;ms medium,4.43g;casein,0.5g;gelrite,4g;ph=5.8;潮霉素,50mg或者双丙胺膦,2mg;羧苄,200mg;头孢,250mg;naa,0.3mg;6-ba,3mg。
127.生根培养基1l:蔗糖,10g;ms medium,2.215g;gelrite,4g;ph=5.8。
128.上述rt-pcr检测转基因水稻的方法如下:取t2代转基因株系萌发后14天的水稻幼苗和同一萌发条件下的野生型水稻幼苗,用megan公司的植物rna小量提取试剂盒提取水稻叶片总rna,并用dnase i进行dna的消化。在nanodrop2000(thermo fisher,usa)测定浓度后,取2ug采用invitrogen公司的反转录试剂盒以oligo d(t)为引物进行cdna的合成。用osapl基因的特异性定量检测引物qf和qr对osapl基因的cdna进行扩增,以水稻中的actin1基因作为内参,其引物为af和ar。将定量结果分析后,得到不同转基因水稻株系中的osapl基因表达量。
129.上述引物的序列如下:
130.qf:5'-ccgatcatgtccggcgactc-3';
131.qr:5'-catcaccgacgggctcccca-3';
132.af:5'-accacaggtattgtgttggactc-3';
133.ar:5'-agagcatatccttcatagatggg-3'。
134.不同转基因水稻株系中的osapl基因表达量的检测结果如图1和图2所示。结果表明,与野生型水稻相比,line1株系(ol1)中osapl基因的表达量最高(图1),命名为osapl-trh;line7株系(tl7)中osapl基因的表达量最低(图2),命名为trl。
135.四、转基因水稻的表型分析
136.分别取t3代纯合osapl-trh水稻转基因株系(简称oe1)、osapl-trl水稻转基因株系(简称rnai7)和野生型水稻kitaake(wt),种子萌发后置于温室中培养。正常条件下生长75天后,选取t3代的成熟种子进行种子表型的统计分析。随机选取野生型和转基因株系灌浆成功的种子(30粒),用千分尺对转基因水稻的籽粒大小进行了测量。
137.结果如图3所示(图3a为野生型成熟种子形态、图3b为rnai7成熟种子形态、图3c为oe1成熟种子形态、图3d为百粒重检测结果、图3e为种子长度检测结果、图3f为种子宽度检测结果、图3g为种子厚度检测结果)。结果表明,野生型水稻kitaake、osapl-trh水稻转基因株系(oe1)、osapl-trl水稻转基因株系(rnai7)的种子平均长度分别为7.23mm、7.09mm、6.71mm,种子平均宽度分别为3.49mm、3.54mm、3.35mm,种子平均厚度分别为2.51mm、2.64mm、2.24mm。与野生型相比,osapl-trh转基因株系(oe1)的种子宽度增加了1.4%,种子厚度增加了5.2%;而与野生型相比,osapl-trl水稻转基因株系(rnai7)的种子长度降低了7.2%、宽度降低了4%、厚度降低了10.8%。更值得注意的是,野生型水稻kitaake、osapl-trh水稻转基因株系(oe1)、osapl-trl水稻转基因株系(rnai7)的种子平均百粒重分别为2.09g、2.28g、1.18g。与野生型相比,osapl-trh转基因株系(oe1)的成熟种子百粒重增加了9.1%,而osapl-trl水稻转基因株系(rnai7)则降低了43.5%(图3)。说明将osapl基因的表达量降低后,水稻种子变小、产量降低,而过量表达该基因则会使水稻种子变大、产量增加。以上结果表明osapl蛋白及其编码基因具有调控水稻产量的功能,在水稻中过量表达osapl蛋白的编码基因,可以提高水稻的产量。
138.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1