一种广谱型蛋白质荧光探针及其制备方法和应用
本发明属于医学检测技术领域,具体涉及一种广谱型蛋白质荧光探针及其制备方法和应用。
背景技术:
蛋白质是构成生命机体最基础的物质,具有复杂的空间结构。人体中有多种蛋白质,构成具有各种功能的生物分子,如激素、酶、抗体等。血清白蛋白(hsa)是由3个结构域组成的心型大分子,由肝实质细胞合成,占血浆蛋白的40%-60%,是人类血浆中含量最丰富的蛋白质,人体血浆渗透压(25-33mmhg)的80%由其维持。hsa具有重要生理功能。作为一种多功能载体,它可以可逆的结合到许多生物活性分子上,参与内源性物质(如脂肪酸、类固醇、维生素等)和外源性药物的运输,在药代和药效动力学中起着关键作用。在正常生理情况下,血浆中hsa的浓度约为35-55mg/ml;由于肾小球的滤过作用,尿液中hsa浓度一般不超过30mg/l。健康成年人每天的尿液中大约有150mg的蛋白质,其中hsa约占20%。尿液中hsa的水平可以直接反应机体的健康状况,如果hsa含量过高则称为微量蛋白尿(又称尿蛋白)。尿蛋白是尿常规中的一项必做检测项目,它可以反映肾脏功能,同时是心血管疾病的参考指标。因此,尿液中hsa的浓度水平被认为是临床前诊断的重要参数。
目前,蛋白质的检测方法主要包括蛋白质组学、放射免疫分析、电化学、标准比色法、免疫比浊法等。以上方法在实际应用中存在着试剂昂贵、程序繁琐、灵敏度低、线性范围窄等不足。近年来,基于荧光探针的蛋白质分析方法由于具有操作便捷、灵敏度高、响应快、成本低、可设计性强等优点,受到研究者的广泛关注。近年来,虽有少量的蛋白质荧光探针被报道,但仍存在以下缺陷:数量稀少,可供选择的范围窄;灵敏度普遍较低,难以应用于低丰度蛋白质的检测;仅能在模拟尿液基质中进行检测,无法对真实尿液样品中的蛋白质进行定量分析。
技术实现要素:
本发明的目的是提供一种广谱型蛋白质荧光探针及其制备方法和应用,以解决现有技术中荧光探针数量少,灵敏度低以及无法对真实尿液样品中的蛋白质进行定量分析等问题。
本发明为实现其目的采用的技术方案是:一种广谱型蛋白质荧光探针(简称pypos),其具有式(ⅰ)所示结构:
上述荧光探针的制备方法,包括以下步骤:
(1)将4-羟基苯乙腈和1,3-丙磺内酯溶解到甲苯中,加热回流,待反应完成后,分离得到化合物a:
(2)将化合物a和1-芘甲醛溶解到乙醇中加热回流,分离纯化后得到式(ⅰ)所示结构的荧光探针。
步骤(1)中,4-羟基苯乙腈和1,3-丙磺内酯的摩尔比为1∶1。
步骤(1)中,反应温度为100-110℃,反应时间为7-8h。
步骤(1)中,分离步骤为:反应结束后,将反应液自然冷却至室温,溶液中沉淀出白色固体,滤出固体并干燥,得到化合物a。
步骤(2)中,化合物a和1-芘甲醛的摩尔比为1∶1。
步骤(2)中,反应温度为80-90℃,反应时间为7-8h。
步骤(2)中,加入无水哌嗪作为催化剂,化合物a与催化剂的摩尔比为1∶2。
步骤(2)中,分离纯化步骤为:反应结束后,待反应液冷却到室温析出橙色固体,沉淀经过滤、乙醇洗涤、真空干燥后得到荧光探针纯品。
本发明步骤(1)的反应式为:
本发明步骤(2)的反应式为:
上述的广谱型蛋白质荧光探针在尿蛋白检测中的应用。
本发明的有益效果是:
(1)合成简单
本发明的检测蛋白质的荧光探针原料易得、合成步骤简单、易于分离纯化,适合批量生产,有利于商业化的推广应用。
(2)具有聚集诱导发光(aie)性质
pypos具有典型的aie性质,在聚集状态下能够发出明亮的黄色荧光。
(3)对蛋白质具有广谱响应性
pypos对蛋白质分子,如胰岛素(ins)、胰蛋白酶(tps)、酯酶(est)、溶菌酶(lz)、牛血清白蛋白(bsa)、人血清白蛋白(hsa)表现出显著的光谱响应性。
(4)响应速率快、选择性好
pypos对蛋白质的响应过程可在5min内完成,检测过程不受其它物质(如离子、多糖、维生素、氨基酸、尿素等)的干扰。
(5)实际应用性强
pypos可以对尿液中的hsa高灵敏定量分析,还可以应用于临床尿蛋白的分级和裸眼鉴别。
附图说明
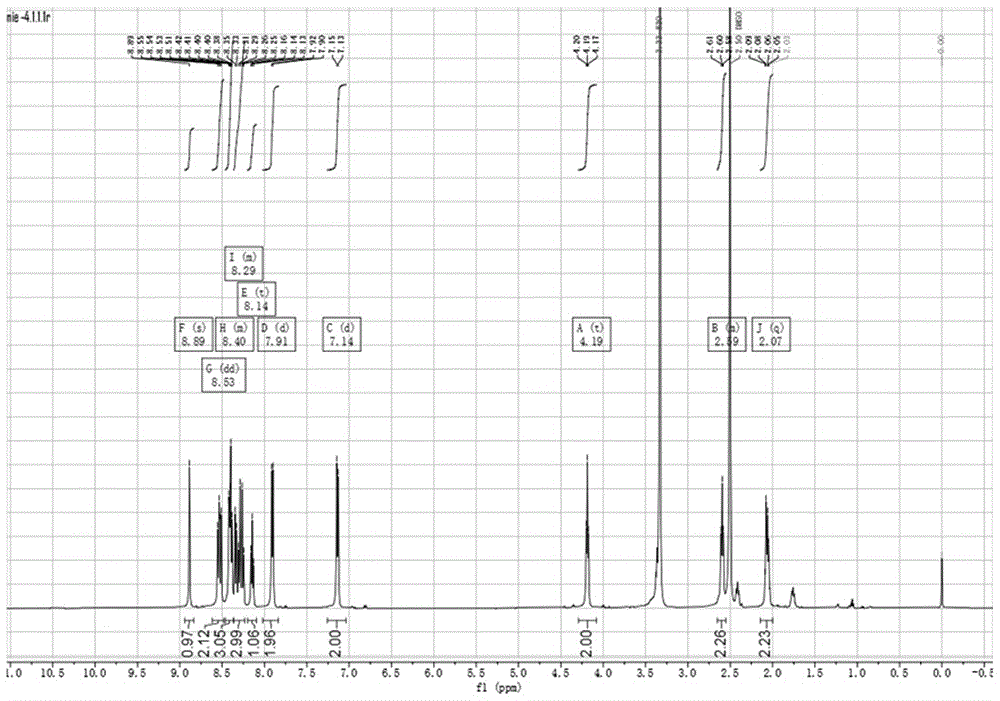
图1是pypos的1hnmr谱图。
图2是pypos的13cnmr谱图。
图3是pypos在甲苯体积分数为0-100%的甲苯-四氢呋喃混合溶液中的荧光光谱图。
图4是不同ins浓度的pypos荧光光谱图,其中,(a)是pypos的荧光光谱随ins浓度的变化趋势;(b)是pypos在540nm处的荧光强度与ins浓度间的线性关系。
图5是不同tps浓度的pypos荧光光谱图,其中,(a)是pypos的荧光光谱随tps浓度的变化趋势;(b)是pypos在540nm处的荧光强度与tps浓度间的线性关系。
图6是不同est浓度的pypos荧光光谱图,其中,(a)是pypos的荧光光谱随est浓度的变化趋势;(b)是pypos在540nm处的荧光强度与est浓度间的线性关系。
图7不同lz浓度的pypos荧光光谱图,其中,(a)是pypos的荧光光谱随lz浓度的变化趋势;(b)是pypos在540nm处的荧光强度与lz浓度间的线性关系。
图8不同bsa浓度的pypos荧光光谱图,其中,(a)是pypos的荧光光谱随bsa浓度的变化趋势;(b)是pypos在540nm处的荧光强度与bsa浓度间的线性关系。
图9不同hsa浓度的pypos荧光光谱图,其中,(a)是pypos的荧光光谱随hsa浓度的变化趋势;(b)是pypos在540nm处的荧光强度与hsa浓度间的线性关系。
图10是pypos对不同蛋白质的响应速率图;其中,(a)是pypos对ins的响应速率;(b)是pypos对tps的响应速率;(c)是pypos对est的响应速率;(d)是pypos对lz的响应速率;(e)是pypos对bsa的响应速率;(f)是pypos对hsa的响应速率。
图11是加入不同物质后,pypos在540nm处的荧光强度对比图,其中,(a)是在加入蛋白质及其它糖类、氨基酸后,pypos在540nm处的荧光强度;(b)是在加入常见离子后,pypos在540nm处的荧光强度。
图12是pypos及pypos-蛋白质的络合物在540nm处的荧光强度随时间的变化。
图13是在尿液中,pypos的荧光曲线图,其中,(a)是pypos在尿液中对hsa的荧光响应性;(b)是在尿液中,pypos在540nm处的荧光强度与hsa浓度的线性关系。
图14是pypos对临床分级的尿蛋白样品的检测结果图,其中,(a)是pypos在加入临床分级的尿蛋白样品后的荧光光谱;(b)是加入临床分级的尿蛋白样品后,pypos在500nm处的荧光强度与尿蛋白分级的对应关系;(c)是不同分级的蛋白尿和pypos-不同分级的蛋白尿混合液的颜色和荧光。
具体实施方式
下面结合实施例对本发明做进一步的阐述,下述实施例仅作为说明,并不以任何方式限制本发明的保护范围。
实施例1pypos的合成
(1)化合物a的合成
向100ml的圆底烧瓶中依次加入4-羟基苯乙腈0.27g(2mmol)和1,3-丙磺内酯0.24g(2mmol),甲苯30ml,开启搅拌,加热至110℃,回流8h后终止反应。然后将反应溶液冷却至室温,析出白色固体,滤出固体并干燥得到化合物a,将其进行下一步反应。
(2)荧光探针pypos的合成
向50ml圆底烧瓶中依次加入1-芘甲醛0.23g(1mmol)、化合物a0.26g(1mmol),哌嗪0.17g(2mmol),乙醇30ml。开启搅拌,加热至沸腾,回流8h后终止反应。待反应液冷却至室温并析出橙色固体,滤出沉淀物,用乙醇洗涤两次并真空干燥,得到pypos纯品。
其1hnmr图谱如图1:(500mhz,dmso-d6)δ8.89(s,1h),8.53(dd,j=12.9,8.6hz,2h),8.46–8.37(m,3h),8.36–8.23(m,3h),8.14(t,j=7.6hz,2h),7.91(d,j=8.8hz,2h),7.14(d,j=8.8hz,2h),4.19(t,j=6.6hz,2h),2.65–2.55(m,2h),2.07(q,j=7.2,6.3hz,2h).
其13cnmr图谱如图2:(126mhz,dmso-d6)δ160.25,139.41,132.36,131.29,130.86,129.66,129.30,129.00,128.94,128.15,128.00,127.82,127.18,126.76,126.61,126.49,126.44,125.32,124.30,124.30,118.63、115.62、114.75、67.53、48.31、25.73.
实施例2pypos的aie性质
将实施例1制备的pypos的dmso储备液(浓度为1mm)加入到2mlep管中,然后向管中依次加入不同体积分数的甲苯和四氢呋喃(v甲苯:v四氢呋喃=0:10,1:9,2:8,3:7,4:6,5:5,6:4,7:3,8:2,9:1,10:0)。溶液总体积为1ml,pypos终浓度为10μm。以上溶液室温放置1h后测定其荧光光谱(激发波长405nm)。
图3为pypos在甲苯体积分数为0-100%的甲苯-四氢呋喃混合液中的荧光光谱。如图3所示,四氢呋喃和甲苯分别作为pypos的良性溶剂和不良性溶剂,随着甲苯-四氢呋喃混合溶液中甲苯体积分数的增大,pypos的溶解度逐渐减小,当甲苯体积分数由0增加到50%时,荧光缓慢增长;而当甲苯体积分数由50%增加至90%,荧光迅速增强;随着甲苯体积分数进一步升至100%,荧光强度开始降低,这主要是由于pypos聚集体的沉淀导致的。pypos的发射光谱在混合溶剂中的变化趋势与已报道的aie染料高度一致,反映出其具有aie特性。
实施例3pypos对ins的光谱响应性
将实施例1制备的pypos的dmso储备液(浓度为1mm)加入到2mlep管中,然后向管中依次加入去离子水、tris-hcl缓冲溶液(浓度为100mm,ph=7)和不同体积的ins储备液(浓度为0.5mg/ml),溶液总体积为1ml,pypos终浓度为10μm,tris-hcl缓冲溶液(ph=7)终浓度为10mm,ins终浓度为0-50μg/ml,以上溶液室温放置1h后测定其荧光光谱(激发波长405nm)。
图4(a)为加入0-50μg/mlins后,pypos的荧光光谱;图4(b)为加入0-16μg/mlins后,pypos在540nm处的荧光强度与ins浓度的线性关系图。如图4(a)和图4(b)所示,随着ins浓度的增加,pypos的荧光逐渐增强,显示出对ins的高灵敏响应。pypos在540nm处的荧光强度与0-16μg/ml范围内的ins浓度符合线性方程:f540=26.54*[ins]+45.95(r2=0.9915),检测限为0.058μg/ml。表明pypos对于ins有较高的灵敏度,可以应用于ins的定量分析。
实施例4pypos对tps的光谱响应性
将实施例1制备的pypos的dmso储备液(浓度为1mm)加入到2mlep管中,然后向管中依次加入去离子水、tris-hcl缓冲溶液(浓度为100mm,ph=7)和不同体积的tps储备液(浓度为0.5mg/ml),溶液总体积为1ml,pypos终浓度为10μm,tps终浓度为0-200μg/ml,以上溶液室温放置1h后测定其荧光光谱(激发波长405nm)。
图5(a)为加入0-200μg/mltps后,pypos的荧光光谱;图5(b)为加入0-8μg/mltps后,pypos在540nm处的荧光强度与tps浓度的线性关系图。如图5(a)和图5(b)所示,随着tps浓度的增加,pypos的荧光逐渐增强,显示出对tps的高灵敏响应。pypos在540nm处的荧光强度与0-8μg/ml范围内的tps浓度符合线性方程:f540=17.76*[tps]+81.25(r2=0.9339),检测限为0.087μg/ml。结果表明pypos对于tps有较高的灵敏度,可以应用于tps的定量分析。
实施例5pypos对est的光谱响应性
将实施例1制备的pypos的dmso储备液(浓度为1mm)加入到2mlep管中,然后向管中依次加入去离子水、tris-hcl缓冲溶液(浓度为100mm,ph=7)和不同体积的est储备液(浓度为0.5mg/ml),溶液总体积为1ml,pypos终浓度为10μm,tris-hcl缓冲溶液(ph=7)终浓度为10mm,est终浓度为0-200μg/ml,以上溶液室温放置1h后测定其荧光光谱(激发波长405nm)。
图6(a)为加入0-200μg/mlest后,pypos的荧光光谱;图6(b)为加入0-16μg/mlest后,pypos在540nm处的荧光强度与est浓度的线性关系图。如图6(a)和图6(b)所示,随着est浓度的增加,pypos的荧光逐渐增强,显示出对est的高灵敏响应。pypos在540nm处的荧光强度与0-16μg/ml范围内的est浓度符合线性方程:f540=14.80*[est]+64.10(r2=0.9876),检测限为0.105μg/ml。结果表明pypos对于est有较高的灵敏度,可以应用于est的定量分析。
实施例6pypos对lz的光谱响应性
将实施例1制备的pypos的dmso储备液(浓度为1mm)加入到2mlep管中,然后向管中依次加入去离子水、tris-hcl缓冲溶液(浓度为100mm,ph=7)和不同体积的lz储备液(浓度为0.5mg/ml),溶液总体积为1ml,pypos终浓度为10μm,tris-hcl缓冲溶液(ph=7)终浓度为10mm,lz终浓度为0-15μg/ml,以上溶液室温放置1h后测定其荧光光谱(激发波长405nm)。
图7(a)为加入0-15μg/mllz后,pypos的荧光光谱;图7(b)为加入0-9μg/mllz后,pypos在540nm处的荧光强度与lz浓度的线性关系图。如图7(a)和图7(b)所示,随着lz浓度的增加,pypos的荧光逐渐增强,显示出对lz的高灵敏响应。pypos在540nm处的荧光强度与0-9μg/ml范围内的lz浓度符合线性方程:f540=28.39*[lz]+56.61(r2=0.9997),检测限为0.055μg/ml。结果表明pypos对于lz有较高的灵敏度,可以应用于lz的定量分析。
实施例7pypos对bsa的光谱响应性
将实施例1制备的pypos的dmso储备液(浓度为1mm)加入到2mlep管中,然后向管中依次加入去离子水、tris-hcl缓冲溶液(浓度为100mm,ph=7),和不同体积的bsa储备液(浓度为0.5mg/ml),溶液总体积为1ml,pypos终浓度为10μm,tris-hcl缓冲溶液(ph=7)终浓度为10mm,bsa终浓度为0-50μg/ml,以上溶液室温放置1h后测定其荧光光谱(激发波长405nm)。
图8(a)为加入0-50μg/mlbsa后,pypos的荧光光谱;图8(b)为加入0-14μg/mlbsa后,pypos在540nm处的荧光强度与bsa浓度的线性关系图。如图8(a)和图8(b)所示,随着bsa浓度的增加,pypos的荧光逐渐增强,显示出对bsa的高灵敏响应。pypos在540nm处的荧光强度与0-14μg/ml范围内的bsa浓度符合线性方程:f540=23.30*[bsa]+138.71(r2=0.9977),检测限为0.066μg/ml。结果表明pypos对于bsa有较高的灵敏度,可以应用于bsa的定量分析。
实施例8pypos对hsa的光谱响应性
将实施例1制备的pypos的dmso储备液(浓度为1mm)加入到2mlep管中,然后向管中依次加入去离子水、tris-hcl缓冲溶液(浓度为100mm,ph=7)和不同体积的hsa储备液(浓度为0.5mg/ml),溶液总体积为1ml,pypos终浓度为10μm,tris-hcl缓冲溶液(ph=7)终浓度为10mm,hsa终浓度为0-100μg/ml,以上溶液室温放置1h后测定其荧光光谱(激发波长405nm)。
图9(a)为加入0-100μg/mlhsa后,pypos的荧光光谱;图9(b)为加入0-10μg/mlhsa后,pypos在540nm处的荧光强度与hsa浓度的线性关系图。如图9(a)和图9(b)所示,随着hsa浓度的增加,pypos的荧光逐渐增强,显示出对hsa的高灵敏响应。pypos在540nm处的荧光强度与0-10μg/ml范围内的hsa浓度符合线性方程:f540=28.70*[hsa]+75.50(r2=0.9989),检测限为0.054μg/ml。结果表明pypos对于hsa有较高的灵敏度,可以应用于hsa的定量分析。
实施例9pypos对蛋白质的响应速率
将实施例1制备的pypos的dmso储备液(浓度为1mm)、去离子水、tris-hcl缓冲溶液(浓度为100mm,ph=7)和不同体积的各蛋白质储备液(浓度为0.5mg/ml),依次加入四面透光的石英比色皿中,立刻放入荧光分光光度计,采用时间荧光扫描模式进行测定。激发波长设定为405nm,发射波长设定为540nm,时间间隔为2s。溶液总体积为1ml,pypos终浓度为10μm,tris-hcl缓冲溶液(ph=7)终浓度为10mm,各蛋白质终浓度为20μg/ml。
图10(a)-(f)为加入各蛋白质后,pypos在540nm处的荧光强度随时间的变化曲线。如图10(a)-10(f)所示,在加入各蛋白质(终浓度均为20μg/ml)后,pypos在540nm处的荧光强度迅速升高并在5min内达到稳定水平,表明pypos与蛋白质分子的结合速率很快,可以应用于蛋白质的快速检测。
实施例10pypos对蛋白质的选择性
将实施例1制备的pypos的dmso储备液(浓度为1mm)加入2mlep管中,再依次向管中加入去离子水、tris-hcl缓冲溶液(浓度为100mm,ph=7)和各种待测物,溶液总体积为1ml,pypos终浓度为10μm,tris-hcl缓冲溶液(ph=7)终浓度为10mm,以上溶液室温放置1h后测定其荧光光谱(激发波长405nm)。糖类及氨基酸分析物包括ins(20μg/ml)、tps(20μg/ml)、est(20μg/ml)、lz(20μg/ml)、bsa(20μg/ml)、hsa(20μg/ml)、hep(20μg/ml)、cs(20μg/ml)、ha(20μg/ml)、glu(500μm)、atp(20μg/ml)、ca(500μm)、dextran(20μg/ml)、biotin(20μg/ml)、cre(2mm)、creatine(3mm)、urea(30mm)、la(100μm)、gsh(1mm)、cys(1mm)、phe(1mm)、ala(1mm)、met(1mm)、glu(1mm)、arg(1mm)、lys(1mm)、tyr(1mm)、leu(1mm)、pro(1mm)、trp(1mm)、ser(1mm)、thr(1mm)、asp(1mm)、val(1mm)、his(1mm)。离子分析物包括na+(1mm)、k+(1mm)、ca2+(1mm)、mg2+(500μm)、zn2+(500μm)、fe2+(1mm)、fe3+(1mm)、cu2+(1mm)、co2+(1mm)、ni+(1mm)、sr2+(1mm)、sn2+(1mm)、ba2+(1mm)、cr2+(1mm)、pb2+(1mm)、nh4+(1mm)、f-(1mm)、cl-(1mm)、br-(1mm)、i-(1mm)、s2-(1mm)、s2o32-(1mm)、so32-(1mm)、so42-(1mm)、po43-(1mm)、ppi(1mm)、stpp(1mm)、co32-(1mm)、ch3coo-(1mm)、no3-(1mm)、edta(1mm)。
图11(a)为加入各种糖类、氨基酸等物质后,pypos在540nm处的荧光强度。图11(b)为加入各种离子后,pypos在540nm处的荧光强度。如图11(a)所示,只有在加入蛋白质后,pypos在540nm处的荧光强度才显著增高,其它物质的引入对荧光强度的影响相对较小,通过比较pypos在540nm处荧光强度的高低可以很容易区分蛋白质与其它物质。如图11(b)所示,各种阳离子和阴离子对pypos在540nm处荧光强度的影响也有限,因此干扰性也较小。以上结果反映出,pypos对蛋白质分子具有较高的选择性,在蛋白质检测过程中受其它物质的干扰较小。
实施例11pypos与蛋白质反应前后的稳定性
将实施例1制备的pypos的dmso储备液(1mm)加入到2mlep管中,再向管内依次加入去离子水、tris-hcl缓冲溶液(100mm,ph=7)和蛋白质储备液(0.5mg/ml)。溶液总体积为1ml,pypos终浓度为10μm,tris-hcl缓冲溶液(ph=7)终浓度为10mm,蛋白质终浓度为20μg/ml,以上溶液每隔1h进行一次荧光光谱的测定(激发波长405nm),共4h。
图12为pypos和pypos-蛋白质复合物在540nm处的荧光强度随时间的变化。如图12所示,pypos-tps络合物的荧光在3h内下降至40%,随后保持稳定;pypos及pypos与其它五种蛋白质的复合物的荧光降低幅度在4h内小于20%。结果表明,pypos和pypos–蛋白质络合物能在较长时间内保持稳定。
实施例12pypos对尿液中hsa的线性响应范围
将实施例1制备的pypos的dmso储备液(1mm)加入到2mlep管中,再向管内依次加入去离子水、tris-hcl缓冲溶液(100mm,ph=7)、健康人尿液和hsa储备液(0.5mg/ml),
溶液总体积为1ml,pypos终浓度为10μm,tris-hcl缓冲溶液(ph=7)终浓度为10mm,尿液体积分数为10%,hsa终浓度为0-400μg/ml。以上溶液室温放置1h后测定其荧光光谱(激发波长405nm)。
图13(a)为在稀释尿样中加入0-400μg/mlhsa后,pypos的荧光光谱;图13(b)为在稀释尿样(v尿样:vtris-hcl=1:9)中加入0-100μg/mlhsa后,pypos在500nm处的荧光强度与has浓度的线性关系图。
如图13(a)和13(b)所示,在稀释尿液(v尿样:vtris-hcl=1:9)中,pypos的荧光随着hsa浓度(0-400μg/ml)的增加逐步增强,500nm处的荧光强度与hsa浓度在0-100μg/ml范围内符合线性关系。根据iupac推荐的公式(lod=3σ/s,σ为加入hsa前的pypos在500nm处荧光强度的标准偏差(n=11),s是荧光强度与hsa浓度的线性方程的斜率),尿液样品中hsa的检测限为0.28μg/ml。以上结果表明,pypos可以应用于尿液中的hsa的高灵敏定量分析。
实施例13荧光探针pypos在临床样本中的应用
将实施例1制备的pypos的dmso储备液(1mm)加入到2mlep管中,再向管内依次加入去离子水、tris-hcl缓冲溶液(100mm,ph=7)和临床病人尿液。溶液总体积为1ml,pypos终浓度为10μm,tris-hcl缓冲溶液(ph=7)终浓度为10mm,临床病人尿液体积分数为10%。以上溶液室温放置1h后测定其荧光光谱(激发波长405nm)。临床病人尿液样品根据尿蛋白分级分为五组:“-”样本3个;“-+”样本5个;“+”样本6个;“++”样本6个;“+++”样本7个。
图14(a)为加入临床分级的尿蛋白样品后,pypos的荧光光谱;图14(b)加入临床分级的尿蛋白样品后,pypos在500nm处的荧光强度与尿蛋白分级的对应关系;图14(c)为不同分级的蛋白尿和pypos-蛋白尿混合液的颜色和荧光。
如图14(a)和14(b)所示,pypos对尿液样本展现出良好的响应性,不同尿蛋白分级样本的荧光曲线呈束状分布,分区明显。pypos在500nm处的荧光强度可灵敏的对各分级样本进行区分,每个分级所对应的荧光强度区域不同,仅“-+”和“+”出现了部分交叉现象。此外,如图14(c)所示,在自然光下,能够清晰观察到pypos溶液随着尿蛋白分级的升高颜色逐渐加深;在紫外线(365nm)照射下,健康人的尿样荧光微弱,随着尿蛋白分级的升高,绿色荧光逐渐增强。以上结果表明,pypos基本上能够应用于临床上尿蛋白的分级,此外,也可以通过裸眼观测待测液颜色与荧光的变化,对尿蛋白进行粗略分级。
实施例14pypos的合成
(1)化合物a的合成
向100ml的圆底烧瓶中依次加入4-羟基苯乙腈0.27g(2mmol)和1,3-丙磺内酯0.24g(2mmol),甲苯30ml,开启搅拌,加热至100℃,回流7h后终止反应。然后将反应溶液冷却至室温,析出白色固体,滤出固体并干燥得到化合物a,将其进行下一步反应。
(2)荧光探针pypos的合成
向50ml圆底烧瓶中依次加入1-芘甲醛0.23g(1mmol)、化合物a0.26g(1mmol),哌嗪0.17g(2mmol),乙醇30ml。开启搅拌,加热至沸腾,回流7h后终止反应。待反应液冷却至室温并析出橙色固体,滤出沉淀物,用乙醇洗涤两次并真空干燥,得到pypos纯品。对所得产物进行表征,其具有同实施例1产物类似的性质。
- 还没有人留言评论。精彩留言会获得点赞!