靶向SARS-CoV-2受体结合基序的单克隆抗体及其识别抗原表位和应用
靶向sars-cov-2受体结合基序的单克隆抗体及其识别抗原表位和应用
技术领域
1.本发明属于免疫学技术领域,具体涉及靶向sars-cov-2受体结合基序的单克隆抗体及其识别抗原表位和应用。
背景技术:
2.由严重急性呼吸系统综合症冠状病毒2(sars-cov-2)引起的2019年冠状病毒病(covid-19)大流行对全球公共卫生构成了前所未有的威胁,迫切需要安全有效的预防措施和疗法来防治该病。sars-cov-2病毒刺突(s)蛋白的受体结合域(rbd)与它的细胞受体血管紧张素转化酶2(ace2)之间的结合在病毒附着,融合和进入过程中起着最重要的作用,因此被认为是阻断病毒进入的主要靶标。rbd也是公认的是抗体、抑制剂和疫苗设计的主要候选物。受体结合基序(rbm)是rbd中的主要功能基序,形成s蛋白和hace2之间的界面。众所周知,rbd和ace2之间的相互作用界面在它们的结合活性中起着至关重要的作用。最有效的中和抗体直接针对rbm,通过竞争结合ace2结合位点或通过空间位阻阻断rbm和ace2结合界面形成。rbm,尤其是那些与ace2识别有关的残基,是中和抗体识别的主要位点。
3.针对病毒的被动和主动免疫方法通常集中于有效中和抗体作用。用从病毒感染中恢复的患者血浆进行被动免疫有很长的成功历史。这种被动免疫在1995年期间广泛用于预防流感病毒,并在2014-2015年埃博拉病毒小范围流行期间使用。这种被动免疫方法也被用来治疗由sars-cov-2冠状病毒引起的疾病covid-19。有几份报告描述了将恢复性血浆注入sars-cov-2感染患者后的明显益处,而没有不良副作用。美国食品药品监督管理局最近为此目的批准了血浆免疫疗法,并概述了安全标准。近年来,已开发出针对病毒的高特异性的中和性单克隆抗体,作为恢复性患者血浆的更高级替代品。病毒疫苗开发的主要目标是诱导产生具有有效中和活性的抗体,该目标也同样适用于sars-cov-2。
4.对sars-cov-2主要候选物,特别是rbm的抗体反应的了解将为基于血浆或单抗的免疫疗法和疫苗的开发提供有用信息。靶向sars-cov-2rbm的中和单克隆抗体可以阻断病毒与hace2结合,因此是有前途的抗病毒药物。但是,快速传播的变异sars-cov-2病毒株可能会导致单个抗体逃脱,疫苗效力下降。靶向非重叠表位的多种抗体的组合能够提供增强的保护,可以极大地降低病毒通过逃逸突变产生抗性。因此,仍需要研发新的针对不同抗原表位的单克隆抗体来应对新的变异毒株。
技术实现要素:
5.本发明的目的在于提供靶向sars-cov-2受体结合基序的单克隆抗体,该抗体能够特异性识别sars-cov-2受体结合基序中的抗原表位
473
yqagstp
479
。
6.本发明的第二个目的在于提供与上述单克隆抗体特异性结合的抗原表位及其应用。
7.本发明的第三个目的在于提供包含上述单克隆抗体编码基因的核酸分子,以及包
含该核酸分子的表达盒、重组载体、重组细胞或重组菌。
8.本发明的第四个目的在于提供上述单克隆抗体、核酸分子、表达盒、重组载体、重组细胞或重组菌的应用。
9.本发明的第五个目的在于提供一种包含上述单克隆抗体的药物组合物。
10.为了实现上述目的,本发明采用以下技术方案:
11.靶向sars-cov-2受体结合基序的单克隆抗体,其包含氨基酸序列如seq id no:1-3所示的vhcdr1、vhcdr2和vhcdr3,和氨基酸序列如所示seq id no:4-6所示的vlcdr1、vlcdr2和vlcdr3。
12.优选的,所述单克隆抗体包含氨基酸序列如seq id no.7所示的重链可变区,和氨基酸序列如seq id no.8所示的轻链可变区。
13.本领域技术人员显然知晓,在本发明所具体公开的单克隆抗体的重链和轻链可变区氨基酸序列基础上,可通过常规蛋白质工程方法进行一个或多个氨基酸的添加、删除、替换等修饰,获得保守型变异体或其片段,而仍能保持与sars-cov-2rbm特异性结合。
14.优选的,所述单克隆抗体重链恒定区为igg1型,轻链恒定区为kappa型。
15.优选的,所述单克隆抗体特异性结合位于sars-cov-2rbm的抗原表位,所述抗原表位与ace2识别位点部分重叠,其氨基酸序列如seq id no.9或seq id no.10所示。
16.一种sars-cov-2rbm的抗原表位,所述抗原表位的氨基酸序列如seq id no.9或seq id no.10所示;或所述抗原表位为包含yqagstp核心序列的seq id no.9的截短肽。
17.抗原表位的应用,为以下任一所示:
18.1)在制备sars-cov-2抗血清或单克隆抗体中的应用;
19.2)在制备sars-cov-2疫苗中的应用;
20.3)在制备sars-cov-2免疫检测试剂或试剂盒中的应用。
21.一种核酸分子,包含编码上述单克隆抗体的基因序列。优选的,所述单克隆抗体重链可变区的基因序列如seq id no.11所示,轻链可变区的基因序列如seq id no.12所示。
22.本发明涉及的抗体核酸分子可以利用基因工程重组技术或化学合成方法获得。本领域技术人员显然知晓,在本发明提供的上述核酸分子经一个或多个核苷酸添加、删除、替换、修饰等突变后得到的重链可变区核苷酸序列和/或轻链可变区核苷酸序列的变异序列,其所编码的氨基酸序列组成的单链抗体或嵌合单克隆抗体或改型单克隆抗体或其他形式的单克隆抗体或抗体片段,仍保留与sars-cov-2rbm特异性结合的能力。
23.含有上述核酸分子的表达盒、重组载体、重组细胞或重组菌。
24.具体的,所述重组载体选自原核或真核表达载体,进一步的,所述重组载体选自细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒或其他载体。表达系统为细菌、酵母菌、丝状真菌、哺乳动物细胞、昆虫细胞、植物细胞或无细胞表达系统。
25.上述单克隆抗体、核酸分子或上述表达盒、重组载体、重组细胞或重组菌的应用,为以下任一所示:
26.1)在制备预防和/或治疗sars-cov-2感染所致疾病的药物中的应用;
27.2)在制备sars-cov-2免疫检测试剂或试剂盒中的应用。
28.一种药物组合物,包含上述单克隆抗体和药学可接受的载体、稀释剂或赋形剂。
29.本发明取得的有益效果:
30.本发明提供了靶向sars-cov-2rbm的单克隆抗体,该抗体能够特异性的结合位于sars-cov-2rbm的抗原表位
473
yqagstp
479
,该抗原表位与ace2识别位点部分重叠,经试验证明,本发明的单克隆抗体能够抑制病毒与ace2结合,是有效的中和抗体,可用于预防和/或治疗sars-cov-2感染所致疾病的药物开发,具有良好的临床应用价值。本发明的单克隆抗体识别表位明确,具有优秀的亲和力和很高的特异性,稳定性能良好,为sars-cov-2的预防、检测和治疗提供了新的工具。
31.本发明提供了靶向sars-cov-2rbm的单克隆抗体的重链和轻链的可变区氨基酸序列,在此基础上,可以采用常规抗体工程的方法获得本发明的单克隆抗体,进一步的,还可采用一个或多个氨基酸的添加、删除、替换等修饰,获得其活性片段或保守性变异体,为进一步提升抗体的特异性和亲和力奠定基础。
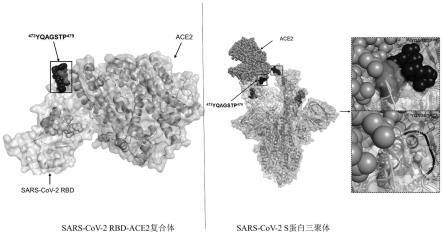
32.本发明还提供了位于sars-cov-2rbm上的新发现的抗原表位,该表位肽能够特异性识别sars-cov-2抗体,也能够诱导动物产生有效的体液免疫应答,具有较强的免疫反应性和免疫原性,为sars-cov-2疫苗设计、抗体研发以及抗体检测试剂盒的研发提供重要的抗原靶点。
附图说明
33.图1为阳性反应多肽(seq id no.9)与抗血清反应结果图;
34.图中,s1-s6为rbd抗原免疫所得猪血清;m1-m6为rbd抗原免疫所得鼠血清;nc为非rbd区域多肽,作为阴性对照。
35.图2为阳性反应多肽(seq id no.9)免疫小鼠血清效价结果图;
36.图中,鼠1-鼠5为阳性反应多肽免疫的5只小鼠编号;bsa为阴性对照。
37.图3为单克隆抗体反应性的ifa鉴定结果图;
38.图中,10d2为本发明单克隆抗体名称;alexa fluor488为alexa fluor488标记的羊抗鼠igg;dapi为细胞核染料,指示细胞核;nc为抗其他病毒的单克隆抗体,作为阴性对照。
39.图4为本发明单克隆抗体10d2的western-blotting鉴定结果图;
40.图中,m为蛋白marker,sars-cov-2,sars-cov,mers-cov分别代表相应泳道为对应病毒的s蛋白。
41.图5为所述单抗的中和能力鉴定结果图;
42.图中,10d2为本发明单克隆抗体,nc为其他病毒的单克隆抗体,作为阴性对照。
43.图6为表位活性所需的最小表位肽鉴定结果图;
44.图中,左侧为n端截短多肽反应结果;右侧为c端截短多肽反应结果。
45.图7为最小表位(seq id no.10)空间定位及结构分析图。
具体实施方式
46.下面结合具体实施方式对本发明作进一步描述,但本发明的保护范围并不仅限于此;以下实施例中所涉及的仪器设备如无特别说明,均为常规仪器设备;所涉及的试剂如无特别说明,均为市售常规试剂;所涉及的试验方法,如无特别说明,均为常规方法。
47.实施例1采用完全暴露rbm的抗原免疫的动物血清分析b细胞表位肽
48.1.抗原的设计
49.采用类似于先前报道的策略(a universal design of betacoronavirus vaccines against covid-19,mers,and sars,dai,l等),在sars-cov-2rbd的基础上对抗原进行了工程改造,改造后的抗原为稳定的rbd-二聚体形式,该二聚物完全暴露双重受体结合基序,而不引入任何外源序列,进而保留抗原效力,提高中和抗体滴度。
50.2.动物血清获得
51.用上述抗原(每只小鼠5μg,每头猪50μg)以肌肉注射的方式分别免疫小鼠和猪。初次注射后,所有动物于初次免疫后的第14天,第28天进行加强免疫,共加强免疫2次。最后一次加强免疫后14天收集血样并用于b细胞表位肽的分析实验。
52.3.b细胞表位肽的分析方法
53.根据sars-cov-2s蛋白的参考序列(access number:yp_009724390),合成22条重叠肽段覆盖整个rbd,长度为20个氨基酸的肽段,相邻肽段重叠5个氨基酸。
54.将所述每个肽段分别包被96孔酶标板,并与获得的动物血清进行间接酶联免疫反应(elisa)检测,确定阳性反应肽段,阳性反应肽段的氨基酸序列如seq id no.9所示,阳性反应多肽与免疫的动物血清的反应见图1。
55.间接elisa步骤如下:
56.(1)用cbs液将上述肽段稀释成浓度为2.5μg/ml的包被液包被酶标板,100μl/孔,37℃
57.孵育2h;
58.(2)弃去包被液,用pbst洗板后,用5%的脱脂奶进行封闭,4℃封闭过夜;
59.(3)将以1:100稀释的小鼠血清样品(一抗)和以1:1000稀释的猪血清样品(一抗),依次加入酶标板中,50μl/孔,37℃孵育30min;
60.(4)弃去一抗,用pbst洗板,洗干净,拍干;
61.(5)将稀释好的hrp标记的羊抗鼠igg(二抗)或羊抗猪igg(二抗)加入反应孔中,50μl/孔,37℃孵育30min;
62.(6)弃去二抗,用pbst冲洗干净,拍干;
63.(7)每孔加入现配的tmb显色液100μl,暗室反应5min;
64.(8)每孔加入50μl 2m h2so4终止反应;
65.(9)酶标仪读取每孔的od
450
值。
66.实施例2单克隆抗体的制备
67.1.免疫原的制备——多肽偶联载体蛋白bsa(牛血清白蛋白)
68.利用水溶性的氨基-巯基交联剂sulfo-smcc进行偶联。sulfo-smcc具有sulfo-nhs酯和马来酰亚胺两个反应基团,可以在在伯氨基与巯基之间发生反应。首先,在ph7-9的条件下,sulfo-smcc与载体蛋白bsa的伯胺基发生反应,形成稳定的酰胺键,得到活化的载体蛋白bsa。其次,活化的bsa经pbs(ph7.2-7.4)透析,换三次透析液,每次间隔6个小时。收集透析好的溶液,用pbs调整蛋白浓度至5mg/ml。最后,在ph 6.5-7.5的条件下,将活化好的bsa与阳性反应肽段seq id no.9的巯基发生反应,形成稳定的硫醚键,形成免疫原性载体蛋白bsa与阳性反应肽段偶联物,以用于抗体制备。
69.2.动物免疫
70.(1)将上述偶联物中加入弗氏完全佐剂,经乳化后用于首次免疫;
71.(2)通过背部皮下多点注射的方法,免疫4~8周龄的雌性balb/c小鼠5只,免疫剂量20μg/只;
72.(3)每隔2周用弗氏不完全佐剂与上述偶联物乳化后以相同的方法和剂量对balb/c小鼠进行2次加强免疫;
73.(4)2周后,尾静脉采血测定针对sars-cov-2s蛋白的特异性抗体效价,选择效价较高的小鼠(图2),于细胞融合前4天,通过尾静脉注射的方法,用不含佐剂的上述偶联物对balb/c小鼠进行超强免疫,免疫剂量是40μg/只。
74.3.细胞融合及单克隆抗体制备
75.采用聚乙二醇的方法,将免疫小鼠的脾细胞与小鼠骨髓瘤细胞sp2/0按细胞数量8:1的比例进行细胞融合,融合后的细胞用hat选择培养基进行筛选;于融合后12天,分别以sars-cov-2s蛋白和阳性反应肽段seq id no.9作为包被抗原,通过间接elisa法初步筛选阳性杂交瘤细胞;
76.间接elisa法步骤如实施例1进行,一抗、二抗不同,一抗为1:100稀释的杂交瘤上清,二抗为hrp标记的羊抗鼠igg(二抗),其他操作如实施例1。
77.4.通过有限稀释法对杂交瘤细胞进行亚克隆
78.用1640/10完全培养基稀释上述阳性杂交瘤细胞至约1.5cells/ml,每孔100μl加入到预铺有100μl饲养细胞的96孔板中,置于37℃,5%co2培养箱中培养6~8天;进一步通过间接elisa法和间接免疫荧光法(ifa)筛选阳性杂交瘤细胞;进行2~3次亚克隆,直至获得稳定分泌抗sars-cov-2s蛋白和阳性多肽seq id no.9的单克隆抗体的杂交瘤细胞株,即可获得目的杂交瘤细胞,将筛选得到的阳性单克隆扩大培养,按细胞数1~2
×
106/管进行冻存。
79.5.单克隆杂交瘤细胞株稳定性鉴定
80.将所建立的单克隆杂交瘤细胞株连续培养3个月并反复液氮冻存复苏,从而鉴定杂交瘤细胞的稳定性;结果显示单克隆杂交瘤细胞株稳定性良好。
81.6.体内诱生腹水法制备单抗
82.选择经产的雌性balb/c小鼠,腹腔内注射500μl灭菌石蜡,一周后,腹腔内注射获得的单克隆杂交瘤细胞,注射量为2
×
105个细胞,待小鼠腹部膨大后抽取腹水,离心后取上清,用饱和硫酸铵法对腹水进行纯化。
83.实施例3抗体的纯化及鉴定
84.1.饱和硫酸铵沉淀法进行抗体纯化,操作方法如下:
85.(1)取5ml单抗腹水,加入5ml pbs缓冲液,再逐滴加入饱和硫酸铵溶液2.5ml,使成为终浓度为20%的硫酸铵溶液,边加边搅拌,充分混匀后,静置30min。
86.(2)8000r/min,离心20min,弃去沉淀,以除去纤维蛋白。
87.(3)在上清液中加入12.5ml饱和硫酸铵溶液,充分混匀,静置30min。
88.(4)8000r/min,离心20min,弃去上清。
89.(5)于沉淀中加入10ml pbs缓冲液,使之溶解,再加入5ml饱和硫酸铵溶液,使之成为33%硫酸铵溶液,充分混匀后,静置30min。
90.(6)8000r/min,离心20min,弃去上清,以除去白蛋白。
91.(7)重复步骤5,2~3次。
92.(8)用5ml pbs缓冲液溶解沉淀,装入透析袋,4℃下用pbs缓冲液透析,换液4次。
93.(9)8000r/min,离心20min,弃沉淀,上清即为纯化抗体,测抗体浓度,分装后,-20℃保存。
94.2.单克隆抗体效价测定
95.间接elisa测定方法参照实施例1进行,一抗略有不同:将纯化的单克隆抗体用5%的脱脂奶从1:200开始进行2倍倍比稀释,依次加入酶标板中,50μl/孔,37℃孵育30min;其他步骤参照实施例1进行,elisa检测结果显示该单克隆抗体效价为1:4.096
×
105。
96.3.亚型鉴定
97.用小鼠单克隆抗体亚型鉴定试剂盒(sigma,mouse monoclonal antibody isotyping kit)对单抗的亚型进行鉴定,鉴定结果显示单克隆抗体属于igg1,轻链型为kappa型。
98.4.单抗特异性鉴定
99.将上述单克隆抗体按一定比例稀释后分别加入真核表达载体plvx-sars-cov-2-s瞬时转染的293t细胞中,利用ifa检测方法测定结果如图3所示,单克隆抗体与细胞源sars-cov-2s蛋白发生特异性反应,而与未转染细胞不反应;western-blotting鉴定结果如图4所示,单抗特异性识别sars-cov-2的s蛋白发生反应,而不与sars-cov和mers-covs蛋白反应。
100.5.单抗的中和活性
101.通过替代病毒中和试验(svnt),具体使用cpass
tm
sars-cov-2中和抗体试剂盒(金斯瑞,南京,中国)评估了所述单抗的的中和能力,具体操作步骤依据产品说明书进行,阴性对照是抗非洲猪瘟病毒的单克隆抗体,结果如图5所示,inhibition(抑制值)=(1-样品od值/阴性对照od值)
×
100%,当抑制值≥20%时,表明所测单抗为中和抗体,由图5可知,所述单克隆抗体为中和抗体。
102.实施例4单克隆抗体可变区基因扩增与序列测定
103.1.引物设计
104.根据鼠源单克隆抗体的序列特征,设计重链可变区引物序列
105.p1:5
’‑
aggtsmarctgcagsagtcwgg-3’;
106.p2:5
’‑
tgaggagacggtgaccgtggtcccttggcccc-3’。
107.设计轻链可变区引物序列
108.p3:5
’‑
actagtcgacatggagwcagacacactsctgytatgggt-3’;
109.p4:5
’‑
cccaagcttactggatggtgggaagatgga-3’。
110.2.聚合酶链反应(pcr)扩增
111.通过分子克隆技术分别获得单克隆抗体的可变区序列,送上海生工生物有限公司测序。
112.使用trizol分离杂交瘤细胞的总rna,并使用primescript
tm
ii试剂盒(takara biomedical technology(beijing)co.)合成cdna。利用上述引物在两个单独的pcr反应中分别扩增单克隆抗体的轻链可变区(vl)和可变区重链(vh)。
113.测序结果如下:本发明的单克隆抗体的重链可变区和轻链可变区的氨基酸序列分
别为seq id no.7、seq id no.8所示。进一步分析得到单克隆抗体重链可变区vhcdr1-3的氨基酸序列分别如seq id no.1-3所示;单克隆抗体的轻链可变区vlcdr1-3的氨基酸序列分别如seq id no.4-6所示。
114.实施例5靶向sars-cov-2受体结合基序的特异性单克隆抗体识别表位最小基序的鉴定
115.通过系统性地从两端截短阳性多肽r465(seq id no.9)建立截短文库,截短肽氨基酸序列见表1,利用间接elisa法鉴定截短多肽与所述单克隆抗体的反应,间接elisa测定方法参照实施例1进行,一抗有所不同,一抗用本发明的单克隆抗体,结果如图6所示,其中,左侧为n端截短多肽与单抗反应结果,右侧为c端截短多肽与单抗反应结果,由图6可知,表位活性所需的最小表位肽为“473
yqagstp
479”(seq id no.10)。
116.表1截短肽氨基酸序列表
[0117][0118][0119]
实施例6抗原表位的空间定位及结构分析
[0120]
通过映射到sars-cov-2rbd-ace2复合体(pdb id:6m0j)和sars-cov-2s蛋白三聚体(pdb id:7a95),分析了所述表位(seq id no.10)的空间分布和结构特性,结果如图7所示,所述表位位于rbm区域的环状结构上,与ace2结合位点有重叠,进一步表明它是干扰病毒-受体相互结合的潜在中和抗体的靶标。
[0121]
实施例7包含所述抗体的免疫疗法(鸡尾酒疗法)
[0122]
针对s蛋白的受体结合域上的表位开发抑制s蛋白与ace2结合的sars-cov-2单克隆抗体,是针对covid-19的治疗性干预措施的重点。但随着这种大流行病继续在人群中传播,有可能出现具有逃避单个抗体中和能力的病毒突变体。用单抗体药物治疗病毒,效果会随着时间的推移而下降,但使用多种抗体混合物的”鸡尾酒疗法”在面对病毒突变时仍然有效。结合不同表位的两种及两种以上中和抗体的组合,可以确保对这些突变体的保护。本发明提供的单克隆抗体的靶向明确的位于sars-cov-2受体结合基序中的潜在中和表位seq id no.10,可以作为“鸡尾酒疗法”的候选抗体。具体实现方式可参照现有技术(regn-cov2,a neutralizing antibody cocktail,in outpatients with covid-19,weinreich dm等和structure-based development of human antibody cocktails against sars-cov-2,
wang,n等),在此不再做具体赘述。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1