用于治疗肝脑病的甾族化合物的制作方法
本申请是申请号为201580006600.1,申请日为2015年1月14日,发明名称为“用于治疗肝脑病的甾族化合物”的中国专利申请的分案申请。
本发明涉及用于治疗肝脑病的甾族化合物。
背景技术:
肝脑病(he)为在急性和慢性肝病中严重的神经精神病学和神经认知并发症。由于慢性肝病大的和增加的流行性,he为显著和增加的健康护理问题。he的特征在于损害睡眠-醒来周期、认识力、记忆力、学习、运动协调、意识、降低的活力水平和人格改变,其在从极微的he(mhe)到明显的he(ohe)的范围内变化。mhe表现为认知损害,并且对与健康相关的生活品质和实施复杂任务(例如驾驶)的能力具有有害的影响。此外,ohe在临床上表为精神和运动障碍并且症状在镇静和昏迷之间的定向障碍范围内变化。
天然存在的类固醇经历强烈的代谢,并且通常不适用于口服给药。内源性甾族激素孕烯诺龙、黄体酮、脱氧皮质酮、可的松和皮质醇(称为孕烷醇酮)的代谢物以及睾酮、雄烯二酮和脱氢表雄酮的代谢物已经全部成为各种研究的主题,这至少部分说明它们在哺乳动物的神经学信号系统中的作用。甾族代谢物诱导cns症状和病症,并且类固醇对于γ-氨基丁酸受体-氯化物离子载体(gabaa-r)复合物作为正调节剂发挥作用,并由此称为gabaa受体调节类固醇(gams)。
某些类固醇已显示为特异性gabaa受体增强剂。这些类固醇的实例可特别存在于wo2008/063128中。这些类固醇中的一些为有效的,并且例如已显示具有以药理学剂量诱导健忘症、镇静和麻醉的能力。wo99/45931和wo03/059357公开了类固醇的拮抗效果。wang等人在2000年(actaphysiolscand169,333-341)和wang等人在2002年(jneurosci22(9):3366-75)公开了3β-oh-5α-孕-20-酮和其它3β-oh-5α/β孕类固醇的拮抗效果。wo2006/056794和wo2010/144498公开了使用化合物治疗肝代偿失调、肝脑病和门静脉高压症。需要提供新的和有效的治疗性治疗,用于肝脑病和相关的病症。
技术实现要素:
本发明提供用于治疗肝脑病的化合物3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐,
3α-乙炔基-3β-羟基雄甾烷-17-酮肟属于一类称为gabaa受体调节甾族拮抗剂(gamsas)的化合物。
我们已发现3α-乙炔基-3β-羟基雄甾烷-17-酮肟能通过内源性类固醇(例如别孕烷醇酮和四氢脱氧皮质酮(thdoc))选择性抑制gabaa受体的正调节。已知这些类固醇诱导镇静、认知损害和运动扰乱,并且它们在脑中的浓度在患有肝病-诱导的高氨血症和he的患者中升高。
然而,我们还已经发现3α-乙炔基-3β-羟基雄甾烷-17-酮肟对于γ-氨基丁酸(gaba)在gabaa受体的作用不具有拮抗效果。从安全性角度,该意外的选择性是有利的,因为抑制在gabaa受体处的gaba结合可导致副作用,包括惊厥。
此外,3α-乙炔基-3β-羟基雄甾烷-17-酮作用于α1和α5gabaa受体亚型二者,因此能对运动和认知损害发挥正效果,和由gabaa受体的过度活化而产生的镇静效果。3α-乙炔基-3β-羟基雄甾烷-17-酮对运动和认知损害的正效果已在he的两种动物模型(在大鼠中高氨血症和门-腔静脉吻合术,见下页)中说明。
与he的现有治疗不同,3α-乙炔基-3β-羟基雄甾烷-17-酮不影响体内氨水平。因此,明显还存在其用于治疗的补充用途的可能性。
因此,存在良好的基础认为3α-乙炔基-3β-羟基雄甾烷-17-酮肟特别良好地适用于治疗he和相关病症。
附图说明
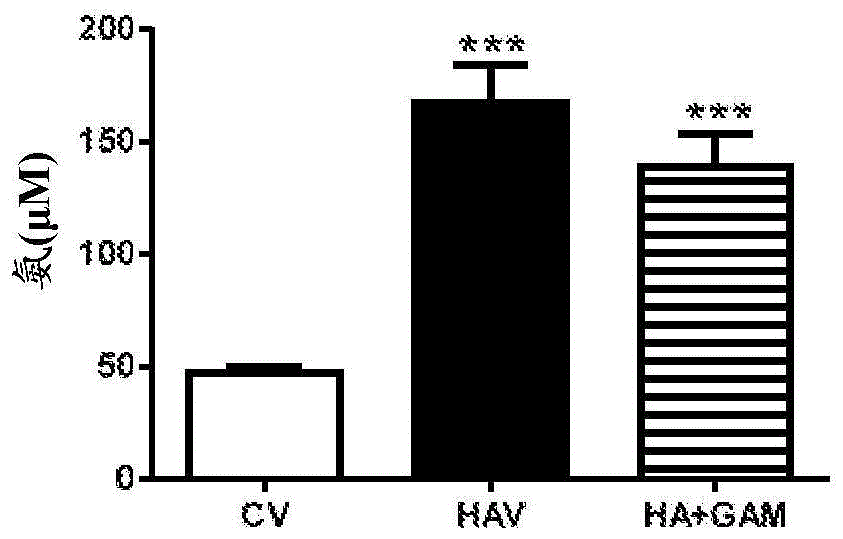
图1显示3α-乙炔基-3β-羟基雄甾烷-17-酮肟不影响血氨水平。各值为12只大鼠/组的平均值±sem,显著不同于对照的值用星号***指示;p<0.001。cv=用媒介物治疗的对照大鼠;hav=用媒介物治疗的高氨血大鼠;ha+gam=用3α-乙炔基-3β-羟基雄甾烷-17-酮肟治疗的高氨血大鼠。
图2显示在径向迷宫中,3α-乙炔基-3β-羟基雄甾烷-17-酮肟恢复高氨血大鼠的空间学习。该图显示在径向测试中的工作误差。工作误差在方框1中。各值为8只大鼠/组的平均值±sem。#p<0.05相对hav。cv=用媒介物治疗的对照大鼠;hav=用媒介物治疗的高氨血大鼠;ha+gam=用3α-乙炔基-3β-羟基雄甾烷-17-酮肟治疗的高氨血大鼠。
图3显示在morris水迷宫测试中,3α-乙炔基-3β-羟基雄甾烷-17-酮肟恢复高氨血大鼠的特定记忆(specialmemory)。该图显示在第3天的第一次试验找到平台的时间。各值为8只大鼠/组的平均值±sem。hav相对cvp=0.052。cv=用媒介物治疗的对照大鼠;hav=用媒介物治疗的高氨血大鼠;ha+gam=用3α-乙炔基-3β-羟基雄甾烷-17-酮肟治疗的高氨血大鼠。
图4显示3α-乙炔基-3β-羟基雄甾烷-17-酮肟恢复高氨血大鼠的运动协调。各值为15只大鼠/组的平均值±sem。显著不同于cv的值用*指示,p<0.05,显著不同于hav的值用###指示,p<0.001。cv=用媒介物治疗的对照大鼠;hav=用媒介物治疗的高氨血大鼠;ha+gam=用3α-乙炔基-3β-羟基雄甾烷-17-酮肟治疗的高氨血大鼠。
图5显示总血浆3α-乙炔基-3β-羟基雄甾烷-17-酮肟浓度。在每日注射治疗的最后一周期间和第5天,在皮下注射3α-乙炔基-3β-羟基雄甾烷-17-酮肟后4小时和23小时,在对照和高氨血大鼠中总血浆3α-乙炔基-3β-羟基雄甾烷-17-酮肟浓度。ha=高氨动物。
图6提供在每日注射20mg/kg七周后,在皮下注射3α-乙炔基-3β-羟基雄甾烷-17-酮肟后1-2小时,在对照和高氨血大鼠中未结合的*脑3α-乙炔基-3β-羟基雄甾烷-17-酮肟浓度。
*未结合的脑浓度=与载体蛋白质或脑组织未结合的在脑中3α-乙炔基-3β-羟基雄甾烷-17-酮肟的分数。
图7提供显示α1β2γ2lgabaa受体的四氢脱氧皮质酮(thdoc)增强的活化的代表性电生理测量。将表达人α1β2γ2lgabaa受体的hek-293细胞暴露于30μmgaba或30μmgaba+100nmthdoc达40ms。在施用thdoc+gaba之前用thdoc预孵育20秒。
图8提供显示α1β2γ2l和α5β3γ2lgabaa受体的thdoc增强的活化的3α-乙炔基-3β-羟基雄甾烷-17-酮(gamsa)拮抗作用和对gaba无抑制的代表性电生理测量。a)关于α1β2γ2lgabaa受体的30μmgaba的100nmthdoc增强的活化的1μm3α-乙炔基-3β-羟基雄甾烷-17-酮拮抗作用,b)1μm3α-乙炔基-3β-羟基雄甾烷-17-酮不拮抗α1β2γ2lgabaa受体的30μmgaba活化,c)关于α5β3γ2lgabaa受体的0.3μmgaba的200nmthdoc增强的活化的1μm3α-乙炔基-3β-羟基雄甾烷-17-酮拮抗作用;这指示thdoc效果的拮抗作用,d)1μm3α-乙炔基-3β-羟基雄甾烷-17-酮不拮抗α5β3γ2lgabaa受体的0.3μmgaba活化。
图9说明在高氨血大鼠和pcs大鼠中,3α-乙炔基-3β-羟基雄甾烷-17-酮恢复运动协调的能力。使用梁步行测试(beamwalkingtest)评定运动协调。(a)显示用媒介物治疗的对照(cv)或高氨血(hav)大鼠和用3(ha3)、10(ha10)或20(ha20)mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮治疗的高氨血大鼠的数据。(b)显示用媒介物治疗的假装-操作的对照(sm)或pcs大鼠和用0.7(pcs0.7)或2.5(pcs0.5)mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮治疗的pcs大鼠的数据。各值为在每一条下指示的大鼠数量的平均值±sem。显著不同于对照或假装大鼠的值用星号指示。显著不同于用媒介物治疗的高氨血大鼠或pcs大鼠的值用“a”指示。*p<0.05;ap<0.05;aap<0.01;aaap<0.001。
图10说明在高氨血大鼠和pcs大鼠中,在morris水迷宫中,3α-乙炔基-3β-羟基雄甾烷-17-酮恢复空间记忆力的能力。在用媒介物治疗的对照(cv)或高氨血(hav)大鼠,和对于用3(ha3)、10(ha10)或20(ha20)mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮(a,b)治疗的高氨血大鼠,以及在用媒介物治疗的假装-操作的对照(sm)或pcs大鼠,和对于用0.7(pcs0.7)或2.5(pcs2.5)mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮(c,d)治疗的pcs大鼠中,评定在morris水迷宫中的空间学习记忆力。(a,c)在不同时期(differentseccions)达到平台的逃脱潜伏期(laterncy)(以秒计)。(b,d)在记忆力测试期间在正确的象限中所花的时间(%)。各值为在每一条下指示的大鼠数量的平均值±sem。显著不同于对照或假装大鼠的值用星号指示。显著不同于用媒介物治疗的高氨血大鼠或pcs大鼠的值用“a”指示。*p<0.05;ap<0.05。
图11说明在高氨血大鼠和pcs大鼠中,在径向迷宫中,3α-乙炔基-3β-羟基雄甾烷-17-酮恢复空间学习的能力。在用媒介物治疗的对照(cv)或高氨血(hav)大鼠,和对于用3(ha3)、10(ha10)或20(ha20)mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮(a,b)治疗的高氨血大鼠,以及在用媒介物治疗的假装-操作的对照(sm)或pcs大鼠中,和对于用0.7(pcs0.7)或2.5(pcs2.5)mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮(c,d)治疗的pcs大鼠中,评定在径向迷宫中的空间学习。(a,c)在不同时期的工作误差。(b,d)在第1-2天期间的工作误差。各值为在每一条下指示的大鼠数量的平均值±sem。显著不同于对照或假装大鼠的值用星号指示。显著不同于用媒介物治疗的高氨血大鼠或pcs大鼠的值用“a”指示。*p<0.05;ap<0.05;aap<0.01。
图12说明3α-乙炔基-3β-羟基雄甾烷-17-酮在夜晚期间提高自发运动活性和部分恢复pcs大鼠的昼夜节律的能力。在用媒介物或用0.7(pcs0.7)或2.5(pcs2.5)mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮治疗的假装-操作的对照(sm)或pcs大鼠中评定运动活性。在每一小时期间的运动活性在a中显示;在夜晚期间和在白天期间活性的比率在b中显示;和在白天或夜晚期间的总活性在c中显示。在下午7点关灯。各值为8只大鼠/组的平均值±sem。显著不同于sm大鼠的值用星号指示;*p<0.05;**p<0.01;***p<0.001。显著不同于pcs大鼠的值用a指示;ap<0.05。
图13说明乙炔基-3β-羟基雄甾烷-17-酮在白天期间使得垂直活性正常化(normalized)和部分恢复pcs大鼠的昼夜节律的能力。如图12所述进行实验,但是显示垂直计数。各值为8只大鼠/组的平均值±sem。显著不同于sm大鼠的值用星号指示;*p<0.05;**p<0.01;***p<0.001。显著不同于pcs大鼠的值用a指示;ap<0.05;aap<0.01。
图14显示在高氨血大鼠和pcs大鼠中,在行为测试时,在血浆和在脑中的乙炔基-3β-羟基雄甾烷-17-酮暴露。在a)高氨血大鼠,和b)pcs大鼠中,以μm显示乙炔基-3β-羟基雄甾烷-17-酮的总血浆浓度。在c)高氨血大鼠和d)pcs大鼠中,以nmol/kg显示乙炔基-3β-羟基雄甾烷-17-酮的未结合的脑浓度。注意在不同大鼠模型中暴露类似,其中使用的剂量为,在高氨血大鼠中为3、10和20mg/kg/天,而在pcs大鼠中为0.7和2.5mg/kg/天(notethesimilarexposuresinthedifferentratmodelswiththedosesused,inhyperammonemicrate3,10and20mg/kg/dayandinrateswithpcs0.7and2.5mg/kg/day)。数据得自研究结束时,即,在用在芝麻油中的乙炔基-3β-羟基雄甾烷-17-酮每天皮下给予一次,在九周每日治疗后。
具体实施方式
在详细描述本发明之前,应理解的是,本文使用的术语仅用于描述具体实施方案的目的,并且不旨在限制。
注意到,在本说明书和所附权利要求中,除非上下文明确另外指示,否则单数形式“一个”、“一”和“该”还包括复数指代物。
术语“药物组合物”以其最宽的含义使用,包括含有至少一种活性物质和任选的载体、佐剂、稀释剂、组成等的所有药学上可适用的组合物。
术语“给药”和“给药模式”以及“给药途径”也以其最宽的含义使用。
根据本发明使用的化合物3α-乙炔基-3β-羟基雄甾烷-17-酮肟可采用多种方式给药,很大程度上取决于是否局部(local)、局部(topical)或全身给药模式对于待治疗的肝脑病状况是最适合的。这些不同的给药模式例如局部(例如,在皮肤上)、局部(包括眼用和用于各种粘膜,例如阴道和直肠递送)、口服、肠胃外或经肺(其包括上和下导气管)。这样的组合物和制剂的制备为药物和制剂领域技术人员通常已知的,并且可适用于本发明组合物的制剂。
术语“拮抗剂”指阻碍另一种物质(激动剂)诱导其效果的物质。在本申请中,术语拮抗剂和阻断剂可互换使用。
术语“a型肝脑病”通常意指与急性肝衰竭相关的肝脑病,其通常与脑浮肿相关。
术语“b型肝脑病”通常意指由门-全身分流(portal-systemicshunting)引起的肝脑病(旁路),而没有相关的固有的肝病。
术语“c型肝脑病”通常意指在患有肝硬化(cirrhosis)的患者中出现的肝脑病,这种类型细分为事件性、持久的和极微的脑病。
术语“极微的肝脑病”通常意指不导致在临床上明显的认知机能障碍但是可用神经心理学研究证明的肝脑病。
术语“明显的肝脑病”通常意指在临床上明显的肝脑病,其表现为具有大量精神和运动障碍的神经精神病学综合征。明显的肝脑病可由于事件而引起,在先前稳定的患者中经数小时或数天的时间段,或者患者可能呈现持久的神经精神病学异常。
术语“高氨血症”通常意指代谢扰乱,其特征在于在血液中过量的氨。
术语“肝移植”通常意指除去作为急性肝衰竭或肝硬化的结果的患病的肝并且用来自供体的健康的肝来替代它的外科手术程序。大多数肝移植手术使用来自已故供体的肝,但是肝也可来自活的供体(健康人的肝脏的一部分)。患有例如肝硬化的患者通常经历肝脑病,并且术前肝脑病为移植后神经学并发症的重要预测因子。
术语“慢加急性肝衰竭(acute-on-chronicliverfailure)”通常意指肝硬化的急性代偿失调,至少一个器官衰竭,或者属于高短期死亡率的亚组。
术语“补偿的肝硬化”通常意指没有任何临床迹象但是可包括渐近食管或胃脉管曲张和早期症状(例如疲劳和能量损失、食欲丧失和重量减轻、恶心或腹痛)的肝硬化。
术语“代偿失调硬化”通常意指具有各种临床迹象(例如黄疸、腹水、浮肿、肝脑病、胃肠出血、门静脉高压症、细菌感染或任何组合)的发展的肝硬化。
术语“门静脉高压症”通常意指在肝硬化后肝静脉压力梯度,具有或不具有相关的经颈静脉肝内门体循环分流(tips)。
在本公开内的术语“预防”通常意指预防疾病或病症肝脑病发生。
在本公开内的术语“减轻”通常意指降低或免除疾病或病症肝脑病。
遭受肝脑病的患者可能显示这样的症状,其包括但不限于损害睡眠-清醒周期、认识力、记忆力、学习、运动协调、意识、降低的活力水平和人格改变、认知损害、定向障碍和昏迷。
本发明人已意外地显示3α-乙炔基-3β-羟基雄甾烷-17-酮肟可用于治疗肝脑病。
在本发明的第一方面,提供了用于治疗肝脑病的化合物3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐
在本发明的一种实施方案中,所述肝脑病为a型肝脑病。
在本发明的另一实施方案中,所述肝脑病为b型肝脑病。
在本发明的另一实施方案中,所述肝脑病为c型肝脑病。
在本发明的另一实施方案中,所述肝脑病为极微的肝脑病。
在本发明的另一实施方案中,所述肝脑病为明显的肝脑病。
在本发明的另一实施方案中,所述化合物用于其中在患有急性肝衰竭的患者中治疗所述肝脑病。
在本发明的另一实施方案中,所述化合物用于其中在具有或不具有慢加急性肝衰竭的患有慢性肝病的患者中治疗所述肝脑病。
在本发明的另一实施方案中,所述化合物用于在患有急性肝衰竭的患者中,或在具有或不具有慢加急性肝衰竭的患有慢性肝病的患者中预防或减轻肝脑病,例如a型肝脑病、b型肝脑病、c型肝脑病、极微的肝脑病、明显的肝脑病。
在本发明的另一实施方案中,使用的所述化合物在肝移植之前、期间或之后提供。
在本发明的另一实施方案中,提供了一种药物组合物,所述组合物包含用于治疗肝脑病的3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐以及一种或多种药学上可接受的载体、赋形剂和/或稀释剂。
在本发明的另一方面,提供了一种治疗肝脑病的方法,所述方法包括给予有需要的患者药学上有效量的3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐
在本发明的一种实施方案中,所述肝脑病为a型肝脑病。
在本发明的另一实施方案中,所述肝脑病为b型肝脑病。
在本发明的另一实施方案中,所述肝脑病为c型肝脑病。
在本发明的另一实施方案中,所述肝脑病为极微的肝脑病。
在本发明的另一实施方案中,所述肝脑病为明显的肝脑病。
在本发明的另一实施方案中,所述患者遭受急性肝衰竭。
在本发明的另一实施方案中,所述患者遭受具有或不具有慢加急性肝衰竭的慢性肝病。
在本发明的另一实施方案中,所述化合物在肝移植之前、期间或之后提供。
在本发明的另一实施方案中,提供了一种预防或减轻肝脑病的方法,所述方法包括给予有需要的患者药学上有效量的3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐
所述肝脑病可为a型肝脑病、b型肝脑病、c型肝脑病、极微的肝脑病或明显的肝脑病。此外,所述预防可在患有急性肝衰竭的患者中,或者在具有或不具有慢加急性肝衰竭的患有慢性肝病的患者中。
在本发明的另一方面,提供了用于治疗门静脉高压症的化合物3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐
所述应用还可为预防或减轻门静脉高压症。患有门静脉高压症的患者通常遭受肝病,例如慢性肝病、肝硬化或急性肝衰竭。
在本发明的另一方面,提供了一种治疗门静脉高压症的方法,所述方法包括给予有需要的患者药学上有效量的3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐
所述方法还可预防或减轻门静脉高压症。患有门静脉高压症的患者通常遭受肝病,例如慢性肝病、肝硬化或急性肝衰竭。
在本发明的另一方面,提供了用于治疗肝代偿失调的化合物3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐
所述应用还可为预防或减轻肝代偿失调。患有肝代偿失调的患者通常遭受肝病,例如慢性肝病,或者可能怀疑具有沉淀事件,例如胃肠出血、感染、门静脉血栓形成或脱水。
在本发明的另一方面,提供了一种治疗肝代偿失调的方法,所述方法包括给予有需要的患者药学上有效量的3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐
所述方法还可预防或减轻肝代偿失调。患有肝代偿失调的患者通常遭受肝病,例如慢性肝病,或者可能怀疑具有沉淀事件,例如胃肠出血、感染、门静脉血栓形成或脱水。
在本发明的另一方面,提供了化合物3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐在制造用于治疗肝脑病的药物中的用途
在本发明的一种实施方案中,所述肝脑病为a型肝脑病。
在本发明的另一实施方案中,所述肝脑病为b型肝脑病。
在本发明的另一实施方案中,所述肝脑病为c型肝脑病。
在本发明的另一实施方案中,所述肝脑病为极微的肝脑病。
在本发明的另一实施方案中,所述肝脑病为明显的肝脑病。
在本发明的另一实施方案中,所述应用为其中所述肝脑病在患有急性肝衰竭的患者中治疗。
在本发明的另一实施方案中,所述应用为其中所述肝脑病在具有或不具有慢加急性肝衰竭的患有慢性肝病的患者中治疗。
在本发明的另一实施方案中,所述应用在肝移植之前、期间或之后提供。
在本发明的另一实施方案中,化合物3α-乙炔基-3-β-羟基雄甾烷-17-酮肟或其药学上可接受的盐在制造药物中的所述用途可用于在患有急性肝衰竭的患者中,或在具有或不具有慢加急性肝衰竭的患有慢性肝病的患者中预防或减轻肝脑病,例如a型肝脑病、b型肝脑病、c型肝脑病、极微的肝脑病、明显的肝脑病。
在该方面的另一实施方案中,提供了一种药物组合物,所述组合物包含用于治疗肝脑病的3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐以及药学上可接受的载体、赋形剂和/或稀释剂。所述应用还可为预防或减轻肝脑病。
在本发明的其它方面,为用于抑制或治疗由高氨血症引起的症状的化合物3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐
本发明的其它实施方案为用于在患有急性肝衰竭的患者中,或在具有或不具有慢加急性肝衰竭的患有慢性肝病的患者中治疗或预防肝脑病(例如a型肝脑病、b型肝脑病、c型肝脑病、极微的肝脑病、明显的肝脑病)的化合物3α-乙炔基-3β-羟基雄甾烷-17-酮肟;其中所述治疗或预防包括共同给予3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐以及氨-降低化合物,例如利福昔明、乳果糖、鸟氨酸苯乙酸酯和甘油苯丁酸酯,优选氨-降低化合物为利福昔明或乳果糖,最优选氨-降低化合物为利福昔明。
本发明的其它实施方案为在患有急性肝衰竭的患者或具有或不具有慢加急性肝衰竭的患有慢性肝病的患者中治疗或预防肝脑病(例如a型肝脑病、b型肝脑病、c型肝脑病、极微的肝脑病、明显的肝脑病)的方法;其中所述治疗或预防包括共同给予3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐与氨-降低化合物,例如利福昔明、乳果糖、鸟氨酸苯乙酸酯和甘油苯丁酸酯,优选氨-降低化合物为利福昔明或乳果糖,最优选氨-降低化合物为利福昔明。
本发明的其它实施方案为化合物3α-乙炔基-3β-羟基雄甾烷-17-酮肟在制造药物中的用途,所述药物用于在患有急性肝衰竭的患者中,或在具有或不具有慢加急性肝衰竭的患有慢性肝病的患者中治疗或预防肝脑病(例如a型肝脑病、b型肝脑病、c型肝脑病、极微的肝脑病、明显的肝脑病);其中所述治疗或预防包括共同给予3α-乙炔基-3β-羟基雄甾烷-17-酮肟或其药学上可接受的盐与氨-降低化合物,例如利福昔明、乳果糖、鸟氨酸苯乙酸酯和甘油苯丁酸酯,优选氨-降低化合物为利福昔明或乳果糖,最优选氨-降低化合物为利福昔明。
本发明的其它方面为化合物3α-乙炔基-3β-羟基雄甾烷-17-酮肟,其中在每一个可能的取代位置的一个或多个氢原子可被氘或氚取代,用于治疗肝脑病,例如极微的肝脑病或明显的肝脑病。
本发明的其它方面为化合物3α-乙炔基-3β-羟基雄甾烷-17-酮肟,其中在每一个可能的取代位置的一个或多个氢原子可被氘或氚取代,用于涉及测定化合物在组织或流体中的浓度的测定法。
根据本发明,3α-乙炔基-3β-羟基雄甾烷-17-酮肟可通过以下给药途径之一给药:静脉内、经鼻、经直肠、经颊、阴道内、经皮、肌内和口服。根据一种实施方案,将3α-乙炔基-3β-羟基雄甾烷-17-酮肟静脉内给药。根据另一实施方案,将3α-乙炔基-3β-羟基雄甾烷-17-酮肟经鼻给药。使用作为膏霜、凝胶和软膏配制或为缓释粘附型药物贴剂形式的3α-乙炔基-3β-羟基雄甾烷-17-酮肟经皮给药为另一种可能的给药形式,其类似地适用于自身药疗法。
药物组合物可根据正常的药理学程序适应或调节,其包含适用于所选途径的化学形式的有效药物以及本领域技术人员常规使用和公知的合适的佐剂、载体、稀释剂和媒介物。用于口服给药的常规使用的佐剂和媒介物为例如填料或悬浮剂,像二氧化钛、乳糖酸酐、二氧化硅、二氧化硅胶体、甲基纤维素、硬脂酸镁、微晶纤维素等。用于静脉内给药的常规使用的佐剂和媒介物为例如注射用无菌水(wfi)、无菌缓冲液(例如其将溶液缓冲至ph7.4)白蛋白溶液、脂质溶液、环糊精等。用于经皮给药的常规使用的佐剂和媒介物为例如凡士林、液体石蜡、甘油、水、mct油、芝麻油、植物油等。剂量自然会根据以下而变:给药模式,待治疗的具体病况或期望的效果、患者的性别、年龄、重量和健康以及由治疗医师评价的可能的其它因素。
现在将通过多个说明性、非限制性实施例来描述本发明。
实施例1
3α-乙炔基-3β-羟基雄甾烷-17-酮肟的合成
步骤1:合成3α-乙炔基-3β-羟基雄甾烷-17-酮
在氮气下,在(rt)室温下,将3,17-雄甾烷二酮(5.0mmol)溶解于50ml无水thf中。搅拌下,在室温下,逐滴加入乙炔基溴化镁(1.1当量),在氮气流下,在室温下,让溶液搅拌过夜。溶液随后用饱和nh4cl(aq)淬灭,水相用二氯甲烷(3×30ml)萃取。将收集的有机相减压蒸发,将所得到的黄色油溶解于二氯甲烷中,用盐水洗涤,经mgso4干燥。溶液在真空下还原(reduced),残余物通过二氧化硅快速柱层析法(1:4的乙醚:二氯甲烷)纯化,典型的收率为65%。最终痕量的副产物可通过从乙醚进一步重结晶而除去。
1hnmr(400mhz,cdcl3-d6):δ2.43(s,1h);2.42(m,1h);2.10-2.04(m,2h);1.02(m,1h);0.86(s,3h);0.83(s,3h)。
步骤2:合成3α-乙炔基-3β-羟基雄甾烷-17-酮肟
在250ml圆底烧瓶中,在室温和空气气氛下,将3α-乙炔基-3β-羟基雄甾烷-17-酮(10mmol)溶解于5ml二氯甲烷和50ml乙醇中。将4当量的nh2oh盐酸盐和4当量的乙酸钠溶解于5mlh2o中,随后加入到甾族溶液中。加入20ml乙醇,让混合物回流过夜。随后冷却混合物,减压除去溶剂。白色残余物用50mlh2o和50ml二氯甲烷处理,水相用3×30ml二氯甲烷萃取。随后收集的有机相经mgso4干燥,过滤,减压除去溶剂。最终的残余物通过二氧化硅快速柱层析法纯化(4:1的二氯甲烷:乙醚),典型的收率为95-100%(定量)。
1hnmr(400mhz,cdcl3-d6):δ2.51-2.47(m,2h);2.43(s,1h);1.00(m,1h);0.80(m,1h);0.90(s,3h),0.83(s,3h)。
实施例2
3α-乙炔基-3β-羟基雄甾烷-17-酮肟在肝脑病的动物模型中的治疗效果
治疗和测试日程
在该研究中,使用重现存在于肝脑病中的许多认知和运动改变的慢性高氨血症的动物模型。对大鼠在其食物中喂食氨,用富含氨的食物两周后,它们发展肝脑病的症状。在第3周和第4周3α-乙炔基-3β-羟基雄甾烷-17-酮肟治疗期间,进行梁步行测试,同时在第4周至第5周3α-乙炔基-3β-羟基雄甾烷-17-酮肟治疗期间,进行morris水迷宫测试,并且第6周至第7周3α-乙炔基-3β-羟基雄甾烷-17-酮肟治疗期间,进行径向迷宫测试。
关于动物(雄性wistar大鼠)将研究分为两个系列,每一个系列包括以下组:用媒介物治疗的对照(cv,n=8/系列),用3α-乙炔基-3β-羟基雄甾烷-17-酮肟治疗的对照(c+gam,n=8/系列),用媒介物治疗的高氨血大鼠(hav,n=8/系列),用3α-乙炔基-3β-羟基雄甾烷-17-酮肟治疗的高氨血大鼠(ha+gam,n=8/系列)。约上午9点皮下注射1ml/kg,实施每日一次的用20mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮肟或用媒介物治疗。在开始用含有铵的饮食一周后开始治疗,并且持续整个实验阶段。
制备3α-乙炔基-3β-羟基雄甾烷-17-酮肟的测试品,作为20mg/kg的在芝麻油中的悬浮液。
在径向迷宫中的空间学习
设计径向迷宫作为评定空间学习的方法。设备由中心区域组成,该区域通向(accessto)八个等尺寸的臂形物。臂状物70cm长,10cm宽,中心区域直径30cm。迷宫由黑色有机玻璃制成,升高到超过地面(defloor)80cm。每一个臂状物具有侧壁,其中邻近中心区域一侧的高度(30cm)比远侧(5cm)高。在每一个臂状物的远侧尽头,安装凹进的杯,用于放置食物奖赏(hernandez-rabazav.等人2010)。
为了使大鼠习惯于迷宫,在末端暗示(不同尺寸的海报和物体)存在下,连续两天让大鼠探究迷宫10分钟,在整个训练中所述末端暗示保持就位(inplace)。
在径向迷宫中的训练由五个单元组成,每个单元三个试验,连续实施十天。任务涉及定位四个丸粒,根据随机布置,将每一个所述丸粒放置在不同的臂状物的末端。布置对于每一只大鼠是特异的,并且在整个训练中保持不变。计算空间参考误差和工作记忆力的数量,并且表述为每个单元参考和工作误差的数量。此外,学习指数用于评价任务的学习,并且定义为正确选择-参考误差的数量(hernandez-rabaza等人2010)。
结果
在径向迷宫中,3α-乙炔基-3β-羟基雄甾烷-17-酮肟恢复高氨血大鼠的空间学习。高氨血大鼠显示降低的空间学习并且在径向迷宫任务中实施更多的工作误差。空间记忆力被3α-乙炔基-3β-羟基雄甾烷-17-酮肟完全恢复(图2)。
实施例3
3α-乙炔基-3β-羟基雄甾烷-17-酮肟在肝脑病的动物模型中的治疗效果
治疗和测试日程
治疗和测试日程在实施例2中描述。
在morris水迷宫中的空间记忆力
设计迷宫作为评定空间学习的方法(morrisr.1984)。使用任意分成四个象限的黑色圆形池(160cm直径,40cm高)进行测试。通过加入黑色油漆,得到水不透明性。在训练期间,在一个象限的中心,将直径10cm的透明的有机玻璃平台浸入水表面下2cm(monfort等人,europeanjournalofneuroscience,2007,25,2103-211)。
如下进行测试:第一天为预训练日,将大鼠放入水中两次达30秒,仅用于适应水。随后在3天期间,训练大鼠认识到看不见的平台的固定的位置。每一个训练试验包含在缺少平台的三个象限之一处将大鼠面向壁放置在池中。在每一个试验中随机地使用不同的起点。训练由每天五次游泳组成。给每一动物最多120秒以找到平台,并且留出15秒在平台上,如果大鼠不能在120秒内定位平台,则由实验人员手动引导它至平台。该测试的目的在于让大鼠认识到哪里放置了看不见的平台并且在可能的最短的时间内到达该平台。由viewpointcompany提供的视频跟踪系统(viewpoint2.5,champagneaumontd`or,法国)记录找到隐藏的平台所需的时间、速度和路径,并且用作学习该任务的度量。15次训练试验后,从池中移除平台,让大鼠在池中游90秒,记录在训练期间在放置所述平台的象限中所花的时间。
结果
在morris水迷宫中,3α-乙炔基-3β-羟基雄甾烷-17-酮肟完全恢复高氨血大鼠的空间记忆力。高氨血大鼠显示降低的记忆力,并且比对照需要更多的时间才能找到平台(图3)。
实施例4
3α-乙炔基-3β-羟基雄甾烷-17-酮肟在肝脑病的动物模型中的治疗效果
治疗和测试日程
治疗和测试日程如实施例2中描述。
在梁步行中的运动协调
在梁-步行测试中,训练大鼠横过升高的窄的梁以到达封闭的逃脱平台。梁由光滑的圆木(直径20mm)制成。将梁提升至距离地板1m。测量的运动协调的参数为:横过梁的足滑脱(或者足错误)和潜伏期。(jover等人,2006;carter等人,2010)。为了使大鼠习惯,实验人员将大鼠放置在梁的起点,并且帮助大鼠横过梁三次。此后,测试由三个连续的试验组成。对于每一个试验,记录左或右后爪滑脱梁的次数的数量。
结果
在梁-步行测试中,3α-乙炔基-3β-羟基雄甾烷-17-酮肟完全逆转高氨血大鼠的运动不协调。高氨血大鼠显示运动不协调(增加的滑脱数量=足错误)(图4)。
实施例5
在外原性给药后,在血浆和脑组织中3α-乙炔基-3β-羟基雄甾烷-17-酮肟的浓度
获得血浆
在第二周氨处理和第一周3α-乙炔基-3β-羟基雄甾烷-17-酮肟治疗结束时从大鼠的尾部(得自实施例2)以及也在动物处死期间从颈部得到血液。为了得到血浆,加入edta7.5nm,并且在5分钟期间以1500r.p.m离心。
氨测定
使用pocketchemba(woodleyequipmentcompanyltd,英国)(一种氨分析仪)测量血液样品中的氨浓度。该装置能够立即测试并且在3分钟20秒内递送结果。其还免除预加工的需要,所述预加工例如离心分离。
处死
通过断头处死大鼠。采集包括小脑的半个脑,并且在-80℃下保存,用于测定3α-乙炔基-3β-羟基雄甾烷-17-酮肟。分割不同的脑区域(小脑、皮层、海马和纹状体),并且在-80℃下保存,用于可能的gams测定。
3α-乙炔基-3β-羟基雄甾烷-17-酮肟浓度的分析
分析采集的脑和血浆样品的3α-乙炔基-3β-羟基雄甾烷-17-酮肟浓度。将血浆和脑样品在室温下融化。用3倍体积的乙腈使血浆进行蛋白质-沉淀,脑组织用1:4的组织:pbs(ph7.4)比率均化,随后在超声处理期间用2倍体积的甲醇:乙腈(1:1)萃取20分钟。随后振动样品,以10000×g离心10分钟(heraeuspico17离心机)。随后将上清液用等体积的pbs稀释,并分析。由于3α-乙炔基-3β-羟基雄甾烷-17-酮肟浓度太高将一些样品作为10倍稀释物重新分析。用37.5%乙腈在pbs缓冲液中的溶液制备稀释物。
通过掺入空白血浆/脑均浆达到0.5-5000ng/ml浓度而制备标准品,并且在其它方面如样品一样处理该标准品。用lc-ms进行测定。
结果
氨测定:3α-乙炔基-3β-羟基雄甾烷-17-酮肟不影响血氨水平。与对照大鼠(47±3μm)相比,在喂食铵饮食的大鼠(167±17μm)中血液中的氨水平升高。在对照大鼠(55±7μm)中或在高氨血大鼠(139±15μm)中,3α-乙炔基-3β-羟基雄甾烷-17-酮肟不影响血氨水平(图1)。这些结果是出乎意料的,因为所有显示对肝脑病症状的效果的较早研究都降低氨水平。
在暴露后测定3α-乙炔基-3β-羟基雄甾烷-17-酮肟
在本研究中,分别在用3α-乙炔基-3β-羟基雄甾烷-17-酮肟治疗最后一周时和治疗第5天时,在注射后4小时和23小时分析在血浆中3α-乙炔基-3β-羟基雄甾烷-17-酮肟的总浓度。在血浆中3α-乙炔基-3β-羟基雄甾烷-17-酮肟的浓度在图5中显示,脑浓度在图6中显示。分别地,在治疗第5天时,在注射后23小时与在注射后4小时相比,3α-乙炔基-3β-羟基雄甾烷-17-酮肟的浓度更低,而在治疗最后一周时,发现,在4小时和23小时两组中,3α-乙炔基-3β-羟基雄甾烷-17-酮肟的浓度类似。在脑中,在上次治疗后1-2小时,发现在对照(91±4.1nmol/kg未结合的*3α-乙炔基-3β-羟基雄甾烷-17-酮肟)和在ha大鼠(106±15.4nmol/kg未结合的*3α-乙炔基-3β-羟基雄甾烷-17-酮肟)中,3α-乙炔基-3β-羟基雄甾烷-17-酮肟的浓度类似(图6)。在整个24小时内,浓度显示出乎意料的高的水平和稳定的浓度。
*未结合的脑浓度=在脑中与载体蛋白质或脑组织未结合的3α-乙炔基-3β-羟基雄甾烷-17-酮肟的分数
实施例6
3α-乙炔基-3β-羟基雄甾烷-17-酮肟在gabaa受体处拮抗thdoc而非gaba的效果的能力
关于α1β2γ2l和α5β3γ2lgabaa受体的全细胞电压-夹电生理
为了电生理测量,使用具有resolve芯片的
在室温下进行全细胞电压-夹记录(21-23℃,对液接电势(liquidjunctionpotential)补偿-17mv,如haage等人,2002;neher,1992中)。通过pclamp9.0软件、digidata1322a转换器和axonpatch200b产生指令脉冲和收集数据(axoninstruments,fostercity,ca)。patch电极(2-6mω)填充包括以下的细胞内溶液(ic):140mmcs-葡糖酸盐,3.0mmnacl,1.2mmmgcl2,10mmhepes,1.0mmegta,2mmmg-atp,0.1%dmso,ph7.2。
将thdoc和3α-乙炔基-3β-羟基雄甾烷-17-酮肟溶解于二甲基亚砜(dmso)中,随后用ec溶液稀释,以包括0.1%dmso。
不同的方案用于不同的电生理测量。由于体内的α1β2γ2l-gabaa受体存在于突触内,使用类似于该情况的条件,高gaba浓度(30μm)的短施用(40ms)。相反,α5β3γ2l-gabaa受体存在于突触外,因此所用的条件为长暴露(6s)于低gaba浓度(0.3μm)。使用thdoc的ec75浓度,即,对于研究α1β2γ2l使用100nm,而当评价表达α5β3γ2l的细胞时,使用200nm。对于两种细胞类型,在施用gaba之前,使用用thdoc或thdoc+3α-乙炔基-3β-羟基雄甾烷-17-酮的预暴露。
将在gaba存在下的甾族效果关于对照标准化,以避免在测量的参数中细胞间和细胞内变化的影响,将每一个细胞用作其自身对照,分析在曲线下的面积(auc)。
结果
使用对表达人受体突变体的重组体hek293-细胞的电生理测量,研究3α-乙炔基-3β-羟基雄甾烷-17-酮在gabaa受体处的影响。在gaba存在下,α1β2γ2lgabaa受体的100nmthdoc-增强的活化示于图7。
3α-乙炔基-3β-羟基雄甾烷-17-酮(1μm)部分拮抗thdoc在gabaa受体的α1β2γ2l和α5β3γ2l亚单位突变体二者处的影响(图8的a和c)。关于α1β2γ2l受体,3α-乙炔基-3β-羟基雄甾烷-17-酮抑制29±4.7%的gaba的thdoc增强(p<0.001),而关于α5β3γ2l受体,抑制为49±4.7%(p<0.001,表1)。
相反,3α-乙炔基-3β-羟基雄甾烷-17-酮(1μm)不拮抗gabaa受体的gaba-活化(图8的b和d)。当gaba为唯一的受体活化剂时,3α-乙炔基-3β-羟基雄甾烷-17-酮在α1β2γ2lgabaa受体(-3.1±1.7%,ns)或α5β3γ2lgabaa受体(-3.8±1.5%,ns)处没有显著的影响(表1)。
表1.3α-乙炔基-3β-羟基雄甾烷-17-酮(gamsa)在gabaa受体处拮抗thdoc而非gaba的能力
实施例7
3α-乙炔基-3β-羟基雄甾烷-17-酮对其它靶和受体的选择性
测定3α-乙炔基-3β-羟基雄甾烷-17-酮对于受体、离子通道和酶(包括所有主要类型的神经递质受体)的结合。在共113个靶中,用3α-乙炔基-3β-羟基雄甾烷-17-酮以10μm一式两份测试(perkinelmer,定制筛选)。结合活性定义为大于或等于配体结合的50%抑制。
结果
在10μm下,对于任何研究的神经递质相关的受体、甾族受体或肽受体,3α-乙炔基-3β-羟基雄甾烷-17-酮不显示结合活性。
实施例8
3α-乙炔基-3β-羟基雄甾烷-17-酮对具有he和门-腔静脉吻合术大鼠的运动协调的治疗效果
治疗和测试日程
在大鼠中的慢性高氨血症。通过给雄性wistar大鼠喂食含有乙酸铵(30重量%)的饮食,使雄性wistar大鼠(140-160g)变为高氨血的(felipo等人,europeanjournalofbiochemistry,1988,176,567-571)。
门-腔静脉吻合术。用异氟烷使雄性wistar大鼠(220-240g)麻醉,如lee和fisher(surgery,1961,50,668-672)所描述的,实施末端至侧面门-腔静脉吻合术。假装操作对照大鼠;将它们的门静脉和下腔静脉夹住10分钟。
经历门-腔静脉吻合术程序的大鼠在本文中称为“pcs大鼠”。
进行适当的测量,使得动物的疼痛和不适最小化。实验由我们中心的comitedeexperimentaciónybienestaranimal(ceba)批准,并且根据directiveoftheeuropeancommission(2010/63/eu)的指南和用于实验动物的护理和管理的西班牙法规(r.d.1201/2005)来实施。
用3α-乙炔基-3β-羟基雄甾烷-17-酮治疗。
在大鼠的背部通过皮下注射给予在芝麻油中的3α-乙炔基-3β-羟基雄甾烷-17-酮,一天一次。在高氨血大鼠中实施两组不同的实验。在第一组中,使用四组大鼠:1)注射媒介物的对照大鼠;2)注射媒介物的高氨血大鼠;3)注射20mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮的对照大鼠和4)注射20mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮的高氨血大鼠。
随后不将注射3α-乙炔基-3β-羟基雄甾烷-17-酮的对照大鼠包括入,因为在这些大鼠中未发现相关的效果。
在第二组实验中,使用五组大鼠:1)注射媒介物的对照大鼠;2)注射媒介物的高氨血大鼠,和3-5)注射3、10或20mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮的高氨血大鼠。在每一个实验中,使用6-8只大鼠/组。
对于使用pcs大鼠的实验,使用以下组的大鼠:1)注射媒介物的假装大鼠;2)注射媒介物的pcs大鼠;3-4)注射0.7或2.5mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮的pcs大鼠。在每一个实验中使用的大鼠的数量在相应的图中显示或在相应的图的描述中给出。
统计分析。
显示的数据为在每一个图中指示的大鼠数量的平均值±sem。使用双向anova和bonferroni后测试估计统计显著性,并且当仅比较一个参数时,使用学生t-检验。使用windows的graphpadprism软件(graphpadsoftwareinc.,lajolla,ca,usa)实施分析。
运动协调。梁步行测试。
使用木质梁(20mm直径),如gonzalez-usano等人(acschemicalneuroscience,2014,19,5(2),100-105)所描述的测试运动协调。使大鼠横过位于在地面之上约一米的一米长的木质梁,通过两名观察者记录足错误(滑脱)的数量。通过在记录测量前,使大鼠横过梁高达五次,针对该测试训练大鼠。足错误(滑脱)的数量为运动不协调的度量。
结果
3α-乙炔基-3β-羟基雄甾烷-17-酮显示恢复高氨血大鼠和pcs大鼠二者的运动协调。
在梁步行测试中高氨血大鼠显示运动不协调,与对照大鼠(1.0±0.1)相比,具有较高(p<0.05)数量的滑脱(1.4±0.1)。用3α-乙炔基-3β-羟基雄甾烷-17-酮治疗恢复高氨血大鼠的运动协调(图9的a)。对于3mg/kg(0.8±0.1滑脱,p<0.05)和20mg/kg(0.78±0.07滑脱,p<0.05)的剂量,效果在统计学上是显著的。
在梁步行测试中pcs大鼠还显示运动不协调,与假装-操作的对照大鼠(0.71±0.07)相比,具有较高(p<0.01)数量的滑脱(1.2±0.1)。用3α-乙炔基-3β-羟基雄甾烷-17-酮治疗也恢复pcs大鼠的运动协调(图9的b)。对于0.7mg/kg的剂量,滑脱的数量为0.75±0.10(p<0.05相对pcs大鼠)。在2.5mg/kg下,3α-乙炔基-3β-羟基雄甾烷-17-酮也改进运动协调,返回至与假装大鼠类似的值(0.8±0.1滑脱;p相对pcs大鼠=0.058)(图9的b)。
实施例9
3α-乙炔基-3β-羟基雄甾烷-17-酮对具有he和门-腔静脉吻合术的大鼠的空间记忆力和空间学习的治疗效果
治疗和测试日程
治疗和测试日程如在实施例8中描述。
在morris水迷宫测试中的空间记忆力和学习。
使用任意分成四个象限的圆形池(直径160cm,长40cm),如monfort等人(europeanjournalofneuroscience,2007,25,2103-2111)所描述而进行测试。在预训练后,经过3天,训练大鼠认识到看不见的平台的固定位置。训练涉及在缺少平台的三个象限之一中将大鼠面向壁放置在池中。在每一个试验中随机地使用不同的起点。训练由每天三次游泳组成。给每一个动物最多120秒以找到平台,并且留出20秒在平台上。如果大鼠不能在120秒内定位平台,则由实验人员手动引导它至平台。手动记录找到隐藏的平台所需的时间,并且用作学习该任务的度量。
24小时后通过移除平台并且测量在平台所在的象限中大鼠所花的时间来评定空间记忆力。
结果
在高氨血大鼠和pcs大鼠中,在morris水迷宫测试中,3α-乙炔基-3β-羟基雄甾烷-17-酮显示恢复空间记忆力。
在morris水迷宫中,高氨血大鼠显示降低的空间记忆力。在三天的训练期间,所有组的大鼠学会寻找平台,并且到达平台的潜伏期降低(图10的a)。在高氨血大鼠中学习能力稍微降低,与对照相比,需要更多的时间到达平台。
在高氨血大鼠中,空间记忆力显著降低(p<0.05)。在记忆力测试中,与对照大鼠(39±2%的时间)相比,高氨血大鼠在正确的象限中保持的时间较少(30±2%的时间)。在高氨血大鼠中,在morris水迷宫中,用3α-乙炔基-3β-羟基雄甾烷-17-酮治疗恢复空间记忆力。对于3、10和20mg/kg剂量,在正确的象限中所花的时间的百分数分别为41±4,42±5和38±3(图10的b)。
在morris水迷宫中,pcs大鼠还显示降低的空间记忆力。在三天的训练期间,所有组的大鼠学会寻找平台,并且到达平台的潜伏期降低(图10的c)。在pcs大鼠中,空间记忆力显著降低(p<0.05)。在记忆力测试中,在正确的象限中,pcs大鼠与对照大鼠(41±2%的时间)相比保持较少的时间(31±3%的时间)。在pcs大鼠中,在morris水迷宫中,用3α-乙炔基-3β-羟基雄甾烷-17-酮治疗恢复空间记忆力。对于0.7和2.5mg/kg剂量,在正确的象限中所花的时间的百分数分别为34±4和39±3(图10的d)。
实施例10
3α-乙炔基-3β-羟基雄甾烷-17-酮对具有he和门-腔静脉吻合术大鼠的空间学习的治疗效果
治疗和测试日程
治疗和测试日程如在实施例8中描述。
在径向迷宫测试中的空间学习。
设备由中心区域组成,该区域通向八个等尺寸的臂状物。臂状物70cm长,10cm宽,中心区域直径30cm。每一个臂状物的远侧尽头具有含有食物奖赏的杯。在末端暗示存在下,连续两天让大鼠探究迷宫10分钟,以适应迷宫。在径向迷宫中的训练由每天三次试验,连续六天组成。任务涉及定位四个丸粒,根据hernandez-rabaza等人(addictionbiology,2010,15,413-423)描述的随机布置,将每一个所述丸粒放置在不同的臂状物的末端。记录工作记忆力误差的数量(在相同的试验中访问已经访问过的臂状物)并且表述为工作误差。
结果
发现在径向迷宫测试中,3α-乙炔基-3β-羟基雄甾烷-17-酮恢复空间学习。
在径向迷宫中,高氨血大鼠显示降低的空间学习。如在图11的a中显示的,在第1-3天,与对照大鼠相比高氨血大鼠中的工作误差的数量更高。在训练日期间,所有组的大鼠学习,在第3天后,对照和高氨血大鼠之间的差异不显著。(图11的a)。在第1-2天,与对照大鼠(11±1.5误差)相比高氨血大鼠中(18±3误差)工作误差的数量更高(p<0.05)。用3α-乙炔基-3β-羟基雄甾烷-17-酮治疗的高氨血大鼠的行为与对照一样。对于3、10和20mg/kg剂量,误差数量(与对照并非显著不同)分别为6.5±2.8、8.8±1.9和12±2(图11的b-c)。
在径向迷宫中,pcs大鼠也显示降低的空间学习。如在图11的c中显示的,在第1和2天,与假装大鼠相比pcs大鼠中工作误差的数量更高。在训练日期间,所有组的大鼠学习,在第3天后,假装和pcs大鼠之间的差异不显著。(图11的c)。在第1-2天,与假装大鼠(10±2误差)相比pcs大鼠中(22±2误差)中工作误差的数量更高(p<0.01)。用0.7mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮治疗pcs大鼠不足以改进在径向迷宫中的性能(23±2误差)。在径向迷宫中,用2.5mg/kg治疗使得pcs大鼠的性能完全正常化(11±1误差,p<0.05相对pcs)。
实施例11
在pcs大鼠中,3α-乙炔基-3β-羟基雄甾烷-17-酮对昼夜节律和夜间运动活性的治疗效果。
治疗和测试日程
治疗和测试日程在实施例8中描述。
自发运动活性的昼夜节律。
使用actimeter(medassociates,st.albans,vt)测量运动活性。将大鼠单独放置在开放的活性室(activitychamber)(43×43×31cm)中,在亮-暗(l:d)为12h:12h的条件下,连续记录运动活性达14天。以5分钟的间隔记录数据。通过以三个方向(x、y和z)放置的红外运动检测器的阵列检测运动活性。当在x或y方位中大鼠中断三个连续的红外检测器时,该设备记录一个走动计数。当在z位置大鼠中断红外检测器时,记录垂直计数。软件允许测量运动活性的不同参数,例如走动计数或垂直计数(ahabrach等人journalofneuroscienceresearch,2010,88,1605-14)。
结果
发现3α-乙炔基-3β-羟基雄甾烷-17-酮在夜晚期间提高自发运动活性并且部分恢复pcs大鼠的昼夜节律。
在夜晚期间(大鼠的活性期),pcs大鼠显示降低的运动活性(走动计数),其显示1849±176计数,这显著(p<0.05)低于对照大鼠(4546±584计数)。0.7mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮稍微提高(p<0.05)pcs大鼠的活性至2652±275计数。2.5mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮不影响走动计数(2235±170计数3α-乙炔基-3β-羟基雄甾烷-17-酮)(图12的a和12的c)。
在pcs大鼠中在夜晚期间的走动活性相对在白天期间的活性的比率降低,指示改变的昼夜节律(图12的b)。对于对照大鼠,该比率为3.3±0.4,在pcs大鼠中降低(p<0.001)至0.8±0.16。用3α-乙炔基-3β-羟基雄甾烷-17-酮治疗的pcs大鼠显示在夜晚/白天活性比率方面中部分的但是显著的改进(p<0.05),对于0.7和2.5mg/kg,分别达到1.7±0.2和1.6±0.3(图12的b)。这指示部分恢复昼夜节律活性。
还发现3α-乙炔基-3β-羟基雄甾烷-17-酮使得白天期间的垂直活性正常化并且部分恢复pcs大鼠的昼夜节律。
在夜晚期间(大鼠的活性期),pcs大鼠显示降低的垂直活性,显示561±108计数,这显著(p<0.05)低于对照大鼠(1228±138计数)。0.7mg/kg或2.5mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮在夜晚期不影响垂直活性(分别为664±121和695±185计数)(图12的a和12的c)。
与此相反,pcs大鼠显示在白天期间提高的垂直活性,其显示682±114计数,这显著(p<0.05)高于对照大鼠(391±64计数)。0.7mg/kg或2.5mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮使得白天期间的垂直活性完全正常化,其分别达到339±47和424±44计数。(图12的a和12的c)。
在pcs大鼠中,在夜晚期间的垂直活性相对在白天期间的活性的比率也降低,指示改变的昼夜节律(图12的b)。对于对照,该比率为3.7±0.6,并且在pcs大鼠中降低(p<0.001)至0.8±0.01。用3α-乙炔基-3β-羟基雄甾烷-17-酮治疗的pcs大鼠显示在夜晚/白天活性比率方面中部分的但是显著的改进(p<0.01),对于0.7和2.5mg/kg,分别达到2.1±0.4和1.9±0.6(图12的b)。这指示部分恢复垂直活性的昼夜节律。
实施例12
3α-乙炔基-3β-羟基雄甾烷-17-酮治疗对高氨血大鼠和pcs大鼠中血氨浓度的影响。
治疗和测试日程
治疗和测试日程如在实施例8中描述。
测定氨。
遵循制造商的说明,使用20μl新鲜血液,使用试剂盒iiammoniaarkray测试(pocketchemba,arkray),测量血氨。
结果
发现在高氨血大鼠和pcs大鼠中,3α-乙炔基-3β-羟基雄甾烷-17-酮不影响氨水平。
与对照(47±3μm)相比,在高氨血大鼠(167±16μm)中血氨水平升高(p<0.001)。在高氨血大鼠(139±14μm)中,用20mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮治疗不影响氨水平。
在pcs大鼠中得到类似的结果。与假装大鼠(125±31μm)相比,在pcs大鼠(348±27μm)中血氨水平升高(p<0.001)。用3α-乙炔基-3β-羟基雄甾烷-17-酮治疗不影响血氨,在用0.7和2.5mg/kg的3α-乙炔基-3β-羟基雄甾烷-17-酮治疗的pcs大鼠中分别保持在302±30和294±37μm。
实施例13
在治疗周期之后,在高氨血大鼠和pcs大鼠中,在血浆和脑组织中的3α-乙炔基-3β-羟基雄甾烷-17-酮浓度
治疗和测试日程
治疗和测试日程在实施例8中描述。
分析3α-乙炔基-3β-羟基雄甾烷-17-酮暴露。
在治疗周期结束时,由尾静脉采集血浆,通过断头而处死后,收集脑,立即在干冰上冷冻。为了分析3α-乙炔基-3β-羟基雄甾烷-17-酮暴露,脑组织以1:4的组织:pbs(ph7.4)比率均化,随后用2倍体积的甲醇:乙腈(1:1)萃取,用3倍体积的乙腈使血浆蛋白质沉淀。通过watersacquityuplc+watersxevo-tqs三重四级杆质谱仪(triplequadrupole)(admescopeoy,oulu,芬兰)实施分析。为了计算在脑中游离3α-乙炔基-3β-羟基雄甾烷-17-酮暴露的量,通过渗析来测定在脑均浆中的未结合的馏分(fub),在ha中的fub=0.70,而在pcs中的fub=1.43%(admescopeoy,oulu,芬兰)。
结果
在高氨血大鼠中,在血浆和脑组织二者中,以3、10和20mg/kg,每日一次给药3α-乙炔基-3β-羟基雄甾烷-17-酮导致剂量依赖性暴露。在行为测试时,在血浆中3α-乙炔基-3β-羟基雄甾烷-17-酮的总浓度分别为0.34±0.03、1.08±0.11、1.95±0.61μm,而在脑组织中,未结合的3α-乙炔基-3β-羟基雄甾烷-17-酮的浓度分别为6.1±1.4、11.6±1.4、23±5nmol/kg(图14的a)。
同样,在pcs大鼠中,暴露为剂量依赖性的,并且在较低的剂量用于这些大鼠的情况下,0.7和2.5mg/kg,暴露与高氨血大鼠中的那些非常类似。在0.7和2.5mg/kg/天下,血浆中的总浓度分别为0.48±0.09和1.64±0.30μm,在行为测试时,在脑中未结合的浓度分别为6.18±0.97和17±2nmol/kg。
- 还没有人留言评论。精彩留言会获得点赞!