一种多模态分子影像探针P-FFGd-TCO及其制备方法与应用
本发明设计分子影像学,具体涉及一种多模态分子影像探针p-ffgd-tco及其制备方法与应用。
背景技术:
多模态分子影像学能够整合不同成像模态的优势,实现对疾病标志物的高灵敏度和高空间分辨率的成像检测,在生物医学研究和临床诊断领域具有广阔的前景。目前,国内外学者都在发展不同的策略构建多模态成像探针,但它们往往是通过将多种成像分子包裹在纳米颗粒(nps)中来实现多模态成像在同一探针上的组合,由于纳米探针尺寸较大,因此这些探针可能受到成像结果重现性差、网状内皮系统(res)摄取高和组织渗透能力弱等限制,不利于活体的精确成像。而基于小分子的多模态探针,除具有明确化学结构外,较小的分子尺寸赋予其良好的组织穿透能力,更易于检测组织深处的生物标志物。这些探针通常会因扩散作用脱离靶标组织,从而降低靶标组织与活体背景的成像信号比(tbr),缩短成像时间窗口,无法实现对活体的长期成像。因此迫切的需要开发具有高组织渗透性和长组织停留时间的多模态成像探针,以改善对体内生物分子成像的精确性和可靠性。
在近年来,肿瘤预靶向策略作为一种应用于活体核素成像和核素治疗的新兴研究方法,在肿瘤的诊断治疗领域获得了广泛的关注。与传统的核素成像不同,预靶向成像不需要预先将核素与抗体或纳米探针等靶向载体在体外共价连接,而是将这两个组分分别连接在能够通过反应高效结合的基团上,使它们在在肿瘤部位特异性结合从而使核素在肿瘤部位停留。随着生物正交化学的快速发展,特别是基于四嗪(tz)和反式环辛烯(tco)的反电子需求的狄尔斯-阿尔德(inverse-electrondemanddeals-alder,iedda)环加成反应的发展,预靶向成像策略已广泛应用于肿瘤的pet成像和放射治疗。通过两步成像,预靶向策略有效减少了放射性核素的血液循环时间,允许短半衰期的放射性核素与抗体或纳米探针联用,有助于减少患者的辐射危害。基于此,近年来研究人员们开发了很多特异性成像恶性肿瘤的正电子发射型计算机断层显像(pet)探针。尽管使用预靶向策略有助于改善肿瘤的pet成像效果,但单一的成像模态仍限制肿瘤检测的灵敏度和分辨率,不利于临床上肿瘤的成像检测。因此,必须开发一种新的多模态成像探针,使其具有高组织渗透性和肿瘤的长组织停留时间,以提高活体成像检测的灵敏度和分辨率。
技术实现要素:
发明目的:本发明所要解决的技术问题是针对现有技术的不足,提供一种多模态分子影像探针p-ffgd-tco。
本发明还要解决的技术问题是提供上述多模态分子影像探针p-ffgd-tco的制备方法。
本发明进一步要解决的技术问题是提供上述多模态分子影像探针p-ffgd-tco在制备造影剂中的应用。
本发明最后要解决的技术问题是提供上述多模态分子影像探针p-ffgd-tco在预靶向多模态成像中的应用。
发明思路:本发明将酶介导的原位自组装和生物相容反应预靶向策略相结合,设计合成了能够自组装形成荧光和顺磁性nps并含有tco基团用于预靶向成像的小分子探针p-ffgd-tco。
为了解决上述第一个技术问题,本发明公开了一种如式ff-tco所示的结构;
一种含有上述结构ff-tco的多模态分子影像探针p-ffgd-tco,其包含以下几个部分:(1)被alp识别磷酸基团(-po3h2)淬灭荧光的疏水nir荧光团(花青素衍生物,cy-cl);(2)用于mr成像的亲水性dota-gd螯合物;(3)疏水二肽(ff)连接片段,以促进分子自组装;(4)用于快速生物正交反应的tco基团。
其中,所述多模态分子影像探针探针p-ffgd-tco结构如式如下:
为了解决上述第二个技术问题,本发明公开了上述多模态分子影像探针探针p-ffgd-tco的制备方法,包括如下步骤:
步骤a:化合物mcy-nh2与化合物1进行反应,得到化合物2;
步骤b:化合物2进行取代反应,得到化合物3;
步骤c:化合物3进行取代反应,得到化合物4;
步骤d:化合物4进行配位反应,得到探针p-ffgd-tco;
步骤a中,所述反应为化合物mcy-nh2、化合物1、苯并三氮唑-n,n,n′,n′-四甲基脲六氟磷酸盐(hbtu)、n,n-二异丙基乙胺(dipea)溶于溶剂中,进行反应,得到含有化合物2的反应液。
其中,所述化合物mcy-nh2、化合物1、hbtu和dipea的摩尔比为7:7-10:7-11:15.5-19.5,优选为7:7:9:17.5。
其中,所述化合物mcy-nh2的浓度为0.004-0.024mmol/ml,优选为0.014mmol/ml。
其中,所述溶剂包括但不限于四氢呋喃,优选为无水四氢呋喃。
其中,所述反应温度为20-30℃,优选为室温。
其中,所述反应是在搅拌状态下进行的。
其中,所述反应的时间为1h以上,优选为1-5h,进一步优选为2h。
其中,所述反应结束后,将含有化合物2的反应液旋蒸,纯化,洗脱,即得化合物2。
其中,所述洗脱的洗脱机为ch2cl2和ch3oh的混合液,优选为体积比为50-10:1的ch2cl2和ch3oh的混合液。
步骤b中,所述反应为将化合物2和n,n-二异丙基乙胺(dipea)溶于第一溶剂中搅拌,再加入氯磷酸二乙酯溶液进行第一反应,得到中间体;将中间体溶于第二溶剂,与三甲基溴硅烷(tms-br)进行第二反应,即得含有化合物3的反应液。
其中,所述在惰性气体保护下,将化合物2和dipea溶于第一溶剂中。
其中,所述第一溶剂包括但不限于二氯甲烷(dcm),优选为无水二氯甲烷。
其中,所述化合物2与dipea的摩尔比为1:7-13,优选为1:10。
其中,所述化合物2的浓度为0.002-0.022mmol/ml,优选为0.012mmol/ml。
其中,所述搅拌的温度为20-30℃,优选为室温。
其中,所述搅拌的时间为2min以上,优选为2-20min,进一步优选为10min。
其中,所述氯磷酸二乙酯溶液的溶剂包括但不限于二氯甲烷(dcm)。
其中,所述氯磷酸二乙酯溶液的浓度为0.02-0.22mmol/ml,优选为0.12mmol/ml。
其中,所述化合物2与氯磷酸二乙酯的摩尔比为1:1-3,优选为1:2。
其中,所述第一反应是在搅拌状态下反应。
其中,所述第一反应的温度为20-30℃,优选为室温。
其中,所述第一反应的时间为0.5h以上,优选为0.5-3.5h,进一步优选为2h。
其中,所述第一反应结束后,将反应液稀释后,萃取,有机层干燥,过滤,所得滤液旋蒸,得到中间体。
其中,所述稀释为用dcm稀释;优选地,用20mldcm稀释。
其中,所述萃取为用饱和na2co3水溶液、1mhcl和饱和nacl水溶液萃取3次。
其中,所述干燥为将有机层用无水na2so4干燥。
其中,所述中间体是在惰性气体保护下溶解于第二溶剂;优选为,所述中间体在氮气保护下溶解于第二溶剂。
其中,所述第二溶剂包括但不限于dcm。
其中,所述化合物2与第二溶剂的用量比为6mmol:400-600ml,优选为6mmol:500ml。
其中,化合物2与tms-br的摩尔比为1:15-25,优选为1:20。
其中,所述第二反应的温度为20-30℃,优选为室温。
其中,所述第二反应的时间为12h以上,优选为12-36h,进一步优选为24h。
其中,所述第二反应结束后,淬灭反应,再滴入dipea的甲醇溶液,调节ph至中性,旋蒸,纯化,即得化合物3。
其中,所述淬灭为用甲醇淬灭。
其中,所述dipea的甲醇溶液的浓度为0.1-0.5mmol/ml,优选为0.3mmol/ml。
步骤c中,所述反应为将化合物3、dipea和(e)-环辛-4-烯基2,5,2-二氧杂-1-吡咯烷基碳酸酯(tco-nhs)溶于溶剂中反应,得到含有化合物4的反应液。
其中,所述化合物3、dipea和(e)-环辛-4-烯基2,5,2-二氧杂-1-吡咯烷基碳酸酯的摩尔比为1:1.5-3.5:1-2.5,优选为1:2.5:1.5。
其中,所述溶剂包括但不限于dmf。
其中,化合物3的浓度为0.01-0.05mmol/ml,优选为0.03mmol/ml。
其中,所述反应的温度为20-30℃,优选为室温。
其中,所述反应是在搅拌状态下进行。
其中,所述反应的时间为1h以上,优选为1-7h,进一步优选为4h。
其中,所述反应完成后,将含有化合物4的反应液滴入冰乙醚中,离心,即得化合物4。
步骤d中,所述反应为将化合物4溶液的ph调节为6.0-7.0,再加入gdcl3溶液,搅拌,再将ph调节为6.0-7.0,反应,得到含有p-ffgd-tco的反应液。
其中,所述化合物4溶液的溶剂包括但不限于n,n-二甲基甲酰胺(dmf)。
其中,所述化合物4溶液的浓度为0.004-0.024mmol/ml,优选为0.014mmol/ml。
其中,所述ph调剂为用nahco3在冰浴条件下调节;优选地,所述ph调节为用1mnahco3在冰浴条件下调节。
其中,所述gdcl3溶液的溶剂为二次水。
其中,所述gdcl3溶液的浓度为0.18-0.38mmol/ml,优选为0.28mmol/ml。
其中,所述搅拌为在冰浴下搅拌。
其中,所述搅拌的时间为1min以上,优选为1-19min,进一步优选为10min。
其中,所述反应的温度为20-30℃,优选为室温。
其中,所述反应的时间为6h以上,优选为6-18h,进一步优选为12h。
其中,所述反应结束后,将含有p-ffgd-tco的反应液离心,纯化,冻干,即得。
为了解决上述第三个技术问题,本发明公开了上述多模态分子影像探针p-ffgd-tco在制备肿瘤诊断成像剂中的应用。
优选地,所述多模态分子影像探针p-ffgd-tco在制备碱性磷酸酶(alp)阳性肿瘤诊断成像剂中的应用。
进一步优选地,所述碱性磷酸酶为hela细胞膜表面的内源性alp。
为了解决上述第四个技术问题,本发明公开了上述多模态分子影像探针p-ffgd-tco在预靶向多模态成像中的应用。
其中,所述多模态分子影像探针p-ffgd-tco与四嗪探针联用作为预靶向探针应用于预靶向多模态成像。
其中,所述四嗪探针为化合物tz-fitc、化合物tz-780-zw和化合物tz-peg-noda中的任意一种;
其中,所述所述多模态分子影像探针p-ffgd-tco在体内利用酶介导进行自组装,再与四嗪探针联用作为预靶向探针应用于预靶向多模态成像;其中,所述酶为碱性磷酸酶(alp),优选为hela细胞膜表面的内源性alp。
其中,所述多模态分子影像探针p-ffgd-tco与放射性元素标记的四嗪探针tz-peg-noda联用作为预靶向诊疗探针应用于碱性磷酸酶阳性肿瘤的预靶向多模态成像。
其中,所述放射性元素标记的四嗪探针tz-peg-noda的结构式如下:
其中,当所述四嗪探针为化合物tz-fitc和tz-780-zw时,所述多模态分子影像探针p-ffgd-tco与四嗪探针的摩尔比为1:0.5-1.2;当所述四嗪探针为化合物tz-peg-noda,所述多模态分子影像探针p-ffgd-tco与四嗪探针的摩尔比为1:0.05-1.2。
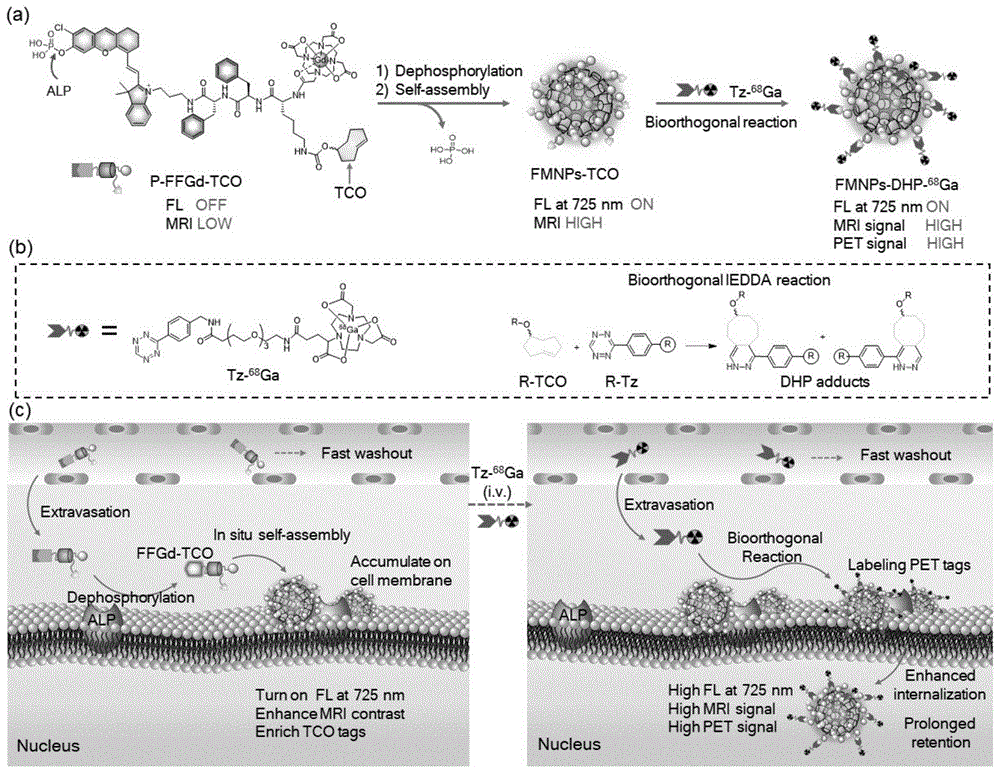
其中,如图1所述由于po3h2和dota-gd基团的高度亲水性,因此p-ffgd-tco最初是水溶性的小分子探针,具有猝灭的nir荧光和低的r1驰豫率。在alp介导的去磷酸化后,p-ffgd-tco转化为两亲性ffgd-tco,此时nir荧光被激活。脱去磷酸根的cy-cl荧光团和疏水的ff二肽使ffgd-tco易于发生分子自组装,形成荧光和磁性的纳米颗粒(fmnps-tco),相较于p-ffgd-tco,fmnps-tco尺寸增加并伴随r1驰豫率的增强。此外,具有高密度tco的fmnps-tco能够通过快速的生物正交iedda反应与放射性标记的tz分子(如tz-68ga)发生反应,生成具有荧光和放射性的顺磁性纳米颗粒(fmnps-dhp-68ga)。全身给药后,小分子探针p-ffgd-tco能够从血管渗出并渗透到肿瘤组织内部,在肿瘤细胞膜上过表达的alp的作用下,p-ffgd-tco去磷酸化并原位自组装形成fmnps-tco。原位组装的fmnps-tco由于较大的尺寸,降低了扩散速率并停留在高表达alp的肿瘤细胞表面,同时提供增强的nir荧光和mri信号;停留在肿瘤内的fmnps-tco还可以增加肿瘤组织中tco的积累,而未激活的p-ffgd-tco则很容易从血液和其他alp阴性组织中快速清除。在双模态的nir荧光和mri的引导下,tz-68ga经尾静脉注射进入体内并渗透进入肿瘤组织中,通过快速的iedda反应与fmnps-tco进行原位的连接。生成的68ga-fmnps能够在肿瘤部位长时间停留,实现放射性核素在肿瘤的富集,当游离的tz-68ga从血液和其他alp阴性组织中快速清除后,能够提供高信背比的pet成像对肿瘤进行检测。综上所述,p-ffgd-tco能够实现alp激活的nir荧光、mri和pet三模态成像信号,从而可以对体内alp阳性的肿瘤进行高灵敏度和高空间分辨率的预靶向多模态成像检测。
有益效果:与现有技术相比,本发明具有如下优势:
本发明提供了一种多模态分子影像探针ffgd-tco,其能够实现alp激活的nir荧光、mri和pet三模态成像信号,从而可以对体内alp阳性的肿瘤进行高灵敏度和高空间分辨率的预靶向多模态成像检测。
附图说明
下面结合附图和具体实施方式对本发明做更进一步的具体说明,本发明的上述和/或其他方面的优点将会变得更加清楚。
图1.通过原位自组装和生物正交反应进行预靶向多模态成像的alp激活探针的示意图及其用于体内alp活性的预靶向多模态成像的示意图。
图2.(a)p-ffgd-tco(100μm)与alp(500u/l)孵育0、10、20、30分钟的hplc分析。(b)p-ffgd-tco(5μm)与alp(100u/l)在tris缓冲液(ph=8.0)中于37℃孵育0-25分钟的uv-vis吸收和(c)荧光光谱,荧光光谱激发波长为680nm。(d)p-ffgd-tco(100μm)与alp(500u/l)在37℃下于tris缓冲液(ph=8.0)中孵育0-40分钟的dls分析。(e)p-ffgd-tco(100μm)与alp(500u/l)在37℃下于tris缓冲液(ph=8.0)中孵育40分钟,形成的fmnps-tco的tem图像。比例尺:1μm。(f)与alp(500u/l)在37℃下孵育0-40分钟后,在tris缓冲液中的p-ffgd-tco(100μm)的t1加权mr图像(插图,1.0t)和t1值(0.5t)(n=3)。
图3.(a)用不同浓度的alp孵育30分钟后,p-ffgd-tco(5μm)的荧光光谱。(b)荧光强度(λem=710nm)对alp浓度从0.5-20u/l的线性拟合曲线。误差棒代表标准偏差(n=3)。使用3σ/k方法计算获得检测限为0.067u/l。(c)在tris缓冲液(ph8.0)中与mmp-2(10nmol/l)、ggt(100u/l)、组织蛋白酶b(100u/l)、caspase-3(0.2μg/ml)、alp(100u/l)或alp(100u/l)与抑制剂一起孵育的p-ffgd-tco的荧光强度。(d)在tris缓冲液(ph8.0)中与mmp-2(100nmol/l)、ggt(250u/l)、组织蛋白酶b(250u/l)、caspase-3(2μg/ml)、alp(500u/l)或alp(500u/l)与抑制剂一起孵育的p-ffgd-tco的t1加权mr图像。
图4.(a)与alp(100u/l)孵育30分钟前(上)后(中),以及再与tz-fitc反应15分钟(下)的p-ffgd-tco(20μm)的hplc分析。(b)tz-fitc(5μm),fmnps-tco(5μm)和fmnps-dhp-fitc(5μm)在tris缓冲液中的紫外可见吸收和(c)荧光光谱。(d)fmnps-tco(100μm)和fmnps-dhp-fitc(100μm)在tris缓冲液(ph=8.0)中的t1值(0.5t)和(e)dls分析。(f)左:超速离心后,i:tz-fitc和ii:fmnps-dhp-fitc的照片(上)和fl图像(下)。右:在sec上含有tz-fitc(i)或fmnps-dhp-fitc(ii)的重悬溶液的fl成像。
图5.探针细胞毒性测试。将人宫颈癌hela细胞与不同浓度的p-ffgd-tco或p-gd-tco(0、2.5、5、10、25、50、75、100μm)孵育24h后,通过mtt分析确定细胞活力(n=5)。
图6.(a)探针与tz-fitc用于活细胞alp活性的预靶向成像示意图。(b)与p-ffgd-tco(20μm)孵育5-50分钟后hela细胞的nir荧光成像。比例尺:25μm。(c)不同处理组细胞团的照片(上),fl(中)和t1加权mr(下)图像。λex/em=670/(750±50)nm。i:hela细胞与p-ffgd-tco(20μm,1小时)孵育。ii:将hela细胞与na3vo4(10mm,20min)孵育,然后与p-ffgd-tco(20μm,1h)孵育。iii:huvec细胞与p-ffgd-tco(20μm,1小时)孵育。iv:hela细胞与p-gd-tco(20μm,1小时)孵育。(d)p-ffgd-tco(20μm,1h)处理后,分离hela细胞裂解液获得的细胞膜组分放大nps的tem和stem图像以及cl和gd的元素分布图。插图:细胞组分重悬于200μl二次水后的照片。(e)hela和huvec细胞分别用20μm的p-ffgd-tco孵育30分钟后,再用tz-fitc(10μm)孵育30分钟的fl成像。比例尺:25μm。(f)hela和huvec细胞分别用20μm的p-ffgd-tco孵育30分钟后,再用tz-fitc(10μm)孵育30分钟后细胞团的明场、荧光和mr成像。(g)将hela细胞与p-ffgd-tco(20μm)孵育1小时及将tz-fitc(10μm)与p-ffgd-tco预处理的hela细胞孵育1小时后培养基和细胞裂解液的hplc分析。
图7.(a)接受尾静脉注射p-ffgd-tco和p-gd-tco(50μm,200μl)的小鼠在0、1、2、4和6小时的fl成像。(b)尾静脉注射p-ffgd-tco和p-gd-tco(0.02mmolkg-1)的小鼠注射前,注射前,注射后2、6和10hhela肿瘤的t1加权mr图像(1t)。(c)在0、0.5、1、2和4h接受指定处理的小鼠中,hela肿瘤的ir780fl成像。i:p-ffgd-tco(50μm,200μl,4h)+tz-780-zw(25μm,200μl);ii:p-gd-tco(50μm,200μl,4h)+tz-780-zw(25μm,200μl);iii:pbs(200μl,4h)+tz-780-zw(25μm,200μl);iv:p-ffgd-tco(50μm,200μl,4h)+780-zw(25μm,200μl)。
图8.(a)尾静脉注射p-ffgd-tco或p-gd-tco(50μm,200μl)4小时后,再注射tz-780-zw(25μm,200μl)3小时后hela荷瘤小鼠的肿瘤和主要器官的离体荧光图像(cy-cl:ex/em=660/710nm,ir780:ex/em=780/845nm)。(b)cy-cl和(c)ir780在肿瘤和主要器官中的荧光强度定量分析。
图9.尾静脉注射p-ffgd-tco或p-gd-tco(50μm,200μl)4小时后,再注射tz-780-zw(25μm,200μl)3小时后hela荷瘤小鼠的肿瘤组织切片荧光图像(cy-cl:ex/em=660/710nm,ir780:ex/em=780/845nm)
图10.(a)在10%fbs的pbs缓冲液中孵育0-120分钟后,tz-68ga的放射性hplc分析。(b)tz-68ga,ffgd-dhp-68ga和与p-ffgd-tco(20μm,1h)和tz-68ga(500μci)孵育后或单独使用tz-68ga孵育后的hela细胞裂解液的放射性hplc分析。(c)hela细胞或p-ffgd-tco(20μm,1小时)预处理的hela细胞与tz-68ga(5μci)孵育10、20、40和60分钟后的放射剂量分析。
图11.(a)接受i.v.注射p-ffgd-tco(50μm,200μl),p-gd-tco(50μm,200μl)和pbs(200μl)并在注射后4小时静脉注射tz-68ga的hela荷瘤小鼠的fl和在10、30、60、90和120分钟时的pet成像。fl图像(cy-cl)在探针注射后4小时获取。(b)静脉注射p-ffgd-tco(50μm,200μl),p-gd-tco(50μm,200μl)和pbs(200μl)后4h小鼠hela肿瘤的fl强度(cy-cl)。(c)注射tz-68ga后10、30、60、90和120分钟时肿瘤中的放射性同位素摄取量和(d)肿瘤肌肉(前腿)信号之比(t/m)。
具体实施方式
下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均可从商业途径获得。
下述实施例中所述“%”,如无特殊说明,均为摩尔百分比。
试剂与仪器:所有化学试剂和溶剂均购自与上海百灵威科技有限公司,梯希爱(上海)化成工业发展有限公司和sigma-aldrich。分析溶剂与试剂为色谱纯,常规试剂均为分析纯且未经进一步纯化处理。高糖n-fmoc-l-苯丙氨酸和n-fmoc-n-boc-l-赖氨酸购自glbiochem(shanghai)ltd.。lysotracker@greendnd-26从thermofisherscientificinc.购买获得。dulbecoo’smodifiedeaglemedium(dmem),胎牛血清(fetalbovineserum,fbs),胰蛋白酶(trypsin)和3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazoliumbromide(mtt)细胞增殖检测试剂盒均购自keygenbiotech(中国南京)。
1h-nmr和13c-nmr光谱使用400mhzbrukeravanceiii400核磁仪获得,溶剂为dmso-d6或cd3od,化学位移(δ)以ppm为单位,单重峰,双重峰,三重峰,四重峰,dd(doubletofdoublets)峰,多重峰以及宽峰分别以s,d,t,q,dd,m以及br表示;耦合常数(j)以hz为单位;氢的个数用图谱的积分值确定,并标记为nh。高效液相色谱(hplc)使用thermoscientificdionexultimate3000,洗脱剂为ch3cn/h2o(1‰cf3cooh)。基质辅助激光解吸/电离飞行时间质谱(maldi-tof-ms)分析使用absciex4800plusmalditof/toftm质谱仪uv-vis光谱使用oceanopticsmaya2000pro光谱仪进行测量。荧光光谱使用horibajobinyvonfluoromax-4荧光计测得。动态光散射(dls)分析使用90plus/bi-mas设备(美国布鲁克海文)测的。tem图像和edx分析使用jem-2800透射电子显微镜(日本jeol,ltd。)获得。核磁共振r1弛豫度在0.5t核磁成像仪(nmi20-015v-1,niumag)上获得,并在1t核磁成像仪(brukericontm)上进行了体内和体外mr成像实验。细胞和组织切片的荧光图像使用leicatcssp8共聚焦激光扫描显微镜或olympusix73荧光倒置显微镜获取。mtt测定使用酶标仪(tcan)获取。活体荧光图像用ivisluminaxriii系统获得,并使用livingimage软件(perkinelmer)测量圈取区域信号来量化荧光强度。
实施例1:探针的设计、合成与表征
路线s1展示了探针p-ffgd-tco和ffgd-tco的结构设计。
反应条件:(a)hbtu,dipea,thf,r.t.,2h,84%;(b)(i)氯磷酸二乙酯,dipea,r.t.,2h;(ii)tms-br,r.t.,24h,49%;(c)(e)-环辛-4-烯基2,5,2-二氧杂-1-吡咯烷基碳酸酯(tco-nhs),dipea,dmf,r.t.,4h,94%;(d)gdcl3,nahco3,ph6-7,r.t.,12h,74%;(e)dmf,nahco3,ph9-10,r.t.,12h,86%.
化合物1的合成:化合物1通过标准固相肽合成(spps)程序(nat.protocol.,2007,2,3247)合成,原料使用2-氯三苯甲基氯树脂,fmoc保护的氨基酸和1,4,7,10-四氮杂环十二烷-1,4,7-乙酸三叔丁酯-10-乙酸。固相合成反应步骤结束后,使用1%tfa的dcm溶液从树脂上裂解产物。真空旋蒸除去溶剂后,加入冷的乙醚得到沉淀物,并将所得沉淀物离心,得到粗化合物1,将其干燥并直接用于下一步骤。产量:196mg(90%)。1hnmr(400mhz,dmso-d6)δ8.71-8.56(m,1h),8.53-8.39(m,1h),8.191-7.87(m,1h),7.25(h,j=7.3,6.7hz,10h),6.73(s,1h),4.64-4.42(m,3h),4.27-4.03(m,4h),3.91(s,2h),3.53(s,2h),3.49(s,3h),3.44-3.32(m,3h),3.14-2.68(m,16h),1.51-1.31(m,40h),1.09(t,j=7.0hz,2h).13cnmr(101mhz,dmso-d6)δ172.64,171.07,170.16,169.65,155.47,137.52,137.34,129.25,129.06,128.18,127.89,126.42,126.18,118.26(q,j=295hz,cf3cooh),83.40,81.20,77.29,64.88,54.54,54.31,53.48,53.30,53.11,51.11,37.62,36.62,32.06,29.33,28.22,27.68,22.49,15.12.ms:calcd.forc57h91n8o13+[(m+h)+]:1095.6706;high-solution(hr)maldi-msfound:m/z1095.5695.
化合物2的合成:首先,根据已报道的方法(anal.chem.2018,90,2875)合成了nir荧光团mcy-nh2。然后,将mcy-nh2(34mg,0.07mmol),化合物1(76.6mg,0.07mmol),hbtu(34mg,0.09mmol)和dipea(30μl,0.175mmol)溶于无水thf(5ml)溶液中,室温搅拌2小时。反应完成后,真空旋蒸除去thf。残余物通过硅胶快速色谱法纯化,使用ch2cl2/ch3oh(50:1至10:1v/v)的混合溶液作为洗脱剂,得到化合物2为蓝色固体。产量:95mg(84%)。1hnmr(400mhz,dmso-d6)δ8.57(d,j=14.8hz,1h),8.35(s,1h),8.17(s,1h),8.06(s,1h),7.75(d,j=7.3hz,1h),7.69(s,1h),7.65(d,j=7.9hz,1h),7.54(t,j=7.6hz,1h),7.47(t,j=7.4hz,1h),7.43(s,1h),7.34(s,1h),7.22(d,j=4.2hz,6h),7.16(d,j=5.9hz,4h),7.09(s,1h),6.73(t,j=4.8hz,1h),6.55(d,j=14.9hz,1h),4.55(s,1h),4.47(q,j=7.7hz,1h),4.33(dt,j=13.5,7.1hz,2h),4.19(s,2h),3.85(s,13h),3.50(s,7h),3.31-3.06(m,7h),3.02-2.91(m,5h),2.89-2.75(m,6h),2.68(s,4h),2.38(q,j=6.0hz,1h),1.75(s,6h),1.53-1.26(m,36h),1.19-1.06(m,2h).13cnmr(101mhz,dmso-d6)δ177.27,170.73,169.66,160.24,158.22(q,j=32hz,cf3cooh),156.71,155.46,152.26,145.00,141.92,141.24,137.49,132.45,129.17,129.08,128.88,128.05,127.83,127.05,126.25,126.06,122.70,118.01,114.80,114.10,113.09,104.32,103.12,81.25,81.16,77.30,54.26,53.50,53.08,51.11,50.32,42.66,37.72,35.92,32.19,29.32,28.21,27.69,27.39,24.37,23.47,22.54,19.85,0.06.ms:calcd.forc85h118cln10o14+[m+]:1537.8512;hrmaldi-msfound:m/z1537.6931.
化合物3的合成:在氮气保护下,将化合物2(95mg,0.06mmol)和dipea(105μl,0.6mmol)溶于5ml无水dcm并在室温搅拌10分钟,然后将氯磷酸二乙酯(17.5μl,0.12mmol)溶于1mldcm中并滴加入反应液中,溶液在室温下持续搅拌2小时。然后将反应混合物用20mldcm稀释,并用饱和na2co3水溶液,hcl(1m)和饱和nacl水溶液萃取3次,有机层用无水na2so4干燥。过滤去除沉淀后旋蒸去除溶剂,并将残余物在氮气保护下溶解于5mldcm中。将tms-br(158μl,1.2mmol)快速加入溶液中,并将反应混合物在室温搅拌持续反应24小时。反应完全后,在-20℃将反应溶液滴加到50ml甲醇中以淬灭反应,然后将溶于5ml冷甲醇中的dipea(210μl,1.2mmol)滴入混合物中,以将ph值调节至中性。然后旋蒸去除溶剂,并通过制备hplc纯化残余物,通过冻干获得为蓝色固体的化合物3。产量:41mg(49%)。1hnmr(400mhz,dmso-d6)δ8.55(d,j=15.0hz,1h),8.34(d,j=7.7hz,1h),8.19(s,2h),7.81(d,j=7.3hz,1h),7.75(s,1h),7.71(d,j=7.9hz,1h),7.60-7.54(m,2h),7.51(t,j=7.4hz,1h),7.48-7.39(m,1h),7.34(s,1h),7.23(d,j=4.3hz,5h),7.17(d,j=4.3hz,4h),7.10(q,j=4.2hz,1h),6.65(d,j=15.1hz,1h),4.55(q,j=8.3hz,1h),4.50-4.43(m,1h),4.38(dd,j=13.4,7.0hz,1h),4.30-3.81(m,5h),3.66-3.35(m,11h),3.31-3.21(m,3h),3.14(d,j=29.4hz,7h),3.02-2.90(m,4h),2.85(dd,j=13.6,8.6hz,2h),2.76-2.63(m,6h),1.77(s,6h),1.58-1.31(m,6h),1.23(dd,j=17.9,10.1hz,3h),1.09(t,j=7.0hz,1h).13cnmr(101mhz,dmso-d6)δ178.03,171.35,170.92,170.79,170.66,159.32,158.80(q,j=32hz,cf3cooh),158.17,157.85,153.80,151.49,151.29,145.16,142.08,141.16,137.50,137.42,137.42,135.84,130.82,129.50,129.15,129.14,128.96,128.55,128.03,127.85,127.42,126.27,126.09,123.77,122.80,121.46,120.86,120.78,118.49(q,j=297hz,cf3cooh),116.96,114.34,113.41,112.55,107.61,105.34,54.41,54.06,53.47,52.62,50.67,50.36,48.72,43.16,41.77,41.77,38.51,37.57,37.31,35.98,31.50,28.50,27.46,27.16,26.51,23.64,22.09,19.70,17.93,16.62,12.25.ms:calcd.forc68h87cln10o15p+[m+]:1349.5773;hrmaldi-msfound:m/z1349.4028.
化合物4的合成:将化合物3(41mg,0.03mmol),dipea(14μl,0.075mmol)和(e)-环辛-4-烯基2,5,2-二氧杂-1-吡咯烷基碳酸酯(tco-nhs,12mg,0.045mmol)溶于1mldmf中,室温持续搅拌4小时。反应完成后,将反应溶液滴入冰乙醚(20ml)中,得到蓝色沉淀,将其离心并干燥以获得粗化合物4,其无需进一步纯化即可直接用于下一步。产量:43mg(94%)。1hnmr(400mhz,dmso-d6)δ8.52(d,j=15.0hz,1h),8.27(d,j=7.8hz,1h),8.16(d,j=9.5hz,1h),7.81(dd,j=7.4,1.3hz,1h),7.73(s,1h),7.70(d,j=8.0hz,1h),7.60-7.54(m,2h),7.49(t,j=7.4hz,1h),7.33(s,1h),7.30(s,1h),7.21(d,j=4.4hz,4h),7.18-7.14(m,5h),7.09(q,j=4.4hz,1h),7.04(s,1h),6.89(t,j=5.7hz,1h),6.63(d,j=15.1hz,1h),5.55(ddd,j=15.1,10.7,3.8hz,1h),5.39(ddd,j=15.5,10.9,3.5hz,1h),4.54-4.49(m,1h),4.45(dd,j=14.7,8.0hz,2h),4.40-4.31(m,2h),4.29-4.21(m,2h),4.21-4.12(m,2h),4.01(s,2h),3.90(d,j=9.3hz,2h),3.53(s,4h),3.32(s,4h),3.22(m,4h),3.06(s,7h),2.95(d,j=10.7hz,2h),2.89-2.80(m,3h),2.76-2.61(m,5h),2.22(m,3h),1.86(d,j=5.7hz,5h),1.80(d,j=4.1hz,2h),1.75(s,6h),1.62-1.47(m,4h),1.47-1.32(m,2h),1.32-1.22(m,2h),1.19-1.09(m,2h).13cnmr(101mhz,dmso-d6)δ178.33,171.79,170.77,159.02,158.43(q,j=32hz,cf3cooh),155.65,151.18,145.38,142.24,141.16,137.49,134.86,132.44,130.22,129.27,129.11,129.08,128.94,128.04,127.87,127.62,126.25,126.10,122.88,121.27,121.00,120.93,118.31(q,j=296hz,cf3cooh),117.92,114.41,113.53,108.12,105.82,78.86,54.24,53.97,53.70,52.63,52.60,50.76,50.58,50.47,48.36,43.15,40.65,38.16,37.68,37.38,35.94,33.69,32.14,30.56,29.29,28.59,27.55,27.09,23.60,22.50,19.71.ms:calcd.forc77h99cln10o17p+[m+]:1501.6610;hrmaldi-msfound:m/z1501.5804.
探针p-ffgd-tco的合成:将化合物4(43mg,0.028mmol)溶解在2ml的dmf中,在冰浴中小心地向其中加入1mnahco3溶液以将ph值调节至6.0。然后,将gdcl3(104mg,0.28mmol)溶于1ml二次水中并加入到反应溶液中。然后将该溶液在冰浴中保持搅拌10分钟,并使用1mnahco3小心地将ph值调节回6.0。然后将反应溶液移回室温并搅拌过夜。反应完成后,将反应混合物离心(4000rpm,5分钟),并通过半制备型hplc纯化上清液。通过冻干的方法获得作为蓝色固体的p-ffgd-tco。产量:35mg(74%)。通过分析型hplc确认纯度。hplc保留时间tr=15.0min(纯度,84%)。mladi-ms:calcd.forc77h96clgdn10o17p+[m+]:1656.5617;found:m/z1656.4963.
探针ffgd-tco的合成:将p-ffgd-tco(20mg,0.012mmol)溶解于2ml的dmf中,向其中加入1mnahco3溶液以将ph值调节至10。然后将反应混合物在室温下搅拌过夜。反应完全后,通过半制备型hplc纯化上清液。通过冻干的方法获得ffgd-tco为蓝色固体。产量:16mg(86%)。ms:calcd.forc77h95clgdn10o14+[m+]:1576.5953;hrmaldi-msfound:m/z1576.7333.
对比例1:对照探针的设计、合成与表征
为研究探针原位自组装能力在预靶向多模态成像中的作用,合成了不带有疏水phe-phe多肽序列的对照探针。图s2展示了对照探针的结构设计,对照探针被设计为包含以下几个部分:(1)被alp识别磷酸基团(-po3h2)淬灭荧光的疏水nir荧光团(花青素衍生物,cy-cl);(2)用于mr成像的亲水性dota-gd螯合物;(3)用于快速生物正交反应的tco基团。
反应条件:(a)hbtu,dipea,tfh,r.t.,2h,89%;(b)(i)dcp,dipea,r.t.,2h;(ii)tms-br,r.t.,12h,47%;(c)tco-nhs,dipea,dmf,r.t.,4h,96%;(d)gdcl3,nahco3,ph6.5,r.t.,12h,93%.
化合物5的合成:化合物5使用2-氯三苯甲基氯树脂,fmoc-lys(boc)和1,4,7,10-四氮杂环十二烷-1,4,7-tris-乙酸叔丁酯-10-乙酸通过标准固相肽合成(spps)程序合成。反应完全后,使用1%tfa的dcm溶液从树脂上裂解后,真空旋蒸除去溶剂。将冰乙醚(30ml)加入到残余物中,并将得到的沉淀物离心,得到化合物5,将其干燥并直接用于下一步。产量:138mg(86%)。1hnmr(400mhz,dmso-d6)δ7.39(s,1h),6.78(s,1h),4.26-4.20(m,1h),4.03(m,5h),3.54(s,5h),3.39(d,j=6.8hz,3h),3.24(s,5h),3.04(s,4h),2.94-2.83(m,4h),1.73(s,1h),1.66-1.52(m,2h),1.47(s,9h),1.41(s,17h),1.37(s,10h),1.30(s,2h),1.09(t,j=6.9hz,1h).13cnmr(101mhz,dmso)δ172.80,169.41,158.44(q,j=32hz,cf3cooh),155.51,118.39(q,j=297hz,cf3cooh),83.24,81.24,77.30,64.87,54.50,54.25,53.23,52.25,50.93,50.26,48.68,30.96,29.14,28.21,27.67,22.67,15.12.ms:calcd.forc39h73n6o11+[(m+h)+]:801.5337;hrmaldi-msfound:m/z801.5109.
化合物6的合成:将mcy-nh2(41mg,0.088mmol),化合物5(70.4mg,0.088mmol),hbtu(43mg,0.114mmol)和dipea(38μl,0.22mmol)溶于无水thf(5ml)溶液,反应液在室温下搅拌2小时。反应完全后,真空旋蒸除去thf。残余物通过快速柱层析纯化,使用ch2cl2/ch3oh(50:1至10:1v/v)的混合溶液作为洗脱剂,得到化合物6为蓝色固体。产量:97mg(89%)。1hnmr(400mhz,dmso-d6)δ8.75(dd,j=20.6,6.9hz,1h),8.59(d,j=14.8hz,1h),8.33(q,j=5.2hz,1h),7.90(s,1h),7.77(d,j=7.3hz,1h),7.69(d,j=1.6hz,1h),7.66(d,j=8.0hz,1h),7.55(t,j=7.6hz,1h),7.49(d,j=7.4hz,1h),7.44(s,1h),7.18(d,j=3.6hz,1h),6.75(s,1h),6.59(d,j=14.9hz,1h),4.44(s,2h),4.24-4.15(m,2h),4.05(m,2h),3.54(d,j=11.2hz,3h),3.46(s,5h),3.36-3.25(m,4h),3.24-3.13(m,4h),2.97(s,4h),2.91-2.83(m,2h),2.77-2.70(m,3h),2.68(s,2h),2.00-1.89(m,2h),1.88-1.80(m,2h),1.76(s,6h),1.71-1.65(m,1h),1.54(d,j=7.9hz,2h),1.48(s,11h),1.43-1.27(m,28h),1.23(s,2h).13cnmr(101mhz,dmso)δ177.35,170.73,170.62,169.64,165.75,164.71,160.30,158.61(q,j=34hz,cf3cooh),156.70,155.49,152.25,145.03,141.94,141.29,132.52,128.83,127.98,127.06,126.85,122.73,118.04,117.25(q,j=290hz,cf3cooh),114.78,114.04,112.94,104.32,103.09,83.43,81.13,77.30,54.80,54.66,54.34,53.35,53.11,50.98,50.32,48.34,47.98,47.60,47.24,42.72,38.55,36.14,32.06,31.67,29.34,28.34,28.15,27.60,27.35,26.80,23.47,22.76,22.50,19.84.ms:calcd.forc67h100cln8o12+[m+]:1243.7144;hrmaldi-msfound:m/z1243.7247.
化合物7的合成:在氮气保护下,将化合物6(97mg,0.078mmol)和dipea(137μl,0.78mmol)溶于5ml无水dcm并在室温搅拌10分钟,然后将氯磷酸二乙酯(22.75μl,0.156mmol)溶于1mldcm中并滴加入反应液中,溶液在室温下保持搅拌2小时。然后将反应混合物用20mldcm稀释,并用饱和na2co3水溶液,hcl(1m)和饱和nacl水溶液洗涤3次,有机层用无水na2so4干燥。过滤去除沉淀后旋蒸去除溶剂,并将残余物在氮气保护下溶解于5mldcm中。将tms-br(205.4μl,1.56mmol)快速加入溶液中,并将反应混合物在室温持续搅拌反应24小时。反应完全后,在-20℃将反应溶液滴加到50ml甲醇中以淬灭反应,然后将溶于5ml冷甲醇中的dipea(273μl,1.56mmol)滴入混合物中,以将ph值调节至中性。然后旋蒸去除溶剂,并通过制备hplc纯化残余物,通过冻干获得为蓝色固体的化合物7。产量:39mg(47%)。1hnmr(400mhz,dmso-d6)δ8.76(s,1h),8.58(s,1h),8.45(d,j=14.6hz,1h),7.78(d,j=7.1hz,1h),7.69(s,1h),7.62(s,1h),7.55(t,j=7.5hz,1h),7.49(t,j=7.4hz,1h),7.36(d,j=16.6hz,2h),6.63(d,j=15.0hz,1h),4.45(s,2h),4.29-4.16(m,1h),3.98(s,4h),3.56(s,4h),3.29(s,9h),3.09(s,8h),2.70(dd,j=15.4,6.8hz,6h),2.02(s,2h),1.83(s,2h),1.73(s,6h),1.55(s,3h),1.33(d,j=6.3hz,2h),1.26(q,j=6.8hz,1h).13cnmr(101mhz,dmso)δ178.52,171.40,171.10,169.07,165.98,159.06,158.69(q,j=32hz,cf3cooh),151.20,150.67,145.36,142.11,141.40,130.31,128.97,128.87,127.51,122.91,120.83,120.76,118.36(q,j=296hz,cf3cooh),117.43,114.29,113.32,107.81,105.62,54.62,53.98,52.97,52.85,50.90,50.39,48.58,48.31,43.60,38.50,36.28,31.54,28.57,27.50,26.81,26.60,23.66,22.34,19.75,17.96,16.65.ms:calcd.forc50h69cln8o13p+[m+]:1055.4405;hrmaldi-msfound:m/z1055.4718.
化合物8的合成:将化合物7(39mg,0.036mmol),dipea(16.8μl,0.09mmol)和(e)-环辛-4-烯基2,5,2-二氧杂-1-吡咯烷基碳酸酯(tco-nhs,15mg,0.054mmol)溶于1mldmf中,室温持续搅拌4小时。反应完成后,将反应溶液滴入冰乙醚(20ml)中,得到蓝色沉淀,将其离心并干燥以获得粗化合物8,其无需进一步纯化即可直接用于下一步。产量:41mg(93%)。1hnmr(400mhz,dmso-d6)δ8.62(s,1h),8.52(s,1h),8.43(d,j=14.6hz,1h),7.78(d,j=7.2hz,1h),7.67(s,2h),7.54(t,j=7.4hz,1h),7.47(t,j=7.3hz,1h),7.33(d,j=10.1hz,2h),7.19(s,1h),7.06(s,1h),6.93(s,1h),6.61(d,j=14.8hz,1h),5.52-5.59(m,1h),5.46-5.32(m,1h),4.42(s,2h),4.17(s,2h),3.75(s,4h),3.57(s,4h),3.27(s,3h),3.00(s,13h),2.88(s,2h),2.70(s,4h),2.41-2.33(m,1h),2.26(d,j=5.6hz,2h),2.20(d,j=10.7hz,1h),2.00(s,2h),1.91-1.77(m,6h),1.72(s,6h),1.66-1.61(m,1h),1.53(s,3h),1.38-1.29(m,2h),1.24(s,2h).13cnmr(101mhz,dmso)δ178.30,171.42,171.17,159.24,157.97(q,j=31hz,cf3cooh),155.62,151.23,145.23,141.97,141.41,134.80,132.39,130.65,128.78,128.51,127.36,122.87,118.61(q,j=298hz,cf3cooh),116.84,114.15,113.18,107.54,105.33,78.78,54.62,54.02,53.44,52.99,50.83,50.47,49.12,43.56,40.58,38.09,36.10,33.63,32.06,31.53,30.49,29.10,28.49,27.51,26.72,24.32,23.67,22.69,19.72.ms:calcd.forc59h81cln8o15p+[m+]:1207.5242;hrmaldi-msfound:m/z1207.5665.
探针p-gd-tco的合成:将化合物8(41mg,0.034mmol)溶解在2ml的dmf中,在冰浴中小心地向其中加入1mnahco3溶液以将ph值调节至6.5。然后,将gdcl3(126mg,0.34mmol)溶于1ml二次水中并加入到反应溶液中。然后将该溶液在冰浴中持续搅拌10分钟,并使用1mnahco3小心地将ph值调节回6.5。然后将反应溶液移回室温并搅拌过夜。反应完成后,将反应混合物离心(4000rpm,5分钟),并通过半制备型hplc纯化上清液。通过冻干的方法获得作为蓝色固体的p-gd-tco。产量:26mg(56%)。通过分析型hplc确认纯度。hplc保留时间tr=13.6min(纯度,92%)。mladi-ms:calcd.forc59h78clgdn8o15p+[m+]:1362.4248;maldi-msfound:m/z1362.4176.
实施例2:四嗪探针的设计、合成与表征
路线s3、s4及s5显示多个连接有四嗪的成像探针,用于与探针p-ffgd-tco联合用于细胞及活体水平肿瘤alp的成像检测。
(1)探针tz-fitc的合成:
反应条件:(a)dipea,dmf,r.t.,2h,92%.
将5-异硫氰酸根荧光素(23mg,0.06mmol),3-(4-苄基氨基)-1,2,4,5-四嗪(11.5mg,0.06mmol)和dipea(28μl,15mmol)混合在2ml的dmf中,混合液避光室温搅拌2小时。反应完成后通过半制备hplc纯化反应混合物。冻干后获得橙色固体形式的tz-fitc。产量:31.8mg(92%)。1hnmr(400mhz,dmso-d6)δ10.59(s,1h),10.22(s,1h),8.70(s,1h),8.51(d,j=8.4hz,2h),8.28(s,1h),7.81(dd,j=8.4,1.9hz,1h),7.66(d,j=8.4hz,2h),7.23(d,j=8.3hz,1h),6.69(d,j=2.3hz,2h),6.67-6.55(m,4h),4.97(d,j=5.2hz,2h).13cnmr(101mhz,dmso-d6)δ181.16,168.42,165.40,159.53,158.06,151.89,147.26,144.14,141.13,130.44,129.85,129.03,128.14,127.79,126.59,124.16,117.02,112.60,109.70,102.20,46.84.ms:calcd.forc30h21n6o5s+[(m+h)+]:577.1294;hrmaldi-msfound:m/z577.1821.
(2)探针tz-780-zw的合成:
反应条件:(a)n3-zw,cuso4,抗坏血酸钠,r.t.30min;(b)nan3,r.t.10min;炔丙基乙酸,cuso4,抗坏血酸钠,r.t.30min;(c)edc,nhs,dipea,3-(4-苄氨基)-1,2,4,5-四嗪,r.t.,3h,总产率74%
tz-780-zw是根据已报道的“一锅三步法”连续点击反应合成路线合成的(j.am.chem.soc.2020,142,6,2787-2794)。将c-pc-nir(30mg,0.05mmol)和n3-zw(24mg,0.1mmol)溶于3ml的dmso中,加入溶有cuso4(4mg,0.025mmol)和抗坏血酸钠(5mg,0.025mmol)的50μl二次水。反应溶液在室温下持续搅拌30分钟。反应完成后将溶于20μl二次水中的叠氮化钠(0.1mmol)直接加入到反应混合物中,并在室温下搅拌反应。反应10分钟后,加入炔丙基乙酸(5mg,0.05mmol),然后加入溶于二次水(200μl)的cuso4(8mg,0.05mmol)和抗坏血酸钠(10mg,0.05mmol)。将混合物在室温保持搅拌。反应30分钟后,将混合物通过半制备hplc纯化,并在真空下除去洗脱液。将残余物溶解在2mldmf中,向其中加入3-(4-苄氨基)-1,2,4,5-四嗪(12mg,0.06mmol),edc(12mg,0.06mmol)和nhs(7mg,添加0.06mmol)。混合溶液在室温持续搅拌3小时。反应完全后,使用半制备型hplc纯化混合物,冻干后获得tz-780-zw的绿色固体。产量:49mg(74%)。1hnmr(400mhz,dmso-d6)δ10.60(s,1h),8.75(t,j=6.0hz,1h),8.45(d,j=8.4hz,2h),8.36(s,1h),8.12(s,2h),7.59(d,j=8.4hz,2h),7.54(d,j=7.4hz,2h),7.43(dt,j=15.3,7.9hz,4h),7.25(t,j=7.4hz,2h),6.63(d,j=13.9hz,2h),6.36(d,j=14.1hz,2h),4.94(t,j=6.8hz,6h),4.47(d,j=5.8hz,2h),4.29(s,4h),3.88(t,j=6.9hz,4h),3.65-3.48(m,4h),3.10(s,15h),2.72-2.82(m,11h),2.12-1.94(m,10h),1.26(d,j=11.5hz,12h).13cnmr(101mhz,dmso-d6)δ172.05,171.08,165.35,158.09,147.53,146.90,146.18,144.91,141.84,141.00,140.91,130.30,128.56,128.12,127.75,126.47,125.48,125.23,123.04,122.47,111.49,101.80,62.61,60.40,50.64,48.71,47.29,43.33,42.77,41.90,34.92,27.23,27.00,26.31,23.82,21.98,21.08,20.20,18.87.ms:calcd.forc68h89n18o7s2+[m+]:1333.6598;hrmaldi-msfound:m/z1333.7843.
(3)探针tz-peg-noda的合成:
反应条件:(a)5,8,11-三恶唑-2-氮杂双癸二酸,dipea,hbtu,r.t.3h;30%tfa/dcm,30min;(b)noda-ga-nhsester,dipea,r.t.3h,总反应产率62%.
将3-(4-苄氨基)-1,2,4,5-四嗪(10mg,0.05mmol),5,8,11-三恶唑-2-氮杂双癸二酸(19mg,0.06mmol),hbtu(23mg,0.06mmol)和dipea(22μl,0.125mmol)溶于2ml无水thf溶液中,室温持续搅拌3小时。反应完全后,真空旋蒸除去thf。将残余物溶于5ml30%tfa的dcm溶液中,并在室温下搅拌30分钟。脱去boc后,真空旋蒸除去溶剂。将残余物溶解在1ml的dmf中,然后添加noda-ga-nhs酯(28mg,0.06mmol)和dipea(52μl,0.3mmol)。将反应混合物在室温持续搅拌3小时。反应后,使用半制备型hplc纯化混合物,冻干后获得粉红色油状的tz-peg-noda。产量:24mg(62%)。1hnmr(400mhz,dmso-d6)δ10.59(s,1h),8.68-8.54(m,2h),8.46(d,j=8.3hz,2h),7.55(d,j=8.3hz,2h),4.43(d,j=5.9hz,2h),4.09(s,2h),3.92(s,2h),3.68(t,j=6.3hz,3h),3.53(s,10h),3.46(t,j=5.7hz,3h),3.40(s,4h),3.28(q,j=5.4hz,4h),3.13(s,7h),2.45(t,j=6.3hz,2h).13cnmr(101mhz,dmso-d6)δ171.66,170.42,168.58,165.38,158.06,144.86,130.26,127.95,127.71,118.01(q,j=295hz,cf3cooh),69.69,69.52,68.68,66.81,54.66,53.87,52.50,50.46,48.32,47.93,41.78,38.86,36.11.ms:calcd.forc33h50n19o11+[(m+h)+]:748.3630;maldi-msfound:m/z748.3166.
实施例3:探针性能测试
1、探针对alp的酶切响应及自组装测定
(1)首先在alp酶切缓冲溶液(含有1%dmso10mmtris,ph8.0)中,研究了探针p-ffgd-tco(100μm)对alp的响应性能。如图2a所示,将探针p-ffgd-tco(100μm)与alp(500u/l)在tris缓冲液(ph=8.0)中37℃孵育0-30min后,利用高效液相色谱(hplc)对反应液进行分析,结果显示p-ffgd-tco(tr=15.0min)能够在alp的催化下转化为脱磷酸化产物ffgd-tco(tr=17.5min)。
(2)接下来研究了探针在加入alp前后的反应变化,随着快速的去磷酸化,p-ffgd-tco原本在605nm和652nm处的紫外吸收峰逐渐红移至690nm,并由于自组装过程的π-π堆积作用在750nm处出现了肩峰(图2b)。探针p-ffgd-tco在710nm处的荧光迅速激活,并在25分钟后达到最大值(图2c)。
(3)接下来又探究了探针的自组装过程,如图2d所示,p-ffgd-tco与alp孵育后,在溶液中出现了能够被检测的纳米聚集体,其水合粒径约为55nm,在孵育40分钟后达到250nm。透射电镜(tem)显示,自组装形成的fmnps-tco在探针与alp孵育40分钟后呈球形的纳米颗粒(图2e)。纳米颗粒的形成进一步降低了探针的横向驰豫时间,如图2f所示,探针与alp孵育后,随着孵育时间的延长,溶液的横向驰豫时间逐渐缩短,展现出了增强的t1加权磁共振成像信号(图2f插图)。
这些结果表明,p-ffgd-tco可以被alp迅速去磷酸化,然后自组装形成fmnps-tco,最终增强nir荧光和mri信号。
2、探针对alp的检测灵敏度研究
取p-ffgd-tco(10μm,100μl)与100μl含有不同浓度的alp的tris酶切缓冲溶液混合,探针最终工作浓度为5μm,alp酶最终浓度分别为0、0.5、1、2、4、6、10、20、40、60,80、100和150u/l,每个浓度组三个平行试验,将上述溶液于37℃下孵育25分钟,然后使用horibajobinyvonfluoromax-4荧光仪获得反应溶液的荧光光谱,激发波长为680nm。将得到的荧光强度(λem=710nm)对alp浓度做图,得到各自拟合直线的斜率k。检测限lod=3δ/k。其中,δ为测量11个空白探针孔溶液的强度值的标准方差。
结果如图3a所示,探针的荧光强度随着alp浓度的增大而增强。如图3b所示,荧光强度(λem=710nm)与alp浓度(0-20u/l)成线性关系,线性方程为y=3915x(u/l)+4008,r2=0.9969。探针对ggt的检测限lod经计算为67mu/l,表明探针可用于ggt的高灵敏检测。
3、探针对alp的检测特异性
取p-ffgd-tco(10μm,100μl)与100μl含有不同酶的tris酶切缓冲溶液混合,探针最终工作浓度为5μm,不同酶分别为mmp-2(10nmol/l)、ggt(100u/l)、组织蛋白酶b(100u/l)、caspase-3(0.2μg/ml)、alp(100u/l)或alp(100u/l)与抑制剂na3vo4(1mm)或pbs(10mm)。每组三个平行试验,将上述溶液于37℃下孵育25分钟,然后使用horibajobinyvonfluoromax-4荧光仪获得反应溶液在710nm处的荧光强度,激发波长为680nm。其次,取p-ffgd-tco(200μm,100μl)与100μl含有不同酶的tris酶切缓冲溶液混合,探针最终工作浓度为100μm,不同酶分别为mmp-2(100nmol/l)、ggt(250u/l)、组织蛋白酶b(250u/l)、caspase-3(2μg/ml)、alp(500u/l)或alp(500u/l)与抑制剂na3vo4(10mm)。混合液在37℃下孵育30分钟。使用t1-flash序列(重复时间ms/回波时间ms,276/5.0ms;切片厚度1.500mm),使用1t磁共振成像仪(布鲁克icontm)获取不同溶液的t1加权mri图像。
结果如图3c所示,只有alp的加入可以激活探针并引起荧光强度的显著增强,而在na3vo4(1mm)的作用下,alp对探针的激活得到明显的抑制,其他酶的加入均没有引起探针荧光强度的明显增强。同时mr成像也证实,只有与alp孵育后,能够明显增强探针的mr成像信号,其他酶的加入均没有引起探针mr成像信号的明显增强(图3d)。以上结果说明探针对alp具有很强的特异性。
4、探针自组装后的生物相容反应可行性研究
取p-ffgd-tco(40μm,100μl)与100μl含有200u/lalp酶的tris酶切缓冲溶液混合,探针最终工作浓度为20μm,alp酶最终浓度为100u/l,溶液于37℃下孵育30分钟使探针酶切完全并均匀组装。取tz-fitc(10mm,0.4μl)加入到的反应溶液中(终浓度为20μm),并将混合物在室温下反应15分钟,然后将反应溶液在tris缓冲液中稀释4倍。通过高效液相色谱分析反应的进行,使用海洋光学maya2000pro光谱仪对其uv-vis吸收光谱进行测定,并使用horibajobinyvonfluoromax-4荧光计使用同步荧光扫描记录相应的荧光光谱。为了进行dls、mr分析和尺寸排阻色谱对反应后的纳米颗粒进行研究,将p-ffgd-tco(终浓度100μm)与alp(终浓度500u/l)在37℃下孵育30分钟,然后添加tz-fitc(终浓度100μm)并将混合物在室温下反应15分钟。使用90plus/bi-mas设备对反应溶液进行dls分析。然后,在0.5磁共振扫描仪(nmi20-015v-1,niumag)上获取溶液的t1值。体积排阻色谱柱通过ivislumiaxriii系统软件进行成像研究以确认fitc与纳米颗粒结合(cy-cl:ex/em=660/710nm,fitc:480/530nm)。
hplc分析表明,探针形成的纳米颗粒与tz-fitc能够在溶液中通过快速的生物正交反应偶联在一起,生成二氢吡嗪(dhp)的共轭加成产物(图4a)。紫外吸收表明,形成的fmnps-dhp-fitc中同时存在fitc(λabs=485nm)和聚集的cy-cl(λabs=690nm及750nm处的肩峰)的吸收峰(图4b)。同时荧光光谱显示纳米颗粒中同时也存在fitc和cy-cl的荧光发射(图4c)。磁共振数据显示,反应前后溶液的t1值相似(图4d),表明组装形成的纳米颗粒在反应前后保持相对稳定。dls显示由于纳米颗粒表面fitc的附着,fmnps-dhp-fitc的水合粒径约为270nm,比fmnps-tco的水合粒径略大一些(图4e)。
将反应液超速离心,上清液澄清透明且不含荧光,体积排阻色谱(sec)柱分析结果显示,在用pbs缓冲液洗脱后,nps中cy-cl的nir荧光出现在sec柱的前部,与fitc的荧光重叠良好,而tz-fitc中fitc的荧光带则被困在色谱柱的顶部。这些结果表明fitc通过快速的iedda反应共价结合到探针p-ffgd-tco形成的纳米颗粒表面,形成了稳定的纳米复合物。
5、细胞培养
人宫颈癌hela细胞和人脐静脉内皮huvec细胞购自中国科学院上海干细胞研究所,并在dmem(dulbecco改良eagle培养基)培养基中培养。培养基中添加10%(v/v)胎牛血清(fbs),每毫升培养基加入100单位青霉素和100单位链霉素。所有细胞均在37℃的湿润环境(5%co2)中培养。
(1)细胞毒性研究(mtt)
将培养的hela细胞接种在平底96孔板中(每孔5000个细胞,每孔有100μl的dmem),并在37℃下孵育过夜。吸去每孔中的dmem,将p-ffgd-tco和p-gd-tco加入dmem培养基配成不同浓度的溶液(0、2.5、5、10、25、50、75和100μm),每孔加入100μl。孵育24小时后,将50μlmtt溶液(1mg/ml于pbs缓冲溶液中)加入每个孔中。将细胞在37℃下继续孵育4小时,然后小心除去每个孔中的溶液。每孔再添加150μldmso溶液溶解孔中生成的紫色晶体。用酶标仪(tcan)检测每个孔溶液在490nm处的吸光度(od)。将空白细胞的吸光度(od对照)用作对照,每孔细胞的生存活性百分比可由od/odcontrol×100%计算得到,每组实验重复三次。
(2)活细胞中alp活性的成像检测
为了验证探针能否对活细胞内的alp活性进行多模态,选取了alp高表达的人宫颈癌hela细胞和alp低表达的正常人脐静脉上皮细胞huvec,通过mtt细胞增殖实验考察了探针及对照探针对alp高表达hela细胞的细胞毒性。
如图5所示,加入不同浓度(0、2.5、5、10、25、50、75和100μm)的探针及对照探针并孵育24小时后,探针及对照探针对细胞均没有表现出很强的生物毒性,说明探针不会影响细胞的活力,可以用于对活细胞中的alp活性进行检测。
为验证探针对细胞中alp的成像能力,将培养的hela和huvec细胞(~10000个/孔)分别接种在玻璃底共聚焦皿上,每孔500μldmem培养基。孵育24小时后,除去培养基,将不含fbs但含有p-ffgd-tco(20μm)的dmem培养基添加到培养皿中,孵育不同时间后洗去,使用共聚焦显微镜对细胞进行荧光成像,如图6b所示,p-ffgd-tco与细胞孵育10分钟后,在alp大量存在细胞膜表面出现cy-cl的nir荧光,并随着孵育时间不同增强,进一步可以被内吞进入细胞内部。将细胞用不同方式(i:将hela细胞与p-ffgd-tco(20μm)孵育1小时;ii:将hela细胞用na3vo4(10mm)预处理20分钟,然后与p-ffgd-tco(20μm)孵育1小时;iii:将huvec细胞与p-ffgd-tco(20μm)孵育1小时;iv:将hela细胞与p-gd-tco(20μm)孵育1小时。)处理后。使用胰酶消解并离心得到细胞团。通过ivis-lumiaxriii系统(ex/em=660/710nm)和1.0t磁共振成像仪(重复时间ms/回波时间ms,446/15;切片厚度1.000毫米)对细胞团进行荧光成像和mr成像。如图6c所示,与p-ffgd-tco孵育后的hela细胞呈现最强的荧光和mr信号,而alp低表达的huvec细胞或是使用alp抑制剂na3vo4预处理的hela细胞双模态信号都很弱,表明,内源性的alp激活了p-ffgd-tco的分子自组装过程,使其黏附在细胞膜表面,从而产生了牢固的膜结合nir荧光和t1加权mri信号。
将p-ffgd-tco孵育后的hela细胞超声裂解,并利用100000g,60分钟的超速离心方法得到细胞膜组分,对其进行tem成像研究。tem成像显示,细胞膜表面存在球形纳米颗粒,并含有gd元素,证明探针在细胞膜表面自组装形成纳米颗粒,从而产生了增强的nir荧光和mri信号(图6d)。
(3)活细胞中alp活性的预靶向成像检测
为验证探针对alp酶的预靶向成像能力,将培养的hela和huvec细胞(~10000个/孔)分别接种在玻璃底共聚焦皿上。除去培养基,按照图6a方案所示,将不含fbs但含有p-ffgd-tco(20μm)的500μldmem培养基添加到培养皿中,孵育30分钟后洗去,然后将含有tz-fitc(10μm)的500μldmem培养基加入培养皿中,并在37℃下孵育30分钟。除去培养基,用1mlpbs缓冲液轻轻洗涤一次。添加500μl不含探针的新鲜dmem培养基后,使用leicatcssp8共焦激光扫描显微镜对细胞进行荧光成像。另外,将相同处理方法的细胞使用胰酶消解并离心得到细胞团。通过ivis-lumiaxriii系统(cy-cl:ex/em=660/710nm,fitc:480/530nm)和1.0t磁共振成像仪(重复时间ms/回波时间ms,446/15;切片厚度1.000毫米)对细胞团进行荧光成像和mr成像。该细胞进一步利用细胞超声粉碎仪裂解,并对细胞内探针进行hplc分析。
如图6e所示,经探针孵育后的hela细胞表面同时存在cy-cl和fitc的荧光,fitc的荧光与探针的nir荧光能够有很好地融合。而当huvec细胞与两个探针分别孵育后,几乎没有cy-cl以及fitc的荧光出现。与细胞成像相一致,hela细胞和huvec细胞都与p-ffgd-tco(20μm)孵育1小时后,再与tz-fitc(10μm)孵育30分钟后,仅在hela细胞团中观察到强的fitc的荧光、cy-cl的nir荧光以及明亮的t1加权mri信号(图6f)。细胞裂解液hplc显示,hela细胞与p-ffgd-tco孵育30分钟后,细胞的裂解液中有脱磷酸产物ffgd-tco的存在,当将tz-fitc(10μm)添加到已与p-ffgd-tco(20μm)孵育1小时的hela细胞培养基中,培养基和细胞裂解液的hplc分析表明几乎所有的tz-fitc都转化为ffgd-dhp-fitc,并保留在hela细胞上,在培养基中则无法检测到tz-fitc和ffgd-dhp-fitc的存在(图6g)。
这些hplc结果与荧光和mr成像一致,表明(1)p-ffgd-tco可被hela细胞膜表面的内源性alp有效地去磷酸化。(2)由于原位自组装成fmnps-tco,去磷酸化的ffgd-tco(不是gd-tco)能够大量滞留在hela细胞上。(3)保留有fmnps-tco的细胞可为tz-ftic的快速iedda反应提供tco基团,从而捕获fitc并增强成像对比度。
6、活体水平对alp活性的预靶向多模态成像检测
取免疫缺陷的6只6-8周龄的雌性balb/c裸鼠,在右后大腿外侧皮下注射2×106hela细胞,建立异种移植hela肿瘤。当肿瘤的平均体积达到约150mm3时,将小鼠随机分为两组(n=3)。为了对荷有皮下hela肿瘤的小鼠进行活体荧光成像,通过尾静脉将p-ffgd-tco或p-gd-tco(50μm,200μl)的生理盐水注射进入小鼠体内。在注射后0h,1h,2h,4h和6h使用ivisluminaxriii成像系统采集全身荧光图像。为了对荷有皮下hela肿瘤的小鼠进行alp活性的t1加权mr成像,通过尾静脉将p-ffgd-tco或p-gd-tco(0.02mmolkg-1)的生理盐水注射进入小鼠体内。在注射前,注射后2h,4h和10h采集mr图像。为研究探针在活体水平对alp的预靶向成像检测,通过尾静脉在小鼠体内注射p-ffgd-tco(50μm,200μl)、p-gd-tco(50μm,200μl)或200μl生理盐水。4小时后,通过尾静脉将tz-780-zw(25μm,200μl)或780-zw(25μm,200μl)注入小鼠体内。采集注射前,注射后30分钟,1小时,2小时,3小时和4小时的全身荧光图像。
如图7a所示,在尾静脉注射p-ffgd-tco1小时后,在肿瘤部位就可以观察到明亮的荧光,随着时间的延长缓缓下降,在6小时后依旧能够对肿瘤边缘进行区分。相比之下,虽然注射对照探针p-gd-tco后小鼠肿瘤部位也产生了很强的荧光,但由于p-gd-tco无法自组装,代谢速度较快,肿瘤部位的荧光下降速度更快。t1加权mr图像显示,尾静脉注射p-ffgd-tco后小鼠肿瘤的mri对比度明显上升,并在6小时达到最大,而对照探针p-gd-tco处理的小鼠肿瘤部位mri对比度更低,代谢更快(图7b)。这些结果证明,p-ffgd-tco可以在alp介导的原位自组装作用下在肿瘤中产生更高的fl和mr对比,能够对于alp阳性肿瘤进行双模态的体内成像。利用p-ffgd-tco在体内alp作用下自组装形成的纳米颗粒,可以进一步将另一成像探针通过生物正交反应与纳米颗粒在体内进行偶联,从而在alp高表达的肿瘤中富集,实现alp介导的信号放大。如图7c所示,在注射p-ffgd-tco4小时后,肿瘤内有cy-cl明亮的nir荧光,在注射tz-780-zw后也同时点亮了ir780的荧光。ir780的荧光在注射后30分钟即达到最大值,然后缓慢下降,在4小时后仍存在很强的荧光信号。相反,当预先注射p-gd-tco或pbs溶液时,小鼠肿瘤中cy-cl的荧光强度明显更弱,表明肿瘤内tco基团的积累较少。注射tz-780-zw30分钟后,ir780的荧光不仅分布在肿瘤部位,并且大量分布在小鼠的非肿瘤组织中,然后肿瘤内ir780的荧光强度迅速下降,并在4小时后几乎降至与背景相同。当给预先注射p-ffgd-tco的小鼠注射780-zw(缺少tz基团的tz-780-zw类似物)时,肿瘤部位ir780的荧光也迅速降至背景,与注射p-gd-tco或pbs的小鼠相似,在注射4小时候,肿瘤部位ir780的荧光比注射tz-780-zw的小鼠低约2倍。
尾静脉注射tz-780-zw3小时后,小鼠的主要器官和肿瘤组织被取出并进行离体的荧光成像,注射有p-ffgd-tco和tz-780-zw的小鼠肿瘤中显现出cy-cl和ir780的荧光,相较于注射p-gd-tco的小鼠肿瘤荧光强度高约2.2和3.2倍(图8)。此外,肿瘤组织切片的荧光成像也证实,与p-gd-tco处理的肿瘤相比,p-ffgd-tco处理组的肿瘤切片具有更强的cy-cl以及ir780的荧光(图9)。这些实验结果表明,alp介导的p-ffgd-tco在肿瘤内的原位自组装能够有效地在肿瘤部位积累tco基团,然后通过快速的iedda反应捕获tz-780-zw,从而延长了ir780在肿瘤的停留时间并增强了它的荧光。因此原位自组装与生物正交反应的结合非常适用于体内alp活性的预靶向成像。
7、p-ffgd-tco在体外水平的放射性标记
(1)tz-peg-noda的放射性标记实验步骤
使用一次性注射器将5mlhcl(0.05mol/l)注入68ga3+发生器。分别取出0.5、0.5、0.5、1.4、0.7和1.4ml包含68ga3+的溶液。在同位素剂量测试之后,将第四次和第五次获取的溶液使用铅罐转移到热室中。然后将1.4ml含68ga3+的溶液准确转移至新的离心管中,并使用预先制得备的乙酸钠溶液将ph值调节至4.0。之后,加入20μgtz-peg-noda,将混合物在37℃下孵育15分钟,每5分钟摇晃震荡一次。取少量最终溶液用于放射性hplc分析,其他溶液直接使用无需进一步纯化。
(2)fmnps-tco在体外的放射性标记研究
将p-ffgd-tco(20μm)与alp(100u/l)在tris缓冲液(ph=8.0)中于37℃孵育30分钟,以获得均匀的fmnps-tco。然后加入含有tz-68ga(500μci)的溶液,并将混合物在室温下放置15分钟。反应后,取出200μl溶液,并通过放射性hplc进行分析。
为了对细胞内放射性标记探针进行hplc分析,将大约1×106hela细胞接种到6cm细胞培养皿上。在37℃下孵育过夜后,将培养基替换为2ml添加或不添加20μmp-ffgd-tco的新鲜dmem,与细胞孵育1h。除去培养基,用1mlpbs缓冲液轻轻洗涤一次。然后加入2ml含tz-68ga(500μci)的新鲜dmem,与细胞孵育30分钟。除去培养基,用1mlpbs缓冲液轻轻洗涤一次。用胰蛋白酶消化细胞,离心并计数。用200μldmso裂解后,将细胞裂解液与300μl冰meoh和500μl去离子水混合,并在4℃下以14000rpm离心10分钟。将250μl细胞裂解物上清液分别注入放射性hplc系统中进行分析。
为了对细胞沉淀进行同位素剂量测试,将hela细胞以2×105个细胞/孔的密度接种在6孔细胞培养板上。在37℃下孵育过夜后,将培养基替换为2ml添加或不添加20μmp-ffgd-tco的新鲜dmem,与细胞孵育1h。除去培养基,用1mlpbs缓冲液轻轻洗涤一次。然后加入2ml含tz-68ga(5μci)的新鲜dmem,并与细胞孵育10、20、40和60分钟。除去培养基,用1mlpbs缓冲液轻轻洗涤一次。细胞用500μlnaoh(1m)溶解,收集并转移到新的离心管中。与含有tz-68ga(5μci)的标准溶液相比一同进行放射性剂量的研究。该标准溶液是在细胞孵育之前制备的,分别用于计算细胞在不同时间点的放射性总剂量。
如图10a所示,将tz-68ga置于含有10%胎牛血清(fbs)的pbs缓冲溶液中于37℃孵育2小时,tz-68ga保持较高的稳定性,几乎没有放射性副产物出现。放射性hplc分析表明,与fmnps-tco反应15分钟后,几乎所有的tz-68ga多可以转化为68ga标记的dhp产物(ffgd-dhp-68ga)。将p-ffgd-tco预处理的hela细胞与tz-68ga孵育20分钟时,在细胞裂解液的放射性hplc分析中发现明显的ffgd-dhp-68ga的存在,而hela细胞仅与tz-68ga一起孵育后,细胞裂解液中几乎没有检测到tz-68ga(图10b)。细胞的同位素丰度分析显示,与tz-68ga孵育10分钟后,p-ffgd-tco预处理的hela细胞中保留了约5.8%的68ga,这一数值在孵育60分钟后达到了10.3%(图4.38c)。与之相反,与tz-68ga孵育60分钟后,未经p-ffgd-tco预处理的hela细胞中仅有0.56%的68ga。这些实验结果表明,tz-68ga能够有效地与组装的fmnps-tco发生共价偶联,从而增强68ga的积累,以便于在hela细胞中对alp的活性进行pet成像检测。
8、小鼠肿瘤alp的预靶向pet成像
通过尾静脉在携带hela肿瘤的小鼠体内注射p-ffgd-tco(50μm,200μl)、p-gd-tco(50μm,200μl)或200μl生理盐水。4小时后,通过inveondedicatedmicro-pet扫描仪成对扫描两只小鼠。当扫描仪开始扫描时,通过尾静脉静脉注射溶于盐水(200μl)中的tz-68ga(约200μci)。在整个实验过程中,使用含有2%异氟烷的氧气以1.5l/min的流速麻醉小鼠。使用专业的图像处理软件(asipro,西门子)处理并获得实时和动态的图像,第一个小时的动态图像被重建并分成十二帧。然后分别获取90分钟和120分钟的静态图像。进一步对肿瘤部位的感兴趣区域(roi)进行分析,并根据注射剂量进行了归一化处理。组织的摄取值表示为每立方厘米组织注射剂量的百分比(%id/ml)。
图11b显示,不同预处理组中注射p-ffgd-tco的小鼠肿瘤内显示出最亮的cy-cl的荧光,表明fmnps-tco大量积累在肿瘤内部。随后通过尾静脉注射tz-68ga并进行pet成像,pet成像显示在尾静脉注射tz-68ga,蓄积有fmnps-tco的肿瘤中放射性信号大量积累(图11a)。在注射10分钟后,p-ffgd-tco处理组的肿瘤内68ga的摄取约为6.0±0.4%id/ml,比p-gd-tco处理组(3.5±0.2%id/ml)和pbs处理组(2.5±0.1%id/ml)分别高出1.7倍和2.4倍。其放射性在注射2小时后逐渐降低至3.0±0.2%id/ml,而经p-gd-tco-和pbs处理组肿瘤中的信号大幅度减弱,%id/ml分别为0.4±0.1和0.18±0.08(图11c)。相较于p-gd-tco或psb处理组肿瘤中更低的放射性信号,p-ffgd-tco处理组的肿瘤中放射性信号的增多表明tz-68ga能够与肿瘤中停留的fmnps-tco发生生物正交反应,从而有助于改善肿瘤细胞对tz-68ga的摄取并延长肿瘤中放射性信号的停留时间。由于在肿瘤成像过程中,正常组织中未反应的tz-68ga能够迅速被清除,因此能够有效降低背景信号,p-ffgd-tco处理组的肿瘤与肌肉(t/m)信号之比由10分钟的2.4±0.2增加到2小时的9.1±0.4(图11d)。增强的t/m可以清晰地将肿瘤病灶与相邻的正常组织进行区分。相比之下,经p-gd-tco-和pbs处理的肿瘤在2小时的t/m比分别仅为1.3±0.2和1.0±0.2,从pet图像几乎无法获取肿瘤的位置信息。这些pet成像结果与tz-780-zw的荧光成像结果相匹配,表明通过原位自组装和生物正交反应结合的预靶向策略能够为体内alp活性的多模态成像提供有效地方法,这有利于化学生物学研究和临床疾病诊断。
本发明提供了一种多模态分子影像探针ffgd-tco及其制备方法与应用的思路及方法,具体实现该技术方案的方法和途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加以实现。
- 还没有人留言评论。精彩留言会获得点赞!