一种生姜枯萎病菌的分离鉴定及PCR快速检测方法
本发明涉及pcr检测技术应用
技术领域:
。
背景技术:
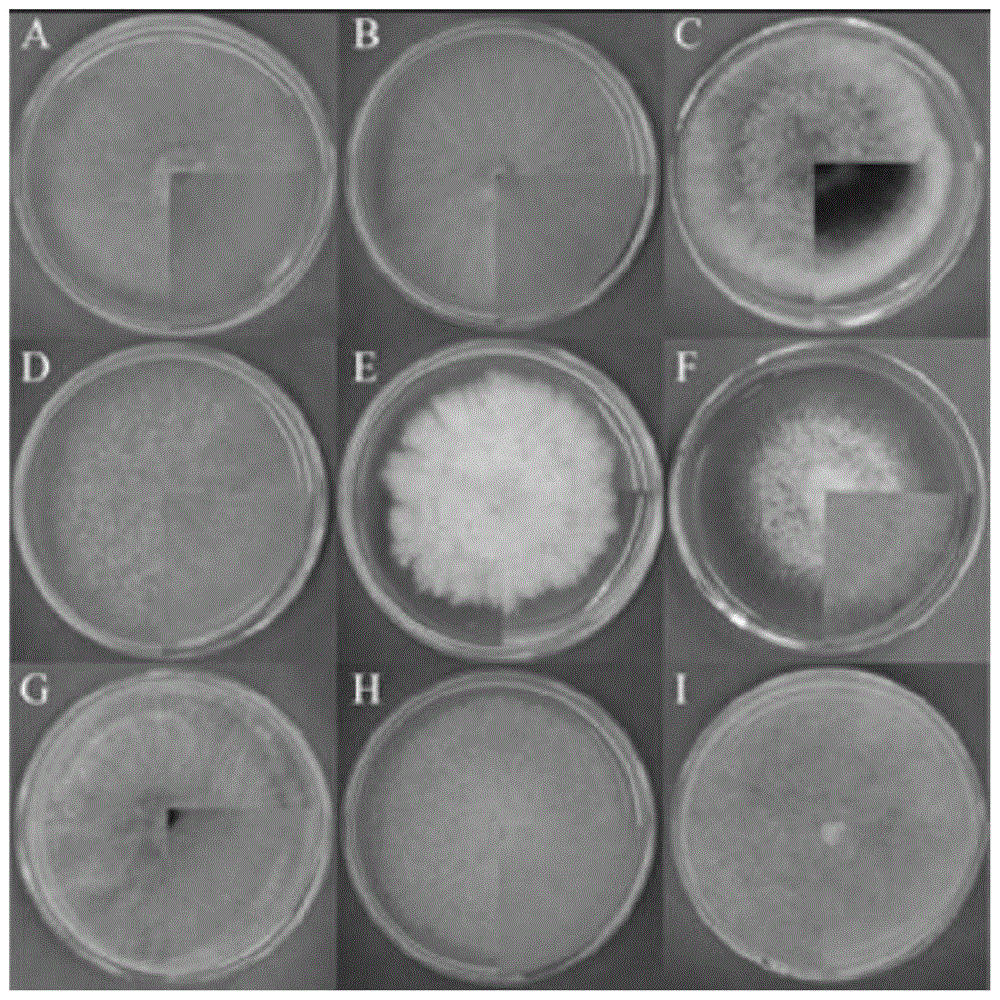
:生姜是一种药食同源的世界性植物,不仅能够作为调味香辛料,其内含的生物活性物质如姜酚、黄酮、姜辣素及姜精油等还能起到杀菌、消炎及抗肿瘤的作用,而且具有极高的药用和食用价值。生姜枯萎病是导致全球生姜产量和品质降低的一种重大土传真菌病害,治理难度相当大。由于枯萎病菌早期常通过孢子传播,肉眼不易觉察,被发现后早已对生产造成巨大损失,因此,快速分离和鉴定病原菌,对寄主和土壤中的枯萎病菌进行及时检测,对于生姜枯萎病的早期防控至关重要。据不完全统计,我国应用pcr及其相关技术而检测的植物病害达50余种,但目前关于利用pcr技术对生姜枯萎病病原菌进行检测的方法还尚未见报道。技术实现要素:本发明针对现有技术中存在的技术问题,提供一种生姜枯萎病菌的分离鉴定及pcr快速检测方法,解决了如今并未有利用pcr技术对生姜枯萎病病原菌进行检测的方法,从而实现快速检测。本发明解决上述问题的技术方案如下:一种生姜枯萎病菌的分离鉴定及pcr快速检测方法,包括以下步骤:1)选取实验材料,其中供试病样为生姜枯萎病发病期,选取检测病菌、培养基、试剂、仪器;2)病原菌的分离和纯化,在生姜枯萎病发病时期,从田间采集具有枯萎病典型症状的生姜发病植株,用流水冲洗干净表面泥土后吸干水分,采用组织块分离法取病株样本病健交界处,将其剪成1cm×1cm的小块,经75%(体积分数)乙醇浸泡,再用2%的次氯酸钠溶液处理,最后取出用无菌水连续冲洗,得到消毒后的组织块;3)将消毒后的组织块晾干表面水分后置于pda平板上,每皿放3~5块,置于恒温培养箱中黑暗培养,3d后观察组织块周围是否有菌丝长出,并将菌丝挑到新的pda培养基上继续进行纯化培养,以此方法纯化5~6次左右,最后将纯化后得到的分离物在显微镜下观察为形态颜色一致的菌丝即可,依据纯化后的菌落特征进行编号,统计菌株的种类和数量后保存备用;4)验证分离菌株的致病性,进行回接试验:s1、孢子悬浮液的制备,将菌种在pda培养基上进行继代培养,28℃下恒温避光培养至菌丝长满平板的2/3,用无菌水冲洗培养皿,将分生孢子冲洗下来,然后用无菌双层纱布过滤除去菌丝,采用血球计数板计数调整孢子悬浮液浓度约为1×107cfu/ml;s2、接种姜苗培育,选择肥厚、无病虫害的健康生姜根茎作种姜,23℃保温催芽至种芽芽长约1cm,芽粗约0.8cm,根据种芽数量将原有姜块根茎分成小块,每块保留1~2个壮芽,待种芽出土后再继续培土并正常管理,直至长出2叶1心后备用;s3、选取长势一致的健康生姜幼苗进行接种处理,采用针刺法将生姜幼苗茎基部刺伤成0.3cm深浅一致的伤口,并注射30μl浓度为1×107cfu/ml病菌的孢子悬浮液,以注射相同剂量无菌水的盆栽生姜幼苗为对照,试验共2个处理,每个处理重复10盆,共20盆,接种后进行常规管理,待接种发病后,观察致病力,并从病部再分离病原菌,比较所分离病原菌与原接种病原菌是否一致。5)菌株的形态学和分子生物学鉴定,将其进行形态学鉴定、分子生物学鉴定;6)采用特异性引物设计和反应条件优化,以f.solani基因组dna为模板,用镰刀菌通用引物tef-1αf/tef-1αr对其进行pcr扩增,pcr反应体系(25μl):模板dna1μl、10mmol/l上下游引物各1μl、2×taqpcrmastermix(含染料)12.5μl,ddh2o补足体系,pcr反应条件同1.2.3节(退火温度根据引物而定),利用premier5.0对测序所得序列进行引物设计,获得一对特异性引物,用特异性引物f8/r8对生姜枯萎病菌(f.solani)dna模板进行扩增,根据梯度pcr温度设置,结合引物自身退火温度,在55.0~70.0℃之间共设置12个温度梯度,以筛选引物最佳退火温度;7)引物灵敏度测试,于超微量紫外分光光度计测定dna初始浓度为454ng/μl,用灭菌ddh2o将f.solanidna模板分别稀释6个浓度梯度,采用筛选出的特异性引物及上述pcr反应程序进行扩增,测试引物灵敏度;8)分别取回接实验发病后的整株生姜幼苗及盆中适量带菌病土,验证特异性引物的实际适用性,根据植物基因组dna提取试剂盒提取生姜幼苗dna,采用土壤基因组提取试剂盒(soilgenomicdnaextractionkit)提取土壤基因组dna,以发病生姜幼苗及土壤基因组dna为模板,进行阴性对照,用特异性引物f8/r8进行pcr扩增,并进行对照。在上述技术方案的基础上,本发明还可以做如下改进。进一步,所述步骤1)中选取的供试病样为大黄姜,所述选取的检测病菌为腐皮镰刀菌,所述选取的培养基为马铃薯葡萄糖琼脂固体培养基(pda)。进一步,所述步骤1)中选取的试剂为无水乙醇、2×taqpcrmastermix(含染料)、核酸染色剂goldview、dl1000dnamarker、真菌基因组快速提取试剂盒(rapidfungigenomicdnaextractionkit)、土壤基因组提取试剂盒(soilgenomicdnaextractionkit)和植物基因组提取试剂盒(plantgenomicdnaextractionkit)。进一步,所述步骤1)中选取的仪器为spx-150b-z型生化培养箱、t100pcr仪、chemidocxrs+凝胶成像分析系统、dyy-7c电泳仪和sma4000微量紫外/可见分光光度计。进一步,所述步骤2)中乙醇浸泡的时间为30s,所述2%的次氯酸钠溶液处理时间为1min,所述无菌水连续冲洗次数为5次。进一步,所述步骤3)中恒温培养箱的温度为28℃,所述保存备用的温度为4℃。进一步,所述步骤6)中的12个温度梯度分别为55.0、55.1、56.2、57.7、59.5、61.6、63.5、65.5、67.4、68.9、69.7以及70.0℃。进一步,所述步骤7)中的6个浓度梯度,其中初始浓度为454ng/μl,而其余浓度分别为45.4ng/μl、4.54ng/μl、454pg/μl、45.4pg/μl、4.54pg/μl。进一步,所述步骤8)中阳性对照的对照物为f.solani基因组dna。进一步,所述步骤8)中阴性对照的对照物为ddh2o、健康生姜幼苗及无菌土。与现有技术相比,本申请的技术方案具有以下有益技术效果:该生姜枯萎病菌的分离鉴定及pcr快速检测方法,利用柯赫氏法则,结合形态学和分子生物学的方法成功分离鉴定出生姜枯萎病病原菌为腐皮镰刀菌(f.solani),通过特异性引物的设计和反应条件优化,建立了一套快速、准确的生姜枯萎病菌pcr分子检测技术,该技术灵敏度高、稳定性强,能够准确对带菌姜种和田间病土进行检测,并应用于生姜生产过程中枯萎病的监测预警,从而有效的解决了如今并未有利用pcr技术对生姜枯萎病病原菌进行检测的方法,从而实现快速检测。附图说明图1为本发明中分离纯化后所得9株不同菌落形态的病菌的示意图;图2为本发明中接种d6菌株后生姜幼苗发病情况的示意图;图3为本发明中d6菌株的菌落形态及分生孢子显微观察示意图;图4为本发明中利用its1/its4引物对d6菌株扩增结果的示意图;图5为本发明中基于菌株d6rdna-its序列构建的系统发育树示意图;图6为本发明中引物f8/r8对生姜枯萎病菌的特异性检测的示意图;图7为本发明中引物f8/r8最佳退火温度筛选结果的示意图;图8为本发明中引物f8/r8扩增腐皮镰刀菌的灵敏度测试的示意图;图9为本发明中带菌生姜幼苗腐皮镰刀菌特异性检测的示意图;图10为本发明中带菌土壤特异性检测的示意图。具体实施方式以下结合附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定发明的范围。请参阅图1-5,本实施例中的一种生姜枯萎病菌的分离鉴定及pcr快速检测方法。1材料和方法1.1试验材料供试病样为大黄姜,于生姜枯萎病发病期采自长江大学农业产业科技园生姜种植基地。供试菌株均由长江大学香辛作物研究院保存,其中腐皮镰刀菌为检测病菌,具体详见表1。培养基:马铃薯葡萄糖琼脂固体培养基(pda)。试剂:无水乙醇、2×taqpcrmastermix(含染料)、核酸染色剂goldview,北京索莱宝科技有限公司;dl1000dnamarker,宝生物工程(大连)有限公司;真菌基因组快速提取试剂盒(rapidfungigenomicdnaextractionkit),北京百泰克生物科技有限公司;土壤基因组提取试剂盒(soilgenomicdnaextractionkit),北京索莱宝科技有限公司;植物基因组提取试剂盒(plantgenomicdnaextractionkit),南京建成生物工程研究所有限公司。1.2试验仪器spx-150b-z型生化培养箱,上海博迅医疗生物仪器股份有限公司;t100pcr仪、chemidocxrs+凝胶成像分析系统,美国bio-rad公司;dyy-7c电泳仪,北京六一仪器厂;sma4000微量紫外/可见分光光度计,美林恒通(北京)仪器有限公司。表1供试菌株及其来源序号菌株寄主1腐皮镰刀菌fusariumsolani生姜zingiberofficinaleros.2尖孢镰刀菌fusariumoxysporum黄瓜cucumissativuslinn.3木贼镰刀菌fusariumequiseti西瓜citrulluslanatusthunb.4布什镰刀菌fusariumboothii生姜zingiberofficinaleros.5禾谷镰刀菌fusariumgraminearum生姜zingiberofficinaleros.6串珠镰刀菌fusariummoniliforme玉米zeamayslinn.7六株链格孢alternariaalstroemeriae生姜zingiberofficinaleros.8致病疫霉phytophthorainfestans马铃薯solanumtuberosumlinn.9茄链格孢alternariasolani生姜zingiberofficinaleros.10球壳孢菌chaetomiumsubglobosum生姜zingiberofficinaleros.1.3方法1.3.1病原菌的分离和纯化:在生姜枯萎病(gingerfusariumwilt)发病时期,从田间采集具有枯萎病典型症状的生姜发病植株,用流水冲洗干净表面泥土后吸干水分,采用组织块分离法取病株样本病健交界处,将其剪成1cm×1cm的小块,经75%(体积分数)乙醇浸泡30s,再用2%的次氯酸钠溶液处理1min,最后取出用无菌水连续冲洗5次,将消毒后的组织块晾干表面水分后置于pda平板上,每皿放3~5块,置于28℃恒温培养箱中黑暗培养,3d后观察组织块周围是否有菌丝长出,并将菌丝挑到新的pda培养基上继续进行纯化培养,以此方法纯化5~6次左右,最后将纯化后得到的分离物在显微镜下观察为形态颜色一致的菌丝即可,依据纯化后的菌落特征进行编号,统计菌株的种类和数量,4℃保存备用。1.3.2回接实验:为验证分离菌株的致病性根据柯赫氏法则(koch'spostulates)进行回接试验。孢子悬浮液的制备:将菌种在pda培养基上进行继代培养,28℃下恒温避光培养至菌丝长满平板的2/3,用无菌水冲洗培养皿,将分生孢子冲洗下来,然后用无菌双层纱布过滤除去菌丝,采用血球计数板计数调整孢子悬浮液浓度约为1×107cfu/ml。接种姜苗培育:选择肥厚、无病虫害的健康生姜根茎作种姜,23℃保温催芽至种芽芽长约1cm,芽粗约0.8cm,根据种芽数量将原有姜块分成小块,每块保留1~2个壮芽,待种芽出土后再继续培土并正常管理,直至长出2叶1心后备用。回接试验于2020年6月30日~8月30日在长江大学香辛作物研究院温室内进行,选取长势一致的健康生姜幼苗进行接种处理,采用针刺法将生姜幼苗茎基部刺伤成0.3cm深浅一致的伤口,并注射30μl浓度为1×107cfu/ml病菌的孢子悬浮液,以注射相同剂量无菌水的盆栽生姜幼苗为对照,试验共2个处理,每个处理重复10盆,共20盆,接种后进行常规管理,待接种发病后,观察致病力,并从病部再分离病原菌,比较所分离病原菌与原接种病原菌是否一致。1.3.3菌株的形态学和分子生物学鉴定:形态学鉴定:将经回接试验确认为生姜枯萎病病原菌的菌株接种到pda培养基上,通过插片培养法28℃培养7d后,在光学显微镜下观察菌丝形态,于产孢培养基上28℃培养3d后,获得孢子,观察分生孢子及分生孢子梗的形态特征,并进行显微形态观测、拍照,参照有关资料进行鉴定。分子生物学鉴定:将分离出的病菌接种至铺有灭菌玻璃纸的pda平板上,28℃恒温培养5d后收集菌丝,并用液氮充分研磨成细粉,称取100mg细粉于1.5ml离心管中,剩余步骤参照真菌dna提取试剂盒说明书,以提取的真菌基因组总dna作模板,利用真菌通用引物its1(5'-tccgtaggtaacctgcgg-3')和its4(5'-tcctccgcttat-tgatatgc-3'),对其rdna-its区域进行扩增,引物委托深圳华大基因股份有限公司合成,pcr反应体系(25μl):引物(its1/its4)1μl,2×taqpcrmastermix(含染料)12.5μl,dna模板1μl,ddh2o10.5μl,扩增条件:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸1min,30个循环;72℃延伸10min,4℃保存30min,反应结束后,取pcr产物5μl在1%琼脂糖凝胶上进行电泳检测,pcr扩增产物委托生工生物工程(上海)股份有限公司进行纯化和测序,测序结果在ncbi上进行blast比对分析。将测序所得序列提交至ncbi核酸序列比对库,获得不同菌株的序列登录号,下载目标菌株和相似菌株的代表序列,利用mega7中的nj法进行系统发育进化树的构建,并进行1000次自展抽值检验分子进化树可靠性,分析病原菌菌株与数据库菌株的亲缘关系,进行近源物种信息的确认。1.3.4特异性引物设计和反应条件优化:以f.solani基因组dna为模板,用镰刀菌通用引物tef-1αf/tef-1αr对其进行pcr扩增,pcr反应体系(25μl):模板dna1μl、10mmol/l上下游引物各1μl、2×taqpcrmastermix(含染料)12.5μl,ddh2o补足体系,pcr反应条件同1.2.3节(退火温度根据引物而定),pcr产物委托生工生物工程(上海)股份有限公司进行双向测序,利用premier5.0对测序所得序列进行引物设计,获得1对特异性引物f8/r8(f8:gctcagcggcttcctattg,r8:cggggtattcatcattcacttca),引物由生工生物工程(上海)股份有限公司进行合成。用特异性引物f8/r8对生姜枯萎病菌(f.solani)dna模板进行扩增,根据梯度pcr温度设置,结合引物自身退火温度,在55.0~70.0℃之间共设置12个温度梯度(55.0、55.1、56.2、57.7、59.5、61.6、63.5、65.5、67.4、68.9、69.7和70.0℃),以筛选引物最佳退火温度。1.3.5引物灵敏度测试:于超微量紫外分光光度计测定dna初始浓度为454ng/μl,用灭菌ddh2o将生姜枯萎病菌(f.solani)dna模板分别稀释成终浓度为45.4ng/μl、4.54ng/μl、454pg/μl、45.4pg/μl、4.54pg/μl共6个浓度梯度,采用筛选出的特异性引物及上述pcr反应程序进行扩增,测试引物灵敏度。1.2.6发病植株苗和带菌土壤检测:分别取回接实验发病后的整株生姜幼苗及盆中适量带菌病土,验证特异性引物的实际适用性,根据植物基因组dna提取试剂盒提取生姜幼苗dna,采用土壤基因组提取试剂盒(soilgenomicdnaextractionkit)提取土壤基因组dna,以发病生姜幼苗及土壤基因组dna为模板,用特异性引物f8/r8进行pcr扩增,以枯萎病菌(f.solani)基因组dna为阳性对照,ddh2o、健康生姜幼苗及无菌土为阴性对照。2.结果与分析2.1分离纯化:为了分离获得引起生姜枯萎病的主要病原菌‘腐皮镰刀菌’,根据方中达的方法对发生枯萎病的生姜植株进行了病菌的分离纯化,最终获得了23株病菌,结合形态观察筛选出9株不同菌落形态的病菌,其结果如图1所示。2.2回接实验:将这9种菌株配置成1×107cfu/ml的孢子悬浮液,用针刺法将菌株孢子悬浮液接种于生姜幼苗茎基部,培养35d左右,只有接种菌株d6的生姜植株幼苗开始发病,且致病力较强(图2),发病初期症状:发病植株茎基部离地3cm左右的叶片首先变黄,呈失水状,45d后地上部枝叶逐渐萎蔫,发病后期整株姜苗黄化倒伏,土壤表面有白色菌丝,对照植株健康生长,未出现上述症状,回接孢子悬浮液处理的生姜植株的发病率约为70.12%,由表1可知,接种该菌株的生姜植株其株高、茎粗、地上部鲜质量、根状茎鲜质量为对照的74.02%、75.96%、78.56%和77.70%,均达到显著差异水平(表2)。再从植株的病健交界处按照本研究分离病原菌的方法重新进行病菌的分离、纯化和鉴定,在pda培养基上选择性培养,分离到的病菌菌落形态特征均与菌株d6相同,因此,依据柯赫氏法则进行回接实验的结果表明,重新分离得到的菌株与接种菌株形态特征一致,证明菌株d6为生姜枯萎病的致病菌。表2接种d6菌株45d后生姜植株生长情况处理株高/cm茎粗/cm地上部鲜重/g地下部鲜重/g发病率/%对照40.88±3.013.12±0.2016.47±1.4220.45±1.790.00±0.00接种30.26±1.52**2.37±0.88**2.94±1.27**15.91±1.98**70.12±0.50**注:表格中**表示处理结果与对照相比存在极显著差异2.3生姜枯萎病菌形态鉴定:通过回接实验验证菌株d6致病性最强,因此选择d6作为候选菌株进行形态学鉴定,该菌株在pda培养基上菌落整体呈圆形,生长旺盛,边缘为白色,中央稍隆起,底部为紫红色,菌丝体浓密而厚实,呈辐射状向周围扩散(图3a),小型分生孢子为单孢、假头状着生,大型分生孢子为镰刀形或肾形,两端细胞稍尖,少数为1~3隔,大小为4.5~14.0μm×1.8~6.23μm,产孢细胞直接着生在菌丝上,分生孢子梗有分支(图3b和图3c),初步确认该菌株为腐皮镰刀菌f.solani。2.4分子生物学鉴定:研究结果表明,利用rdna-its通用引物its1/its4扩增,结合its序列比对以及形态学分析,可有效鉴定致病菌株,如雷早娟等利用rdna-its通用引物its1/its4对分离物基因组dna进行扩增,并对其its基因序列进行分析,结合形态学鉴定结果,确定导致冬枣黑斑病的病原真菌为极细链格孢a.tenuissima,为了进一步明确d6菌株为引起生姜枯萎病的腐皮镰刀菌f.solani,我们采用its1/its4引物对分离获得的d6菌株进行扩增,pcr结果表明,利用its1/its4引物可以扩增到544bp的dna片段(图4);将获得的its序列与genbank核酸序列数据库相似菌株序列进行blast比对,分离物d6的its序列与腐皮镰刀菌f.solani相似度达到100%以上(见表3);利用系统发育树进行分析(bootstrapreplications为1000),d6与f.solani在同一分支上,表明其与腐皮镰刀菌f.solani亲缘关系最近,因此,结合分子生物学鉴定以及形态观察结果,确定菌株d6为腐皮镰刀菌f.solani(图5)。表3d6菌株its序列的blast比对结果注:表中仅采用ncbi数据库中blast比对前3条结果以作例证2.5引物特异性验证:特异引物筛选:用设计的特异性引物f8/r8对所有供试菌株进行检测,结果显示,引物f8/r8可以扩增出一条大小为381bp的特异性片段,该片段的大小与预期目的条带大小一致,且只有f.solani基因组dna能扩增出此片段,其它供试菌株均无目的条带出现(见图6),该结果表明f8/r8对生姜枯萎病菌f.solani具有特异性,能够区别生姜枯萎病菌与其他病原菌。泳道m:dl1000maker;泳道n:ddh2o(阴性对照);泳道1~10分别为腐皮镰刀菌f.solani、尖孢镰刀菌fusariumoxysporum、木贼镰刀菌fusariumequiseti、布什镰刀菌fusariumboothii、禾谷镰刀菌fusariumgraminearum、串珠镰刀菌fusariummoniliforme、六株链格孢alternariaalstroemeriae、致病疫霉phytophthorainfestans(mont.)debary、茄链格孢alternariasolani(ell.etmart.)jonesetgrout.和球壳孢菌chaetomiumsubglobosum。退火温度优化:为筛选出最佳退火温度,优化反应体系,以得到清晰且单一的特异性条带,采用梯度pcr对腐皮镰刀菌f.solani基因组dna进行扩增,梯度pcr扩增结果显示,当退火温度在55~63.5℃时得到的条带均较清晰,且63.5℃后续无条带出现,说明该引物最适宜的退火温度在63.5℃左右,后续扩增程序均采用63.5℃作为退火温度(见图7)。泳道m:dl1000maker;泳道n:ddh2o(阴性对照);泳道1~12:退火温度分别为55.0、55.1、56.2、57.7、59.5、61.6、63.5、65.5、67.4、68.9、69.7和70.0℃。2.6引物灵敏度测试用微量紫外可见分光光度计检测提取出的生姜枯萎病(f.solani)菌株dna初始浓度为454ng/μl,将供试生姜枯萎病(f.solani)菌株基因组dna以10倍稀释法分别稀释成454ng/μl、45.4ng/μl、4.54ng/μl、454pg/μl、45.4pg/μl、4.54pg/μl等6个浓度梯度进行扩增,结果表明,在本研究中引物f8/r8对供试菌株基因组的最低检测浓度为454pg/μl(见图8)。泳道m:dl1000maker;泳道n:ddh2o(阴性对照);泳道1~6:分别代表灵敏度为454ng/μl、45.4ng/μl、4.54ng/μl、454pg/μl、45.4pg/μl、4.54pg/μl。2.7发病植株及带菌土壤检测:分别以接种病原菌f.solani后发病的生姜幼苗和土壤基因组dna为模板,利用特异性引物f8/r8对其进行pcr扩增,结果显示,病原菌、发病生姜幼苗、带菌土壤均可以扩增出1条大小为381bp的条带,而健康生姜幼苗、无菌土和ddh2o对照均无条带产生(见图9和图10),表明该特异性引物不仅可以直接对f.solani基因组dna进行检测,也可以从枯萎病发病生姜幼苗和带菌土壤中检测到f.solani基因组dna,表明本研究建立的检测方法可以应用实际生产中的病原菌快速分子检测。图9:泳道m为dl1000marker;泳道1为生姜腐皮镰刀菌(fusariumsolani)dna:泳道2为发病生姜幼苗dna;泳道ck1为健康生姜幼苗dna;泳道ck2为ddh2o。图10:泳道m为dl1000marker;泳道1为生姜腐皮镰刀菌(fusariumsolani)dna:泳道2为带菌土壤dna;泳道ck1为健康土壤dna;泳道ck2为ddh2o。3.结论本研究利用柯赫氏法则,结合形态学和分子生物学的方法成功分离鉴定出生姜枯萎病菌腐皮镰刀菌f.solani,通过特异性引物的设计和反应条件优化,建立了一套快速、准确的生姜枯萎病菌pcr分子检测技术,该技术灵敏度高、稳定性强,能够准确对带菌姜种和田间病土进行检测,可应用于生姜生产过程中枯萎病的监测预警。以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1