大麻素衍生物及其制备方法和在医药上的应用与流程
1.本发明涉及大麻素衍生物,或者其立体异构体、溶剂化物、前药、代谢产物、药学上可接受的盐或共晶,其药物组合物以及在制备药物中的应用。
背景技术:
2.大麻(cannabis sativa l.)为桑科大麻属一年生草本植物,起源于中亚和东亚,广泛分布于美国、印度、巴西等地。大麻的药用历史悠久,但成瘾性和精神致幻作用,使其临床应用受到极大限制。大麻含有数百种不同的化学物质,大约有70多种成分被称为大麻素,主要包括大麻二酚(cannabidiol,cbd)、大麻酚(cannabinol,cbn)、四氢大麻酚(tetrahydrocannabinol,thc)及其同系物等。大麻素水溶性差,口服生物利用度低,需要开发新的技术,以达到改善药物在体内的吸收、分布、转运与代谢过程、提高生物利用度、提高药物对靶部位作用的选择性、降低药物的毒副作用、延长作用时间等的技术效果。
技术实现要素:
3.本发明的目的是提供新的大麻素衍生物,或者其立体异构体、溶剂化物、代谢产物、药学上可接受的盐、共晶或者前药,其药物组合物以及其在制备药物中的应用。本发明化合物与大麻素相比,可改善药物在体内的吸收、分布、转运与代谢过程,具有更高的口服生物利用度,提高药物对靶部位作用的选择性,降低药物的毒副作用,延长作用时间,提高治疗效果。
4.本技术的一个或多个实施方式提供通式(i)的化合物,或者其所有的立体异构体、溶剂化物、代谢产物、药学上可接受的盐或共晶:
[0005][0006]
其中:
[0007]
a为大麻素残基,所述的大麻素残基任选被1个或者多个选自羟基、c1‑6烷基、=o或者c1‑6羟烷基的取代基所取代;
[0008]
l为
‑
ch2‑
或者
‑
ch(ch3)
‑
;
[0009]
r1、r2各自独立地为h、c1‑6烷基或者c2‑6烯基,所述的c1‑6烷基任选被1个或者多个选自卤素或者羟基的取代基所取代;
[0010]
n为1或者2;
[0011]
或者,通式(i)的化合物任选被1个或者多个d原子取代。
[0012]
本技术的一个或多个实施方式提供通式(i)的化合物,或者其所有的立体异构体、溶剂化物、代谢产物、药学上可接受的盐或共晶:
[0013][0014][0015]
其中:
[0016]
a为大麻素残基,所述的大麻素残基任选被1个或者多个选自羟基、c1‑6烷基、=o或者c1‑6羟烷基的取代基所取代;
[0017]
l为
‑
ch2‑
或者
‑
ch(ch3)
‑
;
[0018]
r1、r2各自独立地为或者c1‑6烷基,所述的c1‑6烷基任选被1个或者多个选自卤素或者羟基的取代基所取代;
[0019]
n为1或者2;
[0020]
或者,通式(i)的化合物任选被1个或者多个d原子取代。
[0021]
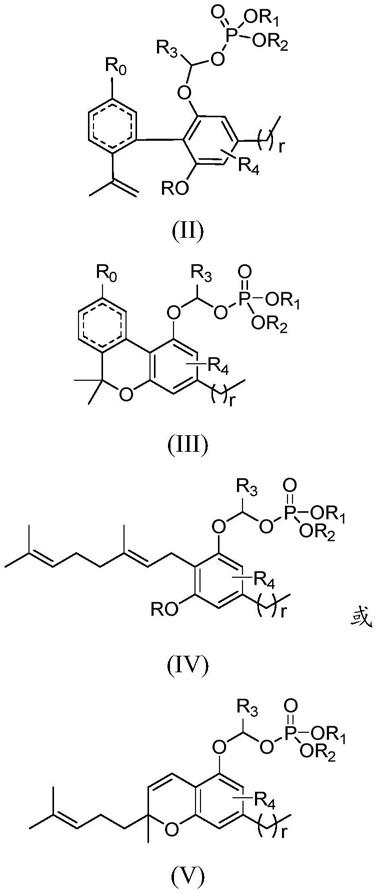
本技术的一个或多个实施方式提供通式(ii)、(iii)、(iv)或者(v)所示的化合物,或者其立体异构体、溶剂化物、代谢产物、药学上可接受的盐或共晶:
[0022][0023]
其中,
[0024]
为单键或者双键;
[0025]
r0为甲基或者
‑
ch2oh;
[0026]
r为h、
‑
ch2‑
o
‑
p(=o)(or1)(or2)、
‑
ch(ch3)
‑
o
‑
p(=o)(or1)(or2)或者c1‑6烷基;
[0027]
r1、r2各自独立地为h或者c1‑6烷基,所述的烷基任选被1个或者多个选自卤素或者羟基的取代基所取代;
[0028]
r3为h或者甲基;
[0029]
r4为h或者羧基;
[0030]
r为0、1、2、3、4、5或者6;
[0031]
或者,通式(ii)、(iii)、(iv)或者(v)可以任选被1个或者多个d原子取代。
[0032]
本技术的一个或多个实施方式提供通式(ii)
‑
1、(iii)
‑
1、(iv)
‑
1或者(v)
‑
1所示的化合物,或者其所有的立体异构体、溶剂化物、代谢产物、药学上可接受的盐或共晶:
[0033][0034]
其中,
[0035]
r0、r、r1、r2、r3、r4和r定义与通式(ii)、(iii)、(iv)或者(v)的定义相同;
[0036]
或者,所述通式(ii)
‑
1、(iii)
‑
1、(iv)
‑
1或者(v)
‑
1的化合物任选被1个或者多个d原子取代。
[0037]
在本技术的一个或多个实施方式中,本技术的化合物为:
[0038]
[0039]
[0040][0041]
上述结构任选进一步被1个或者多个d原子取代。
[0042]
在本技术的一个或多个实施方式中,其中所述大麻素残基为大麻二酚残基、大麻酚残基或四氢大麻酚残基。
[0043]
在本技术的一个或多个实施方式中,其中所述大麻素残基通过羟基与母核连接。
[0044]
在本技术的一个或多个实施方式中,其中所述的盐选自钠盐、钾盐、钙盐或者镁盐。
[0045]
本技术的一个或多个实施方式提供药物组合物,所述药物组合物包含:
[0046]
(1)本技术的化合物或其立体异构体、溶剂化物、代谢产物、药学上可接受的盐或者共晶;
[0047]
(2)任选的一种或者多种其他活性成分或其立体异构体、水合物、代谢产物、溶剂化物、药学上可接受的盐或者共晶;以及
[0048]
(3)药学上可接受的载体和/或赋形剂。
[0049]
在本技术的一个或多个实施方式中,所述的其他活性成分选自银杏内酯、抗肿瘤剂、抗凝血剂、抗癫痫剂、抗抑郁剂、抗焦虑剂、催眠剂、镇痛剂和麻醉剂中的一种或多种。
[0050]
在本技术的一个或多个实施方式中,银杏内酯为银杏内酯a、银杏内酯b、银杏内酯c、银杏内酯d、银杏内酯j、银杏内酯m、银杏内酯k、银杏内酯l、银杏内酯n、银杏内酯p、银杏内酯q、白果内酯的一种或任意两种及以上以任意比例的组合。
[0051]
本技术的一个或多个实施方式提供本技术的化合物或其立体异构体、溶剂化物、代谢产物、药学上可接受的盐或者共晶或者本技术的药物组合物,在制备用于治疗创伤后应激障碍、面瘫、中风、偏头痛、冠心病稳定型心绞痛、脑梗塞、血栓栓塞、心肌梗塞、心脏缺血、冠状动脉疾病、高血压、脑缺血、改善性功能、痉挛、急性和慢性疼痛、纤维肌痛、术后疼痛、丛集性头痛、紧张性头痛、背疼、四肢痛、腰痛、颈部疼痛、神经性疼痛、癌痛、三叉神经痛、关节炎疼痛、炎性疼痛、dravet综合征、lennox
‑
gastaut综合征、prader
‑
willi综合征、sturge
‑
weber综合征、脆性x综合征、焦虑、双相情感障碍、自闭症、广泛性焦虑症、社交焦虑症、癫痫、帕金森氏病、阿尔茨海默氏病、亨廷顿氏病、阿片类药物滥用、酗酒、尼古丁成瘾、厌食症、恶病质、化疗相关恶心呕吐、术后恶心和呕吐、肌萎缩性侧索硬化症(als)、friedreich共济失调、精神分裂症、强迫症、多发性硬化症、抑郁、睡眠障碍、多发性硬化引起的痉挛、肌张力障碍、睡眠呼吸暂停、麻痹性痴呆、记忆力减退或者胶质母细胞瘤的药物中的用途。
[0052]
除非有相反的陈述,在说明书和权利要求书中使用的术语具有下述含义。
[0053]
本发明所述基团和化合物中所涉及的碳、氢、氧、硫、氮或f、cl、br、i均包括它们的同位素情况,及本发明所述基团和化合物中所涉及的碳、氢、氧、硫或氮任选进一步被一个或多个它们对应的同位素所替代,其中碳的同位素包括
12
c、
13
c和
14
c,氢的同位素包括氕(h)、氘(d,又叫重氢)、氚(t,又叫超重氢),氧的同位素包括
16
o、
17
o和
18
o,硫的同位素包括
32
s、
33
s、
34
s和
36
s,氮的同位素包括
14
n和
15
n,氟的同位素包括
17
f和
19
f,氯的同位素包括
35
cl和
37
cl,溴的同位素包括
79
br和
81
br。
[0054]“烷基”是指1至20个碳原子的直链或支链饱和脂肪族烃基,优选为1至8个(例如1、2、3、4、5、6、7、8个)碳原子的烷基,更优选为1至6个碳原子的烷基,进一步优选为1至4个碳原子的烷基。非限制性实施例包括甲基、乙基、正丙基、异丙基、正丁基、仲丁基、新丁基、叔丁基、正戊基、异戊基、新戊基、正己基及其各种支链异构体;当烷基被取代基时,可以任选进一步被1个或者多个取代基所取代。
[0055]“烷氧基”是指烷基中至少1个碳原子被氧原子取代所形成的基团。非限制性实施例包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、仲丁氧基、叔丁氧基、正戊氧基、正己氧基、环丙氧基和环丁氧基。所述的烷基定义与上文所述的“烷基”定义相同。
[0056]“烯基”是指含有1至10个(例如1、2、3、4、5、6、7、8、9、10个)碳
‑
碳双键,由2至20个
碳原子组成的直链或者支链不饱和脂肪族烃基,优选2至12个(例如2、3、4、5、6、7、8、9、10、11、12个)碳原子的烯基,更优选2至8个碳原子的烯基,进一步优选2至6个碳原子的烯基。非限制性实施例包括乙烯基、丙烯
‑2‑
基、丁烯
‑2‑
基、丁烯
‑2‑
基、戊烯
‑2‑
基、戊烯
‑4‑
基、己烯
‑2‑
基、己烯
‑
3基、庚烯
‑2‑
基、庚烯
‑3‑
基、庚烯
‑4‑
基、辛烯
‑3‑
基、壬烯
‑3‑
基、癸烯
‑4‑
基和十一烯
‑3‑
基。所述的烯基可以任选进一步被1个或者多个取代基所取代。
[0057]“炔基”是指含有1至10个(例如1、2、3、4、5、6、7、8、9、或10个)碳
‑
碳叁键,由2至20个碳原子组成的直链或者支链不饱和脂肪族烃基,优选2至12个(例如2、3、4、5、6、7、8、9、10、11或12个)碳原子的炔基,更优选2至8个碳原子的炔基,进一步优选2至6个碳原子的炔基。非限制性实施例包括乙炔基、丙炔
‑1‑
基、丙炔
‑2‑
基、丁炔
‑1‑
基、丁炔
‑2‑
基、丁炔
‑3‑
基、3,3
‑
二甲基丁炔
‑2‑
基、戊炔
‑1‑
基、戊炔
‑2‑
基、己炔
‑1‑
基、1
‑
庚炔
‑1‑
基、庚炔
‑3‑
基、庚炔
‑4‑
基、辛炔
‑3‑
基、壬炔
‑3‑
基、癸炔
‑4‑
基、十一炔
‑3‑
基、十二炔
‑4‑
基。所述的炔基可以任选进一步被一至多个取代基所取代。
[0058]“芳基”是指是指取代的或未取代的芳香环,其可以是5至8元(例如5、6、7、8元)的单环、5至12元(例如5、6、7、8、9、10、11、12元)双环或者10至15元(例如10、11、12、13、14、15元)三环体系,其可以是桥环或者螺环,非限制性实施例包括苯基、萘基。所述的芳基可以任选进一步被1个或者多个取代基所取代。
[0059]“杂芳基”是指取代的或未取代的芳香环,其可以是3至8元(例如3、4、5、6、7、8元)的单环、5至12元(例如5、6、7、8、9、10、11、12元)双环或者10至15元(例如10、11、12、13、14、15元)三环体系,且包含1至6个(例如1、2、3、4、5、6个)选自n、o或s的杂原子,优选5至8元杂芳基,杂芳基的环中选择性取代的1至4个(例如1、2、3、4个)n、s可被氧化成各种氧化态。杂芳基可以连接在杂原子或者碳原子上,杂芳基可以是桥环或者螺环,非限制性实施例包括环吡啶基、呋喃基、噻吩基、吡喃基、吡咯基、嘧啶基、吡嗪基、哒嗪基、咪唑基、哌啶基苯并咪唑基、苯并吡啶基、吡咯并吡啶基。杂芳基任选进一步被1个或多个取代基所取代。
[0060]“碳环基”或“碳环”是指饱和或者不饱和的芳香环或者非芳香环。当为芳香环时,其定义与上文“芳基”的定义相同;当为非芳香环时,其可以是3至10元(例如3、4、5、6、7、8、9、10元)的单环、4至12元(例如4、5、6、7、8、9、10、11、12元)双环或者10至15元(例如10、11、12、13、14、15元)三环体系,可以是桥环或者螺环,非限制性实施例包括环丙基、环丁基、环戊基、1
‑
环戊基
‑1‑
烯基、1
‑
环戊基
‑2‑
烯基、1
‑
环戊基
‑3‑
烯基、环己基、1
‑
环己基
‑2‑
烯基、1
‑
环己基
‑3‑
烯基、环己烯基、环己二烯基、环庚基、环辛基、环壬基、环癸基、环十一烷基、环十二烷基、十二烷基、所述的“碳环基”或“碳环”任选进一步被1个或者多个取代基所取代。
[0061]“杂环基”或“杂环”是指饱和或不饱和的芳香性杂环或者非芳香性杂环,当为芳香性杂环时,其定义与上文“杂芳基”定义相同;当为非芳香性杂环时,其可以是3至10元(例如3、4、5、6、7、8、9、10元)的单环、4至12元(例如4、5、6、7、8、9、10、11、12元)双环或者10至15元(例如10、11、12、13、14、15元)三环体系,且包含1至4个(例如1、2、3、4个)选自n、o或s的杂原子,优选3至8元杂环基。“杂环基”或“杂环”的环中选择性取代的1至4个(例如1、2、3、4个)n、s可被氧化成各种氧化态;“杂环基”或“杂环”可以连接在杂原子或者碳原子上;“杂环基”或“杂环”可以为桥环或者螺环。“杂环基”或“杂环”的非限制性实施例包括环氧乙基、环氧丙
基、氮杂环丙基、氧杂环丁基、氮杂环丁基、硫杂环丁基、1,3
‑
二氧戊环基、1,4
‑
二氧戊环基、1,3
‑
二氧六环基、氮杂环庚基、氧杂环庚基、硫杂环庚基、氧氮杂卓基、二氮杂卓基、硫氮杂卓基、吡啶基、哌啶基、高哌啶基、呋喃基、噻吩基、吡喃基、n
‑
烷基吡咯基、嘧啶基、吡嗪基、哒嗪基、哌嗪基、高哌嗪基、咪唑基、哌啶基、吗啉基、硫代吗啉基、噻噁烷基、1,3
‑
二噻烷基、二氢呋喃基、二噻戊环基、四氢呋喃基、四氢噻吩基、四氢吡喃基、四氢噻喃基、四氢吡咯基、四氢咪唑基、四氢噻唑基、四氢吡喃基、苯并咪唑基、苯并吡啶基、吡咯并吡啶基、苯并二氢呋喃基、2
‑
吡咯啉基、3
‑
吡咯啉基、二氢吲哚基、2h
‑
吡喃基、4h
‑
吡喃基、二氧杂环己基、1,3
‑
二氧戊基、吡唑啉基、二噻烷基、二噻茂烷基、二氢噻吩基、吡唑烷基、咪唑啉基、咪唑烷基、1,2,3,4
‑
四氢异喹啉基、3
‑
氮杂双环[3.1.0]己基、3
‑
氮杂双环[4.1.0]庚基、氮杂双环[2.2.2]己基、3h
‑
吲哚基喹嗪基、n
‑
吡啶基尿素、1,1
‑
二氧硫代吗啉基、氮杂二环[3.2.1]辛烷基、氮杂二环[5.2.0]壬烷基、氧杂三环[5.3.1.1]十二烷基、氮杂金刚烷基和氧杂螺[3.3]庚烷基。所述的“杂环基”或“杂环”可以任选进一步被1个或者多个取代基所取代。
[0062]“环烷基”是指饱和的环烃基,其环可以为3至10元(例如3、4、5、6、7、8、9、10元)的单环、4至12元(例如4、5、6、7、8、9、10、11、12元)双环或者10至20元(例如10、11、12、13、14、15、16、17、18、19、20元)多环体系,环碳原子优选3至10个碳原子,进一步优选3至8个碳原子。“环烷基”非限制性实施例包括环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环丙烯基、环丁烯基、环戊烯基、环己烯基、环庚烯基、1,5
‑
环辛二烯基、1,4
‑
环己二烯基和环庚三烯基等。当环烷基被取代时,可以任选进一步被1个或者多个取代基所取代。
[0063]“杂环烷基”是指取代的或未取代的饱和非芳香环基,其可以是3至8元(例如3、4、5、6、7、8元)的单环、4至12元(例如4、5、6、7、8、9、10、11、12元)双环或者10至15元(例如10、11、12、13、14、15元)三环体系,且包含1、2或3个选自n、o或s的杂原子,优选3至8元杂环基。“杂环烷基”的环中选择性取代的1、2或3个n、s可被氧化成各种氧化态;“杂环烷基”可以连接在杂原子或者碳原子上;“杂环烷基”可以为桥环或者螺环。“杂环烷基”非限制性实施例包括环氧乙基、氮杂环丙基、氧杂环丁基、氮杂环丁基、1,3
‑
二氧戊环基、1,4
‑
二氧戊环基、1,3
‑
二氧六环基、氮杂环庚基、哌啶基、哌叮基、吗啉基、硫代吗啉基、1,3
‑
二噻烷基、四氢呋喃基、四氢吡咯基、四氢咪唑基、四氢噻唑基、四氢吡喃基、氮杂二环[3.2.1]辛烷基、氮杂二环[5.2.0]壬烷基、氧杂三环[5.3.1.1]十二烷基、氮杂金刚烷基和氧杂螺[3.3]庚烷基。
[0064]
当上文所述的“烷基”、“烷氧基”、“烯基”、“炔基”、“芳基”、“杂芳基”、“碳环基”、“碳环”、“杂环基”、“杂环”、“环烷基”、“杂环烷基”或者“杂环基”被取代时,可以选进一步被0、1、2、3、4、5、6、7、8、9或者10个选自f、cl、br、i、羟基、巯基、硝基、氰基、氨基、c1‑6烷基氨基、=o、c1‑6烷基、c1‑6烷氧基、c2‑6烯基、c2‑6炔基、
‑
nr
q4
r
q5
、=nr
q6
、
‑
c(=o)oc1‑6烷基、
‑
oc(=o)c1‑6烷基、
‑
c(=o)nr
q4
r
q5
、c3‑8环烷基、c3‑8杂环烷基、c6‑
10
芳基、c5‑
10
杂芳基、
‑
c(=o)oc6‑
10
芳基、
‑
oc(=o)c6‑
10
芳基、
‑
oc(=o)c5‑
10
杂芳基、
‑
c(=o)oc5‑
10
杂芳基、
‑
oc(=o)c3‑8杂环烷基、
‑
c(=o)oc3‑8杂环烷基、
‑
oc(=o)c3‑8环烷基、
‑
c(=o)oc3‑8环烷基、
‑
nhc(=o)c3‑8杂环烷基、
‑
nhc(=o)c6‑
10
芳基、
‑
nhc(=o)c5‑
10
杂芳基、
‑
nhc(=o)c3‑8环烷基、
‑
nhc(=o)c3‑8杂环烷基、
‑
nhc(=o)c2‑6烯基或者
‑
nhc(=o)c2‑6炔基的取代基所取代,且其中所述的取代基c1‑6烷基、c1‑6烷氧基、c2‑6烯基、c2‑6炔基、c3‑8环烷基、c3‑8杂环烷基、c6‑
10
芳基、c5‑
10
杂芳基、
‑
nhc(=o)c6‑
10
芳基、
‑
nhc(=o)c5‑
10
杂芳基、
‑
nhc(=o)c3‑8杂环烷基或者
‑
nhc(=o)c3‑8环烷基任选进一步被1至3个选自oh、f、cl、br、i、c1‑6烷基、c1‑6烷氧基、
‑
nr
q4
r
q5
或者=o的取代基所取
代;r
q1
选自c1‑6烷基、c1‑6烷氧基或者c6‑
10
芳基;r
q2
、r
q3
选自h或者c1‑6烷基;其中,r
q4
、r
q5
选自h、c1‑6烷基、
‑
nh(c=nr
q1
)nr
q2
r
q3
、
‑
s(=o)2nr
q2
r
q3
、
‑
c(=o)r
q1
或者
‑
c(=o)nr
q2
r
q3
,其中所述的c1‑6烷基任选进一步被1个或者多个选自oh、f、cl、br、i、c1‑6烷基、c1‑6烷氧基、c6‑
10
芳基、c5‑
10
杂芳基、c3‑8环烷基或者c3‑8杂环烷基的取代基所取代;或者r
q4
与r
q5
及n原子形成一个3至8元杂环,所述杂环可以含有1个或者多个选自n、o或者s的杂原子。
[0065]“大麻素残基”为大麻素类化合物除羟基的氢以外的部分,其通过羟基与母核化合物连接。
[0066]“氨基酸侧链”是指氨基酸分子中除了氨基和羧基之外的基团。
[0067]“药学上可接受的盐”或者“其药学上可接受的盐”是指本发明化合物保持游离酸或者游离碱的生物有效性和特性,且所述的游离酸通过与无毒的无机碱或者有机碱反应获得的盐,所述的游离碱通过与无毒的无机酸或者有机酸反应获得的盐。
[0068]“药物组合物”是指一种或多种本发明所述化合物、其立体异构体、溶剂化物、代谢产物、药学上可接受的盐或共晶和其它化学组分形成的混合物,其中,“其它化学组分”是指药学上可接受的载体、赋形剂和/或一种或多种其它治疗剂。
[0069]“载体”是指不会对生物体产生明显刺激且不会消除所给予化合物的生物活性和特性的材料。
[0070]“赋形剂”是指加入到药物组合物中以促进化合物给药的惰性物质。非限制性实施例包括碳酸钙、磷酸钙、糖、淀粉、纤维素衍生物(包括微晶纤维素)、明胶、植物油、聚乙二醇类、稀释剂、成粒剂、润滑剂、粘合剂和崩解剂。
[0071]“前药”是指可经体内代谢转化为具有生物活性的本发明化合物。本发明的前药通过修饰本发明化合物中的氨基或者羧基来制备,该修饰可以通过常规的操作或者在体内被除去,而得到母体化合物。当本发明的前药被施予哺乳动物个体时,前药被割裂形成游离的氨基或者羧基。
[0072]“共晶”是指活性药物成分(api)和共晶形成物(ccf)在氢键或其他非共价键的作用下结合而成的晶体,其中api和ccf的纯态在室温下均为固体,并且各组分间存在固定的化学计量比。共晶是一种多组分晶体,既包含两种中性固体之间形成的二元共晶,也包含中性固体与盐或溶剂化物形成的多元共晶。
[0073]“立体异构体”是指由分子中原子在空间上排列方式不同所产生的异构体,包括顺反异构体、对映异构体、非对映异构体和构象异构体。
[0074]“任选”或“任选地”或“选择性的”或“选择性地”是指随后所述的事件或状况可以但未必发生,该描述包括其中发生该事件或状况的情况及其中未发生的情况。例如,“选择性地被烷基取代的杂环基”是指该烷基可以但未必存在,该描述包括其中杂环基被烷基取代的情况,及其中杂环基未被烷基取代的情况。
具体实施例
[0075]
中间体1
[0076]
(1'r,2'r)
‑6‑
((tert
‑
butyldimethylsilyl)oxy)
‑
5'
‑
methyl
‑4‑
pentyl
‑
2'
‑
(prop
‑1‑
en
‑2‑
yl)
‑
1',2',3',4'
‑
tetrahydro
‑
[1,1'
‑
biphenyl]
‑2‑
ol
[0077]
(1'r,2'r)
‑6‑
((叔丁基二甲基甲硅烷基)氧基)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑
2
‑
基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑2‑
醇(中间体1)
[0078][0079]
向(1'r,2'r)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯基]
‑
2,6
‑
二醇1a(4.0g,12.8mmol)的二氯甲烷(34ml)溶液中加入咪唑(3.48g,51.2mmol)和叔丁基二甲基氯硅烷(2.3g,15.4mmol),室温下搅拌过夜。加入水(20ml)淬灭反应,水相用二氯甲烷萃取2次,合并有机相用无水硫酸钠干燥,过滤,滤液减压浓缩,残留物用柱层析分离(正己烷/二氯甲烷=9/1)纯化得到中间体1(3.44g),为无色油状物,反应产率75%。
[0080]1h nmr(300mhz,cdcl3)δ6.30(s,1h),6.19(s,1h),5.88(s,1h),5.52(s,1h),4.57(s,1h),4.47(s,1h),3.93(d,j=6.6hz,1h),2.51
–
2.35(m,3h),2.26
–
1.92(m,2h),1.88
–
1.70(m,5h),1.62(s,3h),1.51
‑
1.58(m,1h),1.39
–
1.04(m,5h),0.99(s,9h),0.88(t,3h),0.21(s,3h),0.17(s,3h)。
[0081]
中间体2
[0082]
(1'r,2'r)
‑
5'
‑
methyl
‑4‑
pentyl
‑
2'
‑
(prop
‑1‑
en
‑2‑
yl)
‑6‑
((triethylsilyl)oxy)
‑
1',2',3',4'
‑
tetrahy
‑
dro
‑
[1,1'
‑
biphenyl]
‑2‑
ol
[0083]
(1'r,2'r)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑6‑
((三乙基甲硅烷基)氧基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑2‑
醇(中间体2)
[0084][0085]
将(1'r,2'r)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑
2,6
‑
二醇1a(0.26g,0.84mmol)和咪唑(0.17g,2.5mmol)溶解于二氯甲烷(1.8ml)中,在0℃下加入三乙基氯硅烷(320mg,2.1mmol),40℃下反应三小时。tlc检测反应完全,停止反应。将溶剂旋干,硅胶柱色谱分离提纯(二氯甲烷/正己烷=1/19),得到标题化合物(1'r,
2'r)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑6‑
((三乙基甲硅烷基)氧基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑2‑
醇中间体2(254mg,72%产率,淡黄色油状物)。
[0086]1h nmr(300mhz,cdcl3)δ6.27(s,1h),6.16(s,1h),5.89(s,1h),5.53(s,1h),4.54(s,1h),4.42(s,1h),3.91(d,j=6.0hz,1h),2.44(t,j=7.5hz,3h),2.19
‑
2.04(m,2h),1.77
‑
1.64(m,5h),1.64(s,3h),1.57
‑
1.54(m,3h),1.35
‑
1.22(m,4h),0.98(t,j=7.8hz,9h),0.87(t,j=6.9hz,3h),0.80
–
0.68(m,6h)。
[0087]
中间体3
[0088]
di
‑
tert
‑
butyl(chloromethyl)phosphate
[0089]
磷酸二叔丁酯(氯甲基)(中间体3)
[0090][0091][0092]
向磷酸二丁酯钾3b(5g,20.1mmol)的水(20ml)溶液中加入碳酸氢钠(6.8g,80.5mmol)和四正丁基硫酸氢铵(0.68g,2.0mmol),加入二氯甲烷(10ml)后,反应体系在0℃下搅拌十分钟,加入氯甲基氯磺酸酯3a(1.63g,24.2mmol)的二氯甲烷(15ml)溶液,室温下搅拌过夜。分离有机相,有机相用无水硫酸钠干燥,过滤,滤液减压浓缩,残留物经过柱层析(乙酸乙酯/正己烷=1/3)分离得到磷酸二叔丁酯(氯甲基)中间体3(1.76g)为无色油状物质,反应产率34%。
[0093]1h nmr(300mhz,cdcl3):δ5.63(d,j=16.4hz,2h),1.50(s,18h)。
[0094]
31
p nmr(121mhz,cdcl3):δ
‑
11.92ppm。
[0095]
中间体4
[0096]
diallyl(chloromethyl)phosphate
[0097]
二烯丙基氯甲基磷酸酯(中间体4)
[0098][0099]
第一步:
[0100]
diallyl hydrogen phosphate
[0101]
磷酸二烯丙基酯(4b)
[0102]
将二氯磷酸甲酯4a(85%,6ml,50mmol)加入吡啶(50ml)中,0℃下搅拌十五分钟
后,加入丙烯醇(17ml,250mmol),室温搅拌过夜。加入碳酸氢钠(250ml)的饱和溶液并室温下继续搅拌2小时,加入乙醚(500ml)分液后,水相降温至0℃后加入盐酸水溶液(26ml)使体系ph=1,加入二氯甲烷(350ml)与正丁醇(150ml)混合溶液分液,有机相用无水硫酸钠干燥,过滤,滤液减压蒸馏得到磷酸二烯丙基酯4b(6.4g)为浅黄色油状物,反应产率71%。
[0103]1h nmr(300mhz,cdcl3):δ6.36(s,2h),6.01
‑
5.88(m,2h),5.37(dd,j=17.9,2.1hz,2h),5.25(d,j=10.4hz,2h),4.53(t,j=6.0hz,4h)。
[0104]
31
p nmr(121mhz,cdcl3):0.89ppm。
[0105]
lcms(esi)[m+1]
+
=178.88。
[0106]
第二步:
[0107]
diallyl(chloromethyl)phosphate
[0108]
二烯丙基氯甲基磷酸酯(中间体4)
[0109]
向磷酸二烯丙基酯4b(6g,33.7mmol)的二氯甲烷(50ml)和水(20ml)溶液中加入碳酸氢钠(11g,135mmol)和四正丁基硫酸氢铵(1.1g,3.37mmol),反应液15℃搅拌十分钟后加入氯甲基氯磺酸酯3a(8.3g,50mmol)的二氯甲烷(30ml)溶液。反应液室温搅拌过夜。分离有机相,有机相用无水硫酸钠干燥,过滤,滤液减压浓缩,残留物用柱层析(乙酸乙酯/正己烷=1/1)分离得到中间体4(2.56g),为无色油状物质,反应产率34%。
[0110]1h nmr(300mhz,cdcl3):δ6.02
‑
5.89(m,2h),5.69(d,j=15hz,2h),5.40(dt,j=17.1,1.4hz,2h),5.29(dd,j=10.5,1.2hz,2h),4.63
‑
4.58(m,4h)。
[0111]
31
p nmr(cdcl3):
‑
2.22ppm。
[0112]
实施例1
[0113]
diethyl((((1'r,2'r)
‑6‑
hydroxy
‑
5'
‑
methyl
‑4‑
pentyl
‑
2'
‑
(prop
‑1‑
en
‑2‑
yl)
‑
1',2',3',4'
‑
tetrahy
‑
dro
‑
[1,1'
‑
biphenyl]
‑2‑
yl)oxy)methyl)phosphate
[0114]
二乙基((((1'r,2'r)
‑6‑
hydroxy
‑
5'
‑
methyl
‑4‑
pentyl
‑
2'
‑
(prop
‑1‑
en
‑2‑
yl)
‑
1',2',3',4'
‑
四氢
‑
[[1,1'
‑
联苯]
‑2‑
基)氧基)甲基)磷酸酯(化合物1)
[0115]
tetraethyl((((1'r,2'r)
‑
5'
‑
methyl
‑4‑
pentyl
‑
2'
‑
(prop
‑1‑
en
‑2‑
yl)
‑
1',2',3',4'
‑
tetrahydro
‑
[1,1'
‑
biphenyl]
‑
2,6
‑
diyl)bis(oxy))bis(methylene))bis(phosphate)
[0116]
四乙基((((((1'r,2'r)
‑
5'
‑
methyl
‑4‑
pentyl
‑
2'
‑
(prop
‑1‑
en
‑2‑
yl)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑
2,6
‑
二基)双(氧基)双(亚甲基))双(磷酸酯)(化合物2)
[0117][0118]
在0℃下,向(1'r,2'r)
‑6‑
((叔丁基二甲基甲硅烷基)氧基)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑2‑
醇中间体1(2.1g,4.9mmol)的n,n
‑
二甲基甲酰胺(15ml)溶液中加入碳酸铯(3.5g,10.78mmol),nai(0.73g,4.9mmol)和氯甲基二乙基磷酸酯(1.0g,4.9mmol)。反应液55℃下搅拌过夜,反应液冷却至0℃,用水(40ml)淬灭,加入乙酸乙酯(20ml)萃取,有机层用水(40ml
×
2)洗涤,经na2so4干燥并浓缩。柱层析(正己烷/乙酸乙酯=10/1)分离得到二乙基((((((1'r,2'r)
‑6‑
羟基
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[[1,1'
‑
联苯]
‑2‑
基)氧基)甲基)磷酸酯化合物1(0.1213g)为棕色油状液体,产率5.2%;四乙基((((((1'r,2'r)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑
2,6
‑
二基)双(氧基)双(亚甲基))双(磷酸盐)化合物2(0.119g)为棕色油状液体,产率4%。
[0119]
化合物1:1hnmr(500mhz,cdcl3)δ6.51(d,1h),6.41(d,1h),6.04(s,1h),5.62
–
5.57(m,1h),5.50
‑
5.43(m,2h),4.48
‑
4.47(m,1h),4.31(s,1h),4.13
‑
4.06(m,4h),3.96(d,1h),2.48(t,3h),2.21
–
2.19(m,1h),2.10
‑
2.03(m,1h),1.77
‑
1.56(m,11h),1.31
–
1.28(m,9h),0.89
‑
0.84(m,3h)。
[0120]
31
p nmr(121mhz,cdcl3)δ
‑
2.47。
[0121]
化合物2:1h nmr(500mhz,cdcl3)δ6.68(s,2h),5.56
‑
5.43(m,5h),5.07(s,1h),4.38
‑
4.34(m,3h),4.10
‑
4.05(m,9h),3.89
‑
3.88(m,1h),2.81
‑
2.72(m,1h),2.49(t,2h),1.54
‑
1.27(m,9h),1.27
‑
1.24(m,16h),0.86
‑
0.81(m,3h)。
[0122]
31
p nmr(121mhz,cdcl3)δ
‑
2.54。
[0123]
实施例2
[0124]
di
‑
tert
‑
butyl((((1'r,2'r)
‑6‑
hydroxy
‑
5'
‑
methyl
‑4‑
pentyl
‑
2'
‑
(prop
‑1‑
en
‑2‑
yl)
‑
1',2',3',4'
‑
tetrahydro
‑
[1,1'
‑
biphenyl]
‑2‑
yl)oxy)methyl)phosphate
[0125]
二叔丁基((((1'r,2'r)
‑6‑
羟基
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',
3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑2‑
基)氧基)甲基)磷酸酯(化合物3)
[0126]
tetra
‑
tert
‑
butyl((((1'r,2'r)
‑
5'
‑
methyl
‑4‑
pentyl
‑
2'
‑
(prop
‑1‑
en
‑2‑
yl)
‑
1',2',3',4'
‑
tetrahydro
‑
[1,1'
‑
biphenyl]
‑
2,6
‑
diyl)bis(oxy))bis(methylene))bis(phosphate)
[0127]
四叔丁基((((1'r,2'r)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑
2,6
‑
二基)双(氧基)双(亚甲基))双(磷酸酯)(化合物4)
[0128][0129]
向(1'r,2'r)
‑6‑
((叔丁基二甲基甲硅烷基)氧基)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑2‑
醇中间体1(0.2g,0.466mmol)的n,n二甲基甲酰胺(4.0ml)溶液中加入碳酸铯(0.34g,1.03mmol)、碘化钠(70mg,0.466mmol)和磷酸二叔丁酯(氯甲基)中间体3(0.12g,0.466mmol),反应液升温至55℃并搅拌四小时。反应液降温至0℃后加入水(10ml)淬灭反应,加入乙酸乙酯(20ml
×
2)萃取反应,有机相无水硫酸钠干燥,过滤,滤液减压浓缩,残留物经过柱色谱(正己烷/乙酸乙酯=100/1
‑
10/1)分离得到二叔丁基((((1'r,2'r)
‑6‑
羟基
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑2‑
基)氧基)甲基)磷酸酯化合物3(48mg,为黄色油状物,产率19%);得到四叔丁基((((1'r,2'r)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑
2,6
‑
二基)双(氧基)双(亚甲基))双(磷酸酯)化合物4(98mg,为黄色油状物,产率28%)。
[0130]
化合物3:1h nmr(300mhz,dmso
‑
d6):δ9.04(s,1h),6.39(s,1h),6.30(s,1h),5.41(d,2h),5.08(s,1h),4.42(d,2h),3.86(d,1h),2.94(m,1h),2.40(t,2h),2.10
‑
1.90(m,1h),1.66
‑
1.43(m,10h),1.40(s,18h),1.33
‑
1.25(m,5h),0.86(t,3h)。
[0131]
lcms(esi),m/z,[m+1]
+
=537.5。
[0132]
化合物4:1h nmr(300mhz,dmso
‑
d6):δ6.69(s,1h),5.46(d,4h),5.09(s,1h),4.40
(s,2h),3.90(d,1h),2.89
‑
2.81(m,1h),2.12
‑
1.92(m,1h),1.67
‑
1.26(m,54h),0.86(t,3h)。
[0133]
lcms(esi),m/z,[m+1]
+
=759.8。
[0134]
实施例3
[0135]
二烯丙基((((1'r,2'r)
‑6‑
羟基
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[[1,1'
‑
联苯]
‑2‑
基)氧基)甲基)磷酸酯(化合物5)
[0136]
diallyl((((1'r,2'r)
‑6‑
hydroxy
‑
5'
‑
methyl
‑4‑
pentyl
‑
2'
‑
(prop
‑1‑
en
‑2‑
yl)
‑
1',2',3',4'
‑
tetrahydro
‑
[1,1'
‑
biphenyl]
‑2‑
yl)oxy)methyl)phosphate(化合物5)
[0137]
四烯丙基((((1'r,2'r)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑
2,6
‑
二基)双(氧基)双(亚甲基))双(磷酸酯)(化合物6)
[0138]
tetraallyl((((1'r,2'r)
‑
5'
‑
methyl
‑4‑
pentyl
‑
2'
‑
(prop
‑1‑
en
‑2‑
yl)
‑
1',2',3',4'
‑
tetrahydro
‑
[1,1'
‑
biphenyl]
‑
2,6
‑
diyl)bis(oxy))bis(methylene))bis(phosphate)(化合物6)
[0139][0140]
向((1'r,2'r)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑6‑
((三乙基甲硅烷基)氧基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑2‑
醇中间体2(3.2g,7.5mmol)的n,n二甲基甲酰胺(22ml)溶液中加入氢化钠(0.7g,16.5mmol)、碘化钠(1.2g,7.5mmol)和二烯丙基氯甲基磷酸酯中间体4(2.1g,8.9mmol),反应液升温至55℃并搅拌四小时。反应液降温至0℃后加入水(10ml)淬灭反应,加入乙酸乙酯(20ml
×
2)萃取反应,有机相无水硫酸钠干燥,过滤,滤液减压浓缩,残留物经过柱色谱(正己烷/乙酸乙酯=100/1
‑
10/1)分离得到二烯丙基((((1'r,2'r)
‑6‑
羟基
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[[1,1'
‑
联苯]
‑2‑
基)氧基)甲基)磷酸酯化合物5(252mg,黄色油状物,产率6.7%)和四烯丙基((((1'r,2'r)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑
2,6
‑
二基)双
(氧基)双(亚甲基))双(磷酸酯)化合物6(277mg,黄色油状物,产率5.3%)。
[0141]
化合物5:1h nmr(300mhz,cdcl3):δ6.98(s,1h),6.77(s,1h),5.98
‑
5.83(m,7h),5.70
‑
5.47(m,4h),4.63
‑
4.50(m,3h),4.45
–
4.41(m,2h),4.15
‑
4.08(m,1h),3.91(s,1h),2.77
‑
2.75(m,2h),2.54
‑
2.49(m,2h),2.15
‑
1.95(m,2h),1.77
‑
1.54(m,7h),1.31
‑
1.23(m,4h),0.87(t,3h)。
[0142]
lcms(esi),m/z,[m+1]
+
=505.4。
[0143]
化合物6:1h nmr(300mhz,cdcl3):δ6.96(s,1h),6.92(s,1h),5.93
‑
5.81(m,7h),5.73
‑
5.42(m,6h),4.67
‑
4.47(m,10h),4.41
‑
4.35(m,6h),3.93
‑
3.88(m,1h),2.78
‑
2.75(m,1h),2.52
‑
2.48(m,2h),2.16
‑
1.94(m,2h),1.75
‑
1.51(m,7h),1.30
‑
1.224(m,4h),0.87(t,3h)。
[0144]
lcms(esi),m/z,[m+1]
+
=695.7。
[0145]
实施例4
[0146]
(((1'r,2'r)
‑6‑
hydroxy
‑
5'
‑
methyl
‑4‑
pentyl
‑
2'
‑
(prop
‑1‑
en
‑2‑
yl)
‑
1',2',3',4'
‑
tetrahydro
‑
[1,1'
‑
biphenyl]
‑2‑
yl)oxy)methyl dihydrogen phosphate
[0147]
(((1'r,2'r)
‑6‑
羟基
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[[1,1'
‑
联苯]
‑2‑
基)氧基)甲基磷酸二氢(化合物7)
[0148][0149]
向二烯丙基(((1'r,2'r)
‑6‑
羟基
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[[1,1'
‑
联苯]
‑2‑
基)氧基)甲基)磷酸酯化合物5(200mg,0.40mmol)的二氯甲烷(10ml)溶液中加入四(三苯基膦)钯(115mg,0.10mmol)和吗啉(348mg,4.0mmol),在室温下反应30分钟。tlc监测至反应结束后加入水(10ml)淬灭反应,加入二氯甲烷(20ml
×
2)萃取反应,有机相无水硫酸钠干燥,过滤,滤液减压浓缩,残留物经过柱色谱(二氯甲烷/甲醇=100/1
‑
10/1)分离得到(((1'r,2'r)
‑6‑
羟基
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[[1,1'
‑
联苯]
‑2‑
基)氧基)甲基磷酸二氢化合物7(33mg),黄色油状物,产率19.5%。
[0150]1h nmr(300mhz,dmso
‑
d6):δ8.14(s,2h),7.10(s,1h),6.95(s,1h),6.74(s,1h),
5.98
‑
5.83(m,3h),4.61
‑
4.52(m,2h),4.13
‑
4.11(m,1h),2.77
‑
2.75(m,1h),2.54
‑
2.49(m,2h),2.05
‑
1.95(m,2h),1.77
‑
1.54(m,9h),1.31
‑
1.23(m,5h),0.87(t,3h)。
[0151]
lcms(esi),m/z,[m+1]
+
=425.6。
[0152]
实施例5
[0153]
(((1'r,2'r)
‑
5'
‑
methyl
‑4‑
pentyl
‑
2'
‑
(prop
‑1‑
en
‑2‑
yl)
‑
1',2',3',4'
‑
tetrahydro
‑
[1,1'
‑
biphenyl]
‑
2,6
‑
diyl)bis(oxy))bis(methylene)bis(dihydrogen phosphate)
[0154]
(((1'r,2'r)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑
2,6
‑
二基)双(氧基)双(亚甲基)双(磷酸二氢)(化合物8)
[0155][0156]
采用化合物7的合成方法制备得到目标产物(((1'r,2'r)
‑
5'
‑
甲基
‑4‑
戊基
‑
2'
‑
(丙
‑1‑
烯
‑2‑
基)
‑
1',2',3',4'
‑
四氢
‑
[1,1'
‑
联苯]
‑
2,6
‑
二基)双(氧基)双(亚甲基)双(磷酸二氢)(化合物8)(24mg)为黄色油状物,反应13.8%。
[0157]1h nmr(300mhz,dmso
‑
d6):δ8.16
‑
8.13(m,4h),6.97(s,1h),6.78(s,1h),5.98
‑
5.83(m,3h),4.62
‑
4.52(m,4h),4.12
‑
4.09(m,1h),2.78
‑
2.74(m,1h),2.57
‑
2.54(m,2h),2.15
‑
2.08(m,2h),1.80
‑
1.52(m,9h),1.30
‑
1.25(m,5h),0.87(t,3h)。
[0158]
lcms(esi),m/z,[m+1]
+
=535.9。
[0159]
大鼠药代动力学
[0160]
取健康成年sd大鼠,禁食过夜(自由饮水)后,给予灌胃(p.o.)给药(10mg/kg)。于给药后30min、1h、8h从颈静脉丛采血0.1ml。所有血样使用k2edta抗凝,随后在5℃、3500rpm离心10min分离血浆,于
‑
20℃保存待测。建立lc/ms/ms法测定血浆中的原形药物浓度(ng/
ml)。
[0161]
实验结果表明,本发明化合物经口服灌胃后,可在血浆中检测到原型药物浓度,表明本化合物具有口服吸收特性,且能在体内快速转化为原型药,并且具有比原型药更好的药代动力学特性。
[0162]
本发明说明书对具体实施方案进行了详细描述,本领域技术人员应认识到,上述实施方案是示例性的,不能理解为对本发明的限制,对于本领域技术人员来说,在不脱离本发明原理的前提下,通过对本发明进行若干改进和修饰,这些改进和修饰获得技术方案也落在本发明的权利要求书的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1