一种应用于钙离子成像的斑马鱼心脏特异标记品系的建立
1.本发明属于遗传学和生物技术领域,特别是公开了一种应用于钙离子成像的斑马鱼心脏特异标记品系的构建方法。
背景技术:
2.钙离子成像技术(calcium imaging)是指利用钙离子指示剂监测组织内钙离子浓度的方法。想要对生物体内钙离子的动态变化进行有效的检测,钙离子指示剂的选择显得尤为重要。钙离子荧光指示剂在未结合钙离子前几乎无荧光,与钙离子结合后,荧光强度显著增强。利用这一原理,可以通过指示剂的信号强弱来观察细胞内钙离子浓度水平的变化。目前使用的钙离子指示剂有化学性钙离子指示剂(chemical indicators)和基因编码钙离子指示剂(genetically
‑
encoded ca
2+ indicators,gecis)两类,而gecis由于其高灵敏度、高亮度和动态荧光范围等优点,已成为应用最为广泛的钙离子检测工具之一,在研究生物体不同组织、系统的生理功能和发育机制方面做出了重要贡献;gcamps是使用最广泛的gecis之一。gcamps是单个绿色荧光蛋白(gfp)、钙调蛋白(cam)和平滑肌细胞肌球蛋白轻链激酶片段m13融合的产物。gcamps具有一个突出的优点,它可以通过特异的启动子和定位序列实现在特定类型细胞或亚细胞结构表达,从而检测目标细胞或亚细胞结构内的钙离子信号的变化,记录生理条件下或给予外源性刺激下不同细胞的反应方式、信号的起源和传递。应用于钙离子成像的斑马鱼心脏标记品系的建立,是利用crispr/cas9基因编辑技术将gcamp5g敲入野生型斑马鱼myl7基因7号外显子上,通过体式荧光显微镜、pcr、测序鉴定斑马鱼基因型,从而建立的一种新的斑马鱼心脏标记品系。这种品系可以研究斑马鱼心脏传导系统的发育,根据荧光反应的变化分析某些传导缺陷引起的心律失常的成因和机制。另外,此品系的建立对于研究其他钙离子参与的疾病、分析疾病发生发展的基础和病理生理机制提供了良好的动物模型,也为探讨药物的生理和药理学机制、评价新药的药理作用和毒性提供了有效的理论依据,在医学上具有十分重要的意义。
技术实现要素:
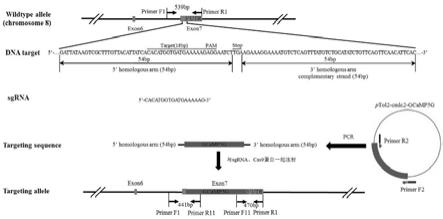
3.本发明的目的在于提供一种应用于钙离子成像的斑马鱼心脏特异标记品系。斑马鱼与人类心脏发育过程中的基因、信号通路有高度同源性,该模型能够帮助我们研究人类心脏疾病病理生理机制和进行心脏疾病治疗药物筛选的理想模型;本发明的另一目的在于提供上述斑马鱼品系的构建方法;本发明所采用的技术方案,具体按照以下步骤实施:步骤1、基于crispr/cas9技术构建针对野生型斑马鱼myl7基因7号外显子的特异性sgrna,所述sgrna的基因序列如primerf所示,待敲入的编码钙离子浓度指示剂的gcamp5g序列如图1所示;步骤2、合成一对5’c6氨基修饰引物,5’端修饰引物为myl7基因7号外显子编码区终止密码子前的54 bp及gcamp5g的5’端22 bp,3’端修饰引物为myl7基因7号外显子编码区
终止密码子后的54 bp及gcamp5g的3’端24 bp,引物序列如primerf2、primerr2所示;步骤3、合成两对检测引物:f1、r1引物用以检测靶位点是否有效果,f11、r11用以检测外源dna序列是否正确插入,两边同源臂是否打靶正确;步骤4、以质粒“ptol2
‑
cmlc2
‑
gcamp5g”dna为模板,用5’c6氨基修饰的引物进行pcr扩增,获得含有myl7同源臂的gcamp5g序列,即gcamp5g基因敲入序列;步骤5、将步骤1中有活性的sgrna、步骤4中的gcamp5g基因敲入序列和cas9蛋白共同注射进入斑马鱼受精卵中,获得f0代斑马鱼;步骤6、将步骤5中f0代培养48 h,在体式荧光显微镜下筛选出阳性f0代斑马鱼;步骤7、将步骤6中性成熟的阳性f0代斑马鱼与野生型斑马鱼交配繁殖,获得f1代杂合子斑马鱼,在体式荧光显微镜下选出可遗传的f1代斑马鱼,再通过pcr、sanger测序鉴定基因型;步骤8、将步骤7获得的性成熟f1代杂合子斑马鱼近交获得f2代斑马鱼,在体式荧光显微镜下镜筛选出f2代纯合子斑马鱼,即为本发明构建的一种应用于钙离子成像的斑马鱼心脏特异标记品系;2.根据权利要求1所述的一种应用于钙离子成像的斑马鱼心脏特异标记品系的构建方法,其特征在于,所述步骤5中sgrna的终浓度为40~60 ng/μl,打靶载体的终浓度为20~100 ng/μl,cas9蛋白的注射浓度为700 ng/μl。
附图说明
4.图1为本发明使用的gcamp5g蛋白的基因编码序列图;图2为本发明使用的ptol2
‑
cmlc2
‑
gcamp5g质粒图;图3为本发明crispr/cas9打靶系统的流程图;图4为本发明验证gcamp5g敲入效果的测序峰图;图5为本发明阳性f1代斑马鱼的电泳结果图;图6为本发明阳性f1代斑马鱼5’端的序列比对图;图7为本发明阳性f1代斑马鱼3’端的序列比对图;图8为本发明阳性f2代斑马鱼荧光图;图9为本发明f2代斑马鱼三引物法的电泳结果图。
具体实施方式
5.下面结合附图和具体的实施例,对本发明作详细描述;实施例1:1)分别设计crispr/cas9基因敲入靶位点和检测引物a、在national center for biotechnology information(ncbi)上查询斑马鱼myl7基因的基因组和mrna序列,根据crispr/cas9基因编辑原理和myl7基因组序列的结构特点,选择myl7基因的打靶敲入位点(f序列中下划线所示);设计合成特异性靶位点pcr引物如下:f(靶位点正向引物):tgtaatacgactcactataggcacatggtgatgaaaaaggttttagagctagaaatagc
r(靶位点反向引物):aagcaccgactcggtgccactb、在national center for biotechnology information(ncbi)上查询斑马鱼myl7基因的基因组mrna序列,根据crispr靶位点上下游约300 bp的基因组区域,利用primer 5.0软件设计引物f1、r1用以检测靶位点是否有效果;pcr检测引物:f1:5
’‑
cccttttcaccagactggctac
‑3’
r1:5
’‑
agaccaagcacagcaactgagt
‑3’
c、利用primer 5.0软件分别在gcamp5g序列5’端和3’端约300 bp的区域,设计引物f11、r11,结合靶位点检测引物f1、r1检测f1代阳性斑马鱼的序列插入情况;pcr检测引物:f11:5
’‑
cacgtgatgacaaaccttgg
‑3’
r11:5
’‑
gttgtggcggatcttgaagt
‑3’
2)构建sgrna表达载体以及特异性sgrna体外合成a、首先将sgrna骨架克隆到p42250载体上;b、特异性sgrna体外合成用bsaⅰ限制性内切酶线性化此质粒;酶切反应总体积为20 μl,体系如下:混匀后于37℃水浴,酶切4 h以上;c、以线性化的p42250载体为模板,通过下面特异性引物进行pcr扩增,获得用于特异性sgrna合成的双链dna;正向特异性靶位点引物f:t7启动子19 bp + 靶序列18 bp + sgrna上游骨架20 bp;反向引物r:21 bpsgrna下游骨架;50 μl高保真pcr反应体系如下:
95℃预变性5 min,95℃变性30 sec,60℃退火30 sec,72℃延伸30 sec,72℃延伸8 min,35个循环。待反应结束后,取1μl样品点样于1.2%琼脂糖凝胶,进行电泳检测,凝胶成像系统拍摄电泳结果;d、检测确定电泳条带正确之后,进行琼脂糖凝胶dna回收,纯化回收pcr产物;e、测定纯化的dna浓度,再以此dna为模板,用20 μl体系进行体外转录,合成特异性sgrna;转录实验中所用tip头、ep管均为rnase
‑
free产品,具体操作如下:20 μl体外转录反应体系:将反应物全部加入1.5 ml rnase
‑
free的ep管中,混匀之后,于37℃水浴2.5 h;然后向转录体系中加入1 μl turbo dnase,放置于37℃水浴锅中反应30 min,用以消化dna模板;再取1μl转录终产物,即sgrna进行琼脂糖凝胶电泳,以检测转录效率;f、特异性sgrna的纯化用rneasy mini kit试剂盒纯化转录成功的sgrna,保存于
‑
80℃;吸取纯化后的sgrna溶液1 μl进行浓度测定;3)设计和合成敲入序列
a、在national center for biotechnology information(ncbi)上查询斑马鱼基因组myl7基因的7号外显子(即最后一个外显子)编码序列终止密码子附近的序列,根据该序列上的打靶位点分别设计5’和3’端的同源臂(引物序列中大写字母所示),并分别将同源臂与gcamp5g基因编码序列对应的5’和3’端前20 bp(引物序列中小写字母所示)一起合成5’c6氨基修饰引物,用于pcr扩增ptol2
‑
cmlc2
‑
gcamp5g载体上的gcamp5g序列;pcr引物如下:f2(正向引物):5
’→3’
gattataagtcgctttgttacattatcacacatggtgatgaaaaagaagaatctatgggttctcatcatcatcatcr2(反向引物):5
’→3’
gtgaatgttgaactgaacagatatgcagacataaactgagacattttcctttcttcacttcgctgtcatcatttgtacb、以ptol2
‑
cmlc2
‑
gcamp5g载体为模板,通过5’c6氨基修饰引物进行pcr扩增,获得打靶载体;正向5’c6氨基修饰引物f2:myl7基因54 bp + gcamp5g序列22 bp;反向5’c6氨基修饰引物r2:myl7基因54 bp + gcamp5g序列24 bp;50 μl高保真pcr反应体系如下:95℃预变性5 min,95℃变性30 sec,60℃退火30 sec,72℃延伸2 min,72℃延伸8 min,35个循环。待反应结束后,取1μl样品点样于1.2%琼脂糖凝胶,进行电泳检测,凝胶成像系统拍摄电泳结果;c、检测确定电泳条带正确之后,进行琼脂糖凝胶dna回收,纯化回收pcr产物;d、测定纯化的dna浓度,此纯化产物即为打靶载体,将产物保存于
‑
20℃;4)斑马鱼胚胎的显微注射在受精后30 min 之内,用吸管吸取胚胎转移至用琼脂糖制作的显微注射专用培养皿中,在进行显微注射之前,将sgrna、打靶载体和cas9蛋白配成混合液充分混匀,其中,sgrna的终浓度为40~60 ng/μl,打靶载体的终浓度为20~100 ng/μl,cas9蛋白的注射终浓度为700 ng/μl,注射约1.8 nl混合液于一细胞期的受精卵内;注射后的受精卵放置于e3水(5 mmol/l nacl,0.17 mmol/l kcl,0.33 mmol/l cacl2,0.33 mmol/l mgso4)中,28℃培
养箱孵化48 h;在体式荧光显微镜下观察胚胎,筛选带荧光的胚胎;5)sanger测序检测靶位点的有效性对斑马鱼胚胎进行显微注射之后,随机挑选早期胚胎,检测myl7基因是否存在突变,可以提前确认选择的靶位点是否有效,显微注射操作是否规范;a、提取斑马鱼基因组斑马鱼胚胎受精50小时后(50 hpf),分别收集野生型(作对照)和注射后胚胎于1.5 ml ep管中,每管5颗胚胎,按照下述方法提取基因组dna,具体步骤如下:(1)向装有胚胎的ep管中加入100 μl细胞裂解液(0.2 mol/l nacl,5 mmol/l edta,0.1 mol/l tris
‑
hcl,0.2%sds)和1 μl蛋白酶k(10 mg/ml),放置于65℃恒温箱中裂解过夜;(2)裂解完成后,放在振荡器上充分震荡,加入等体积预冷的异丙醇,充分颠倒混匀,于4℃条件下,12000 rpm离心10 min,弃掉上清;(3)加入75%乙醇200 μl,于4℃条件下,12000 rpm离心5 min,弃掉上清,室温干燥8~10min;(4)加入10 μl去离子水,充分混匀,即得斑马鱼基因组dna;b、pcr扩增提取基因组dna后,使用pcr检测引物f1、r1进行扩增;20 μl常规pcr反应体系如下:94℃预变性5 min,94℃变性30 sec,60℃退火30 sec,72℃延伸30 sec,72℃延伸8 min,30个循环。待反应结束后,取3μl样品点样于1.2%琼脂糖凝胶,进行电泳检测,凝胶成像系统拍摄电泳结果;c、将剩余pcr产物进行sanger测序,由测序的峰图来初步获得插入或缺失的信息;6)筛选可遗传的杂合子斑马鱼f1代a、将性成熟的阳性f0代斑马鱼分别与野生型斑马鱼杂交得到f1代胚胎,置于28℃培养48 h,在体式荧光显微镜下筛选可遗传的阳性f1代斑马鱼,此阳性f1代为杂合子;b、将阳性f1代剪尾,单独提取基因组,使用pcr检测引物f1、r11进行扩增,得到dna片段a,使用pcr检测引物f11、r1进行扩增,得到dna片段b;20 μl常规pcr反应体系如下:
94℃预变性5 min,94℃变性30 sec,60℃退火30 sec,72℃延伸30 sec,72℃延伸8 min,30个循环。待反应结束后,取3μl样品点样于1.2%琼脂糖凝胶,进行电泳检测,凝胶成像系统拍摄电泳结果;c、阳性f1代dna片段a大小为441bp,dna片段b大小为470bp。电泳图显示dna片段b与预计大小不一致,因此将剩余pcr产物进行sanger测序,由序列比对来检测验证外源dna序列是否正确插入,两边同源臂是否打靶正确;7)获得可遗传的纯合子斑马鱼f2代a、将性成熟的阳性f1代斑马鱼雌雄近交得到f2代胚胎,置于28℃培养48 h,在体式荧光显微镜下筛选阳性f2代斑马鱼;b、由于筛选到的阳性f2代斑马鱼可能是杂合子也可能是纯合子,可以通过对每条阳性f2代斑马鱼成鱼进行剪尾鉴定,筛选出纯合子阳性f2代斑马鱼;c、使用三引物法鉴定f2代斑马鱼。首先将f2代斑马鱼剪尾,单独提取基因组,然后使用pcr检测引物f1、r1、r11进行扩增;20 μl常规pcr反应体系如下:94℃预变性5 min,94℃变性30 sec,60℃退火30 sec,72℃延伸30 sec,72℃延伸8 min,30个循环。待反应结束后,取3μl样品点样于1.2%琼脂糖凝胶,进行电泳检测,凝胶成像系统拍摄电泳结果;d、根据凝胶成像图鉴定f2代斑马鱼的基因型根据三引物法可以判断:野生型只扩增出539 bp条带,杂合子扩增539 bp和441 bp两条条带,纯合子只扩增441 bp条带;图1为gcamp5g蛋白的基因编码序列图;图2为ptol2
‑
cmlc2
‑
gcamp5g质粒图;图3为
crispr/cas9打靶系统的流程图;图4为验证gcamp5g敲入效果的测序峰图,靶位点序列下游可以观察到双峰,说明靶位点有效果;图5为阳性f1代斑马鱼的电泳结果图,阳性f1代dna片段a大小为441bp,dna片段b大小为539 bp;图6为本发明阳性f1代斑马鱼5’端的序列比对图,5’端比对结果显示靶位点下游含有gcamp5g序列,与预计的敲入序列一致;图7为本发明阳性f1代斑马鱼3’端的序列比对图,3’端比对结果显示敲入额外的66 bp,此序列包含3’端同源臂;图8为阳性f2代斑马鱼荧光图,心脏部位尤其是心室有明显的荧光;图9为本发明f2代斑马鱼三引物法的电泳结果图,野生型(1、2)只有一条539 bp的电泳条带,杂合子(3、4)有一条539 bp和一条441 bp的电泳条带,纯合子(5)只有一条441 bp的电泳条带;以上所述,仅是本发明的较佳实施例,并非对本发明做任何形式上的限制,凡是依据本发明的技术实质上对以上实施例所作的任何简单修改、等同变化,均落入本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1