植物免疫激活蛋白PsAEP1及其应用
12protein is a major virulence factor during soybean infection and is recognized as a pamp.plant cell[j],27:2057
‑
2072.
[0011]
petutschnig e k,stolze m,lipka u,et al.2014.a novel arabidopsis chitin elicitor receptor kinase 1(cerk1)mutant with enhanced pathogen
‑
induced cell death and altered receptor processing.new phytol[j],204:955
‑
967.
[0012]
zipfel c 2014.plant pattern
‑
recognition receptors.trends immunol[j],35:345
‑
351.
技术实现要素:
[0013]
本发明的目的之一在于提供一种植物免疫激活蛋白psaep1。
[0014]
本发明的目的之二在于提供一种编码上述植物免疫激活蛋白psaep1的基因序列。
[0015]
本发明的目的之三在于提供一种含有上述植物免疫激活蛋白psaep1基因的重组表达载体。
[0016]
本发明的内容之四在于提供上述植物免疫激活蛋白psaep1及其编码基因的应用。
[0017]
本发明内容具体详述如下:
[0018]
本发明提供一种基因psaep1,该基因来源于大豆疫霉菌,氨基酸序列如seq id no.2所示或将seq id no.2的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且与烟草疫霉病抗性相关的由seq id no.2衍生的蛋白质。
[0019]
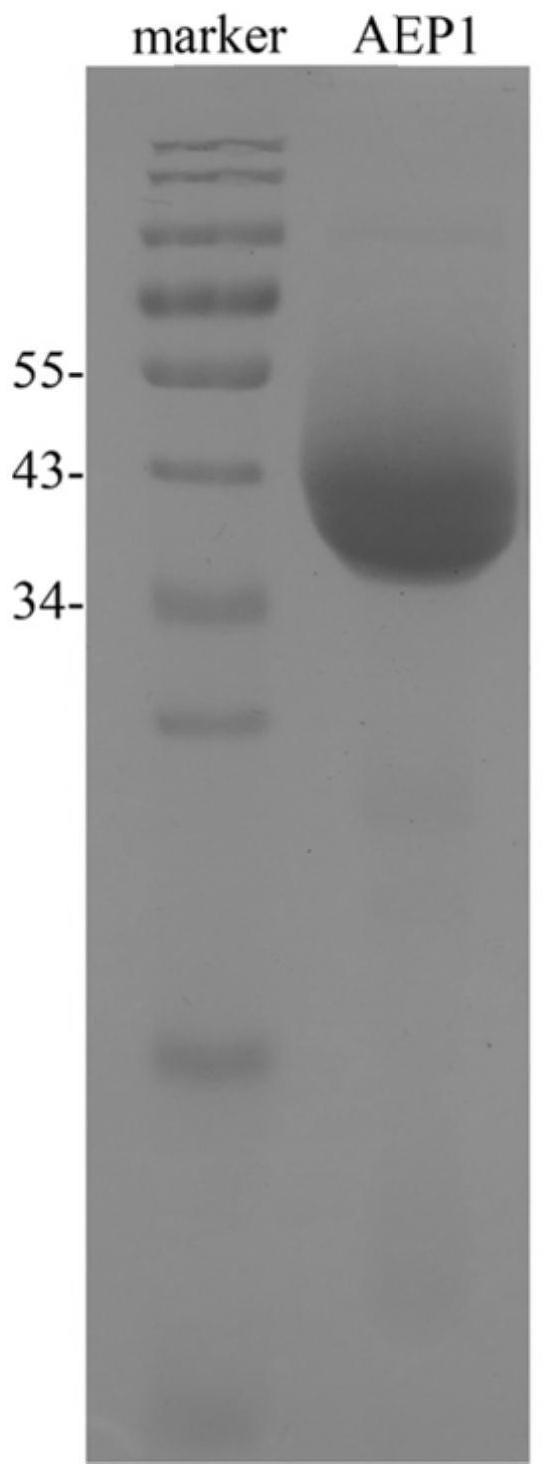
本发明提供上述植物免疫激活蛋白psaep1的编码基因。
[0020]
作为一种优选技术方案,所述的编码基因为如下(1)或(2):
[0021]
(1)如seq id no.1所示的核苷酸序列;
[0022]
(2)与seq id no.1至少具有70%以上的同源性且编码蛋白psaep1的核苷酸序列;优选为与seq id no.1至少具有80%以上的同源性且编码蛋白psaep1的核苷酸序列;进一步优选为与seq id no.1至少具有85%以上的同源性且编码蛋白psaep1的核苷酸序列;更进一步优选为与seq id no.1至少具有90%以上的同源性且编码蛋白psaep1的核苷酸序列;最优选为与seq id no.1至少具有95%以上的同源性且编码蛋白psaep1的核苷酸序列。
[0023]
本发明还提供一种包含上述编码基因的重组表达载体、表达盒、转基因细胞系或重组菌。优选的,所述的重组载体为在ppic9k中插入psaep1编码基因得到的真核表达载体。该重组载体可用于毕赤酵母km71表达。得到分子量约34kd的融合表达蛋白(psaep1
‑
his),能够诱导烟草产生抗性反应,提高植物免疫力。减轻烟草疫霉菌对烟草的危害。
[0024]
上述的植物免疫激活蛋白psaep1在诱导植物防御反应及提高植物抗病性中的应用。优选的,所述植物为烟草、马铃薯、辣椒、茄子或番茄。进一步优选的,所述的抗病性为对烟草疫霉菌的抗性。
[0025]
本发明还提供一种提高植物对疫霉菌抗性的方法,是将本发明所述的植物免疫激活蛋白psaep1喷洒到植物表面或者注入到植物叶片中。
[0026]
在一些实施例中,所述的植物为烟草、马铃薯、辣椒、茄子或番茄。
[0027]
利用本发明的psaep1氨基酸序列,可以设计和人工合成密码子优化的有利于在毕赤酵母中表达的核酸序列。
[0028]
本发明的有益效果
[0029]
该植物免疫激活蛋白可显著提高植物的抗病性,使用浓度低,见效快,作用时间长。psaep1激活植物免疫系统,提高植物抗性,为防治农业生产过程中的植物病害提供了新的途径和方法。
附图说明
[0030]
图1毕赤酵母菌株km71表达psaep1蛋白,蛋白纯化后sds
‑
page检测,使用染色剂为考马斯亮蓝;
[0031]
图2植物免疫激活蛋白psaep1诱导烟草活性氧迸发;
[0032]
图3植物免疫激活蛋白psaep1诱导马铃薯、辣椒、茄子或番茄活性氧迸发;
[0033]
图4植物免疫激活蛋白psaep1诱导烟草抗病相关基因的表达;
[0034]
图5植物免疫激活蛋白psaep1诱导烟草抗烟草疫霉菌的效果图;
[0035]
图6植物免疫激活蛋白psaep1诱导烟草抗烟草疫霉菌的生物量统计。
具体实施方式
[0036]
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。本发明实施例所涉及引物由南京金斯瑞生物科技有限公司合成。
[0037]
微生物信息:大豆疫霉菌菌株p6497馈赠于美国俄勒冈大学brett tyler教授。
[0038]
实施例1植物免疫激活蛋白psaep1的分离与鉴定
[0039]
诱导大豆疫霉菌p6497产游动孢子,将游动孢子接种大豆叶片,侵染10小时后,抽取大豆叶片胞间液,并将侵染胞间液送至上海新生命公司进行蛋白质组测序,结果比对大豆疫霉基因组数据,鉴定到胞间液中的大豆疫霉分泌的候选蛋白psaep1,其氨基酸序列如seq id no.2所示。
[0040]
实施例2植物免疫激活蛋白psaep1编码基因的克隆
[0041]
(1)总rna提取:
[0042]
以液体培养的大豆疫霉菌株p6497的菌丝为材料,总rna的抽提采用omega公司rna提取试剂,按照说明操作,用分光光度计检测rna含量和质量。
[0043]
(2)反转录生成第一链:
[0044]
取0.7μg rna作模板,根据takara公司primescript反转录酶配套试剂使用说明进行cdna合成,定容至20μl反应。取适量的反转录产物用于随后的基因克隆pcr。
[0045]
(3)以cdna第一链为rt
‑
pcr模板,常规方法做pcr,扩增psaep1编码基因的全长:
[0046]
pcr引物扩增序列:
[0047]
上游引物:seq id no.3
[0048]
(5
’‑
cagcaccagctagcatcgatggtgttctccatc
‑3’
)
[0049]
下游引物:seq id no.4
[0050]
(5
’‑
aatctctagaggatccccggccgtggtgaccga
‑3’
)
[0051]
50μl反应体系为,其中5
×
buffer 10μl,2.5mm dntp 4μl,takara primerstartaq酶0.5μl,模板cdna 1μl,加水至50μl;pcr扩增程序为98℃预变性3min,98℃变性15秒,58℃
退火15秒,72℃延伸1min,循环35次,最后72℃延伸10min;琼脂糖凝胶上进行电泳分离,溴化乙锭(eb)染色照相,记录结果,并切胶回收psaep1编码基因的pcr产物。用agarose gel dnapurification kit(takara)对电泳条带进行回收。切胶回收的psaep1编码基因的pcr产物根据cloneexpress ii one step cloning kit(vazyme)按照说明操作连接到smai酶切的pgr107::3ha载体(载体购自于biovector质粒载体菌种细胞基因保藏中心)上得到pgr107::psaep1
‑
3ha质粒,转化大肠杆菌感受态细胞jm109,涂lb(含卡纳50μg/ml)平板,37℃培养16h后菌落pcr验证挑取三个阳性克隆按照质粒提取试剂盒操作(takara)提取质粒,送南京金斯瑞公司测序,测序所得序列应与seq id no.1序列一致。
[0052]
实施例3植物免疫激活蛋白psaep1的真核表达和纯化。
[0053]
(1)真核表达载体的构建
[0054]
psaep1按照seq id no.1所示序列在生工生物股份有限公司通过人工合成。
[0055]
人工合成的psaep1编码基因根据cloneexpress ii one step cloning kit(vazyme)按照说明操作连接到snab1酶切的ppic9k载体上得到ppic9k::psaep1
‑
6his质粒,转化大肠杆菌感受态细胞jm109,涂lb(含卡纳50μg/ml)平板,37℃培养16h后菌落pcr验证挑取三个阳性克隆按照质粒提取试剂盒操作(takara)提取质粒。
[0056]
(2)酵母电击转化
[0057]
酵母蛋白表达过程所用培养基:ypd 1l:10g酵母浸出物,20g蛋白胨,20g琼脂粉溶于1l水。bmgy(buffered glycerol
‑
complex medium)/bmmy(buffered methanol
‑
complex medium)1l:1%酵母浸出物,2%蛋白胨,100mm磷酸钾ph 6.0,1.34%ynb,4
×
10 5%生物素,1%甘油或0.5%甲醇。溶解10g酵母浸出物,20g蛋白胨于700ml水中,灭菌20min,冷至室温,加入下列混合液:100ml 1m磷酸钾缓冲液ph 6.0;100ml 10
×
ynb;2ml 500
×
biotin;100ml 10
×
gy;制bmmy时,加入100ml 10
×
m取代10
×
gy培养基灭菌后存于4度,可放2个月。贮存液:10
×
ynb(13.4%酵母氮源碱ynb,含硫酸铵不含氨基酸)溶解134gynb于1000ml水中,过滤除菌,加热至ynb完全溶解,存于4℃,或用34g ynb(不含硫酸铵不含氨基酸),100g硫酸铵进行配制,可放1年。500
×
生物素(0.02%):溶解20mg生物素于100ml水中,过滤除菌,放于4℃,可放1年;10
×
m(5%甲醇):混合5ml甲醇与95ml水,过滤除菌存于4℃,可放2个月;10
×
gy(10%甘油);混合100ml甘油与900ml水,过滤或高压灭菌,室温放置,可存放1年以上;1m磷酸钾缓冲液ph 6.0;132ml 1m k2hpo4,868ml 1m kh2po4,调整ph值为6.0
±
0.1(如果需调ph值,用磷酸或koh)。过滤或高压灭菌,室温下可放1年以上。
[0058]
酵母电击感受态制备及电击转化
[0059]
毕赤酵母感受态制备:将适量毕赤酵母菌株km71菌株(购自生工生物工程股份有限公司,产品货号为b528425)接种于10ml ypd培养基中,30℃摇床过夜。以1%接种量转接100ml ypd液体培养基,30℃摇床培养至od=1.3
‑
1.5。4℃离心5000rpm,5min,弃上清,用冰预冷无菌水将菌体重悬。4℃离心5000rpm,5min,弃上清,用冰预冷无菌水将菌体重悬。4℃离心5000rpm,5min,弃上清。再用1m的山梨醇洗涤3次,溶于200ul 1m的冰预冷的山梨醇,以备转化。
[0060]
毕赤酵母的转化:在80μl酵母感受态细胞中加入用合适酶切位点线性化的质粒10μl(含量越高越好)冰上放置5min,迅速加入0.2cm电击杯中(冰预冷),电击,迅速加入1ml山梨醇,30℃水浴2h后涂于his缺陷板。
[0061]
酵母菌落验证:用pcr的方法检测重组菌株表型,平板上的菌落长到肉眼可见时(约2天),将除了模板之外的其它pcr反应液的组分准备好,并分装。引物最好使用一条载体上的通用引物,一条使用基因的特异性引物,挑取菌落,先在另一his缺陷平板上点一下,然后再在pcr管中涮下余下酵母菌,对pcr管和his平板上的编号要对应,pcr扩增,1%agarose电泳,对于pcr扩增显现特异性条带的克隆,可以进行后续培养表达蛋白。
[0062]
(3)酵母表达蛋白与纯化
[0063]
酵母bmmy培养4天后,收集菌液,8000rpm离心30min,收集上清液,并根据上清液体积加入硫酸铵粉末(每1l上清液加入475g),硫酸铵溶解后4℃沉淀24小时;8000rpm离心1小时,收集沉淀,随后用灭菌超纯水溶解沉淀(每1l用50ml水溶解),溶解液过0.45μm滤膜,随后滤出液上柱进行蛋白纯化。纯化步骤:使用蛋白自动纯化仪akta
tm avant 25(ge healthcare),先过脱盐柱,脱盐收集液过镍柱,咪唑洗脱后再次脱盐,随后测浓度和进行sds
‑
page电泳。结果:获得纯化后的植物免疫激活蛋白psaep1真核表达蛋白,结果如图1.
[0064]
实施例4植物免疫激活蛋白psaep1在烟草上引起的防卫反应
[0065]
(1)取1μm实施例3纯化的真核表达植物免疫激活蛋白psaep1处理烟草叶片,检测其诱导的活性氧迸发。
[0066]
从5周大的烟草上采集叶碟然后在96孔板中于200ul无菌水中漂浮过夜。用含有鲁米诺和过氧化物酶(35.4μg/ml鲁米诺,10μg/ml过氧化物酶)以及psaep1蛋白的200ul反应缓冲液替换无菌水。使用glomax96微板光度计(promega,madison,wi,usa)测量发光。
[0067]
结果:检测结果表明1μm的psaep1蛋白可以诱导烟草活性氧迸发,如图2。
[0068]
(2)取1μm实施例3纯化的真核表达植物免疫激活蛋白psaep1处理马铃薯、辣椒、茄子或番茄叶片,检测其诱导的活性氧迸发。
[0069]
从适龄大小的马铃薯、辣椒、茄子或番茄上采集叶碟然后在96孔板中于200ul无菌水中漂浮过夜。用含有鲁米诺和过氧化物酶(35.4μg/ml鲁米诺,10μg/ml过氧化物酶)以及psaep1蛋白的200ul反应缓冲液替换无菌水。使用glomax96微板光度计(promega,madison,wi,usa)测量发光。
[0070]
结果:检测结果表明1μm的psaep1蛋白可以诱导马铃薯、辣椒、茄子或番茄活性氧迸发,如图3。
[0071]
(3)真核表达的植物免疫激活蛋白psaep1处理叶片,诱导抗病相关基因转录水平显著升高
[0072]
经测定浓度后的psaep1蛋白,将其浓度调整到200nm。选取5周大的烟草,用1ml不带针头的注射器,将psaep1蛋白从叶片背面注入叶片中,同时以空载体作为对照,注射3h后,收集样品,进行抗病相关基因转录水平的检测。总rna的抽提采用omega公司rna提取试剂盒,并按照说明操作,用分光光度计检测rna含量和质量。
[0073]
反转录生成第一链:取0.7μg rna作模板,根据takara公司primescript反转录酶配套试剂使用说明进行cdna合成,定容至20μl反应。反转录产物用谁进行10倍稀释用于实时荧光定量pcr反应检测基因沉默效率。
[0074]
实时荧光定量pcr反应所用引物如下:
[0075]
nbcyp71d20上游引物:seq id no.7
[0076]
(5
’‑
gttgacgccattgttgag
‑3’
)
[0077]
nbcyp71d20下游引物:seq id no.8
[0078]
(5
’‑
atcttcgcctcctaatgc
‑3’
)
[0079]
nbef1
ɑ
上游引物:seq id no.9
[0080]
(5
’‑
gtatgcctgggtgcttgac
‑3’
)
[0081]
nbef1
ɑ
下游引物:seq id no.10
[0082]
(5
’‑
acagggacagttccaatacca
‑3’
)
[0083]
pcr反应体系包含cdna 5μl,sybr premix ex taq ii(tli rnase h plus)10μl,前后引物各0.4μl,rox reference dye ii 0.4μl,水13.8μl。反应程序:i:95度30秒,ii:95度15秒。检测结果如图4所示。
[0084]
结果:荧光定量pcr结果表明200nm psaep1蛋白处理烟草叶片后3h,诱导烟草抗病相关基因cyp71d20的表达量显著升高(如图4)。
[0085]
实施例5.植物免疫激活蛋白psaep1增强烟草的抗病性
[0086]
(1)将纯化后的psaep1溶液稀释到100nm,从叶片背面注入不用的烟草后,以空载体作为对照,分别处理20株,重复3次。诱导24h后,在处理的叶片上接种烟草疫霉菌,接种三天后观察侵染情况(图5)。收集样品。
[0087]
(2)提取样品基因组,利用荧光定量pcr进行烟草疫霉菌侵染生物量测定(方法同实施例4),选择par作为烟草疫霉内参基因,ef1
ɑ
作为烟草内参基因。定量引物序列如下:
[0088]
par上游引物:seq id no.11
[0089]
(5
’‑
atgaacttccgcgctctgtt
‑3’
)
[0090]
par下游引物:seq id no.12
[0091]
(5
’‑
cagtgacgcgcacgtagac
‑3’
)
[0092]
nbef1
ɑ
上游引物:seq id no.13
[0093]
(5
’‑
gtatgcctgggtgcttgac
‑3’
)
[0094]
nbef1
ɑ
下游引物:seq id no.14
[0095]
(5
’‑
acagggacagttccaatacca
‑3’
)
[0096]
结果:与空载体对照相比,使用psaep1处理的烟草叶片在接种烟草疫霉菌后均出现病斑显著减小,烟草疫霉侵染的生物量显著降低(图6)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1