抗腱生蛋白C抗体和其用途的制作方法
抗腱生蛋白c抗体和其用途
1.本技术是分案申请,原申请的申请日为2015年8月7日、申请号为2015800465321、发明名称为“抗腱生蛋白c抗体和其用途”。
2.本发明涉及用于结合腱生蛋白c的纤维蛋白原样球(fbg)域的抗体及其在与慢性发炎相关之病症之诊断、预后确定和/或治疗中之用途,以及鉴别此类抗体的方法。
3.发炎为组织对有害刺激,如病原体、组织损伤或刺激物的复杂生物反应。其为组织去除有害刺激以及对于组织起始愈合过程的保护性尝试。与发炎相关的异常包含下伏于多种人类疾病的一大组无关病症(发炎性病症)。具有发炎性方面的疾病的实例包括(但不限于)哮喘、自体免疫疾病、肾小球肾炎过敏(过敏反应)、癌症、发炎性肠病、再灌注性损伤、类风湿性关节炎和移植排斥反应。
4.确切地说,慢性发炎为与许多种以上疾病相关的致衰弱和严重病况且特征在于感染或损伤位点处的持续性发炎,或未知来源的持续性发炎,或与改变的免疫反应相关,如在自体免疫疾病中。
5.类风湿性关节炎(ra)为慢性发炎性病况的典型实例,尽管绝非唯一实例。ra的特征在于由促炎性细胞因子和基质金属蛋白酶(mmp)的持续性合成介导的滑膜发炎以及关节软骨和骨骼的破坏。抑制发炎性细胞因子(如tnfα和il
‑
6)的合成的生物化合物成功地在短期内治疗ra。但是,需要重复处理,其使得此为昂贵治疗方法,且并不提供长期缓解。此外,细胞因子功能的总体全身性抑制并非没有固有问题,如增加的感染风险。因此,不管护理的发展,长期有效的治疗慢性发炎性病况的经济模式的需要仍未满足(smolen(2006)和williams(2007))。
6.支持疾病慢性的机制仍不明确且当前未知驱动发炎性和破坏性介质的延长表达的因素。
7.toll样受体(tlr)在驱动ra中的发炎性介质的产生和tlr功能的阻断中的关键作用可具有显著临床益处(综述于brentano(2005)和o'neill(2002)中)。此受体家族形成免疫系统的组成部分。tlr通过识别病原体相关分子模式(pamp)和损伤相关分子模式(damp)介导针对感染和损伤的宿主防御(matzinger(2002))。damp为组织损伤时产生的内源性促炎性分子且包括从损坏或坏死细胞释放的胞内分子、细胞外基质(ecm)分子的片段或在损伤时上调的ecm分子(综述于bianchi(2007)和gordon(2002) 中)。
8.在活化后,tlr促进先天性和适应性免疫反应,包括刺激促炎性细胞因子和mmp 的表达(medzhitov(2002))。tlr在来自ra患者的滑膜组织中以高水准表达(radstake (2004),roelofs(2005),sacre(2007),且(sacre,2008年提交的手稿)且具有tlr4中的靶向缺失或功能突变缺失的小鼠经保护免受实验关节炎(choe(2003)和lee(2005)。此外,tlr4的抑制剂可减少小鼠中的破坏性关节炎(abdollahi
‑
roodsaz(2007))且假定的 tlr4抑制剂在初步i期试验中改善23位患有中度到重度ra的患者中的15位的症状 (vanags(2006)。但是,不清楚哪些tlr配位体涉及疾病发病机理。
9.腱生蛋白c(tnc)为与组织损伤和伤口修复相关的ecm醣蛋白。腱生蛋白c在胚胎发生期间的活性组织重塑期间特定地表现,首先在原肠胚形成和体节形成期间观测到。在发
育后期,表达限于乳腺和肺的分支形态发生位点、发育构架、心血管系统和结缔组织(位于上皮至间质转化的位点)。一旦这些方法停止和在胚胎发生完成之前,表达下调(jones(2000))。
10.腱生蛋白c不正常表达于健康成人组织中,但在成人中,在急性发炎期间特定且短暂上调且持续表达于慢性发炎中(综述于chiquet
‑
ehrismann(2003)中)。免疫组织化学研究显示极少腱生蛋白c表达于正常人类关节中,但水准在ra滑液中、在发炎和纤维化区域(尤其在滑膜衬里之下)、在入侵血管翳和血管周围极大地增加(cutolo(1992)、 maccachren(1992)和salter(1993))。也在来自ra患者的滑膜流体(chevalier(1994)和 hasegawa(2007))和ra软骨(salter(1993)和chevalier(1994))中存在腱生蛋白c水准的显著增加。
11.腱生蛋白c为150万da的大型六聚蛋白质。每一链包含不同域,包括组装域(ta)、 egf样重复序列(egf
‑
l)、iii型纤维结合蛋白样重复序列(tniii)和纤维蛋白原样球 (fbg)(综述于orend(2005)中)。腱生蛋白c和其域的序列显示于图1中。
12.本发明人先前已显示腱生蛋白c为促炎性刺激物且其为关节炎中观测的破坏性关节发炎所需且参与表征慢性发炎性病况的发炎性反应的延长。确切地说,已显示腱生蛋白c为tlr4的内源性活化剂且已展示此分子为破坏性关节发炎所需(wo 2010/103289)。
13.在wo 2010/103289中,腱生蛋白c在介导关节中的免疫反应中的作用通过在在小鼠体内关节内注射腱生蛋白c的fbg域时诱导关节发炎展示。此外,通过酵母聚糖诱导的急性关节发炎不如腱生蛋白c缺陷小鼠中长效。野生型和腱生蛋白c剔除式小鼠同样地回应于通过酵母聚糖诱导的急性发炎,表明腱生蛋白c似乎不参与发炎的起始。但是,通过腱生蛋白c剔除式小鼠展现较不持久滑膜炎指示维持关节发炎的作用。腱生蛋白c在延长关节发炎中的重要性通过来自持续侵蚀性关节发炎的腱生蛋白c保护的小鼠在由mbsa免疫接种诱导的关节炎期间的目标缺失的观测结果强调。
14.显示腱生蛋白c能够活化关节中的细胞且腱生蛋白c的主要活性域已在分子的c 末端映射至纤维蛋白原样球(fbg),一种227个氨基酸(26.9kda)的球状域(siri(1991))。
15.将fbg添加至来自ra患者的滑膜培养物增强促炎性细胞因子的自发释放。其也经由tlr4和myd88依赖性信号传导路径的活化刺激初生人类巨噬细胞中的tnf
‑
α、il
‑
6 和il
‑
8ra和滑膜成纤维细胞中的il
‑
6的合成。
16.已经证明如在lps的情况下,tlr4表达为通过fbg的细胞因子合成的诱导所需。但是,不同于lps,cd14或md
‑
2似乎都不为tlr
‑
4活化所需。cd14对于通过其它配体活化tlr4非必需。不需要tlr4以myd88依赖性方式回应于脂质a(jiang(2005)),纤维结合蛋白eda(外域a)可甚至在不存在cd14的情况下活化肥大细胞 (gondokaryono(2007))且人类单核细胞性thp
‑
1细胞的玻尿酸活化需要tlr4、cd44 和md
‑
2的复合物,但不需要cd14(taylor(2007))。
17.通过每一tlr4配位体形成相异的受体复合物可促进不同胞内衔接子/信号传导分子的补充。这可解释我们在fbg和lps的情况下观测的差异性细胞反应。类似地,tlr4 和cd44复合物的玻尿酸活化在不同于lps的小鼠肺泡巨噬细胞系中诱发基因表达模式 (taylor(2007))。
18.腱生蛋白c的紧密调节的表达模式使其成为治疗慢性发炎的有吸引力的标靶。其在健康成人中显著缺乏,然而,表达在组织损伤时特定地诱导。在急性发炎期间,腱生蛋白c
暂时表达:诱导通常先于发炎且mrna和蛋白质均在发炎消退时不存在于组织(综述于chiquet
‑
ehrismann(2003))。
19.现已显示腱生蛋白c的持续性表达与慢性发炎相关。除ra以外,在其它自体免疫疾病,包括多发性硬化症(gutowski(1999))和修格连氏病(sjogrens disease)(amin (2001))中,以及非愈合伤口和糖尿病性和静脉溃疡(loots(1998))中观测到增加的腱生蛋白c水准。腱生蛋白c的从头合成与口腔粘膜疾病的发炎强度紧密相关且腱生蛋白 c的血浆水准为药物或手术之前和之后的发炎性肠病的活性的可靠指示器(综述于 chiquet
‑
ehrismann(2003)中)。
20.wo 2010/103289描述药剂调变慢性发炎性反应的用途,其中药剂调节腱生蛋白c 的生物活性且其在治疗病况中的用途与慢性发炎相关。但是,仍持续需要用于此类病况的新颖和改进的治疗。
21.clark等人(1997)(52)描述对腱生蛋白的研究且描述对fbg域具有特异性的抗体。抗体为小鼠来源,并且因此不适用作治疗剂。此外,抗体仅描述为具有干扰“淋巴细胞滚动”的特性,相信其为细胞迁移,且不为发炎性细胞因子的细胞活化和产生的量度。未鉴别由clark描述的涉及细胞滚动活性的细胞反受体。相信参与细胞滚动或迁移的过程不为tlr4,或涉及滚动特性的潜在候选反受体的列表中由clark包括的tlr4的显著特性。另外,并非所有结合fbg的抗体都能够抑制发炎性细胞因子的产生。本文所述的抗体序列的改进的特性的新集合不由clark教示或表明,其也不经测试。因此,不存在指示clark描述的抗体与本文所述的抗体结合到fbg的相同区的事物,其似乎不与 tlr4活性相关,因为tlr4通常不考虑(包括clark通过将其自潜在候选物清单省略) 为涉及淋巴细胞滚动活性,clark等人研究的功能与本文所述的新颖抗体的关键消炎特性无关。
22.因此,仍需要产生对腱生蛋白c的fbg域具有特异性的新颖和改进的抗体,尤其具有使其适用作治疗剂所需的特性的那些。
23.本发明人已设计具有适合用于疗法中的特性的抗体和其片段,确切地说人类抗体,其对于腱生蛋白c的纤维蛋白原样球(fbg)域具有极高亲和力,且其中和fbg的生物活性。这些高亲和力抗体适用于多种治疗方法,如在诊断或治疗腱生蛋白c相关病症,尤其是与慢性发炎,包括类风湿性关节炎(ra)相关的病症中使用抗fbg抗体分子的治疗方法。抗体也适用于相关诊断和预测方法。
24.在本发明的第一方面中,提供能够结合至腱生蛋白c的fbg域的抗体或抗原结合片段、其衍生物或变异体,其中抗体或抗原结合片段、其衍生物或变异体包含:一或多个选自seq id no:9
‑
15、5、125、36、37、30
‑
35、38
‑
47、115
‑
118和140的序列;和/ 或一或多个选自seq id no:1
‑
8、124、48
‑
91、128
‑
138、112
‑
114和139的序列;和/或一或多个选自seq id no:5、13、16
‑
21、126、119
‑
121和141的序列;和/或一或多个选自seq id no:22
‑
29、127、122
‑
123和142的序列。
25.序列id号(seq id no)是指指定实例9和11中列出的特定抗体和抗体相关序列的那些。当未明确陈述时,提及的“抗体”包括其抗原结合片段、衍生物或变体。
26.在一个实施例中,根据本发明的抗体或抗原结合片段、其衍生物或变异体包含重链可变区和/或轻链可变区,其为人类或人类化的。
27.在一个实施例中,根据本发明的抗体或抗原结合片段、其衍生物或变异体为人类
或人类化的,包括全人类的。
28.在一个实施例中,根据本发明的抗体或抗原结合片段、其衍生物或变异体中和、降低或阻断tlr4的活化。
29.在一个实施例中,根据本发明的抗体或抗原结合片段、其衍生物或变异体包含人类或人类化的重链可变区和/或轻链可变区(包括全人类抗体或结合片段),其抑制如il
‑
8 的细胞因子在本文所述的分析中的释放。
30.在一个实施例中,根据本发明的抗体或抗原结合片段、其衍生物或变异体对腱生蛋 c的fbg域具有特异性。也就是说,其不与腱生蛋白c家族的其他成员交叉反应。
31.在一个实施例中,根据本发明的抗体或抗原结合片段、其衍生物或变异体与至少鼠类和/或鼠属腱生蛋白c的fbg域交叉反应,尤其与原始腱生蛋白c的fbg域交叉反应。这对于潜在治疗尤其重要,因为其允许在向人类投与之前在体内进行安全性和功效研究。
32.在一个实施例中,提供根据本发明的抗体或抗原结合片段、其衍生物或变异体,其包含6个cdr,即3个重链cdr和3个轻链cdr,例如本文中的抗体中所公开并且进一步包含人类框架。
33.在一个实施例中,提供对于人类腱生蛋白c的fbg域具有至少100nm或更高,例如50nm或更高的亲和力,如1nm或更高亲和力的抗体或抗原结合片段、其衍生物或变异体。亲和力越高,数值越低。
34.在一个实施例中,本发明延伸至在实例9或11中提供的序列表中明确公开的“抗体”。
35.在一个实施例中,提供一种抗体,例如人类或人类化抗体,其交叉阻断本文所公开的抗体或与本文所公开的抗体竞争结合相同抗原决定基。
36.在一个实施例中,本发明的抗体以全长抗体型式,例如不具有效应功能的型式,如 igg4型式提供。
37.在一个实施例中,抗体或抗原结合片段、其衍生物或变异体用于疗法,尤其用于治疗自体免疫疾病或发炎,尤其为本文中描述的病况。
38.本发明的第一方面的抗体或抗原结合片段、其衍生物或变异体可因此为抗原结合片段。抗原结合“片段”可选自由以下组成的群组:fv片段(例如单链fv和二硫化物结合的fv)、fab样片段(例如fab片段、fab'片段和f(ab)2片段)单一可变域(例如v
h
和v
l
域)和域抗体(dab,包括单一和双重型式[即dab
‑
连接子
‑
dab])。
[0039]
术语抗体“衍生物”和“变异体”是指能够以所属领域的技术人员已知的免疫分析型式结合至抗原的任何改性抗体分子(包括同源物),如抗体片段(例如fab或fv片段),或通过添加一或多个氨基酸或其它分子以促进将抗体偶合至另一肽或多肽、大型载体蛋白或固体载体(例如尤其为氨基酸酪氨酸、赖氨酸、谷氨酸、天冬氨酸、半胱氨酸和其衍生物,nh2
‑
乙酰基或cooh末端酰胺基)而改性的改性抗体分子。
[0040]
变异体可包括抗体的氨基酸序列的变型。举例来说,变异体的氨基酸序列可与指定抗体在氨基酸序列水准上50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、 96%、97%、98%或99%一致。
[0041]
变异体还可包括序列变化以利用最常见天然人类生殖系抗体框架和cdr多样性。这可通过用通常发现于天然人类抗体中的氨基酸对关键残基进行定制工程改造而进行。此
方法使人体中的抗
‑
抗体反应的可能性最小化,因为生殖系抗体框架序列在个体之间高度耐受。此技术称为“生殖系化”且所得序列被称为“生殖系化序列”。序列可为完全或部分生殖系化的。本发明的抗体的生殖系化序列的实例描述于实例11中。
[0042]
本发明的抗体可结合至结合tlr4的fbg域,例如通过物理上闭塞与tlr4的结合位点而直接阻断tlr4活化。尽管不希望受理论束缚,本发明人有证据表明tlr4直接结合腱生蛋白c的fbg域。这先前尚未确立,尽管已知腱生蛋白c能够增强tlr4的活性。
[0043]
或者,抗体可结合至不结合tlr4的fbg域的一部分,但这仍可预防tlr4活化(异位效应);抗体可结合至与阻断其活性的另一受体相互作用的fbg域,这可能或可能不对tlr4活性具有影响;和/或抗体可结合至不结合至任何其它受体的fbg域,但仍预防此受体的活化(异位效应)。
[0044]
在一个实施例中,本发明涉及结合fbg域但不抑制tlr4的活化和/或细胞因子(尤其为本文所述的那些,如il
‑
8)的释放的抗体或抗原结合片段、其衍生物或变异体。
[0045]
使用抗体片段而不是全抗体的优点为若干倍。片段的较小尺寸可导致改进的药理学特性,如固体组织的较好渗透。此外,抗原结合片段(如fab、fv、scfv和dab抗体片段)可表达于大肠杆菌(e.coli)中且自其分泌,因此允许便捷地产生大量所述片段。
[0046]
本发明的范围内还包括抗体和其抗原结合片段的改性型式,例如通过聚乙二醇或其它适合聚合物的共价连接改性。也包括抗体和其抗原结合片段的共轭物,例如抗体
‑
药物共轭物。
[0047]
产生抗体和抗体片段的方法在所属领域中众所周知。举例来说,抗体可经由采用抗体分子的体内产生的诱导、免疫球蛋白库的筛选(orlandi等人,1989.《美国国家科学院院刊(proc.natl.acad.sci.u.s.a.)》86:3833
‑
3837;winter等人,1991,《自然(nature)》 349:293
‑
299)或通过培养物中的细胞系的单克隆抗体分子的产生的若干方法中的任一种产生。这些包括但不限于融合瘤技术、人类b细胞融合瘤技术以及埃
‑
巴二氏病毒 (epstein
‑
barr virus,ebv)融合瘤技术(kohler等人,1975.《自然(nature)》256:4950497; kozbor等人,1985.《免疫学方法杂志(j.immunol.methods)》81:31
‑
42;cote等人,1983. 《美国国家科学院院刊(proc.natl.acad.sci.usa)》80:2026
‑
2030;cole等人,1984.《分子与细胞生物学(mol.cell.biol.)》62:109
‑
120)。
[0048]
所选抗原的适合单克隆抗体可通过已知技术制备,例如《单克隆抗体:技术手册 (monoclonal antibodies:a manual of techniques)》,h zola(crc press,1988)和《单克隆融合瘤抗体:技术和应用(monoclonal hybridoma antibodies:techniques andapplications)》,j g r hurrell(crc press,1982)中所公开。
[0049]
抗体片段可使用所属领域中熟知的方法获得(参见例如harlow和lane,1988,《抗体:实验室手册(antibodies:a laboratory manual)》,cold spring harbor laboratory,newyork)。举例来说,根据本发明的抗体片段可以通过蛋白水解抗体或通过编码所述片段的dna在大肠杆菌(e.coli)或哺乳动物细胞(例如,中国仓鼠卵巢细胞培养物或其它蛋白质表达系统)中表达来制备。或者,抗体片段可以通过以常规方法胃蛋白酶或木瓜蛋白酶消化全抗体来获得。
[0050]
所属领域的技术人员应了解,对于人类疗法或诊断学,优选地使用人类化抗体。非人类(例如鼠类)抗体的人类化形式为优选地具有来源于非人类抗体的最小部分的基因工
程改造嵌合抗体或抗体片段。人类化抗体包括其中的人类抗体(受体抗体)的互补决定区经来自具有所要官能性的例如小鼠、大鼠或兔的非人类物种(供体抗体)的互补决定区的残基置换的抗体。在一些情况下,人类抗体的fv框架残基经相应非人类残基置换。人类化抗体也可以包含既不在受体抗体中也不在引入的互补决定区或框架序列中发现的残基。通常,人类化抗体将包含大体上所有的至少一个并且通常是两个可变域,其中所有或大体上所有的互补决定区对应于非人类抗体的互补决定区,并且所有或大体上所有框架区对应于相关人类共有序列的框架区。人类化抗体最佳还包括抗体恒定区的至少一部分,例如fc区,其通常衍生自人类抗体(参见例如,jones等人,1986.《自然》 321:522
‑
525;riechmann等人,1988,《自然》332:323
‑
329;presta,1992,《结构生物学新见(curr.op.struct.biol.)》2:593
‑
596)。
[0051]
人类化非人类抗体的方法在所属领域中是熟知的。通常,人类化抗体具有从非人类来源引入到其中的一或多个氨基酸残基。这些非人类氨基酸残基(通常称为输入残基) 通常获自输入可变域。人类化可以基本上如通过用对应的啮齿动物互补决定区取代人类互补决定区所描述(参见例如:jones等人,1986,《自然》321:522
‑
525;reichmann等人, 1988.《自然》332:323
‑
327;verhoeyen等人,1988,《科学(science)》239:1534
‑
1536l; us 4,816,567)来进行。因此,此类人类化抗体为嵌合抗体,其中基本上少于完整的人类可变域已经来自非人类物种的对应序列取代。在实践中,人类化抗体可能通常为人类抗体,其中一些互补决定区残基并且可能一些框架残基经来自啮齿动物抗体中的类似位点的残基取代。
[0052]
本文中所明确公开的抗体的cdr为人类来源。这是有利的,因为其一般比非人类来源的抗体具有较少免疫原性。
[0053]
人类抗体也可以使用所属领域中已知的各种技术鉴别,包括噬菌体呈现库(参见例如,hoogenboom和winter,1991,《分子生物学杂志(j.mol.biol.)》227:381;marks 等人,1991,《分子生物学杂志》222:581;cole等人,1985,《单克隆抗体和癌症疗法 (monoclonal antibodies and cancer therapy)》,alan r.liss,第77页;boerner等人,1991. 《免疫学杂志(j.immunol.)》147:86
‑
95)。
[0054]
在一个实施例中,提供包含cdr,如来自本文中所公开的抗体的6个cdr或可变区的抗体或抗原结合片段。抗体或抗原结合片段可为嵌合的。嵌合抗体包含片段,例如来自非人类物种(例如小鼠、大鼠、猴等)的框架和/或恒定区。这可用于制备平行试剂,例如用于体内安全性和/或功效研究。
[0055]
一旦获得适合的抗体,可测试其活性,例如通过elisa。
[0056]
在本发明的第一方面的一个实施例中,抗体或抗原结合片段、其衍生物或变异体包含:一或多个选自seq id no:9
‑
11、5、13
‑
14、36、30、32、34、38、40、42、44、46、 116和118的cdr序列;和/或一或多个选自seq id no:1
‑
3、5
‑
7、48、50、52、54、 56、58、60、62、64、66、68、70、72、74、76、78、80、82、84、86、135、88、90 和114的cdr序列;和/或一或多个选自seq id no 16
‑
18、5、13、20和121的cdr 序列;和/或一或多个选自seq id no 22
‑
24和26
‑
28的cdr序列。
[0057]
我们通过“cdr”指如发现于完整免疫球蛋白可变重链(vh)或可变轻链(vl) 中的互补决定区。三个互补决定区(cdr)存在于完整免疫球蛋白的重链和轻链的可变域上。cdr在重链和轻链上均编号为cdr1、cdr2和cdr3。举例来说,vh链包含 cdr1、cdr2和cdr3且vl链
11、30、32、34、36、38、40、42、44和46的vhcdr3序列;选自seqidno:11、30、34和36的vhcdr3序列;或选自seqidno11、30和36的vhcdr3序列。
[0071]
在一个实施例中,抗体或抗原结合片段、其衍生物或变异体包含含seqidno:15、125、117或140的序列的vl序列。
[0072]
在另一实施例中,抗体或抗原结合片段、其衍生物或变异体包含含seqidno:12或seqidno:115的序列的vh序列,且其中vh序列包含cdr3序列,其经以下各者置换:选自seqidno:30、32、34、36、38、40、42、44和46的vhcdr3序列;选自seqidno:30、34和36的vhcdr3序列;或选自seqidno30和36的vhcdr3序列。
[0073]
在此特定情形下,“经置换”意指vh序列seqidno:12或115的cdr3序列自序列缺失且替代cdr3序列(如所指定)代替其而包括在内。换句话说,seqidno:11(其为seqidno:12和115的cdr3序列)经替代cdr3序列(如所指定)置换。
[0074]
在特定实施例中,抗体或抗原结合片段、其衍生物或变异体包含:seqidno:14的vlcdr3序列和选自seqidno:11和30
‑
46的vhcdr3序列;或包含seqidno:7的vlcdr3序列和选自seqidno:3和48
‑
70的vhcdr3序列;或包含seqidno:3的vhcdr3序列和选自seqidno:7和72、74、76、78、80、82、84、86、135、88和90的vlcdr3序列;或包含seqidno:18的vhcdr3序列和seqidno:20的vlcdr3序列;或包含seqidno:24的vhcdr3序列和seqidno:28的vlcdr3序列。
[0075]
优选地,抗体或抗原结合片段、其衍生物或变异体包含:
[0076]
至少一个选自seqidno:1
‑
3和5
‑
7的cdr序列;或至少一个选自seqidno:1、2、48和5
‑
7的cdr序列;或至少一个选自seqidno:1、2、50和5
‑
7的cdr序列;或至少一个选自seqidno:1、2、52和5
‑
7的cdr序列;或至少一个选自seqidno:1、2、54和5
‑
7的cdr序列;或至少一个选自seqidno:1、2、56和5
‑
7的cdr序列;或至少一个选自seqidno:1、2、58和5
‑
7的cdr序列;或至少一个选自seqidno:1、2、60和5
‑
7的cdr序列;或至少一个选自seqidno:1、2、62和5
‑
7的cdr序列;或至少一个选自seqidno:1、2、64和5
‑
7的cdr序列;或至少一个选自seqidno:1、2、66和5
‑
7的cdr序列;或至少一个选自seqidno:1、2、68和5
‑
7的cdr序列;或至少一个选自seqidno:1、2、70和5
‑
7的cdr序列;或
[0077]
至少一个选自seqidno:1
‑
3、5、6和72的cdr序列;或至少一个选自seqidno:1
‑
3、5
‑
6和74的cdr序列;或至少一个选自seqidno:1
‑
3、5、6和76的cdr序列;或至少一个选自seqidno:1
‑
3、5、6和78的cdr序列;或至少一个选自seqidno:1
‑
3、5、6和80的cdr序列;或至少一个选自seqidno:1
‑
3、5、6和82的cdr序列;或至少一个选自seqidno:1
‑
3、5、6和84的cdr序列;或至少一个选自seqidno:1
‑
3、5、6和86的cdr序列;或至少一个选自seqidno:1
‑
3、5、6和135的cdr序列;或至少一个选自seqidno:1
‑
3、5、6和88的cdr序列;或至少一个选自seqidno:1
‑
3、5、6和90的cdr序列;或至少一个选自seqidno:1
‑
3、5、7和114的cdr;或
[0078]
至少一个选自seqidno:9
‑
11和5、13和14的cdr序列;或至少一个选自seqidno:9、10、30、5、13和14的cdr序列;或至少一个选自seqidno:9、10、32、5、13和14的cdr序列;或至少一个选自seqidno:9、10、34、5、13和14的cdr序列;或至少一个选自seqidno:9、10、36、5、13和14的cdr序列;或至少一个选自seqidno:9、10、38、5、13和14的cdr序列;或至少一个选自seqidno:9、10、40、5、13和14的cdr序列;或至少一个选自seqidno:9、
10、42、5、13和14的cdr序列;或至少一个选自seqidno:9、10、44、5、13和14的cdr序列;或至少一个选自seqidno:9、10、46、5、13和14的cdr序列;或至少一个选自seqidno:9、11、116、5、14和118的cdr;或
[0079]
至少一个选自seqidno:16
‑
18和5、13和20的cdr序列;或至少一个选自seqidno:16
‑
18和5、121和20的cdr序列;或至少一个选自seqidno:22
‑
24和26
‑
28的cdr序列。
[0080]
这些组的序列中的每一个对应于vhcdr1、cdr2、cdr3和vlcdr1、cdr2、cdr3区的序列。
[0081]
抗体或抗原结合片段、其衍生物或变异体可包含选自以上列出的组中的一个的cdr序列中的至少一个。优选地,抗体或抗原结合片段、其衍生物或变异体包含选自以上列出的组中的一个的至少一个、两个、三个、四个、五个或六个cdr序列。更优选地,抗体或抗原结合片段、其衍生物或变异体包含至少三个或至少六个选自以上列出的组中的一个的cdr序列。最优选地,抗体或抗原结合片段、其衍生物或变异体包含至少六个选自以上列出的组中的一个的cdr序列。
[0082]
任选地,抗体或抗原结合片段、其衍生物或变异体包含:至少一个选自seqidno:1
‑
3的vhcdr序列;或至少一个选自seqidno:1、2和48的vhcdr序列;或至少一个选自seqidno:1、2和50的vhcdr序列;或至少一个选自seqidno:1、2和52的vhcdr序列;或至少一个选自seqidno:1、2和54的vhcdr序列;或至少一个选自seqidno:1、2和56的vhcdr序列;或至少一个选自seqidno:1、2和58的vhcdr序列;或至少一个选自seqidno:1、2和60的vhcdr序列;或至少一个选自seqidno:1、2和62的vhcdr序列;或至少一个选自seqidno:1、2和64的vhcdr序列;或至少一个选自seqidno:1、2和66的vhcdr序列;或至少一个选自seqidno:1、2和68的vhcdr序列;或至少一个选自seqidno:1、2和70的vhcdr序列;或
[0083]
至少一个选自seqidno:9
‑
11的vhcdr序列;或至少一个选自seqidno:9、10和30的vhcdr序列;或至少一个选自seqidno:9、10和32的vhcdr序列;或至少一个选自seqidno:9、10和34的vhcdr序列;或至少一个选自seqidno:9、10和36的vhcdr序列;或至少一个选自seqidno:9、10和38的vhcdr序列;或至少一个选自seqidno:9、10和40的vhcdr序列;或至少一个选自seqidno:9、10和42的vhcdr序列;或至少一个选自seqidno:9、10和44的vhcdr序列;或至少一个选自seqidno:9、10和46的vhcdr序列;或
[0084]
至少一个选自seqidno:9、116和11的vhcdr序列;或至少一个选自seqidno:9、116和30的vhcdr序列;或至少一个选自seqidno:9、116和32的vhcdr序列;或至少一个选自seqidno:9、116和34的vhcdr序列;或至少一个选自seqidno:9、116和36的vhcdr序列;或至少一个选自seqidno:9、116和38的vhcdr序列;或至少一个选自seqidno:9、116和40的vhcdr序列;或至少一个选自seqidno:9、116和42的vhcdr序列;或至少一个选自seqidno:9、116和44的vhcdr序列;或至少一个选自seqidno:9、116和46的vhcdr序列;或
[0085]
至少一个选自seqidno:16
‑
18的vhcdr序列;或至少一个选自seqidno:22
‑
24的vhcdr序列。
[0086]
这些组的序列中的每一个对应于vhcdr1、cdr2和cdr3区的序列。
[0087]
抗体或抗原结合片段、其衍生物或变异体可包含选自以上列出的组中的一个的vh
cdr序列中的至少一个。优选地,抗体或抗原结合片段、其衍生物或变异体包含至少一个、两个或三个选自以上列出的组中的一个的vhcdr序列。最优选地,抗体或抗原结合片段、其衍生物或变异体包含至少三个选自以上列出的组中的一个的vhcdr序列。
[0088]
任选地,抗体或抗原结合片段、其衍生物或变异体包含:至少一个选自seqidno:5
‑
7的vlcdr序列;或至少一个选自seqidno:5、6和72的vlcdr序列;或至少一个选自seqidno:5
‑
6和74的vlcdr序列;或至少一个选自seqidno:5、6和76的vlcdr序列;或至少一个选自seqidno:5、6和78的vlcdr序列;或至少一个选自seqidno:5、6和80的vlcdr序列;或至少一个选自seqidno:5、6和82的vlcdr序列;或至少一个选自seqidno:5、6和84的vlcdr序列;或至少一个选自seqidno:5、6和86的vlcdr序列;或至少一个选自seqidno:5、6和135的vlcdr序列;或至少一个选自seqidno:5、6和88的vlcdr序列;或至少一个选自seqidno:5、6和90的vlcdr序列;或
[0089]
至少一个选自seqidno:5、114和7的vlcdr序列;或至少一个选自seqidno:5、114和72的vlcdr序列;或至少一个选自seqidno:5、114和74的vlcdr序列;或至少一个选自seqidno:5、114和76的vlcdr序列;或至少一个选自seqidno:5、114和78的vlcdr序列;或至少一个选自seqidno:5、114和80的vlcdr序列;或至少一个选自seqidno:5、114和82的vlcdr序列;或至少一个选自seqidno:5、114和84的vlcdr序列;或至少一个选自seqidno:5、114和86的vlcdr序列;或至少一个选自seqidno:5、114和88的vlcdr序列;或至少一个选自seqidno:5、114和90的vlcdr序列;或
[0090]
至少一个选自seqidno:5、13和14的vlcdr序列;或至少一个选自seqidno:5、118和14的vlcdr序列;或
[0091]
至少一个选自seqidno:5、13和20的vlcdr序列;或至少一个选自seqidno:5、121和20的vlcdr序列;或至少一个选自seqidno:26
‑
28的vlcdr序列。
[0092]
这些组的序列中的每一个对应于vlcdr1、cdr2和cdr3区的序列。
[0093]
抗体或抗原结合片段、其衍生物或变异体可包含选自以上列出的组中的一个的vlcdr序列中的至少一个。优选地,抗体或抗原结合片段、其衍生物或变异体包含至少一个、两个或三个选自以上列出的组中的一个的vlcdr序列。最优选地,抗体或抗原结合片段、其衍生物或变异体包含至少三个选自以上列出的组中的一个的vlcdr序列。
[0094]
在特定实施例中,抗体或抗原结合片段、其衍生物或变异体包含:选自seqidno:3和54的vhcdr3序列;或选自seqidno:11、30和36的vhcdr3序列。
[0095]
在另一实施例中,抗体或抗原结合片段、其衍生物或变异体包含含以下各者的vh和/或vl序列:一或多个选自seqidno12、15、125、37、31、33、35、39、41、43、45、47、115、117和140的序列;和/或一或多个选自seqidno:4、8、124、49、51、53、55、57、59、61、63、65、67、69、71、73、128、75、129、77、130、79、131、81、132、83、133、85、134、87、136、89、137、91、138、112、113和139的序列;和/或一或多个选自seqidno19、21、126、119、120和141的序列;和/或一或多个选自seqidno25、29、127、122、123和142的序列。
[0096]
任选地,抗体或抗原结合片段、其衍生物或变异体的vh序列选自seqidno12、37、31、33、35、39、41、43、45、47和115;和/或选自seqidno:4、49、51、53、55、57、59、61、63、65、67、69、71和112;和/或选自seqidno:19和119;和/或选自:seqidno25和122。
[0097]
任选地,抗体或抗原结合片段、其衍生物或变异体的vl序列选自seqidno:15、
125、117和140;和/或选自seqidno:8、124、73、128、75、129、77、130、79、131、81、132、83、133、85、134、87、136、89、137、91、138、113和139;和/或选自seqidno:21、126、120和141;和/或选自seqidno:29、127、123和142。
[0098]
在特定实施例中,抗体或抗原结合片段、其衍生物或变异体包含vh和vl序列,其包含选自以下序列对的vh和vl序列对的序列:seqidno12和15或125;seqidno115和15或125;seqidno12和117或140;seqidno37和15或125;seqidno37和117或140;seqidno31和15或125;seqidno33和15或125;seqidno35和15或125;seqidno39和15或125;seqidno41和15或125;seqidno43和15或125;seqidno45和15或125;seqidno47和15或125;seqidno31和117或140;seqidno33和117或140;seqidno35和117或140;seqidno39和117或140;seqidno41和117或140;seqidno43和117或140;seqidno45和117或140;seqidno47和117或140;以及seqidno115和117或140;或
[0099]
选自以下序列对:seqidno4和8或124;seqidno49和8或124;seqidno51和8或124;seqidno53和8或124;seqidno55和8或124;seqidno57和8或124;seqidno59和8或124;seqidno61和8或124;seqidno63和8或124;seqidno65和8或124;seqidno67和8或124;seqidno69和8或124;seqidno71和8或124;seqidno112和8或124;seqidno4和113或139;seqidno49和113或139;seqidno51和113或139;seqidno53和113或139;seqidno55和113或139;seqidno57和113或139;seqidno59和113或139;seqidno61和113或139;seqidno63和113或139;seqidno65和113或139;seqidno67和113或139;seqidno69和113或139;seqidno71和113或139;seqidno4和73或128;seqidno4和75或129;seqidno4和77或130;seqidno4和79或131;seqidno4和81或132;seqidno4和83或133;seqidno4和85或134;seqidno4和87或136;seqidno4和89或137;seqidno4和91或138;seqidno112和73或128;seqidno112和75或129;seqidno112和77或130;seqidno112和79或131;seqidno112和81或132;seqidno112和83或133;seqidno112和85或134;seqidno112和87或136;seqidno112和89或137;seqidno112和91或138;以及seqidno112和113或139;或
[0100]
选自以下序列对:seqidno19和21或126;seqidno19和120或141;seqidno119和21或126;以及seqidno119和120或141;或
[0101]
选自以下序列对:seqidno25和29或127;seqidno25和123或142;seqidno122和29或127;以及seqidno122和123或142。
[0102]
换句话说,抗体或抗原结合片段、其衍生物或变异体的vh和vl序列包含指定序列对的vh和vl序列,即每一对将由指定vh序列和两个指定vl序列中的一个组成。
[0103]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含含选自seqidno:4、49、51、53、55、57、59、61、63、65、67、69、71和112的序列的vh序列。
[0104]
在另一优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含含选自seqidno:8、124、73、128、75、129、77、130、79、131、81、132、83、133、85、134、87、136、89、137、91、138、113和139的序列的vl序列。
[0105]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或
变异体,所述人类可变区包含用于cdrh1的seq id no:1,用于cdrh2的seq id no: 2,用于cdrh3的seq id no:3或48或50或52或54或56或58或60或62或64或 66或68或70,用于cdrl1的seq id no:5,用于cdrl2的seq id no:6,和用于 cdrl3的seq id no:7或72或74或76或78或80或82或84或86或88或90或135。举例来说,使用此命名法,我们通过“cdrh1”意指vh链cdr1。
[0106]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:3、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:7。
[0107]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:48、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:7。
[0108]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:50、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:7。
[0109]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:52、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:7。
[0110]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:54、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:7。
[0111]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:56、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:7。
[0112]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:58、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:7。
[0113]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:60、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:7。
[0114]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于
cdrh3的seq id no:62、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:7。
[0115]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:64、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:7。
[0116]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:66、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:7。
[0117]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:68、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:7。
[0118]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:70、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:7。
[0119]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:3、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:72。
[0120]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:3、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:74。
[0121]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:3、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:76。
[0122]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:3、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:78。
[0123]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:3、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:80。
[0124]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或
变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:3、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:82。
[0125]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:3、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:84。
[0126]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:3、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:86。
[0127]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:3、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:88。
[0128]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:3、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:90。
[0129]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:1、用于cdrh2的seq id no: 2、用于cdrh3的seq id no:3、用于cdrl1的seq id no:5、用于cdrl2的seqid no:6和用于cdrl3的seq id no:135。
[0130]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:9、用于cdrh2的seq id no: 10、用于cdrh3的seq id no:11或30或32或34或38或40或42或44或46、用于 cdrl1的seq id no:5、用于cdrl2的seq id no:13和用于cdrl3的seq id no: 14。
[0131]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:9、用于cdrh2的seq id no: 10、用于cdrh3的seq id no:11、用于cdrl1的seq id no:5、用于cdrl2的seqid no:13和用于cdrl3的seq id no:14。
[0132]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:9、用于cdrh2的seq id no: 10、用于cdrh3的seq id no:30、用于cdrl1的seq id no:5、用于cdrl2的seqid no:13和用于cdrl3的seq id no:14。
[0133]
在一个实施例中,提供例如具有人类可变区的抗体或抗原结合片段、其衍生物或变异体,所述人类可变区包含用于cdrh1的seq id no:9、用于cdrh2的seq id no: 10、用于cdrh3的seq id no:11、用于cdrl1的seq id no:5、用于cdrl2的seqid no:13和用于cdrl3的seq id no:14。
no: 55的序列的vh序列。
[0145]
在又一优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含含选自seq idno:12、31、33、35、37、39、41、43、45、47和115的序列的vh序列。
[0146]
在另一优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含含seq id no: 12或115的序列的vh序列。
[0147]
在另一优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含含seq id no: 31的序列的vh序列。
[0148]
在另一优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含含seq id no: 37的序列的vh序列。
[0149]
任选地,抗体或抗原结合片段、其衍生物或变异体另外包含含seq id no:8、124、113或139的序列的vl序列。
[0150]
任选地,抗体或抗原结合片段、其衍生物或变异体另外包含含seq id no:4或112 的序列的vh序列。
[0151]
任选地,抗体或抗原结合片段、其衍生物或变异体另外包含含seq id no:15、125、 117或140的序列的vl序列。
[0152]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:包含seq id no: 37的序列的vh序列;和包含seq id no:15的序列的vl序列。
[0153]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:包含seq id no: 37的序列的vh序列;和包含seq id no:125的序列的vl序列。
[0154]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:包含seq id no: 31的序列的vh序列;和包含seq id no:15的序列的vl序列。
[0155]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:包含seq id no: 31的序列的vh序列;和包含seq id no:125的序列的vl序列。
[0156]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:包含seq id no: 55的序列的vh序列;和包含seq id no:8的序列的vl序列。
[0157]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:包含seq id no: 55的序列的vh序列;和包含seq id no:124的序列的vl序列。
[0158]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:包含seq id no: 4的序列的vh序列;和包含seq id no:8的序列的vl序列。
[0159]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:包含seq id no: 4的序列的vh序列;和包含seq id no:124的序列的vl序列。
[0160]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:包含seq id no: 12的序列的vh序列;和包含seq id no:15的序列的vl序列。
[0161]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:包含seq id no: 12的序列的vh序列;和包含seq id no:125的序列的vl序列。
[0162]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:包含seq id no: 19的序列的vh序列;和包含seq id no:21的序列的vl序列。
[0163]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:包含seq id no: 19的序列的vh序列;和包含seq id no:126的序列的vl序列。
[0164]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:包含seq id no: 25的序列的vh序列;和包含seq id no:29的序列的vl序列。
[0165]
在优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:包含seq id no: 25的序列的vh序列;和包含seq id no:127的序列的vl序列。
[0166]
在另一优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:对应于seqid no:9的序列的vh cdr1序列;对应于seq id no:10或seq id no:116的序列的 vh cdr2序列;对应于seq id no:5的序列的vl cdr1序列;对应于seq id no:13 或seq id no:118的序列的vl cdr2序列;对应于seq id no:14的序列的vl cdr3 序列;和对应于选自seq id no:11、36、30、32、34、38、40、42、44或46的序列的 vh cdr3序列。优选地,vh cdr3序列对应于seq id no:11或seq id no:36的序列。甚至更优选地,vh cdr3序列对应于seq id no:36的序列。
[0167]
在另一优选实施例中,抗体或抗原结合片段、其衍生物或变异体包含:对应于seqid no:1的序列的vh cdr1序列;对应于seq id no:2的序列的vh cdr2序列;对应于seq id no:5的序列的vl cdr1序列;对应于seq id no:6或seq id no:114 的序列的vl cdr2序列;对应于seq id no:7的序列的vl cdr3序列;和对应于选自seq id no:3、48、50、52、54、56、58、60、62、64、66、68或70的序列的vh cdr3 序列。优选地,vh cdr3序列对应于seq id no:3或seq id no:54的序列。甚至更优选地,vh cdr3序列对应于seq id no:54的序列。
[0168]
技术人员将显见的是当末端残基为本文中所公开的轻链可变区序列中的精氨酸(r) 时,其为恒定区的第一氨基酸。因此,在一个实施例中,提供不存在末端残基(当其为来自恒定区的精氨酸(r)时)的轻链可变区序列。
[0169]
本发明的第一方面的抗体或抗原结合片段、其衍生物或变异体可通过更改腱生蛋白 c的转录、翻译和/或结合特性来调节腱生蛋白c的生物活性。
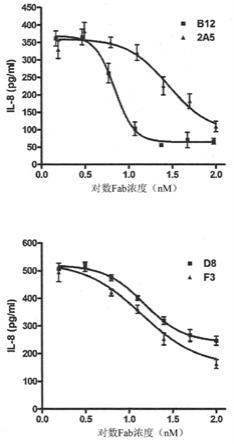
[0170]
此类抗体可使用所属领域中熟知的方法鉴别,如:
[0171]
(a)通过测定测试抗体对腱生蛋白c的表达量的影响,例如通过蛋白质印迹 (southern blotting)或相关杂交技术;
[0172]
(b)通过测定测试抗体对腱生蛋白c蛋白的含量的影响,例如通过使用抗
‑
腱生蛋白c抗体的免疫分析;和
[0173]
(c)通过测定测试抗体对功能性标记物的效应或腱生蛋白c活性的结果,例如经由实例的方法。
[0174]
本发明的第一方面的抗体或抗原结合片段、其衍生物或变异体可下调腱生蛋白c的生物活性。
[0175]
本发明的第一方面的抗体或抗原结合片段、其衍生物或变异体可上调腱生蛋白c的生物活性。上调发炎性分子和细胞的免疫活性的合意性与产生用于缺陷的免疫和发炎患者的疗法和疫苗开发相关。(参见harandi(2009))。
[0176]
本发明的第一方面的抗体或抗原结合片段、其衍生物或变异体可为腱生蛋白c的转录抑制剂。
[0177]
本发明的第一方面的抗体或抗原结合片段、其衍生物或变异体可为腱生蛋白c的翻译抑制剂。
[0178]
本发明的第一方面的抗体或抗原结合片段、其衍生物或变异体可为腱生蛋白c的
结合特性的抑制剂。举例来说,抗体或抗原结合片段、其衍生物或变异体可改变腱生蛋白 c的构形以使其不再能够结合至其一或多个受体。
[0179]
本发明的第一方面的抗体或抗原结合片段、其衍生物或变异体可为腱生蛋白c的竞争性结合抑制剂。所属领域的技术人员应了解,抗体或抗原结合片段、其衍生物或变异体还可通过直接(通过充当腱生蛋白c受体拮抗剂)或间接(通过结合中间或辅助分子) 阻断腱生蛋白c受体功能抑制腱生蛋白c的生物活性。
[0180]
本发明的第一方面的抗体或抗原结合片段、其衍生物或变异体可为tlr
‑
4受体的拮抗剂。我们通过tlr4的拮抗剂包括间接拮抗作用。抗原结合片段、其衍生物或变异体可预防tlr4或也可预防任何其它受体的腱生蛋白c活化。
[0181]
所属领域的技术人员应了解,腱生蛋白c的生物活性通过本发明的抗体或抗原结合片段、其衍生物或变异体的抑制可为完全或部分的。举例来说,相比于未暴露于抗体或抗原结合片段、其衍生物或变异体的发炎性细胞上的腱生蛋白c的生物活性,抗体或抗原结合片段、其衍生物或变异体可抑制腱生蛋白c的生物活性至少10%,优选地至少 20%、30%、40%、50%、60%、70%、80%或90%,且最优选地100%。
[0182]
本发明的第一方面的抗体或抗原结合片段、其衍生物或变异体可选自多克隆或单克隆抗体。
[0183]
抗体或抗原结合片段、其衍生物或变异体可基本上可逆或基本上不可逆地结合至腱生蛋白c的活性位点。在另一实例中,抗体或抗原结合片段、其衍生物或变异体可结合至并非活性位点的腱生蛋白c的一部分以干扰腱生蛋白c与配体或受体的结合。在另一实例中,抗体或抗原结合片段、其衍生物或变异体可结合至腱生蛋白c的一部分以通过异位效应降低蛋白质活性。此异位效应可为参与腱生蛋白c的活性的天然调节,例如通过“上游活化剂”活化腱生蛋白c的异位效应。
[0184]
检测测试抗体或抗原结合片段、其衍生物或变异体与腱生蛋白c之间的相互作用的方法为所属领域中众所周知的。
[0185]
举例来说,可使用超过滤伴以离子喷射质谱/hplc方法或其它物理和分析方法。另外,可使用荧光能量共振转移(fret)方法,其中两种荧光标记实体的结合可通过测量荧光标签彼此极为接近时的相互作用而测量。
[0186]
检测多肽与巨分子(例如dna、rna、蛋白质和磷脂)的结合的替代方法包括表面等离子体共振分析,例如如plant等人,1995,《分析生物化学(analyt biochem)》226(2), 342
‑
348中所述。方法可利用例如用放射性或荧光标记来标记的多肽。
[0187]
鉴别能够结合至多肽的抗体或抗原结合片段、其衍生物或变异体的另一方法为其中多肽暴露于抗体或抗原结合片段、其衍生物或变异体且检测和/或测量化合物与所述多肽的任何结合的方法。可测定抗体或抗原结合片段、其衍生物或变异体与多肽的结合的结合常数。检测和/或测量(定量)抗体或抗原结合片段、其衍生物或变异体与多肽的结合的适合的方法为所属领域的技术人员熟知且可例如使用能够高通量操作的方法,例如基于芯片的方法进行。称作vlsips
tm
的新技术使得能够产生含有数十万或更多不同分子探针的极小芯片。这些生物芯片或阵列具有以阵列布置的探针,每一探针指定特定位置。已产生每一位置具有例如十微米的标度的生物芯片。芯片可用于测定目标分子是否与芯片上的探针中的任一个相互作用。在将阵列于所选测试条件下暴露至目标分子之后,扫描装置可检查阵列
中的每一位置且测定靶分子是否与探针在所述位置相互作用。
[0188]
鉴别对于腱生蛋白c具有结合亲和力的抗体或抗原结合片段、其衍生物或变异体的另一方法为酵母双杂交系统,其中本发明的多肽可用于“捕获”结合腱生蛋白c的蛋白质。酵母双杂交系统描述于fields和song,《自然(nature)》340:245
‑
246(1989)中。
[0189]
抗体或抗原结合片段、其衍生物或变异体可为模拟抗体的高亲和力分子(所谓的
‘
亲和抗体’)(例如参见us 5,831,012和www.affibody.se)。这些配体为由基于蛋白a(来自细菌金黄色酿脓葡萄球菌(staphylococcus aureus)的表面蛋白质)的igg结合域中的一个的架构的三螺旋束组成的小型简单蛋白质。此架构具有作为亲和力配体的极佳特征且可经设计以在高亲和力下结合至任何给定靶蛋白。
[0190]
本发明的第一方面的抗体或抗原结合片段、其衍生物或变异体可预防toll样受体4 (tlr4)或其它受体、toll样受体4的共受体或那些其它受体的共受体的腱生蛋白c活化。
[0191]
初级受体(如tlr4)的共受体帮助信号传导分子结合至初级受体以促进配体识别和结合以及起始/维持由受体结合产生的生物过程。
[0192]
本发明的第一方面的抗体或抗原结合片段、其衍生物或变异体可优选地对于腱生蛋白c的fbg域具有特异性。
[0193]
在本发明的第二方面中,提供包含如本发明的第一方面中定义的抗体或抗原结合片段、其衍生物或变异体和药学上可接受的载剂、赋形剂和/或稀释剂的组合物。
[0194]
所属领域的技术人员应了解,此类有效量的抗体或抗原结合片段、其衍生物或变异体或其调配物可以单次剂量(即急性投与)或更优选地以随时间推移的一系列剂量(即慢性投与)形式传递。
[0195]
本发明的抗体或抗原结合片段、其衍生物或变异体可在各种浓度下调配,这取决于使用的化合物的功效/毒性和使用其的指示。优选地,调配物以0.1μm与1mm之间、更优选地1μm与100μm之间、5μm与50μm之间、10μm与50μm之间、20μm与 40μm之间且最优选地约30μm的浓度包含本发明的抗体或抗原结合片段、其衍生物或变异体。或者,在60μm与70μm之间,优选地约67μm。对于体外应用,调配物可包含较低浓度的本发明化合物,例如在0.0025μm与1μm之间。
[0196]
所属领域的技术人员应了解,本发明的抗体或抗原结合片段、其衍生物或变异体将一般在与关于预期投与途径和标准医药实践选择的适合医药赋形剂稀释剂或载剂的掺和物中投与(例如参见《雷明顿:医药科学和实践(remington:the science and practiceof pharmacy)》,第19版,1995,alfonso gennaro编,mack publishing company, pennsylvania,usa)。
[0197]
举例来说,本发明的抗体或抗原结合片段、其衍生物或变异体可以片剂、胶囊、珠剂、酏剂、溶液或悬浮液形式经口、经颊或舌下投与,其可含有调味剂或着色剂,用于立即、延迟或控制释放应用。本发明的抗体或抗原结合片段、其衍生物或变异体还可经由阴茎海绵体内注射投与。
[0198]
此类片剂可含有赋形剂,如微晶纤维素、乳糖、柠檬酸钠、碳酸钙、磷酸氢二钙和甘氨酸,崩解剂,如淀粉(优选地玉米、马铃薯或木薯淀粉)、淀粉乙醇酸钠、交联羧甲纤维素钠和某些复合硅酸盐,和粒化粘合剂,如聚乙烯吡咯烷酮、羟丙基甲基纤维素 (hpmc)、羟丙基纤维素(hpc)、蔗糖、明胶和阿拉伯胶。另外,可包括如硬脂酸镁、硬脂酸、二十二酸甘油酯以
及滑石的润滑剂。
[0199]
类似类型的固体组合物还可用作明胶胶囊中的填充剂。就此而言的优选的赋形剂包括乳糖、淀粉、纤维素、乳糖或高分子量聚乙二醇。对于水性悬浮液和/或酏剂,本发明化合物可与以下各者组合:多种甜味剂或调味剂、着色物质或染料;乳化剂和/或悬浮剂;以及稀释剂,如水、乙醇、丙二醇以及甘油,和其组合。
[0200]
本发明的抗体或抗原结合片段、其衍生物或变异体也可非经肠,例如静脉内、关节内、动脉内、腹膜内、鞘内、脑室内、胸骨内、颅内、肌肉内或皮下投与,或其可通过输注技术投与。它们最佳以无菌水溶液形式使用,其可能含有其它物质,例如足够的盐或葡萄糖以使得所述溶液与血液等张。必要时,水溶液应经适当缓冲(优选地缓冲到3 到9的ph)。适合的非经肠调配物在无菌条件下的制备易于由所属领域的技术人员熟知的标准药物技术实现。
[0201]
适合于肠胃外投与的调配物包括可含有抗氧化剂、缓冲剂、抑菌剂以及使得调配物与既定接受者的血液等张的溶质的水性和非水性无菌注射溶液;和可包括悬浮剂和增稠剂的水性和非水性无菌悬浮液。可使调配物存于单位剂量或多剂量容器(例如密封安瓿和小瓶)中,并且可在冷冻干燥(冻干)条件下储存,仅需要在使用之前即刻添加无菌液体载体(例如水)用于注射。即用型注射溶液和悬浮液可从先前所描述的种类的无菌粉末、颗粒和片剂来制备。
[0202]
实例方法:
[0203]
1)经添加以抑制水性调配物中的聚集的赋形剂,如缓冲剂和洗涤剂(通常为tween)。
[0204]
2)与适当赋形剂一起冷冻干燥以提供对饼状物有吸引力的松密度、稳定性和美观性
[0205]
3)使用如海藻糖的化合物形成玻璃星。
[0206]
对于向人类患者的经口和肠胃外投与,或其它投与途径,本发明的抗体或抗原结合片段、其衍生物或变异体的日剂量水准将通常为以单次或分次剂量投与的每个成人1到 1000mg(即约0.015到15mg/kg)。
[0207]
举例来说,剂量水准可为约0.5mg/kg至约10mg/kg,投与方案可为每周两次或三次,投与可为静脉内的。
[0208]
本发明的抗体或抗原结合片段、其衍生物或变异体也可鼻内或通过吸入投与且宜以来自加压容器、泵、喷雾器或雾化器(使用适合推进剂,例如二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、氢氟烷烃(如1,1,1,2
‑
四氟乙烷(hfa 134a3或1,1,1,2,3,3,3
‑
七氟丙烷(hfa 227ea3))、二氧化碳或其它适合气体)的干粉吸入器或气雾喷雾器呈递形式传递。在加压气雾剂的情况下,可通过提供用于递送量定量的阀门来确定剂量单位。加压容器、泵、喷雾器或雾化器可含有活性抗体或抗原结合片段、其衍生物或变异体的溶液或悬浮液,例如使用乙醇和推进剂的混合物作为溶剂,其可另外含有润滑剂,例如脱水山梨糖醇三油酸酯。在吸入器或吹入器中使用的胶囊和药筒(例如由明胶制得)可经调配以含有本发明化合物与如乳糖或淀粉的适合粉末基质的粉末混合物。
[0209]
气溶胶或干粉调配物优选地经布置以使得每一定量剂量或
‘
抽吸’含有至少1mg 用于向患者递送的本发明的抗体或抗原结合片段、其衍生物或变异体。应了解,气雾剂的总日剂量将在患者之间变化,且可以单次剂量或更通常地,遍及一整天的分次剂量投与。
[0210]
或者,本发明的抗体或抗原结合片段、其衍生物或变异体可以栓剂或子宫托形式投与,或其可以洗剂、溶液、乳膏、软膏或粉剂形式局部施用。本发明化合物还可经皮投与,例如通过使用皮肤贴片。其还可通过经眼途径投与。
[0211]
对于经眼使用,本发明的抗体或抗原结合片段、其衍生物或变异体可调配为等张、 ph调节的无菌生理盐水中的微粉化悬浮液,或优选地等张、ph调节的无菌生理盐水中的溶液,任选地与防腐剂(如苯扎氯铵)组合。或者,其可调配成软膏,如矿脂。
[0212]
对于局部施用至皮肤,本发明的抗体或抗原结合片段、其衍生物或变异体可调配含有悬浮或溶解于例如与以下中的一或多者的混合物中的活性化合物的适合软膏:矿物油、液体矿脂、白矿脂、丙二醇、聚氧乙烯聚氧丙烯化合物、乳化蜡和水。或者,其可调配为悬浮或溶解于例如以下中的一或多者的混合物中的适合洗剂或乳膏:矿物油、脱水山梨糖醇单硬脂酸酯、聚乙二醇、液体石蜡、聚山梨醇酯60、鲸蜡基酯蜡、鲸蜡硬脂醇、2
‑
辛基十二烷醇、苯甲醇和水。
[0213]
适合于在口中局部投与的调配物包括在调味基质(通常为蔗糖和阿拉伯胶或黄蓍胶)中包含活性成分的口含锭;在惰性基质(如明胶和甘油或蔗糖及和阿拉伯胶)中包含活性成分的片剂;和在适合的液体载剂中包含活性成分的漱口剂。
[0214]
使用持续释放药物传递系统,如微球可为优选的。这些经特定设计以减少注射频率。此类系统的实例为nutropin depot,其将重组人类生长激素(rhgh)囊封于一旦注射便经持续时段缓慢释放rhgh的生物可降解微球中。
[0215]
或者,本发明的抗体或抗原结合片段、其衍生物或变异体可通过直接将药物释放至所需位点的以手术方式植入的装置投与。
[0216]
电穿孔疗法(ept)系统也可用于投与抗体或抗原结合片段、其衍生物或变异体。将脉冲电场传递至细胞的装置增加细胞膜对于药物的渗透率,导致胞内药物传递的显著增强。
[0217]
抗体或抗原结合片段、其衍生物或变异体也可通过电合并(ei)传递。ei在皮肤表面上的直径为至多30微米的小粒子经历与电穿孔中所用一致或类似的电脉冲时发生。在ei中,这些粒子驱动穿过角质层且进入皮肤的更深层。粒子可负载或涂布有药物或基因或仅可充当在皮肤中产生药物可进入的孔隙的“子弹”。
[0218]
抗体或抗原结合片段、其衍生物或变异体传递的替代方法为热敏regel可注射剂。低于体温时,regel为可注射液体,而在体温处其立即形成缓慢腐蚀且溶解为已知的安全的生物可降解聚合物的凝胶储集器。活性药物在生物聚合物溶解时随时间推移传递。
[0219]
抗体或抗原结合片段、其衍生物或变异体药物也可经口传递。一种此类系统利用经口吸收身体中的维生素b12的天然过程来共传递蛋白质和多肽。通过骑乘维生素b12 吸收系统,蛋白质或多肽可移动穿过肠壁。在维生素b12类似物与药物之间产生保留对于复合物的维生素b12部分中的内因子(if)的显著亲和力和复合物的药物部分的显著生物活性的复合物。
[0220]
本发明的第二方面的组合物可进一步包含至少一种其它药剂。
[0221]
此类其它药剂可为消炎剂(其包括(但不限于)非类固醇消炎剂(nsaid))、疾病改善抗风湿药物(dmard)、抑制素(包括hmg
‑
coa还原酶抑制剂,如辛伐他汀 (simvastatin))、生物剂(生物制剂)、类固醇、免疫抑制剂、水杨酸盐和/或杀微生物剂。非类固醇消炎剂包括
抗代谢物药剂(如甲胺喋呤)和消炎金剂(包括硫代苹果酸金钠、硫金苹果酸盐或金盐,如金诺芬)。生物制剂包括抗tnf药剂(包括阿达木单抗 (adalimumab)、依那西普(etanercept)、英利昔单抗(infliximab)、抗il
‑
1试剂、抗il
‑
6 试剂、抗b细胞试剂(利妥昔单抗(retoximab))、抗t细胞试剂(抗cd4抗体)、抗il
‑
15 试剂、抗clta4试剂、抗rage试剂)、抗体、可溶受体、受体结合蛋白、细胞因子结合蛋白、具有改变或减弱功能的突变蛋白、rnai、聚核苷酸适体、反义寡聚核苷酸或ω 3脂肪酸。类固醇(又称为皮质类固醇)包括可的松(cortisone)、泼尼龙(prednisolone) 或地塞米松(dexamethasone)。免疫抑制剂包括环孢素、fk506、雷帕霉素、霉酚酸。水杨酸盐包括阿司匹林(aspirin)、水杨酸钠、水杨酸胆碱和水杨酸镁。杀微生物剂包括奎宁和氯奎。举例来说,抗体或抗原结合片段、其衍生物或变异体可与nsaid、dmard 或免疫抑制剂中的一或多者组合投与
[0222]
在本发明的第三方面中,提供如本发明的第一和第二方面所定义的抗体或抗原结合片段、其衍生物或变异体或组合物,其用作药剂。
[0223]
在本发明的第四方面中,提供如本发明的第一或第二方面所定义的抗体或抗原结合片段、其衍生物或变异体或组合物,其用于治疗和/或诊断慢性发炎性病况。
[0224]
在本发明的第五方面中,提供如本发明的第一或第二方面所定义的抗体或抗原结合片段、其衍生物或变异体或组合物的用途,其用于制造用于治疗和/或诊断慢性发炎性病况的药剂。
[0225]
在本发明的第六方面中,提供治疗慢性发炎性病况的方法,其包含向个体投与有效量的如本发明的第一或第二方面所定义的抗体或抗原结合片段、其衍生物或变异体或组合物。
[0226]
如本发明的第三、第四、第五或第六方面所定义的抗体或抗原结合片段、其衍生物或变异体、组合物、用途或方法可涉及慢性发炎性病况的治疗,其中病况与不当发炎相关的任何病况相关。此类病况包括(但不限于)类风湿性关节炎(ra)、自身免疫病况、发炎性肠病、非愈合伤口、多发性硬化症、癌症、动脉粥样硬化、修格连氏病(sjogrensdisease)、糖尿病、红斑狼疮(包括全身性红斑狼疮)、哮喘、纤维化疾病(包括肝硬化)、肺纤维化、uv损伤和牛皮癣。
[0227]
如第一或第二方面所定义的抗体或抗原结合片段、其衍生物或变异体或组合物可例如用于以下中的一或多者:诊断个体的慢性发炎性病况状态;评估个体罹患慢性发炎性病况的可能性;测定患有慢性发炎性病况的个体的预后;监测慢性发炎性病况的疾病进展;和/或监测用于慢性发炎性病况的治疗的有效性或个体对所述治疗的反应。
[0228]
在本发明的第七方面中,提供如第一或第二方面所定义的抗体或抗原结合片段、其衍生物或变异体或组合物,其用于诊断慢性发炎性病况和/或测定患有慢性发炎性病况的患者的预后。
[0229]
在本发明的第八方面中,提供诊断慢性发炎性病况和/或测定患有慢性发炎性病况的患者的预后的方法,其包含使用如第一或第二方面所定义的抗体或抗原结合片段、其衍生物或变异体或组合物检测腱生蛋白c的fbg域的存在或不存在或量。
[0230]
测定的预后可例如为慢性发炎性病况的恶化。或者,预后可为慢性发炎性病况的减轻(即改善),或预后可为慢性发炎性病况保持原样(即保持恒定而不恶化或改善)。
[0231]
在一个实施例中,第八方面的方法为体外方法。在替代实施例中,第八方面的方法
为体内方法。
[0232]
检测的腱生蛋白c的fbg域的量的增加可指示慢性发炎性病况测定和/或患有慢性发炎性病况的患者的预后。或者,检测的腱生蛋白c的fbg域的量的减少可指示慢性发炎性病况测定和/或患有慢性发炎性病况的患者的预后。
[0233]
优选地,第七方面的抗体或抗原结合片段、其衍生物或变异体或组合物或第八方面的方法允许从衍生自个体或患者的样品中的腱生蛋白c的fbg域的水准或量的分析诊断个体的慢性发炎性病况,或测定患者的预后。
[0234]
在所有方面的优选实施例中,慢性发炎性病况为类风湿性关节炎(ra)和/或侵蚀性类风湿性关节炎。
[0235]
存在于衍生自个体的样品中的腱生蛋白c的fbg域的水准或量可通过在任何适合分析中使用本发明的抗体或抗原结合片段、其衍生物或变异体测定,其可包含使用以下中的一或多者:免疫分析;光谱测定法;西方墨点法;elisa;免疫沉淀;狭缝印迹或斑点印迹分析;等电聚焦;sds
‑
page;抗体微阵列;免疫组织学染色;放射免疫分析 (ria);荧光免疫分析;和/或使用抗生素蛋白
‑
生物素或抗生蛋白链菌素
‑
生物素系统的免疫分析。这些方法是所属领域中众所周知的。
[0236]
我们通过“样品”包括来源于个体的血液(例如血清或血浆)、滑膜流体、脑脊髓液(csf)、尿液和/或关节组织的样品。
[0237]
优选地,将检测的腱生蛋白c的fbg域的量或水准相比于参考值以测定量或水准相比于参考值是否已增加、减少或保持相同。
[0238]
优选地,腱生蛋白c的fbg域的所检测水准或量所比较的参考值为来源于一或多个个体的样品中检测的腱生蛋白c的fbg域的量或水准,所述个体不具有任何可检测慢性发炎性病况/病症或慢性发炎性病况/病症的任何临床症状(在本文中称为“正常样本”)且因此具有所谓的腱生蛋白c的fbg域的“正常值”(也称为“正常水准”或“正常量”)。那些正常水准的实际测量值将取决于用于检测其的特定分析。但是,存在于样品中的腱生蛋白c的fbg域的正常水准/量(即正常值)的一个实例将为15
‑
25ng/ml,优选地20
‑
21ng/ml,最优选地20.7ng/ml,如关于page等人(2012)的表2中的腱生蛋白c水准在先前所描述,其中已描述健康个体和患有发炎病况的患者的血清中的腱生蛋白c表达。
[0239]
优选地,样品中测量的腱生蛋白c的fbg域的水准相比于正常样品中的水准(即腱生蛋白c的fbg域的正常值/水准/量)的约50%或更大的增加诊断患有慢性发炎性病况或判定患有慢性发炎性病况的患者的预后。但是,在其它实施例中,样品中测量的腱生蛋白c的fbg域的水准相比于正常样品中的水准的50%、55%、60%、65%、70%、 75%、80%、85%、90%、95%或100%或更大的增加诊断患有慢性发炎性病况或判定患有慢性发炎性病况的患者的预后。
[0240]
举例来说,如果来源于个体的样品中测量的腱生蛋白c的fbg域的水准相比于来自健康个体的样品中测量的腱生蛋白c的fbg域的正常水准增加50%或更大(即在正好一个特定实例中,在其测量为31ng/ml或更大的情况下),那么个体被诊断为患有慢性发炎性病况(例如ra)和/或测定个体的预后。测定的预后可为慢性发炎性病况的恶化。或者,预后可为慢性发炎性病况的减轻(即改善),或预后可为慢性发炎性病况保持原样(即保持恒定而不恶化或改善)。
[0241]
在第七和第八方面的抗体或抗原结合片段、其衍生物或变异体或方法的一特定实施例中,检测的腱生蛋白c的fbg域的量相比于正常水准的至少50%增加指示慢性发炎性病况测定和/或患有慢性发炎性病况的患者的预后。
[0242]
在本发明的第九方面中,提供用于测定用于个体的适当治疗的如第一或第二方面所定义的抗体或抗原结合片段、其衍生物或变异体或组合物,其中检测的腱生蛋白c的 fbg域的量指示用于个体的适当治疗。
[0243]
在本发明的第十方面中,提供测定用于个体的适当治疗的方法,其包含使用如第一或第二方面所定义的抗体或抗原结合片段、其衍生物或变异体或组合物检测腱生蛋白c 的fbg域的存在或不存在或量,其中检测的腱生蛋白c的fbg域的量指示用于个体的适当治疗。
[0244]
在一个实施例中,第十方面的方法为体外方法。在替代实施例中,第十方面的方法为体内方法。
[0245]
适当治疗可包含投与有效量的药剂或组合物,所述药剂或组合物可为以下中的一或多者:抗体或抗原结合片段、其衍生物或变异体,或如第一或第二方面所定义的组合物; dmards(如甲胺喋呤);抗tnf药物;抗il17疗法;t细胞共刺激调节剂(如orencia
tm
‑ꢀ
阿巴西普):白介素
‑
6(il
‑
6)抑制剂(如actemra
tm
‑
托西利单抗);抗cd20抗体(如 rituxan
tm
‑
rituxumab;b细胞活化因子(如抗baff);janus激酶(jak)的抑制剂(如 tofacitinib
tm
);脾酪氨酸激酶(syk)的抑制剂(如fostamatinib
tm
);瓜氨酸化腱生蛋白c域的一或多种抗tnc抗体;和/或调节瓜氨酸化和/或非瓜氨酸化腱生蛋白c的生物活性的药剂。
[0246]
在特定实施例中,适当治疗靶向腱生蛋白c的fbg域。
[0247]
在另一特定实施例中,适当治疗为投与有效量的如第一或第二方面所定义的抗体或抗原结合片段、其衍生物或变异体或组合物。
[0248]
任选地,第九和第十方面所定义的个体患有慢性发炎性病况。个体可或可不在进行方法之前如此诊断。
[0249]
在某些实施例中,检测的腱生蛋白c的fbg域的量的增加指示适当治疗。在替代实施例中,检测的腱生蛋白c的fbg域的量的减少指示适当治疗。
[0250]
在一个实施例中,样品中测量的腱生蛋白c的fbg域的水准相比于正常样品中的水准(即腱生蛋白c的fbg域的正常水准或量)的约50%或更大的增加或减少判定个体的适当治疗。但是,在其它实施例中,样品中测量的腱生蛋白c的fbg域的水准相比于正常样品中的水准的50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%或更大的增加或减少判定个体的适当治疗。
[0251]
举例来说,如果来源于个体的样品中测量的腱生蛋白c的fbg域的水准相比于来自健康个体的样品中测量的腱生蛋白c的fbg域的正常水准增加50%或更大(即在正好一个特定实例中,在其测量为31ng/ml或更大的情况下),那么测定适当治疗。举例来说,其可接着通过投与有效量的药剂或组合物测定为治疗个体,所述药剂或组合物可为以下中的一或多者:抗体或抗原结合片段、其衍生物或变异体,或如第一或第二方面所定义的组合物;dmards(如甲胺喋呤);抗tnf药物;抗il17疗法;t细胞共刺激调节剂(如orencia
tm
‑
阿巴西普):白介素
‑
6(il
‑
6)抑制剂(如actemra
tm
‑
托西利单抗);抗cd20抗体(如rituxan
tm
‑
rituxumab;b细胞活化因子(如抗baff);janus激酶(jak)的抑制剂(如tofacitinib
tm
);脾酪
氨酸激酶(syk)的抑制剂(如fostamatinib
tm
);瓜氨酸化腱生蛋白c域的一或多种抗tnc抗体;和/或调节瓜氨酸化和/或非瓜氨酸化腱生蛋白c的生物活性的药剂。
[0252]
在一个实施例中,检测的腱生蛋白c的fbg域的增加指示需要增加量的适当治疗。在一替代实施例中,检测的腱生蛋白c的fbg域的减少指示需要增加量的适当治疗。
[0253]
优选地,样品中测量的腱生蛋白c的fbg域的水准相比于正常样品中的水准(即腱生蛋白c的fbg域的正常水准或量)的50%或更大的增加或减少指示需要增加或减少量的适当治疗。但是,在其它实施例中,样品中测量的腱生蛋白c的fbg域的水准相比于正常样品中的水准的50%、55%、60%、65%、70%、75%、80%、85%、90%、 95%或100%或更大的增加或减少指示需要增加或减少量的适当治疗。增加或减少量的适当治疗可为治疗的剂量、投药频率或持续时间的增加或减少。
[0254]
在第九和第十方面的抗体或抗原结合片段、其衍生物或变异体或组合物或方法的一个实施例中,检测的腱生蛋白c的fbg域的量相比于腱生蛋白c的fbg域的正常水准的至少50%增加测定适当治疗和/或指示需要增加量的适当治疗。
[0255]
便利地,诊断方法或测定第八和/或第十方面的适当治疗的方法包含进行以下中的一或多者:免疫分析;光谱测定法;西方墨点法;elisa;免疫沉淀;狭缝印迹或斑点印迹分析;等电聚焦;sds
‑
page;抗体微阵列;免疫组织学染色;放射免疫分析(ria);荧光免疫分析;和/或使用抗生素蛋白
‑
生物素或抗生蛋白链菌素
‑
生物素系统的免疫分析。
[0256]
如本发明的第七、第八、第九或第十方面所定义的抗体或抗原结合片段、其衍生物或变异体、组合物或方法可涉及慢性发炎性病况的治疗,其中病况与不当发炎相关的任何病况相关。此类病况包括(但不限于)类风湿性关节炎(ra)、自身免疫病况、发炎性肠病、非愈合伤口、多发性硬化症、癌症、动脉粥样硬化、修格连氏病(sjogrens disease)、糖尿病、红斑狼疮(包括全身性红斑狼疮)、哮喘、纤维化疾病(包括肝硬化)、肺纤维化、uv损伤和牛皮癣。
[0257]
在本发明的第十一方面中,提供包含以下的分试剂盒:
[0258]
(i)如本发明的第一或第二方面所定义的抗体或其抗原结合片段、衍生物或或组合物变异体
[0259]
(ii)投与构件
[0260]
(iii)使用说明书
[0261]
本发明的第七方面的试剂盒可另外任选地包含
[0262]
(iv)至少一种其它药剂。
[0263]
根据本发明的另一方面,提供用于测定个体的慢性发炎性病况状态的分试剂盒,其包含:
[0264]
(i)如本发明的第一或第二方面所定义的抗体或其抗原结合片段、衍生物或或组合物变异体;和
[0265]
(ii)使用说明书
[0266]
通过“慢性发炎性病况状态”,我们包括测定患有或不患有慢性发炎性病况的个体的预后和/或测定用于所述个体的适当治疗的诊断。
[0267]
本发明的其它方面涉及鉴别对于fbg具有特异性的一或多种治疗抗体,如更早方面中描述的抗体的方法(参见实例中描述的详细抗体筛选方法)。
[0268]
最终治疗分子的详细规范在起始抗体分离项目之前重要。对于本文中经分离的抗体,设定的规范提供于下表:
[0269]
表a.抗体选择的规范。
[0270][0271][0272]
*或如果存在可接受概况在符合“第二里程碑”标准之前实现的协议
[0273]
关键要求为识别对于腱生蛋白c fbg具有高亲和力的抗体,能够阻断细胞活化和发炎性细胞因子产生(回应于腱生蛋白c fbg),且具有与其它物种的足够交叉反应性以允许在那些物种中进行相关安全性和功效研究(且因此对于平行试剂无要求)。
[0274]
也认为有利的是具有对于腱生蛋白家族的其它成员具有较低亲和力的先导抗体且因此基于相比于其它紧密相关蛋白质对腱生蛋白c具有较高程度的同源性(在氨基酸水准上)的此蛋白质选择腱生蛋白r用于特异性测试。细胞效能定义为能够在一组基于相关细胞的分析中抑制腱生蛋白c fbg源性细胞因子释放的最大半浓度。最后,候选物需要在相关抗体型式中稳定以提供在产物的可制造性中不存在重要问题的一些早期指示。
[0275]
采用的筛选方法是基于产生具有正确规范的抗体。因此,初始elisa筛选并入结合人类、大鼠、小鼠和狗tnc
‑
fbg的测试。也针对人类腱生蛋白r fbg测试阳性克隆体。将具有适当结合特性的那些亚克隆为用于效能筛选中的测试的适合抗体型式(thp
‑
1 blue
tm
分析中的fc
‑
his
‑
fbg诱导的碱性磷酸酶报告子的抑制用于筛选且接着通过测量来自thp
‑
1细胞的fc
‑
his
‑
fbg诱导的细胞因子表达的抑制确认活性)。通过第一里程碑的先导克隆体考虑进行先导最佳化,其中噬菌体呈现方法调适用于提供通过第2里程碑的抗体。在考虑进行先导最佳化的本文所述的
‘
亲体’抗体(2a5、b12、f3和d8)中,两个(2a5和b12)提供通过先前同意的规格的最佳化克隆体。
[0276]
因此,在本发明的另一方面中,提供一种鉴别一或多种对腱生蛋白c的fbg域具有特异性的治疗抗体的方法,其包含选择具有表a中列出的特性中的一或多个的抗体。优选地,抗体展现在“第一里程碑”下所列的所有特性,甚至更优选地,抗体展现表a 中的所有特性。
[0277]
在一个实施例中,鉴别一或多种对腱生蛋白c的fbg域具有特异性的治疗抗体的方
法包含选择具有以下特性中的一或多个的抗体:
[0278]
(a)所述抗体为fab或完全抗体(优选地人类igg2或人类igg4);
[0279]
(b)所述抗体对人类腱生蛋白c fbg具有1
‑
10nm的通过表面等离子体共振(spr) 测定的结合亲和力,和/或所述抗体在基于细胞的分析中显示腱生蛋白c的浓度相关抑制,优选地ic50<100nm的诱发性细胞因子释放,优选地使用fc
‑
his
‑
fbg;和
[0280]
(c)所述抗体结合到人类fbg和小鼠、大鼠和狗fbg中的一或多个,优选地通过 elisa测量,所述抗体优选地结合到人类、小鼠、大鼠和狗fbg中的全部。
[0281]
优选地,抗体也展现以下额外特性中的一或多个:
[0282]
(d)所述抗体不结合至人类腱生蛋白r,或展现相比于人类腱生蛋白c阳性对照减少的与人类腱生蛋白r的结合;和
[0283]
(e)所述抗体以至少1mg/ml可溶于pbs。
[0284]
优选地,通过spr测定的亲和力效能为≤320pm和/或在基于细胞的分析中对于诱发性细胞因子释放存在≤1nm的ic50,优选地使用fc
‑
his
‑
fbg。
[0285]
优选地,所述抗体对于至少一种啮齿动物(例如大鼠)和一种非啮齿动物(例如狗) 腱生蛋白c同功异型物具有≤3nm的亲和力。
[0286]
优选地,与人类腱生蛋白r的最大半结合的浓度大于人类腱生蛋白c的等效结合信号至少50倍,优选地100倍,优选地通过elisa结合实验或通过spr测量。优选地,当通过spr测量时,与人类腱生蛋白r的最大半结合的浓度大于与人类腱生蛋白c的等效结合信号至少50倍。优选地,当通过elisa测量时,与人类腱生蛋白r的最大半结合的浓度大于与人类腱生蛋白c的等效结合信号至少100倍。
[0287]
优选地,所述抗体经14天在不沉淀/聚集的情况下以至少20mg/ml可溶于pbs。
[0288]
在本发明的另一方面中,提供一种鉴别一或多种对腱生蛋白c的fbg域具有特异性的治疗抗体的方法,其包含以下步骤:
[0289]
(i)关于结合人类腱生蛋白c fbg和大鼠、小鼠和狗腱生蛋白c fbg中的一或多个的抗体或其片段筛选抗体或抗体片段库,例如噬菌体库,优选地通过elisa;
[0290]
(ii)关于相比于人类腱生蛋白c fbg减少的与人类腱生蛋白r fbg的结合测试(i) 中鉴别的阳性抗体或片段,优选地通过elisa;
[0291]
(iii)将来自(i)和(ii)的鉴别具有所需特性的抗体或片段亚克隆为就效能筛选来说适合的型式(例如fab、fc
‑
scfv、igg2或igg4);和
[0292]
(iv)鉴别展现fc
‑
his
‑
fbg活性抑制的来自(iii)的抗体或片段。
[0293]
任选地,表面等离子体共振(spr)用于步骤(i)和/或(ii)。
[0294]
优选地,步骤(iv)利用fc
‑
his
‑
fbg诱导性碱性磷酸酶报告子(例如在thp
‑
1blue
tm
分析中);和/或测量fc
‑
his
‑
fbg诱导性细胞因子表达(例如来自thp
‑
1细胞)的抑制。
[0295]
在步骤(i)中,优选地,所述抗体或片段结合到人类、大鼠、小鼠和狗腱生蛋白cfbg中的全部。
[0296]
任选地,依序进行方法步骤,然而,其可替代地按任何次序进行。
[0297]
在一个实施例中,通过进行步骤(i)
‑
(iv)的方法鉴别的一或多种治疗抗体展现前述方面的特性(a)
‑
(e)中的一或多个。
[0298]
定义
[0299]
我们通过“发炎”包括通过组织损伤、感染或局部免疫反应起始的流体、血浆蛋白和白色血细胞的局部积聚的含义。
[0300]
我们通过“急性发炎”包括发炎的初始阶段(起始)和紧接着损伤、感染或局部免疫反应之后的短期短暂发炎性反应的含义。通常,急性发炎快速消退,持续大约几分钟至不长于几天。
[0301]
我们通过“慢性发炎”包括持续性和/或未消退发炎的含义。其通常与健康组织的不当破坏相关。这可能是进行性的且持续几周或更长的时段。慢性发炎通常与持续性感染或疾病,包括(但不限于)自身免疫病况相关。
[0302]
我们通过“慢性关节发炎”包括进行性且经几周至几个月的时段不间断,导致如在人类疾病中观测的受影响关节的畸变以及软骨和骨骼破坏的放射证据的持续性发炎的含义(kelly,harris,ruddy和sledge,《风湿病学教科书(textbook of rheumatology)》第4版)。
[0303]
在实验鼠类模型中,慢性关节发炎的特征在于不消退且造成不当组织破坏,甚至持续相对较短时段的发炎。这在组织学上通过滑膜和关节空间中长期存在发炎性细胞、软骨细胞死亡以及软骨和骨骼侵蚀表征(且可通过其鉴别)。
[0304]
我们通过“片段”意指至少四个氨基酸,例如至少4、5、6、7、8、9、10、11、12、 13、14、15、16、17、18、19、20、25、30、35、40、45、50个氨基酸。
[0305]
两个多肽之间的序列一致性百分比可使用适合的计算机程序,例如威斯康星大学遗传计算组(university of wisconsin genetic computing group)的gap程序测定且应了解,一致性百分比是关于序列已最佳比对的聚核苷酸计算。
[0306]
比对可替代地使用clustal w程序进行(如thompson等人,1994,《核算研究(nuc. acid res.)》22:4673
‑
4680)中所述。
[0307]
使用的参数可为如下:
[0308]
快速成对比对参数:k
‑
元组(字体)大小;1,窗口大小;5,空隙罚分;3,顶对角线数目;5.评分方法:x%。
[0309]
多序列比对参数:空隙开口罚分;10,空隙扩展罚分;0.05。
[0310]
计分矩阵:blosum。
[0311]
或者,bestfit程序可用于测定局部序列比对。
[0312]
我们通过“抗体”包括基本上完整的抗体分子,以及嵌合抗体、人类化抗体、人类抗体(其中至少一个氨基酸相对于天然存在的人类抗体突变)、单链抗体、双特异性抗体、抗体重链、抗体轻链、抗体重链和/或轻链的同型二聚体和异二聚体,以及其抗原结合片段和衍生物。
[0313]
我们通过“抗原结合片段”意指能够结合至腱生蛋白c的fbg域的抗体的功能片段。
[0314]
术语“个体(subject)”或“个体(individual)”意指包括人类的所有动物。个体的实例包括人类、母牛、狗、猫、山羊、绵羊和猪。术语“患者”意指患有需要治疗的病症的个体。
[0315]
如本文所用,
‘
药物调配物’意指根据本发明的治疗有效调配物。
[0316]
如本文所用,
‘
治疗有效量’或
‘
有效量’或
‘
治疗有效’是指对于给定病况和投与方案提供治疗效果的所述量。这是与所需的添加剂和稀释剂,即载剂或投与媒剂结合产生所需治疗效果的计算的活性物质的预定量。另外,其预期意指足以减少且最优选地预防宿主
的活动、功能和反应的临床显著缺陷的量。或者,治疗有效量足以引起宿主的临床显著病况的改善。如所属领域的技术人员所理解,化合物的量可取决于其比活性而变化。适合剂量可含有与所需的稀释剂结合产生所需治疗效果的计算的活性组合物的预定量。在制造本发明的组合物的方法和用途中,提供治疗有效量的活性组分。治疗有效量可由熟练的医疗或兽医工作人员基于所属领域中所熟知的患者特征,如年龄、体重、性别、病况、并发症、其它疾病等测定。
附图说明
[0317]
现将参看以下图式描述体现本发明的一方面的实例:
[0318]
图1.人类腱生蛋白c和其域的氨基酸序列
[0319]
图2.人类腱生蛋白c的核苷酸序列
[0320]
图3.多克隆噬菌体elisa。
[0321]
多克隆衍生的第2轮输出噬菌体与涂布有抗原或融合搭配物(fc或cd4)和检测具有抗m13 mab和铕标记的抗小鼠抗体的结合噬菌体的孔一起培育。存在第1轮与第2 轮选择之间的抗原特异性结合剂的富集和相比于第2轮输出群体中的抗fc或rcd4噬菌体的较大比例的hufbg结合剂。
[0322]
图4.分泌的碱性磷酸酶释放的thp1
‑
blue分析中的纯化抗fbg的筛选,通过荧光分析测定。
[0323]
在可达到的最高浓度下测试抗体。在纯化scfv
‑
fc克隆体的验证分析中,2a3、2a5、 2b11和2d12鉴别为通过10nm fc
‑
his
‑
hufbg诱发的信号传导的有效阻断剂(a)。纯化抗fbg fab的分析突出显示包括抗体a12、b12、c2、d7、d8、f3和g1的其它分析的多次额外成功结果。在此实验中,细胞用3nm fc
‑
his
‑
hufbg刺激(b)。
[0324]
图5.与固定的tnc fbg
‑
rcd4蛋白质(人类、小鼠、大鼠和狗)和人类tnrfbg
‑
rcd4的纯化fab结合的交叉反应性elisa结果。
[0325]
使用抗κ或抗λmab,接着使用铕共轭的抗小鼠mab检测结合。
[0326]
图6.biacore传感图迹线用于测定fbg蛋白质与在cm5传感器芯片上捕获的抗 fbg fab b12(a)、2a5(b)、f3(c)和d8(d)的结合的动力学。
[0327]
迹线指示人类、大鼠和小鼠腱生蛋白c rcd4
‑
fbg和人类腱生蛋白r rcd4
‑
fbg的结合。
[0328]
图7.分泌的碱性磷酸酶(seap)释放通过抗fbg fab b12、2a5、d8和f3的浓度相关抑制。
[0329]
纯化抗体在37℃下在3nm人类fc
‑
his
‑
fbg存在下与thp1
‑
blue细胞一起培育18 h。fc
‑
his
‑
fbg诱发的seap的抑制的ic50值为b12(1.7nm)、2a5(20.6nm)、d8 (7.2nm)、f3(8.4nm)。
[0330]
图8.通过抗fbg fab b12、2a5、d8和f3的il
‑
8产生的浓度相关抑制。
[0331]
纯化抗体在37℃下在3nm人类fc
‑
his
‑
fbg存在下与thp1
‑
blue细胞一起培育18 h。fc
‑
his
‑
fbg诱发的il
‑
8释放的抑制的ic50值为b12(6.9nm)、2a5(28.5nm)、 d8(14.9nm)、f3(13.8nm)。
[0332]
图9.抗fbg先导抗体的cdr3随机化策略。
[0333]
vh cdr3随机化在6个残基的三个重叠区段(标记的vh 3.1、vh 3.2和vh 3.3) 中各自进行且vl cdr3在两个的区段(标记的vl 3.1和vl 3.2)中随机化。箭头指示引入至模板dna中以消除主导库的亲体克隆体的终止密码子的位置。(b)用于cdr3 库产生的寡核苷酸。
[0334]
图10.cdr随机化抗体库的选择策略
[0335]
(a)使用cdr随机化库对人类rcd4
‑
his
‑
fbg的选择。(b)使用b12 vh和vl cdr 3随机化库对人类和小鼠fbg的杂交选择。
[0336]
图11.用于筛选亲和力成熟的克隆体以改进与生物素标记的小鼠或人类rcd4
‑
fbg 的结合的抗flag捕获elisa型式的示意图。
[0337]
图12.通过亲和力成熟的higg4抗体165_13_b1、165_13_c3和160_01_a4的fbg 诱发的细胞因子释放的抑制。
[0338]
在200nm人类fc
‑
his
‑
fbg存在下培育初生人类pbmc(37℃,24h)且关于il
‑
8 (a)和tnfa(b)分析测试抗体(100nm或1μm)和上清液。所有测试抗体阻断诱发的细胞因子释放。数据指示由3个分离供体产生的平均值
±
标准误差平均值。
[0339]
图13.来自膝盖置换手术之后的类风湿性关节炎患者的膝盖滑膜的固定冷冻切片中的内源性腱生蛋白c fbg的免疫染色。
[0340]
在阳性对照抗腱生蛋白抗体(a)和型式化为小鼠igg2a的b12抗fbg(c)的情况下可见滑膜的特异性染色。在非免疫同型对照抗体(b、d)的情况下观测到较低水准的非特异性染色。
[0341]
图14.抗体c3(165_13_c3)和b12当用于西方墨点法分析时显示对于tnc
‑
fbg 的良好特异性。
[0342]
重组tnc
‑
fbg(nascient)、tnr
‑
fbg或纤维蛋白原(肯尼迪风湿病学研究所(kir)) 用以下抗体检测:a)在1:20,000(0.25μg/ml)下的165_13_c3 igg4 mab,在4℃下过夜,b)在1:20,000(0.25μg/ml)下的b12 igg4 mab,在4℃下过夜,c)在1:2,000 (0.1μg/ml)下的抗腱生蛋白r抗体(santa cruz biotechnology,sc
‑
9875),在4℃下过夜,d)在1:500下的抗tnc
‑
fbg多克隆抗体(midwood group),在4℃下过夜。
[0343]
图15.使用单克隆抗体b12和对应同型对照的神经胶瘤细胞裂解物的西方墨点法分析。
[0344]
神经胶瘤细胞裂解物(kir)和腱生蛋白c(nascient)用以下各者检测:a.在1:20,000 下的b12 igg4 mab,在4℃下过夜;b.在1:4,000下的igg4同型对照(eureka治疗剂),在4℃下过夜。
[0345]
图16a.fc
‑
his
‑
fbg以剂量依赖性方式体外结合到tlr4。含重组人类tlr4(r&dsystems)的pbs(或单独的pbs)在阻断指定浓度的人类fc
‑
his
‑
fbg之后结合至96孔板。添加且通过培育1μg/ml的抗人类igg1 mab(abd serotec,克隆体2c11)、1μg/ml 的抗小鼠hrp共轭的二级抗体(abd serotec,star13b)和tmb基质进行检测。n=4,显示平均值和sem。
[0346]
图16b.单克隆ab c3(165_13_c3)破坏体外结合fbg和tlr4。含重组人类tlr4 的pbs(或单独的pbs)在阻断与c3 mab一起预培育的重组人类fc
‑
his
‑
tnc
‑
fbg(100 nm)或添加同型对照抗体之后结合至96孔板。通过连续培育针对蛋白质的fc部分的抗体、抗小鼠hrp共轭的二级抗体和tmb基质进行检测。相比于同型对照样品(ic50=44.5 nm)计算c3预培育
样品中的百分比抑制。n=4
[0347]
图17.单克隆抗体c3(165_13_c3)通过用人类或小鼠tnc
‑
fbg,但不用lps刺激的初生人类巨噬细胞降低促炎性细胞因子的产生。
[0348]
(a)重组人类腱生蛋白c fbg(1μm)或lps(enzo)(1ng/ml)用mab c3(1、 0.2和0.04μm)或同型对照mab(1μm)在室温下预培育30分钟,随后一式三份地添加至人类m2巨噬细胞培养物。在24h之后,获取上清液且经受il
‑
8、il
‑
6和tnf细胞因子elisa(bd biosciences)。n=3;(b)重组鼠类腱生蛋白c fbg(1μm)用mabc3(1、0.2和0.04μm)或同型对照mab(1μm)在室温下预培育30分钟,随后一式三份地添加至人类m2巨噬细胞培养物。在24h之后,获取上清液且经受细胞因子 elisa。n=3或更大,显示平均值和sem;(c)使用fc部分突变为非活性的蛋白质 (fc
‑
mut
‑
his
‑
fbg)。也在此系统中测试其它有前景的抗tnc
‑
fbg抗体、b12和a4。在室温下预培育fc
‑
mut
‑
his
‑
fbg(1μm)和c3、160_01_a4或b12(1μm)30分钟,随后添加至人类m2巨噬细胞培养物。在24h之后,获取上清液且经受细胞因子elisa。 n=3,显示平均值和sem。
[0349]
图18a.单克隆抗体b12通过用人类tnc
‑
fbg刺激的初生人类巨噬细胞减少促炎性细胞因子的产生。重组人类腱生蛋白c fbg(1μm)与mab b12(1、0.1、0.01或 0.001μm)或同型对照mab(1μm)一起预培育,随后一式三份地添加至人类m2巨噬细胞培养物。在24h之后,获取上清液且经受细胞因子elisa。
[0350]
图18b.在实验室和更大规模产生的单克隆抗体c3(165_13_c3)在通过初生人类巨噬细胞的fbg诱导的细胞因子合成的阻断中显示相同功效水准。
[0351]
将在较大规模产生的抗体的效能相比于在实验室规模产生的抗体的效能。重组人类腱生蛋白c fbg(1μm)用mab c3(1、0.2和0.04μm)或同型对照mab(1μm)在室温下预培育30min,随后一式三份地添加至人类m2巨噬细胞培养物。在24h之后,获取上清液且经受细胞因子elisa。n=1,ico=实验室规模,lon=更大规模。
[0352]
图19.单克隆抗体c3(165_13_c3)通过用人类tnc
‑
fbg刺激的ra滑膜成纤维细胞减少促炎性细胞因子的产生。
[0353]
重组人类腱生蛋白c fbg(1μm)用mab c3或同型对照mab在室温下预培育30 分钟,随后一式三份地添加至来自ra患者的人类滑膜成纤维细胞培养物。在24h之后,获取上清液且经受细胞因子elisa。n=1,显示平均值和sem
[0354]
图20.大鼠cia模型中的腱生蛋白c的水准。
[0355]
来自胶原蛋白诱导性关节炎的大鼠模型的滑膜流体的tnc水准。测量的tnc的量相对于每一爪的对应临床评分标绘显示。
[0356]
图21.来自胶原蛋白诱导性关节炎的大鼠模型中的c3(165_13_c3)抗体的评估的临床评分。
[0357]
媒剂相对于1mg/kg、3mg/kg和10mg/kg c3抗体。数据以平均值
±
sem呈现。统计有效性:当相比于第7天时,####p<0.0001,当相比于媒剂处理组时**p<0.01。
[0358]
图22:来自胶原蛋白诱导性关节炎的大鼠模型中的c3(165_13_c3)抗体的评估的后爪体积。
[0359]
媒剂相对于1mg/kg、3mg/kg和10mg/kg c3抗体。数据以平均值
±
sem呈现。统计有效性:当相比于第0天时##p<0.01且####p<0.0001,当相比于媒剂处理组时*p<0.05 且**p<
0.01。
[0360]
图23.用于抗原克隆的引物
[0361]
此表详述用于产生用于抗原克隆的表达构筑体的引物。
[0362]
实例1
‑
产生纯化腱生蛋白c fbg作为抗原和分析试剂
[0363]
产生含有腱生蛋白c的fbg域(tnc fbg)的纯化可溶蛋白质以用作抗体选择中的抗原以及后续筛选和表征分析中的试剂。为了使得选择策略能够分离结合多个哺乳动物物种的腱生蛋白c的抗体,合成一系列dna表达构筑体,其并有人类[seq id no:92]、小鼠[seq id no:93]、大鼠[seq id no:94]或狗[seq id no:95]的tnc fbg域。也制备人类腱生蛋白r fbg[seq id no:96]构筑体以识别显示与此同系物的非所需结合的抗体。构筑体产生为具有偶合到如下所述的c端或n端fbg域的大鼠cd4或人类igg1 fc标签的6his标记的蛋白质。
[0364]
蛋白质表达构筑体
[0365]
由genscript(piscataway,usa)合成用于抗原表达的所有合成dna构筑体和进行序列确认。将fbg域克隆至哺乳动物表达载体pbiocam4或biocam5中,其将表达的域分别与大鼠cd4(域3和4)标签(chapple等人,2006)或人类igg1 fc标签(falk 等人,2012)融合。载体从pcmv/myc/er质体(invitrogen)修改(falk等人,2012),其含有衍生自小鼠vh链的内质网(er)信号序列,用于分泌表达的蛋白质。对于产生 n端fbg(例如fbg
‑
fc
‑
his或fbg
‑
rcd4
‑
his)的所有构筑体,消化的pcr产物用 ncoi/noti切分pbiocam4或pbiocam5载体连接。对于产生c端fbg(例如fc
‑
his
‑
fbg 或rcd4
‑
his
‑
fbg)的所有构筑体,消化的pcr产物用bamhi/hindiii切分pbiocam4 或pbiocam5载体连接。用于扩增fbg域的引物在图23中列出。所有构筑体经序列确认。为了促进elisa筛选,在bamhi与hindiii位点之间克隆编码his
‑
标签的插入物(引物2574和2575)(置换his
‑
flag标签)以用于具有fbg
‑
x(n端fbg)融合物的表达质粒。全长腱生蛋白c通过用bstxi和bamhi消化直接自genscript puc57质体克隆且克隆至bstxi/bamhi切分表达载体pfbg
‑
fc
‑
his6中。为了产生his
‑
fbg构筑体,引物经设计以自rcd4
‑
his
‑
fbg表达质粒进行pcr且编码his
‑
fbg的pcr产物用xhoi和 hindiii消化且克隆至xhoi/hindiii消化的pbiocam5中。
[0366]
蛋白质表达和细胞培养
[0367]
使用machery nagel nucleobond xtra midi试剂盒(740410.50,fisher scientific,uk) 制备转染质量质体dna。hek293f悬浮细胞和自由式培养基(用于抗原和抗体表达) 和rpmi培养基来自life technologies(paisley,uk)。如先前所描述地进行hek293f 细胞的转染(chapple等人,2006)。
[0368]
蛋白质纯化和qc
[0369]
蛋白质亲和纯化采用ni
‑
nta琼脂糖或固定的重组蛋白a树脂。
[0370]
为了纯化his标记的蛋白质,培养物上清液与ni
‑
nta琼脂糖(1018240,qiagen, crawley,uk)混合1h且将树脂转移至至proteus 1步midi离心柱(generon,uk)用于离心(200
×
g,2min)。非结合蛋白质用补充有20mm咪唑所谓磷酸盐缓冲盐水(pbs) (ph 8)洗出。结合蛋白质通过添加含300mm咪唑的pbs(ph 8)和管柱离心(200
×
g, 2min)在洗脱份中洗脱。将含有洗脱蛋白质的汇集的洗脱份置于gebaflex midi透析管 (generon d010;分子量截止值3.5kda)中且针对pbs透析。
[0371]
使用蛋白a琼脂糖(pc
‑
a25,generon,maidenhead,uk)纯化表示为人类igg4的 fc
标记的蛋白质和抗体。培养物上清液通过离心(2500
×
g,15min)澄清且与蛋白a 琼脂糖在4℃下混合过夜,随后将树脂转移至proteus 1步骤midi离心柱(generon,uk)。柱经离心(200
×
g,2min)且用pbs洗涤以去除非结合蛋白质。fc标记或igg4蛋白质通过离心(200
×
g,2min)在来自具有0.2m甘氨酸的蛋白a(ph 2.8)的洗脱份中洗脱为tris
‑
hcl(ph 8)。洗脱的洗脱份经汇集且在gebaflex maxi透析管(d045;分子量截止值8kda)中针对pbs透析。
[0372]
通过sds
‑
page(4
‑
12%凝胶)和分光光度法(使用理论消光系数的od280)分析蛋白质的纯度和浓度。当纯化蛋白质用于基于细胞的分析时,首先通过鲎变形细胞溶解物显色内毒素分析(pierce)测定内毒素含量。如果内毒素含量超过1内毒素单位/毫克 (即1eu/mg),那么不使用蛋白质。
[0373]
实例2
‑
分离一级抗fbg抗体
[0374]
抗体噬菌体呈现
[0375]
使用iontas ltd专有人类抗体噬菌体呈现库分离针对腱生蛋白c fbg域的抗体,所述库使用自43种人类淋巴细胞供体分离的dna构筑。选择、噬菌体救援和亚克隆为 psang10(马丁等人,2006)全部使用所属领域中众所周知的技术如先前(schofield等人,2007)所描述地进行。
[0376]
在融合搭配物的n端(例如fbg
‑
fc、fbg
‑
rcd4)或在c端(fc
‑
fbg、rcd4
‑
fbg) 对融合至人类igg1 fc或rcd4的固定tnc fbg进行两轮淘选。含有卡帕(κ)或拉姆达(λ)可变轻链(v
l
)的噬菌体抗体库分别经淘选以促进随后亚克隆为含有恒定卡帕 (κ)或拉姆达(λ)轻(c
l
)链的fab表达载体。
[0377]
多克隆噬菌体群体由所选群体制备且使用涂布有tnc fbg抗原或适当融合搭配物 (fc或rcd4)的elisa板在elisa(多克隆噬菌体elisa)中测试。在与噬菌体一起培育之后,板经洗涤,且使用过氧化酶共轭的抗m13抗体检测结合噬菌体。图3显示第 1轮与第2轮选择之间的抗原特异性结合剂的富集和相比于第2轮输出群体中的抗fc 或rcd4噬菌体的较大比例的fbg结合剂,指示选择成功。
[0378]
确认scfv与抗原的结合和通过elisa的交叉反应性分析
[0379]
第2轮选择输出表示为个别scfv克隆体以在elisa结合分析中确认抗原识别。输出群体亚克隆为细菌表达载体psang10(martin等人,2006),转化成大肠杆菌bl21 (de3),且个别转化体如先前所描述地在96孔板中诱导(schofield等人,2007)。收集大肠杆菌上清液且使用基于delfia的elisa,使用铕标记的抗flag检测抗体分析scfv 与tnc fbg的结合。初始elisa的结果概述于表1中。
[0380][0381]
表1.单克隆scfv elisa.值指示结合至相关固定选择抗原的克隆体数目。
[0382]
通过λ库的最成功选择是基于针对抗原rcd4
‑
fbg和fc
‑
fbg(选择147和148)的淘选。对于κ库,用抗原fbg
‑
rcd4(150)、rcd4
‑
fbg(152)和fc
‑
fbg(153)获得最成功选择。选择来自此elisa筛选的79个阳性克隆体用于其它分析。
[0383]
交叉反应性elisa显示79个抗人类fbg scfv中的67个(85%)对小鼠tnc fbg 具有交叉反应性。抗fbg scfv的dna序列分析指示极佳序列多样性。举例来说,来自v
l
λ库的选择147和148含有92%独特可变重链(v
h
)互补决定区3(cdr3)序列,且来自v
l
κ库的选择150、152和153分别含有67%、91%和100%独特可变v
h cdr3 序列。
[0384]
自最有效选择分离的另外1425个克隆体通过elisa筛选且这导致识别另外401个具有fbg结合特异性的scfv(表2)。将这些克隆体连同79个在初始elisa中鉴别的 scfv选择用于进一步评估。
[0385]
选择(编号)筛选数量成功结果(≥5,000fu)标签结合剂fbg结合剂λrcd4
‑
fbg(147)28566066λfc
‑
fbg(148)28560060κfbg
‑
rcd4(150)28586086κrcd4
‑
fbg(152)2851442142κfc
‑
fbg(153)285944747总计142545049401
[0386]
表2.最有效选择输出的聚焦单克隆scfv elisa。
[0387]
1425种克隆体在特异性elisa中进一步测试,其中对于每一scfv测试与人类腱生蛋白r fbg以及与人类、小鼠、大鼠和狗tnc fbg的结合。克隆体根据对于结合至腱生蛋白c获得的elisa信号除以关于腱生蛋白r fbg结合的信号排序。将具有高于50 的比率的最前面250种克隆体取用于亚克隆和其它分析。
[0388]
实例3
‑
功能分析中的初级抗fbg抗体的筛选
[0389]
抗fbg scfv重新格式化为二价scfv
‑
fc或单体fab以作为全细胞测定系统中的fbg 诱发的信号传导的抑制剂而评估其活性。
[0390]
对于选择147、148、150、152和153中的每一个通过一级elisa信号排序的最前面50种抗fbg scfv以个别选择群体形式亚克隆为哺乳动物表达质粒pbiocam5(falk 等人,
2012)且通过hek293f细胞中的瞬时转染表达(chapple等人,2006)。对于fab 表达,汇集的λ或κscfv可变重链(v
h
)和可变轻链(v
l
)插入物使用专有iontas ltd 方案克隆为双重促进剂fab表达载体(pfab
‑
双重κ或pfab
‑
双重λ,取决于轻链生殖系)。培养物上清液在thp
‑
1细胞分析中筛选活性且选择的scfv
‑
fc和fab成功结果经亲和力纯化以用于再分析和确认抑制活性。
[0391]
thp1
‑
blue
tm
报告细胞分析
[0392]
已显示腱生蛋白c通过fbg域与细胞tlr4的相互作用引发发炎性细胞和成纤维细胞中的细胞因子产生(midwood等人,2009)。导致如tnfa、il
‑
8和il
‑
6的发炎性细胞因子的产生的受体信号传导级联涉及转录因子nf
‑
κb的活化。此方法可在经修改以伴以产生易于测量的蛋白质信号回应于nf
‑
κb活化的
‘
报告’细胞系中研究。thp1
‑
blue
tm
报告细胞系(invivogen;toulouse,france)衍生自人类thp
‑
1单核细胞系且稳定表现 nf
‑
κb诱导分泌的碱性磷酸酶(seap)报告构筑体。这些细胞也构成性地表达细胞表面tlr4,其使得tnc fbg融合蛋白的信号传导活性能够使用含seap的培养物上清液的比色或荧光定量(使用中通量至高通量分析方法)容易地测量。
[0393]
低fbg浓度下的活性对于任何筛选分析的成功重要;如果产生报告蛋白的稳固增加所需的fbg的浓度过高,那么完全抑制任何此类信号所需的scfv、fc
‑
scfv或fab构筑体的表达量和浓度将对于筛选不可接受。fc
‑
fbg在此细胞分析中在低nm水准下产生稳固seap信号(cd4
‑
fbg不在此浓度范围内产生反应)。
[0394]
thp1
‑
blue
tm
细胞根据提供商的方案 (http://www.invivogen.com/pdf/thp1_blue_nf_kb_tds.pdf)在补充的rpmi培养基中培养和继代,除了细胞在超低吸附t75烧瓶中生长。对于分析,thp1
‑
blue
tm
细胞以170 μl的总体积添加至含有含fc
‑
fbg(3或10nm)的rpmi培养基的96孔组织培养板 (100,000个细胞/孔)中。含有含表达的scfv
‑
fc或fab或亲和力经纯化抗体的pbs的培养物上清液以30μl的体积添加且细胞在37℃下培育18h。收获上清液且使用attophos ap 荧光定量系统(s1000;promega)分析seap或使用duoset elisa显影系统(dy208; r&d systems,uk)根据提供商的说明书分析il
‑
8含量。标绘数据且使用prism软件 (graphpad)拟合曲线。
[0395]
以hek293f培养物上清液形式筛选抗fbg抗体突出显示thp1
‑
blue
tm
细胞中 fc
‑
his
‑
fbg诱发的信号传导的假定抑制剂,其中9种在以纯化scfv
‑
fc(图4a)或fab (图4b)形式再分析时确认。fc
‑
his
‑
fbg为进行效能分析操作的关键。单体fbg不在 thp
‑
1blue和人类细胞中引发任何细胞因子反应。
[0396]
实例4
‑
一级抗fbg抗体的功能表征
[0397]
elisa交叉反应性分析
[0398]
thp1
‑
blue
tm
功能分析中鉴别的所述组的9种人类fbg信号传导抑制剂通过elisa 评估与大鼠、小鼠和狗fbg的交叉反应性。也测定与人类腱生蛋白r fbg同系物的结合。分析孔涂布有人类、大鼠、小鼠和狗tnc fbg
‑
rcd4,或人类tnr fbg
‑
rcd4融合蛋白且使用抗
‑
κ或抗
‑
λmab,接着使用铕共轭的抗小鼠mab检测fab的结合。elisa 结果显示4个fab显示与人类tnc fbg的其它哺乳动物同系物的良好交叉反应性,具有与人类tnr fbg的较低表观结合(图5)。这些为:
[0399]
fab 2a5(vh seq id no:4;vl seq id no:8),
[0400]
fab b12(vh seq id no:12;vl seq id no:15),
[0401]
fab d8(vh seq id no:19;vl seq id no:21),和
[0402]
fab f3(vh seq id no:25;vl seq id no:29)。
[0403]
不进一步考虑显示与tnc
‑
fbg的不佳物种交叉反应性的fab。
[0404]
通过表面等离子体共振测定结合亲和力
[0405]
通过25℃下的表面等离子体共振(spr)测量所选fab与人类、大鼠和小鼠tnc fbg 以及人类tnr fbg的结合的亲和力和缔合和解离动力学。使用具有cm5传感器芯片的 biacore t100仪器根据配备有人类fab捕获试剂盒(ge,28
‑
9583
‑
25)的方案进行实验。改变浓度的rcd4
‑
fbg注射至具有固定fab的流动池和参考流动池中。在参考信号减除之后,数据使用t100biaevaluation软件拟合为全域1:1拟合(图6a
‑
d)。
[0406]
计算的动力学常数显示于表3中。用于人类tnc fbg的fab的亲和力的排序为b12 (110pm)>d8(8.49nm)>2a5(11.4nm)>f3(27.4nm)。所有fab显示对于啮齿动物tnc fbg的低纳摩尔亲和力,且对于人类tnr fbg的亲和力通常比人类tnr fbg 低60倍以上。
[0407]
抑制效能分析
[0408]
使用tlr4介导分泌的碱性磷酸酶和il
‑
8细胞因子产生的量度在thp1
‑
blue
tm
分析中测定纯化fab中和hufc
‑
his
‑
fbg活性的效能。如实例2中所述地进行分析,除了将纯化的fab在一系列浓度(0.3
‑
100nm)下添加至分析孔以使得能够使用prism软件 (graphpad)计算ic
50
值。
[0409][0410]
表3.通过表面等离子体共振(spr)光谱法测定的抗fbg fab结合动力学数据。k
d
,平衡解离常数;k
a
,缔合常数;k
d
,解离常数
[0411]
所有抗体显示fc
‑
his
‑
hufbg诱发的碱性磷酸酶的浓度相关抑制(图7)和il
‑
8产生(图8)。通过抗fbg fab的碱性磷酸酶抑制的抑制的效能(ic
50
)排序为b12(1.7nm) >d8(7.2nm)>f3(8.4nm)>2a5(20.6nm),且il
‑
8释放的抑制的效能(ic
50
)排序类似:b12(6.9nm)>f3(13.8nm)>d8(14.9nm)>2a5(28.5nm)。
[0412]
实例5
‑
hutnc fbg域的最佳化抗体的产生和分离
[0413]
通过靶向cdr突变诱发的亲和力成熟
[0414]
选择抗fbg抗体2a5、b12和f3用于亲和力成熟。通过使用kunkel突变诱发对6 个氨
基酸的区段中的vh和vl cdr3残基随机分组而进行靶向cdr突变诱发(fellouse 和sidhu,2007;kunkel等人,1987;sidhu和weiss,2004)。由于给定克隆体的较长vhcdr3(10
‑
16个残基),在三个重叠区段中进行随机分组且在两个重叠区段中对vl cdr3 (9个残基)随机分组(图9a)。使用可在来自32个密码子组合的给定位置编码20种氨基酸中的任一个(和仅单个琥珀终止密码子)的nns(n=a/g/c/t且s=g/c)简併引物进行随机分组。用于突变诱发的寡核苷酸提供于图9b中。因此,起初产生15个库(对于3种抗体,每个vh 3个库且每个vl 2个库)且除了f3 vl 3.1和f3 vl 3.2的所有库足够大(表4)以涵盖由用nns引物对6个残基随机分组产生的理论多样性 (326=1.1
×
109)。cdr3库在救援方法期间组合且这对于亲体抗体克隆体中的每一个产生组合的突变vh库和组合的突变vl库,得到总计6个库。
[0415][0416]
表4.cdr3随机化库的估计大小
[0417]
高严格度噬菌体呈现选择
[0418]
如先前所描述地进行抗生蛋白链菌素戴诺珠粒的噬菌体
‑
抗体选择(dyson等人, 2011)。对生物素标记的rcd4
‑
his
‑
fbg进行多轮液相选择以富集亲和力改进的克隆体。通过相对于一系列抗原浓度选择和比较输出数目与无抗原对照物而凭经验测定每一轮的最佳抗原浓度。通过减少用于每一轮的抗原的量而增加选择的严格度。在选择窗口(来自选择输出与无抗原对照的噬菌体效价之间的倍数差异)降至低于10之后不再进行其它轮的选择。因此,对所有库的生物素标记的人类rcd4
‑
his
‑
fbg进行三轮选择(图10a),除了b12,其由于在第3轮观测的大选择窗口而经受第四轮选择。所有库在每一轮选择处经受相对于抗生蛋白链菌素珠粒和腱生蛋白r的取消选择(第1到3轮的100nm和第4轮的1nm)以避免与抗生蛋白链菌素或腱生蛋白r的不希望的交叉反应性。另外,仅对于b12随机化库进行人类和小鼠抗原在选择轮数之间交替的杂交选择策略(图 10b)。对b12库进行此额外选择的原因为对于结合至人类和小鼠rcd4
‑
his
‑
fbg的b12 亲体抗体观测的亲和力的巨大差异。此差异不如2a5(6.9倍)或f3(2.6倍)亲体抗体显著。此外,进行另一轮选择以选择具有优良解离速率的抗体克隆体。在解离速率选择中,使噬菌体结合至生物素标记抗原(在此状况下为1nm),且随后添加大量过量的非生物素标记的抗原(500nm)至反应物且培育20h或40h。非生物素标记的抗原充当竞争者且捕获自生物素标记的抗原解离的噬菌体抗体,即仅在选择结束时回收具有较长解离速率的抗体(hawkins等人,1992;zahnd等人,2010)。每一轮选择的输出噬
菌体效价连同计算选择窗口显示于表5a
‑
c中。
[0419]
所选群体亚克隆为细菌表达载体psang10(martin等人,2006),转化为大肠杆菌 bl21(de3),且对于elisa和htrf分析收集个别转化体(每个选择46个)以鉴别分别与小鼠fbg和人类fbg具有改进的结合的克隆体。
[0420][0421]
表5a.选择输出效价.第1轮选择.如先前所描述地测定噬菌体输出效价(schofield等人,2007)
[0422][0423]
表5b.选择输出效价.第2轮选择.如先前所描述地测定噬菌体输出效价(schofield等人,2007)
[0424][0425]
表5c.选择输出效价.第3轮选择.如先前所描述地测定噬菌体输出效价(schofield等人,2007)
[0426]
elisa筛选
[0427]
进行抗flag捕获elisa以筛选相比于亲体抗体具有改进的对于小鼠fbg结合的亲和力的克隆体。
[0428]
携带scfv psang10表达质体的大肠杆菌bl21(de3)克隆体用如先前所描述的自动诱导培养基在96孔板中诱导(schofield等人,2007)。收获大肠杆菌上清液用于elisa 分
析。elisa使用具有铕标记的抗flag抗体(sigma,aldrich,uk)的delfia(解离增强型镧系荧光免疫分析)系统。黑色免疫吸收板(nunc)在通过添加2%奶粉,pbs (pb
‑
m,每孔300μl)阻塞的孔中用抗flag m2抗体(sigma,f3165,5μg/ml于pbs 中,每孔50μl)涂布过夜。板用pbs
‑
t(pbs,0.1%tween
‑
20)三次且用pbs洗涤三次,接着添加含有表达的scfv的96孔自动诱导培养物上清液于pbs
‑
m中的1:2稀释液 (每孔50μl)。板经培育1h,如上洗涤且将生物素标记的小鼠或人类rcd4
‑
his
‑
fbg(5 μg/ml于pbs
‑
m中,50μl)添加至每一孔。板再经培育1h,洗涤且添加抗生蛋白链菌素
‑
eu(perkin elmer,1μg/ml,pbs
‑
m,50μl),培育30分钟,洗涤且添加delfia增强溶液(50μl)且在perkin elmer fusion板读取器上读取板(激励=320nm,发射620nm)。分析型式显示于图11中。
[0429]
在此分析中,scfv表达量的差异经标准化,因为scfv在自动诱导培养物中的表达量使抗flag涂布的孔饱和。因此,分析中获得的信号反映在洗涤之后结合的生物素标记的rcd4
‑
his
‑
fbg的量,其将为用于小鼠或人类fbg的所述克隆体的解离速率的函数。来自2a5和b12子库的选择输出的elisa筛选显示与小鼠tnc fbg具有显著改进的结合的克隆体。
[0430]
htrf筛选
[0431]
开发基于htrf的竞争分析以筛选具有改进的与人类tnc fbg的结合的抗体变异体。
[0432]
所有样品和试剂均在4
×
所述浓度下在分析缓冲液(50mm napo4,0.1%bsa,0.4mkf,ph 7.0)中制备。5μl的每一试剂随后添加至低体积384孔分析板(greiner,784075),得到20μl的最终反应体积。使用d2标记试剂盒(cisbio,62d2dpea)如制造商所指导地标记igg抗体。抗生蛋白链菌素铕穴状化合物(cisbio,610sakla,批号25c) 在如由制造商推荐的1.8ng活性部分(sa)/20μl反应物的最终浓度下使用。使用ez 连接磺酸基
‑
nhs
‑
lc
‑
生物素试剂(thermo scientific,21327)制备生物素标记的 rcd4
‑
his
‑
fbg,使用生物素化荧光定量试剂盒(thermo scientific,46610)定量生物素化的程度。适当时,含有scfv的上清液(如关于elisa分析在上文所述地制备)以1/20 的最终稀释度(即分析缓冲液中的1/5稀释度,接着添加5μl稀释样品至20μl fret分析)添加至384孔分析板。用于筛选的d2标记的2a5 igg和b12 igg的浓度分别为15nm 和1.25nm。除非另行说明,否则生物素标记的rcd4
‑
his
‑
fbg(生物素:蛋白质比率=1.8:1) 以2.2nm(在使用2a5 igg抗体的分析中)或1nm(在使用b12 igg的实验中)存在。样品在室温下培育大致1h且使用bmg pherastar仪器测定fret信号:激励=320nm;发射=620nm和665nm;整合开始时间=60μs;整合时间=500μs;100闪光/孔。对于含有培养物上清液的竞争分析,生物素标记的rcd4
‑
his
‑
fbg抗原与抗生蛋白链菌素铕穴状化合物一起预培育45min,随后添加物试剂至分析板。所有fret信号呈现为δr,其中r=(e665/e620
×
104)且δr=(r样品
‑
r背景荧光)。
[0433]
对含有来自亲和力选择的突变库的未经标记的scfv克隆体的培养物上清液测试 fbg与荧光团标记的亲体igg抗体之间的相互作用的抑制。当用于筛选2a5变异体时,此方法产生高比例的具有相对于亲体的改进的抑制(vh cdr3变异体的92%和vlcdr3变异体的79%)的克隆体。为了在完全抑制fret信号的克隆体之间加以区分,随后关于与b12 igg竞争的能力对2a5变异体进行筛选。鉴于b12对于人类fbg的亲和力比2a5强大致100倍(在25℃下通过表面等离子体共振测定的这些相互作用的解离常数分别为0.11nm和15nm),这是更严格的筛选。在两个分析中展现适用范围内的 fret信号的克隆体的相对排序大体上不变,
指示其关于类似抗原决定基竞争。因此,来自亲和力成熟选择的所有2a5和b12 scfv变异体关于其抑制b12 igg分子与人类tncfbg的结合的能力进行筛选。表达为与亲和力成熟的克隆体平行的scfv的亲体克隆体用作基准(表6)。
[0434]
scfv经定序且选择具有独特vh或vl cdr3序列的一组克隆体用于以人类igg4 型式进行其它研究(基于其分别在elisa和htrf分析中与小鼠和人类tnc fbg的结合)。抗体2a5的所选变异体在htrf分析中显示与小鼠fbg的结合的≥10倍提高和≥90%(vh cdr3变异体)或≥83%(vl cdr3变异体)的抑制。
[0435][0436]
表6.具有改进的对于人类rcd4
‑
fbg的亲和力的克隆体的htrf筛选。
[0437]
抗体b12的变异体显示小鼠fbg结合的≥4倍提高,和htrf信号的≥91%抑制。总计鉴别31个具有独特cdr3序列的满足这些标准的克隆体(表7)。
[0438][0439]
表7.鉴别具有改进的与小鼠和人类tnc fbg的结合且选择用于转化为人类igg形式以进行其它研究的克隆体的重链或轻链cdr3序列。
[0440]
这些为结合至人类和小鼠tnc fbg且因此在本发明的方法、用途、组合物和化合物中具有潜在效用的抗体克隆体的重链或轻链序列。举例来说,具有这些cdr3序列的结合tnf fbg的抗体可适用于鉴别tnc或tnc fbg、抑制其功能、对其进行检测和纯化。
[0441]
转化为igg4型式和测定结合动力学
[0442]
31种所关注的scfv亚克隆为人类igg4表达载体而以具有铰链稳定化突变的人类igg4形式产生抗体(s241p;angal等人,1993)。igg4抗体在hek
‑
293f细胞中暂时表达且使用表面等离子体共振光谱法对其与人类和小鼠tnc fbg以及人类tnr fbg的结合的解离速率排序而筛选培养物上清液。简单来说,使用biacore t100仪器且遵循根据人类抗体捕获试剂盒方案(ge,br
‑
1008
‑
39)的方案进行表面等离子体共振(spr)实验。对于解离速率筛选,抗人类fc igg(ge,br
‑
1008
‑
39)的10,000个反应单元(ru) 使用根据胺偶合试剂盒方案(ge,br
‑
1000
‑
50)的edc/nhs交联化学固定于series 5 cm5聚葡萄糖传感器芯片(br
‑
1005
‑
30)的流动池(fc1和fc2)上。含有表达的igg4 的培养物上清液用2
×
pbs
‑
t 1:2地稀释且注射至fc2中(流动速率5μl/min,60s接触时间)以使得能够在25℃下捕获抗体。取决于上清液中的抗体的表现量,抗体捕获水准的范围为308至1975ru。固定浓度的抗原(15nm人类和小
鼠tnc rcd4
‑
his
‑
fbg和100 nm人类tnr rcd4
‑
his
‑
fbg)在30μl/min的流动速率下经由fc 1(参考流动池)和fc 2(抗体捕获流动池)以流动路径注射,且分别经1和5min时段测量缔合和解离阶段。结合表面的再生采用3m mgcl2与30s接触时间。通过参考细胞减除和使用 biaevaluation软件(ge,br
‑
1005
‑
97)假设1:1相互作用来拟合传感图实验数据而测定解离速率。解离速率筛选的结果概述于表8中。
[0443][0444][0445]
表8.用于对人类igg4抗fbg解离速率排序的表面等离子体共振筛选
[0446]
克隆体根据对于人类和小鼠tnc rcd4
‑
his
‑
fbg的低解离速率,和对于人类tnrrcd4
‑
his
‑
fbg的高解离速率排序。来自每一库的排序最高的3种抗体优先考虑作为纯化 igg4进行较详细动态分析。这些克隆体显示于表9、10和11中。
[0447]
克隆体vh cdr3 b12亲体disavpdtfdiseq id no:11165_13_b1vmssmedafdiseq id no:30165_13_d1gtrgegdtfdiseq id no:34
165_13_c3syqsdedafdiseq id no:36
[0448]
表9.具有改进的fbg结合解离速率特征的b12突变体的重链cdr3氨基酸序列
[0449]
克隆体vh cdr3 2a5亲体aqketyaltyseq id no:3160_01_a4aqketlgnaiseq id no:54161_01_h10aqpvwapgtyseq id no:66162_02_d3aqihplgltyseq id no:70
[0450]
表10.具有改进的fbg结合解离速率特征的2a5突变体的重链cdr3氨基酸序列
[0451]
克隆体vl cdr3 2a5亲体qqsystpwtseq id no:7162_02_f3qnqyrgpwtseq id no:76163_02_a12lhhyrepwtseq id no:88163_02_d11lhhykspwtseq id no:90
[0452]
表11.具有改进的fbg结合解离速率特征的2a5突变体的轻链cdr3氨基酸序列
[0453]
对于9种优先考虑的igg4抗体评估详细动态参数。针对与人类、大鼠和狗tncrcd4
‑
his
‑
fbg以及人类tnr rcd4
‑
his
‑
fbg的相互作用测定结合特征。动态分析遵循与对于上文所述的解离速率测定基本上相同的方案,具有如下的一些修改。为了改进动态参数测定的精确性,抗人类fc igg在较低水准(2229ru)固定,导致捕获的抗fbgigg4的量的对应减少。纯化抗fbg igg4在pbs,ph 7.4,0.05%tween
‑
20中稀释为3.5 nm的浓度且以10μl/min的流动速率,60s接触时间注射至fc2中。这通常导致平均捕获80ru抗体(范围:55ru至90ru)。通过在pbs,ph 7.4,0.05%tween
‑
20(最高浓度100nm,除了小鼠rcd4
‑
his
‑
fbg,其为7nm)中的双倍稀释制备抗原。在37℃ (30μl/min,120s接触时间;小鼠rcd4
‑
his
‑
fbgfbg 10μl/min,60s接触时间)下,在流动池和注射室均平衡至此温度的情况下进行分析。如前所述,通过参考细胞减除和使用biaevaluation软件(ge,br
‑
1005
‑
97)假设1:1相互作用来拟合传感图实验数据而测定动态参数。
[0454]
所有九种抗体显示相比于非亲和力成熟的亲体克隆体改进的与小鼠tnc fbg域的结合,且抗体165_13_b1、165_13_c3和160_01_a4在与人类tnr fbg类似物低>70 倍亲和力的情况下对于结合至人类tnc fbg展现亚纳摩尔k
d
值(表12)。
[0455][0456]
表12.在37℃下通过表面等离子体共振测定的抗fbg igg4结合动态数据
[0457]
实例6
‑
初生人类pbmc中的tnc fbg诱发的细胞因子产生的抑制
[0458]
在初生人类pbmc中的fbg诱发的细胞因子释放的体外分析中确认纯化igg4抗体 165_13_b1、165_13_c3和160_01_a4的功能性fbg中和活性。
[0459]
通过密度梯度离心自三个健康人类单一供体白血球层制剂分离外周血单核细胞 (pbmc)群体。在96孔板中以200μl的最终体积进行分析,且确认所有试剂和测试抗体的内毒素含量在使用之前在可接受限度内,其使用鲎变形细胞溶解物(lal)内毒素定量试剂盒(pierce)测定。
[0460]
在测试抗体(100nm和1μm)、对照同型抗体(sigma i4639;100nm和1μm)、地塞米松(1μm)或pbs对照物存在下培养新分离的pbmc样品(2
×
105个细胞/孔)1 h,随后用细菌脂多醣(lps;大肠杆菌026:b6;100ng/ml)或人类fc
‑
his
‑
fbg(200 nm)进行次最大刺激。对照孔(其中lps或fc
‑
his
‑
fbg经相同体积的pbs置换)含有测试抗体或地塞米松。在培育(24h,37℃)之后,收集培养物上清液且储存于
‑
80℃下。将样品解冻至室温,随后分析上清液的细胞因子含量。每一上清液的25μl等分试样用相同体积的rpmi培养基(life technologies)稀释且通过luminex分析对于il
‑
8和tnfα一式两份地分析所得样品。
[0461]
用100ng/ml lps培育pbmc 24h导致il
‑
8和tnfa产生,其不通过暴露于对照igg4 抗体或抗fbg抗体而抑制。相比之下,通过fc
‑
his
‑
fbg诱发的il
‑
8和tnfa释放被所有测试抗体但不被对照igg4完全阻断,证实3种亲和力成熟的抗体165_13_b1、 165_13_c3和160_01_a4的强力和特异性fbg中和活性(图12a、b)。
[0462]
实例7
‑
抗fbg igg4与瓜氨酸化fbg的结合
[0463]
通过表面等离子体共振(spr)测定抗体b12与瓜氨酸化fbg的结合亲和力。b12 使用qmcf表达技术(icosagen,estonia)表示为具有铰链稳定化s241p突变的人类igg4 且通
过蛋白a亲和色谱法(mabselectsure;ge healthcare)纯化。
[0464]
人类tnc fbg的瓜氨酸化
[0465]
纯化人类his
‑
fbg根据提供商的说明书使用肽基精氨酸脱亚胺酶2(pad2; mq
‑
16.201
‑
2.5,modiquest,nl)或肽基精氨酸脱亚胺酶4(pad4;mq
‑
16.203
‑
2.5, modiquest,nl)瓜氨酸化。简单来说,his
‑
fbg在供应的去亚胺化缓冲液(0.1m tris
‑
hclph 7.5,10mm cacl2,5mm二硫苏糖醇)中稀释至1mg/ml且与125mu pad2或pad4 酶混合的250μl接着在37℃下培育2小时。瓜氨酸化通过酶处理样品的氨基酸分析确认。 his
‑
fbg于去亚胺化缓冲液中的等分试样在37℃下在不存在添加的pad酶的情况下培育2h,用作非瓜氨酸化对照蛋白质。瓜氨酸化和未改性的his
‑
fbg蛋白质用于如下所述的spr实验。
[0466]
表面等离子体共振
[0467]
在biacore 3000仪器上进行spr实验。抗人类igg(ge healthcare)使用氨基偶合化学反应共价偶合至cm5传感器芯片的表面。ru单元中表现的偶合抗人类igg的量在 6500
‑
7000(6.5
‑
7.0ng/mm2)之间变化。b12
‑
higg4(1
‑
13nm)在25℃下附接至hbs
‑
ep 缓冲液(10mm hepes,0.15m nacl,2.5mm edta和0.005%tween
‑
20)中的固定抗人类igg。his
‑
fbg变异体与固定的b12
‑
higg4的结合也在25℃下在hbs
‑
ep缓冲液中测量。流动速率在固定实验中为5μl/min且对于动态分析为20μl/min。传感器芯片表面使用3m mgcl2再生。使用biaevaluation程序4.1(ge healthcare)分析数据。
[0468]
b12
‑
igg4与瓜氨酸化his
‑
fbg的结合的分析显示当相比于与未经修饰his
‑
fbg的结合所获得的值,动态参数基本上不变(表13)。这些结果指示b12谱系的抗fbg抗体预期将在治疗或诊断应用中结合tnc fbg的瓜氨酸化和非瓜氨酸化形式。
[0469]
分析物k
d
(m)k
合
(m
‑1s
‑1)k
离
(s
‑1)his
‑
fbg(1.7
±
0.3)
×
10
‑
10
(4.1
±
0.6)
×
106(6.8
±
0.9)
×
10
‑4his
‑
fbg+pad2(3.2
±
0.3)
×
10
‑
10
(3.0
±
0.4)
×
106(9.6
±
0.8)
×
10
‑4his
‑
fbg+pad4(3.2
±
0.7)
×
10
‑
10
(2.6
±
0.6)
×
106(7.8
±
0.4)
×
10
‑4[0470]
表13.b12
‑
higg4与his
‑
fbg变异体的相互作用的动态参数。每一动态参数表示3 个独立测定的平均值
±
标准差。
[0471]
实例8
‑
使用免疫组织化学检测人类ra组织中的tnc fbg
[0472]
进行免疫组织化学研究以测定抗fbg抗体是否有效地识别人体组织中的人类tncfbg蛋白质的内源性形式。腱生蛋白c表达于慢性发炎位点且其在来自患有类风湿性关节炎的个体的关节的发炎滑膜内的定位已通过使用可商购的抗体的免疫组织化学预先展示(goh等人,2010;salter dm,1993)。
[0473]
b12抗体使用qmcf表达技术(icosagen,estonia)表达为小鼠igg2a型式且通过蛋白g亲和色谱法,后跟200凝胶过滤而纯化。识别全长人类腱生蛋白c的egf域的对照小鼠igg1抗腱生蛋白c抗体(克隆株4f10tt;takara clontech)用作阳性对照比较器。针对无关的细菌抗原的小鼠igg1(dako x0931)或igg2a(dako x0943)用作对照一级抗体以测定具有这些同位型的非特异性背景染色的水准。将来自具有确认的ra诊断的供体的人类膝关节滑膜的冷冻切片(asterand,uk)平衡至室温,固定(10min) 于1:1v/v丙酮/甲醇中,且传递至洗涤缓冲液。根据制造商的方案使用具有envision flex 试剂的dako自动染色仪(dako k8010)进行免疫染色。简单来说,将固定的组织载玻片放置到自动化染色机上且阻断(过氧
化酶阻断,5min;蛋白质阻断,10min,dako x0909),随后施用一级抗体(b12或克隆体4f10tt;1、2或4μg/ml)30min。在一些对照中,载玻片不暴露于一级抗体。在洗涤之后,施用hrp标记的山羊抗小鼠二级抗体(20min)且再次洗涤载玻片,接着施用dab+色原体10min。洗涤载玻片,用苏木精复染且盖上盖玻片以使染色微观可视化。
[0474]
在使用丙酮/甲醇固定的ra滑膜的冷冻切片中,抗tnc fbg b12小鼠igg2a显示与通过阳性对照抗体克隆体4f10tt所获得极类似的染色模式。在滑膜、纤维囊、血管结构中和间质内观测到特异性免疫染色。淋巴聚集体内不存在染色(图13a、c)。一些非特异性免疫染色存在于非免疫对照处理组织(图13b、d)中。这些结果证实和扩展 ra滑膜内的腱生蛋白c表达的前述报导,表明b12为在发炎位点处结合内源性腱生蛋白c的有效药剂并且进一步指示fbg为ra中的可接近目标。
[0475]
实例9
‑
抗体序列
[0476]
抗体2a5
[0477]
vh cdr1:elsmh(seq id no:1)
[0478]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0479]
vh cdr3:aqketyalty(seq id no:3)
[0480]
vh氨基酸序列:
[0481][0482]
vl cdr1:rasqyiqgfln(seq id no:5)
[0483]
vl cdr2:aastlqd(seq id no:6)
[0484]
vl cdr3:qqsystpwt(seq id no:7)
[0485]
vl氨基酸序列:
[0486][0487]
抗体b12
[0488]
vh cdr1:dyamh(seq id no:9)
[0489]
vh cdr2:gisgsggstyyadsvkg(seq id no:10)
[0490]
vh cdr3:disavpdtfdi(seq id no:11)
[0491]
vh氨基酸序列:
[0492]
[0493]
vl cdr1:rasqyiqgfln(seq id no:5)
[0494]
vl cdr2:dasnlet(seq id no:13)
[0495]
vl cdr3:qqsystpqt(seq id no:14)
[0496]
vl氨基酸序列:
[0497][0498]
抗体d8
[0499]
vh cdr1:sygis(seq id no:16)
[0500]
vh cdr2:wisayngntnyaqklqg(seq id no:17)
[0501]
vh cdr3:nqdsssdy(seq id no:18)
[0502]
vh氨基酸序列:
[0503][0504]
vl cdr1:rasqyiqgfln(seq id no:5)
[0505]
vl cdr2:dasnlet(seq id no:13)
[0506]
vl cdr3:qqsystlqt(seq id no:20)
[0507]
vl氨基酸序列:
[0508][0508][0509]
抗体f3
[0510]
vh cdr1:sygmh(seq id no:22)
[0511]
vh cdr2:visydgsnkyyadsvkg(seq id no:23)
[0512]
vh cdr3:egydqlfsaesnafdi(seq id no:24)
[0513]
vh氨基酸序列:
[0514]
[0515]
vl cdr1:trssgsiasyfvq(seq id no:26)
[0516]
vl cdr2:ednqrps(seq id no:27)
[0517]
vl cdr3:qsydssnwv(seq id no:28)
[0518]
vl氨基酸序列:
[0519][0520]
抗体165_13_b1(衍生自b12)
[0521]
vh cdr1:dyamh(seq id no:9)
[0522]
vh cdr2:gisgsggstyyadsvkg(seq id no:10)
[0523]
vh cdr3:
[0524]
vh氨基酸序列:
[0525][0526]
vl cdr1:rasqyiqgfln(seq id no:5)
[0527]
vl cdr2:dasnlet(seq id no:13)
[0528]
vl cdr3:qqsystpqt(seq id no:14)
[0529]
vl氨基酸序列:
[0530][0531]
抗体165_13_b6(衍生自b12)
[0532]
vh cdr1:dyamh(seq id no:9)
[0533]
vh cdr2:gisgsggstyyadsvkg(seq id no:10)
[0534]
vh cdr3:
[0535]
vh氨基酸序列:
[0536]
[0537]
vl cdr1:rasqyiqgfln(seq id no:5)
[0538]
vl cdr2:dasnlet(seq id no:13)
[0539]
vl cdr3:qqsystpqt(seq id no:14)
[0540]
vl氨基酸序列:
[0541][0542]
抗体165_13_d1(衍生自b12)
[0543]
vh cdr1:dyamh(seq id no:9)
[0544]
vh cdr2:gisgsggstyyadsvkg(seq id no:10)
[0545]
vh cdr3:
[0546]
vh氨基酸序列:
[0547][0548]
vl cdr1:rasqyiqgfln(seq id no:5)
[0549]
vl cdr2:dasnlet(seq id no:13)
[0550]
vl cdr3:qqsystpqt(seq id no:14)
[0551]
vl氨基酸序列:
[0552][0553]
抗体165_13_c3(衍生自b12)
[0554]
vh cdr1:dyamh(seq id no:9)
[0555]
vh cdr2:gisgsggstyyadsvkg(seq id no:10)
[0556]
vh cdr3:
[0557]
vh氨基酸序列:
[0558]
[0559]
vl cdr1:rasqyiqgfln(seq id no:5)
[0560]
vl cdr2:dasnlet(seq id no:13)
[0561]
vl cdr3:qqsystpqt(seq id no:14)
[0562]
vl氨基酸序列:
[0563][0563][0564]
抗体165_13_d4(衍生自b12)
[0565]
vh cdr1:dyamh(seq id no:9)
[0566]
vh cdr2:gisgsggstyyadsvkg(seq id no:10)
[0567]
vh cdr3:
[0568]
vh氨基酸序列:
[0569][0570]
vl cdr1:rasqyiqgfln(seq id no:5)
[0571]
vl cdr2:dasnlet(seq id no:13)
[0572]
vl cdr3:qqsystpqt(seq id no:14)
[0573]
vl氨基酸序列:
[0574][0575]
抗体165_13_a4(衍生自b12)
[0576]
vh cdr1:dyamh(seq id no:9)
[0577]
vh cdr2:gisgsggstyyadsvkg(seq id no:10)
[0578]
vh cdr3:
[0579]
vh氨基酸序列:
[0580]
[0581]
vl cdr1:rasqyiqgfln(seq id no:5)
[0582]
vl cdr2:dasnlet(seq id no:13)
[0583]
vl cdr3:qqsystpqt(seq id no:14)
[0584]
vl氨基酸序列:
[0585][0586]
抗体165_13_b3(衍生自b12)
[0587]
vh cdr1:dyamh(seq id no:9)
[0588]
vh cdr2:gisgsggstyyadsvkg(seq id no:10)
[0589]
vh cdr3:
[0590]
vh氨基酸序列:
[0591][0592]
vl cdr1:rasqyiqgfln(seq id no:5)
[0593]
vl cdr2:dasnlet(seq id no:13)
[0594]
vl cdr3:qqsystpqt(seq id no:14)
[0595]
vl氨基酸序列:
[0596][0597]
抗体165_13_e1(衍生自b12)
[0598]
vh cdr1:dyamh(seq id no:9)
[0599]
vh cdr2:gisgsggstyyadsvkg(seq id no:10)
[0600]
vh cdr3:
[0601]
vh氨基酸序列:
[0602][0602]
[0603]
vl cdr1:rasqyiqgfln(seq id no:5)
[0604]
vl cdr2:dasnlet(seq id no:13)
[0605]
vl cdr3:qqsystpqt(seq id no:14)
[0606]
vl氨基酸序列:
[0607][0608]
抗体180_11_f5(衍生自b12)
[0609]
vh cdr1:dyamh(seq id no:9)
[0610]
vh cdr2:gisgsggstyyadsvkg(seq id no:10)
[0611]
vh cdr3:
[0612]
vh氨基酸序列:
[0613][0614]
vl cdr1:rasqyiqgfln(seq id no:5)
[0615]
vl cdr2:dasnlet(seq id no:13)
[0616]
vl cdr3:qqsystpqt(seq id no:14)
[0617]
vl氨基酸序列:
[0618][0619]
抗体160_01_e3(衍生自2a5)
[0620]
vh cdr1:elsmh(seq id no:1)
[0621]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0622]
vh cdr3:
[0623]
vh氨基酸序列:
[0624]
[0625]
vl cdr1:rasqyiqgfln(seq id no:5)
[0626]
vl cdr2:aastlqd(seq id no:6)
[0627]
vl cdr3:qqsystpwt(seq id no:7)
[0628]
vl氨基酸序列:
[0629][0630]
抗体160_01_d6(衍生自2a5)
[0631]
vh cdr1:elsmh(seq id no:1)
[0632]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0633]
vh cdr3:
[0634]
vh氨基酸序列:
[0635][0636]
vl cdr1:rasqyiqgfln(seq id no:5)
[0637]
vl cdr2:aastlqd(seq id no:6)
[0638]
vl cdr3:qqsystpwt(seq id no:7)
[0639]
vl氨基酸序列:
[0640][0640][0641]
抗体160_01_h4(衍生自2a5)
[0642]
vh cdr1:elsmh(seq id no:1)
[0643]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0644]
vh cdr3:
[0645]
vh氨基酸序列:
[0646]
[0647]
vl cdr1:rasqyiqgfln(seq id no:5)
[0648]
vl cdr2:aastlqd(seq id no:6)
[0649]
vl cdr3:qqsystpwt(seq id no:7)
[0650]
vl氨基酸序列:
[0651][0652]
抗体160_01_a4(衍生自2a5)
[0653]
vh cdr1:elsmh(seq id no:1)
[0654]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0655]
vh cdr3:
[0656]
vh氨基酸序列:
[0657][0658]
vl cdr1:rasqyiqgfln(seq id no:5)
[0659]
vl cdr2:aastlqd(seq id no:6)
[0660]
vl cdr3:qqsystpwt(seq id no:7)
[0661]
vl氨基酸序列:
[0662][0663]
抗体160_01_f1(衍生自2a5)
[0664]
vh cdr1:elsmh(seq id no:1)
[0665]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0666]
vh cdr3:
[0667]
vh氨基酸序列:
[0668]
[0669]
vl cdr1:rasqyiqgfln(seq id no:5)
[0670]
vl cdr2:aastlqd(seq id no:6)
[0671]
vl cdr3:qqsystpwt(seq id no:7)
[0672]
vl氨基酸序列:
[0673][0674]
抗体160_01_g2(衍生自2a5)
[0675]
vh cdr1:elsmh(seq id no:1)
[0676]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0677]
vh cdr3:
[0678]
vh氨基酸序列:
[0679][0680]
vl cdr1:rasqyiqgfln(seq id no:5)
[0681]
vl cdr2:aastlqd(seq id no:6)
[0682]
vl cdr3:qqsystpwt(seq id no:7)
[0683]
vl氨基酸序列:
[0684][0685]
抗体161_01_f6,又称为160_01_f6(衍生自2a5)
[0686]
vh cdr1:elsmh(seq id no:1)
[0687]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0688]
vh cdr3:
[0689]
vh氨基酸序列:
[0690]
[0691]
vl cdr1:rasqyiqgfln(seq id no:5)
[0692]
vl cdr2:aastlqd(seq id no:6)
[0693]
vl cdr3:qqsystpwt(seq id no:7)
[0694]
vl氨基酸序列:
[0695][0695][0696]
抗体161_01_a12(衍生自2a5)
[0697]
vh cdr1:elsmh(seq id no:1)
[0698]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0699]
vh cdr3:
[0700]
vh氨基酸序列:
[0701][0702]
vl cdr1:rasqyiqgfln(seq id no:5)
[0703]
vl cdr2:aastlqd(seq id no:6)
[0704]
vl cdr3:qqsystpwt(seq id no:7)
[0705]
vl氨基酸序列:
[0706][0707]
抗体161_01_c09(衍生自2a5)
[0708]
vh cdr1:elsmh(seq id no:1)
[0709]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0710]
vh cdr3:
[0711]
vh氨基酸序列:
[0712]
[0713]
vl cdr1:rasqyiqgfln(seq id no:5)
[0714]
vl cdr2:aastlqd(seq id no:6)
[0715]
vl cdr3:qqsystpwt(seq id no:7)
[0716]
vl氨基酸序列:
[0717][0718]
抗体161_01_h10(衍生自2a5)
[0719]
vh cdr1:elsmh(seq id no:1)
[0720]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0721]
vh cdr3:
[0722]
vh氨基酸序列:
[0723][0724]
vl cdr1:rasqyiqgfln(seq id no:5)
[0725]
vl cdr2:aastlqd(seq id no:6)
[0726]
vl cdr3:qqsystpwt(seq id no:7)
[0727]
vl氨基酸序列:
[0728][0729]
抗体161_01_c11(衍生自2a5)
[0730]
vh cdr1:elsmh(seq id no:1)
[0731]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0732]
vh cdr3:
[0733]
vh氨基酸序列:
[0734][0734]
[0735]
vl cdr1:rasqyiqgfln(seq id no:5)
[0736]
vl cdr2:aastlqd(seq id no:6)
[0737]
vl cdr3:qqsystpwt(seq id no:7)
[0738]
vl氨基酸序列:
[0739][0740]
抗体162_02_d3(衍生自2a5)
[0741]
vh cdr1:elsmh(seq id no:1)
[0742]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0743]
vh cdr3:
[0744]
vh氨基酸序列:
[0745][0746]
vl cdr1:rasqyiqgfln(seq id no:5)
[0747]
vl cdr2:aastlqd(seq id no:6)
[0748]
vl cdr3:qqsystpwt(seq id no:7)
[0749]
vl氨基酸序列:
[0750][0751]
抗体162_02_c6(衍生自2a5)
[0752]
vh cdr1:elsmh(seq id no:1)
[0753]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0754]
vh cdr3:aqketyalty(seq id no:3)
[0755]
vh氨基酸序列:
[0756]
[0757]
vl cdr1:rasqyiqgfln(seq id no:5)
[0758]
vl cdr2:aastlqd(seq id no:6)
[0759]
vl cdr3:
[0760]
vl氨基酸序列:
[0761][0762]
抗体162_02_h5(衍生自2a5)
[0763]
vh cdr1:elsmh(seq id no:1)
[0764]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0765]
vh cdr3:aqketyalty(seq id no:3)
[0766]
vh氨基酸序列:
[0767][0768]
vl cdr1:rasqyiqgfln(seq id no:5)
[0769]
vl cdr2:aastlqd(seq id no:6)
[0770]
vl cdr3:
[0771]
vl氨基酸序列:
[0772][0773][0774]
抗体162_02_f3(衍生自2a5)
[0775]
vh cdr1:elsmh(seq id no:1)
[0776]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0777]
vh cdr3:aqketyalty(seq id no:3)
[0778]
vh氨基酸序列:
[0779]
[0780]
vl cdr1:rasqyiqgfln(seq id no:5)
[0781]
vl cdr2:aastlqd(seq id no:6)
[0782]
vl cdr3:
[0783]
vl氨基酸序列:
[0784][0785]
抗体162_02_c1(衍生自2a5)
[0786]
vh cdr1:elsmh(seq id no:1)
[0787]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0788]
vh cdr3:aqketyalty(seq id no:3)
[0789]
vh氨基酸序列:
[0790][0791]
vl cdr1:rasqyiqgfln(seq id no:5)
[0792]
vl cdr2:aastlqd(seq id no:6)
[0793]
vl cdr3:
[0794]
vl氨基酸序列:
[0795][0796]
抗体162_02_c2(衍生自2a5)
[0797]
vh cdr1:elsmh(seq id no:1)
[0798]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0799]
vh cdr3:aqketyalty(seq id no:3)
[0800]
vh氨基酸序列:
[0801]
[0802]
vl cdr1:rasqyiqgfln(seq id no:5)
[0803]
vl cdr2:aastlqd(seq id no:6)
[0804]
vl cdr3:
[0805]
vl氨基酸序列:
[0806][0807]
抗体162_02_f4(衍生自2a5)
[0808]
vh cdr1:elsmh(seq id no:1)
[0809]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0810]
vh cdr3:aqketyalty(seq id no:3)
[0811]
vh氨基酸序列:
[0812][0813]
vl cdr1:rasqyiqgfln(seq id no:5)
[0814]
vl cdr2:aastlqd(seq id no:6)
[0815]
vl cdr3:
[0816]
vl氨基酸序列:
[0817][0818]
抗体162_02_c3(衍生自2a5)
[0819]
vh cdr1:elsmh(seq id no:1)
[0820]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0821]
vh cdr3:aqketyalty(seq id no:3)
[0822]
vh氨基酸序列:
[0823]
[0824]
vl cdr1:rasqyiqgfln(seq id no:5)
[0825]
vl cdr2:aastlqd(seq id no:6)
[0826]
vl cdr3:
[0827]
vl氨基酸序列:
[0828][0829]
抗体162_02_e11(衍生自2a5)
[0830]
vh cdr1:elsmh(seq id no:1)
[0831]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0832]
vh cdr3:aqketyalty(seq id no:3)
[0833]
vh氨基酸序列:
[0834][0835]
vl cdr1:rasqyiqgfln(seq id no:5)
[0836]
vl cdr2:aastlqd(seq id no:6)
[0837]
vl cdr3:cdr3:
[0838]
vl氨基酸序列:
[0839][0840]
抗体163_02_a12(衍生自2a5)
[0841]
vh cdr1:elsmh(seq id no:1)
[0842]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0843]
vh cdr3:aqketyalty(seq id no:3)
[0844]
vh氨基酸序列:
[0845][0846]
vl cdr1:rasqyiqgfln(seq id no:5)
[0847]
vl cdr2:aastlqd(seq id no:6)
[0848]
vl cdr3:
[0849]
vl氨基酸序列:
[0850][0851]
抗体163_02_d11(衍生自2a5)
[0852]
vh cdr1:elsmh(seq id no:1)
[0853]
vh cdr2:gfdpedgetiyaqkfqg(seq id no:2)
[0854]
vh cdr3:aqketyalty(seq id no:3)
[0855]
vh氨基酸序列:
[0856][0857]
vl cdr1:rasqyiqgfln(seq id no:5)
[0858]
vl cdr2:aastlqd(seq id no:6)
[0859]
vl cdr3:lhhykspwt(seq id no:90)
[0860]
vl氨基酸序列:
[0861][0862]
igg4165_13_c3(如angal1993中所述的具有铰链修饰的恒定区)
[0863]
参考文献:angal s1,king dj,bodmer mw,turner a,lawson ad,roberts g,pedleyb,adair jr.《分子免疫学(mol immunol.)》1993年1月;30(1):105
‑
8。
[0864]
qvqlvesggglvqpgrslrlscaasgftfddyamhwvrqapgkglewvsgisgs ggstyyadsvkgrftisrdnaknslylqmnslraedtalyycaksyqsdedafdiwg qgtmvtvssastkgpsvfplapcsrstsest
aalgclvkdyfpepvtvswnsgaltsgv htfpavlqssglyslssvvtvpssslgtktytcnvdhkpsntkvdkrveskygppcppcp apeflggpsvflfppkpkdtlmisrtpevtcvvvdvsqedpevqfnwyvdgvevhnak tkpreeqfnstyrvvsvltvlhqdwlngkeykckvsnkglpssiektiskakgqprep qvytlppsqeemtknqvsltclvkgfpsdiavewesngqpennykttppvldsdgsffl ysrltvdksrwqegnvfscsvmhealhnhytqkslslslgk
[0865]
实例10
‑
蛋白质序列
[0866]
人类腱生蛋白c fbg域的氨基酸序列[seq id no:92]
[0867]
igllypfpkdcsqamlngdttsglytiylngdkaealevfcdmtsdgggwivflr rkngrenfyqnwkayaagfgdrreefwlgldnlnkitaqgqyelrvdlrdhgetafa vydkfsvgdaktryklkvegysgtagdsmayhngrsfstfdkdtdsaitncalsykg afwyrnchrvnlmgrygdnnhsqgvnwfhwkghehsiqfaemklrpsnfrnlegr rkra
[0868]
小鼠腱生蛋白c fbg域的氨基酸序列[seq id no:93]
[0869]
igllypfprdcsqamlngdttsglytiyingdktqalevycdmtsdgggwivflr rkngredfyrnwkayaagfgdrreefwlgldnlskitaqgqyelrvdlqdhgesaya vydrfsvgdaksryklkvegysgtagdsmnyhngrsfstydkdtdsaitncalsykg afwyknchrvnlmgrygdnnhsqgvnwfhwkgheysiqfaemklrpsnfrnlegr r
[0870]
kra
[0871]
大鼠腱生蛋白c fbg域的氨基酸序列[seq id no:94]
[0872]
igllypfprdcsqamlngdttsglytiyingdktqalevycdmtsdgggwivflr rkngredfyrnwkayatgfgdrreefwlgldnlskitaqgqyelrvdlqdhgesaya vydrfsvgdaksryklkvegysgtagdsmnyhngrsfstydkdtdsaitncalsykg afwyknchrvnlmgrygdnnhsqgvnwfhwkgheysiqfaemklrpsnfrnlegr rkra
[0873]
狗腱生蛋白c fbg域的氨基酸序列[seq id no:95]
[0874]
igllypfprdcsqamlngdttsglytiylngdkaqalevycdmtsdgggwivflr rkngredfyrnwkayaagfgdrreefwlgldnlhkitaqgqyelrvdlrdhgktaya vydrfsvgdaktryklkvegysgtagdsmayhngrsfstfdkdtdsaitncalsykg afwyknchrvnlmgrygdnnhsqgvnwfhwkgheysiqfaemklrpsnfrnlegr rkra
[0875]
人类腱生蛋白r fbg域的氨基酸序列[seq id no:96]
[0876]
fphpqdcaqhlmngdtlsgvypiflngelsqklqvycdmttdgggwivfqrrqn gqtdffrkwadyrvgfgnvedefwlgldnihritsqgryelrvdmrdgqeaafasyd rfsvedsrnlyklrigsyngtagdslsyhqgrpfstedrdndvavtncamsykgaww yknchrtnlngkygesrhsqginwyhwkghefsipfvemkmrpynhrlmagrkrqs lqf
[0877]
实例11
‑
生殖系化序列
[0878]
使用imgt/domaingapalign测定最接近生殖系匹配:
[0879]
ehrenmann f.,kaas q.和lefranc m.p.《核酸研究(nucleic acids res.)》,38, d301
‑
307(2010)
[0880]
自非生殖系化序列的变化通过氨基酸的加下划线显示。cdr通过加框序列显示。
[0881]
抗体2a5
[0882]
生殖系化框架:vh氨基酸序列:
[0883][0884]
生殖系化框架:vl氨基酸序列:
[0885][0886]
由于生殖系化序列而改变的cdr:
[0887]
vl cdr2:aasslqs(seq id no:114)
[0888]
抗体b12
[0889]
生殖系化框架:vh氨基酸序列:
[0890][0891]
由于生殖系化序列而改变的cdr:
[0892]
vh cdr2:gisgsggstyyadsvky(seq id no:116)
[0893]
生殖系化框架:vl氨基酸序列:
[0894][0895][0896]
由于生殖系化序列而改变的cdr:
[0897]
vl cdr2:dasslqs(seq id no:118)
[0898]
抗体d8
[0899]
生殖系化框架:vh氨基酸序列:
[0900][0901]
生殖系化框架:vl氨基酸序列:
[0902][0903]
由于生殖系化序列而改变的cdr:
[0904]
vl cdr2:dasslqs(seq id no:121)
[0905]
抗体f3
[0906]
生殖系化框架:vh氨基酸序列:
[0907][0908]
生殖系化框架:vl氨基酸序列:
[0909][0910]
实例12
‑
抗体在西方墨点法中的用途
[0911]
为了证实单克隆抗体igg4 c3(如上文提及的165_13_c3)和igg4 b12可成功地用于西方墨点法,使用纯化蛋白质测试第一特异性(图14)。随后,神经胶瘤细胞裂解物用于测定b12检测其它蛋白质的生物学相关混合物中的全长tnc的能力(图15)。
[0912]
如由图14中的数据所示,重组cd4
‑
tnc
‑
fbg(nascient)、cd4
‑
tnr
‑
fbg或纤维蛋白原(kir)在四种10%sds
‑
page凝胶上在还原条件下运行,随后沾染到硝化纤维素膜且用以下抗体检测:a)在1:20,000(0.25μg/ml)下的165_13_c3 igg4 mab,在4 ℃下过夜,b)在1:20,000(0.25μg/ml)下的b12 igg4 mab,在4℃下过夜,c)在1:2,000 (0.1μg/ml)下的抗腱生蛋白r抗体(santa cruz biotechnology,sc
‑
9875),在4℃下过夜,d)在1:500下的抗tnc
‑
fbg多克隆抗体(midwood group),在4℃下过夜。用于 c3和b12抗体的二级抗体为1:20,000下的abcam(ab6858)(在室温下持续1h)。对于 tnr抗体,二级为1:10,000下的hrp共轭的抗山羊(sigma
‑
aldrich,sab3700259)(在室温下持续1h)。对于多克隆tnc抗体,使用的二级为1:5,000下的hrp共轭的抗兔 (dako,p0217)(在室温下持续1h)。对于显示的所有印迹,暴露于膜为5min。
[0913]
在此实验中,c3和b12均在与tnr
‑
fbg或纤维蛋白原的极小交叉反应性的情况下显示对于tnc
‑
fbg的特异性,指示其用于西方墨点法应用的适合性,因为其对于 tnc
‑
fbg显示良好特异性。
[0914]
如通过图15中的数据所示,神经胶瘤细胞裂解物(kir)和腱生蛋白c(nascient) 在5%sds
‑
page凝胶上在还原条件下运行,随后沾染到膜且用以下各者检测:a.在 1:20,000下的b12 igg4 mab,在4℃下过夜;b.在1:4,000下的igg4同型对照(eureka 治疗剂),在4℃下过夜。使用的二级抗体为1:10,000下的abcam(ab6858)(在室温下持续1h)。印迹用ecl西方墨点法检测试剂(ge healthcare,amersham)显影。印迹暴露于膜1分钟。
[0915]
这些结果指示b12可检测全长tnc以及tnc的分解产物和/或剪接变异体,且显示与存在于细胞裂解物中的其它蛋白质的低交叉反应性
[0916]
实例13
‑
c3抗体的体外活性
[0917]
为了证实单克隆抗体c3(165_13_c3)通过破坏tnc
‑
fbg与其受体tlr4的结合而起作用,首先对于tlr4和fc
‑
his
‑
fbg开发体外结合分析,接着测定用c3预培育 fc
‑
his
‑
fbg的效果。
[0918]
含重组人类tlr4(r&d systems)(1μg/ml(14.6nm))的pbs(或单独的pbs) 结合至96孔板。在阻断(10%bsa)之后,添加指定浓度的人类fc
‑
his
‑
fbg且通过培育1μg/ml下的抗人类igg1 mab(abd serotec,克隆体2c11)、1μg/ml下的抗小鼠hrp 共轭的二级抗体(abd serotec,star13b)和tmb基质进行检测。结果显示于图16a 中,n=4,显示平均值和sem。此实验显示fc
‑
his
‑
fbg以剂量依赖方式在体外结合tlr4。
[0919]
如图16b中所示,单克隆ab c3破坏体外结合fbg和tlr4。含重组人类tlr4的 pbs(或单独的pbs)在阻断与c3 mab一起预培育的重组人类fc
‑
his
‑
tnc
‑
fbg(100nm) 或添加同型对照抗体之后结合至96孔板。通过连续培育针对蛋白质的fc部分的抗体、抗小鼠hrp共轭的二级抗体和tmb基质进行检测。相比于同型对照样品(ic50=44.5 nm)计算c3预培育样品中的百分比抑制。n=4。
[0920]
实例14
‑
抗体b12、a4和c3的消炎效应
[0921]
确认抗tnc
‑
fbg抗体b12、a4(160_01_a4)和c3(165_13_c3)在生物系统中具有消炎效应。为了做到这一点,通过聚蔗糖梯度和逆流离心自外周血(伦敦血库)分离人类单核细胞。单核细胞接着用100ng/ml m
‑
csf(peprotec)分化5天以产生m2巨噬细胞。
[0922]
如由图17a中的结果所示,重组人类fc
‑
tnc fbg(1μm)或lps(enzo)(1ng/ml) 用mab c3(1、0.2和0.04μm)或同型对照(eureka)mab(1μm)在室温下预培育 30分钟,随后一式三份地添加至人类m2巨噬细胞培养物。在24h之后,获取上清液且经受il
‑
8、il
‑
6和tnf细胞因子elisa(bd biosciences),n=3。这些结果显示在1μm 下,c3通过用tnc
‑
fbg刺激的人类m2巨噬细胞极大地减少促炎性细胞因子释放,此减少对于il
‑
8和tnf均为统计显著的。正如期望,c3对lps诱导的细胞因子释放不具有效应。
[0923]
图17b显示来自实验的结果,其中重组鼠类fc
‑
tnc fbg(1μm)用mab c3(1、 0.2和0.04μm)或同型对照mab(eureka)(1μm)在室温下预培育30分钟,随后一式三份地添加至人类m2巨噬细胞培养物。在24h之后,获取上清液且经受细胞因子 elisa。n=3或更大,显示平均值和sem。再次,1μm下的c3极大地减少通过巨噬细胞的鼠类fc
‑
tnc
‑
fbg诱导的细胞因子释放,指示抗体的良好跨种反应性。
[0924]
为了证实fbg诱导的细胞因子释放通过fbg而不是蛋白质的fc部分诱导,使用 fc部分突变为非活性的蛋白质(fc
‑
mut
‑
fbg),也测试抗tnc
‑
fbg抗体b12、c3 (165_13_c3)和a4(160_01_a4)相对于此分子的活性。在室温下预培育fc
‑
mut
‑
fbg (1μm)和c3、a4或b12(1μ
m)30分钟,随后添加至人类m2巨噬细胞培养物。在 24h之后,获取上清液且经受细胞因子elisa。n=3,显示平均值和sem。结果展示在图17c中。此实验证实fc
‑
his
‑
fbg诱导的细胞因子合成不归因于通过fc受体的fc部分信号传导。另外,其显示相关抗体b12和a4以及c3的预培育通过人类m2巨噬细胞极大地减少fbg诱导的细胞因子释放。
[0925]
图18a显示单克隆抗体b12通过用人类tnc
‑
fbg刺激的初生人类巨噬细胞减少促炎性细胞因子的产生。在所述实验中,重组人类腱生蛋白c fbg(1μm)用mab b12 (1、0.1、0.01或0.001μm)或同型对照mab(1μm)在室温下预培育30分钟,随后一式三份地添加至人类m2巨噬细胞培养物。在24h之后,获取上清液且经受细胞因子 elisa,n=1。此处,我们再次可见b12抗体预培育减少fbg诱导的细胞因子释放,在此供体中,il
‑
8给出最小反应。
[0926]
图18b显示在实验室或更大规模产生的单克隆抗体c3在通过初生人类巨噬细胞的 fbg诱导的细胞因子合成的阻断中显示相同功效水准。
[0927]
为了将c3抗体用于动物研究,igg4 b12 165
‑
13
‑
c3产物在使用商业gs
‑
cho表达的领先的合同制造组织下克隆、表达和纯化。用于重链和轻链可变区的cdna关于cho 表达最佳化且在克隆到表达载体中之前由life technologies合成(用商业信号序列)。 cho细胞转染为集合体且最高表现集合体前进到大规模摇瓶生产(22l
‑
11
×
2l于5l 摇瓶中)。在第4天和第8天投与专属进料,随后在第12天收集培养物。材料经离心,随后深度过滤和过滤器杀菌。使用切向流动过滤(30kda分子量截止)进行材料的大致 5.5倍浓缩且所得浓缩物再次经过滤器杀菌,随后进行mabselect sure纯化。产物经洗脱且产物经中和且接着在20mm naoac,ph 5.5,150mm nacl中浓缩/透滤为大致11 mg/ml。还原和非还原sds
‑
page分析连同尺寸排阻
‑
hplc显示高纯度和大于98%单体的材料。内毒素小于0.1eu/mg。
[0928]
在此实验中,将较大规模抗体批次的效能相比于当前较小规模批次。重组人类腱生蛋白c fbg(1μm)用mab c3(1、0.2和0.04μm)或同型对照mab(1μm)在室温下预培育30min,随后一式三份地添加至人类m2巨噬细胞培养物。在24h之后,获取上清液且经受细胞因子elisa。n=1,ico=实验室规模,lon=较大规模材料。此实验显示两批抗体在fbg诱导的细胞因子合成的减少中显示相同效能,即结果一致,无关于生产。
[0929]
实例15
‑
单克隆抗体c3(165_13_c3)通过用人类tnc
‑
fbg刺激的ra滑膜成纤维细胞减少促炎性细胞因子的产生。
[0930]
已报导滑膜成纤维细胞可为ra中的促炎性细胞因子释放的重要来源(r bucala等人(1991)通过类风湿性滑膜成纤维细胞组成型产生促进细胞分裂和发炎性细胞因子 (constitutive production of mitogenic and inflammatory cytokines by rheumatoid synovialfibroblasts.)《实验医学杂志(j.exp.med.)》173:569
‑
574),因此测试c3抗体是否也显示与巨噬细胞类似的对于fbg诱导的细胞因子释放的效应。
[0931]
人类ra成纤维细胞通过组织在含有0.5mg/ml释放酶(liberase)(roche)和0.2 mg/ml dna酶(roche)的rpmi(lonza)中的消化和在37℃下培育1
‑
1.5h而从供体 ra滑膜组织生长出。所得组织吹吸通过200μm尼龙网格;将不穿过网格的材料置于含有具有10%fbs(life technologies)和1%青霉素/链霉素(life technologies)的rpmi 的皮氏培养皿中且在37℃下培育5天。在5天之后,滑膜成纤维细胞从组织生长出且从 ra滑膜成纤维细胞(rasf)培养物去除其余的组织,所述培养物随后维持于含有10% fbs和1%青霉素/链霉素的dmem(lonza)中。对于此实验,rasf以1
×
104个细胞/ 孔平铺。重组人类tnc
‑
fbg(1μm)用
mab c3(1、0.2和0.04μm)或同型对照mab (1μm)在室温下预培育30分钟,随后一式三份地添加至滑膜成纤维细胞培养物。在 24h之后,获取上清液且经受细胞因子elisa。n=1,显示平均值和sem(参见图19)。
[0932]
这些结果指示c3起减少ra滑膜成纤维细胞中的fbg诱导的促炎性细胞因子释放 (il
‑
8和il
‑
6两者)的作用,显示此为发炎ra关节中发现的多种细胞类型的潜在机制。
[0933]
实例16
‑
大鼠模型中的腱生蛋白c的水准。
[0934]
确认腱生蛋白c在小鼠和大鼠cia(胶原蛋白诱导性关节炎)模型中的表达且显示疾病活性与临床评分相关。
[0935]
图20显示测量在两个独立cia研究(kws)结束时自大鼠爪清洗的滑膜流体中的腱生蛋白c的水准的实验的结果。通过elisa(ibl,大型(fn iii
‑
b)试剂盒)测量腱生蛋白c水准。测量的tnc水准接着与临床评分相关,所述临床评分与通过kws指示的所述爪相关。此实验显示爪的临床评分越高,来自所述爪的滑膜流体中可见的tnc 的水准越高。这指示大鼠cia模型为测试c3抗体的良好模型。
[0936]
实例17
‑
评估胶原蛋白诱导性关节炎的大鼠模型中的c3抗体
[0937]
测试igg4 c3(165_13_c3)在标准大鼠胶原蛋白诱导性关节炎模型中的治疗活性。将成年雄性路易斯大鼠随机分配至实验组且使其适应一周。在第0天,通过在下背部的皮内注射向动物投与500μl ii型牛胶原蛋白与不完全弗氏佐剂中的1mg/ml乳液 (cii/ifa)。在第7天,动物接受第二次cii/ifa注射。注射在气体(异氟醚)麻醉下进行。根据显示于下表14中的投与排程投与治疗剂。
[0938]
表14.投与排程
[0939][0940]1完全人类igg4同型对照,临床前级别,(et904,eureka therapeutics),n/a:不适用,iv:静脉内注射,id:皮内注射,cii/ifa:ii型胶原蛋白和不完全弗氏佐剂乳液,*第0天,第 3天,第7天,第10天,第14天,第17天,第21天和第24天
[0941]
自第7天直至实验结束,动物每周由无视于治疗的实验者关于关节炎的临床症状评分三次。在第0天、第14天、第21天和第28天,由无视于处理的实验者使用器官充满度测量器(plethysmometer)测量爪体积。
[0942]
结果
[0943]
非特异性临床观测结果
[0944]
自第0天直至实验结束,每天检查动物的非特异性临床症状,以包括异常姿势(驼背)、异常皮毛条件(竖毛)和异常活动水准(减少或增加的活动)。第6组中的一只动物(id#6.9,经抗体10mg/kg处理)在第21天未从异氟醚麻醉恢复。动物不显示任何非特异性临床症状,如异常姿势、异常皮毛条件和异常活动水准。第1组中的一只动物 (id#1.10,经媒剂处理)由于关节炎的临床症状的严重程度而在实验结束之前的第22 天剔除。
[0945]
临床评分
[0946]
自第7天直至实验结束,动物每周关于关节炎的临床症状评分三次以包括前肢和后肢肿胀。实验者无视于处理。每一肢体在五点标度上评分:(0)不存在肿胀,(1)略微肿胀和/或红斑,(2)轻度肿胀,(3)中度膨胀和(4)重度肿胀和/或关节僵硬。通过将每一肢体的评分相加对于每一动物计算临床评分。提供于图21中的数据经图示(每一实验组的平均值
±
sem)且通过双向anova,接着为用于实验组之间的多个比较的邓尼特事后测试(dunnett’s post
‑
test)进行分析。媒剂处理动物#1.10的最后记录的分数在第22天之后使用。自分析排除自动物#6.9记录的数据。当相比于第7天测量的临床评分时,媒剂处理组中的临床评分自第17天直至实验结束(第28天)显著增加(p<0.0001)。当相比于媒剂处理组时,对照igg4和igg4 c3 1mg/ml剂量组不在第7天于实验结束 (第28天)之间诱发任何显著差异。当相比于第24天的媒剂处理组时,以3mg/kg投与的igg4 c3诱发临床评分的显著减少(p<0.01)。当相比于媒剂处理组时,以10mg/kg 投与的igg4 c3自第22天直至实验结束(第28天)诱发临床评分的显著减少(p<0.01)。
[0947]
爪体积
[0948]
在第0天、第14天、第21天和第28天,使用器官充满度测量器(水置换装置) 测量后爪体积。测量在气体(异氟醚)麻醉下进行。实验者无视于处理。对每一实验天来自每一动物的右后爪和左后爪体积取平均值。图22显示图示的数据(每一实验组的平均值
±
sem)。通过双向anova,接着为用于实验组之间的多个比较的邓尼特事后测试分析数据。媒剂处理动物#1.10的最后记录的值在第28天之后使用。自分析排除自动物#6.9记录的数据。
[0949]
当相比于第0天测量的爪体积,媒剂处理组中测量的爪体积自第14天直至实验结束(第28天)显著增加(在第14天,p<0.01,在第21天和第28天,p<0.0001)。当相比于媒剂处理组时,对照igg4和1mg/kg igg4 c3剂量组不在第0天与第28天之间诱发后爪体积的任何差异。当相比于第28天的媒剂处理组时,以3mg/kg投与的igg4 c3 诱导后爪体积的显著减小(p<0.01)。当相比于第21天(p<0.05)和第28天(p<0.01) 的媒剂处理组时,以10mg/kg投与的igg4 c3诱发后爪体积的显著减小。
[0950]
结论
[0951]
测试抗体igg4 c3(165_13_c3)当以3mg/kg或10mg/kg投与时显著减轻临床症状的严重程度。
[0952]
参考文献
[0953]
1.smolen,j.s.和maini,r.n.白介素
‑
6:新治疗标靶(interleukin
‑
6:a new therapeutictarget.)《关节炎研究与治疗8(arthritis res ther 8)》增刊2,s5(2006)。
[0954]
2.williams,r.o.,paleolog,e.和feldmann,m.类风湿性关节炎和其它自体免疫疾病中的细胞因子抑制剂(m.cytokine inhibitors in rheumatoid arthritis and otherautoimmune diseases.)《药理学当前观点(curr opin pharmacol)》7,412
‑
417(2007)。
[0955]
3.brentano,f.,kyburz,d.,schorr,o.,gay,r.和gay,s.toll样受体信号传导在关节炎的发病机理中的作用(the role of toll
‑
like receptor signalling in the pathogenesis ofarthritis.)《细胞免疫学(cell immunol)》233,90
‑
96(2005)。
[0956]
4.o'neill,l.a.引物:toll样受体信号传导路径
‑
风湿病学家须知(primer:toll
‑
likereceptor signaling pathways
‑
what do rheumatologists need to know?)《自然
风湿病学临床应用(nat clin pract rheumatol)》(2008)。
[0957]
5.matzinger,p.危险模型:对自我的全新认识(the danger model:a renewed sense ofself.)《科学(science)》296,301
‑
305(2002)。
[0958]
6.bianchi,m.e.damp、pamp和警报素:关于危险我们需要知道的一切(damps, pamps and alarmins:all we need to know about danger.)《白血球生物学杂志(j leukocbiol)》81,1
‑
5(2007)。
[0959]
7.gordon,s.模式识别受体:先天性免疫应答的加倍(pattern recognition receptors: doubling up for the innate immune response.)《细胞(cell)》111,927
‑
930(2002)。
[0960]
8.medzhitov,r.和janeway,c.a.,jr.通过先天免疫系统解码自我和非自我的模式 (decoding the patterns of self and nonself by the innate immune system.)《科学(science)》 296,298
‑
300(2002)。
[0961]
9.radstake,t.r.等人toll样受体2和4在类风湿性滑膜组织中的表达和通过促炎性细胞因子白介素
‑
12和白介素
‑
18经由干扰素
‑
γ的调节(expression of toll
‑
like receptors 2and 4in rheumatoid synovial tissue and regulation by proinflammatory cytokinesinterleukin
‑
12and interleukin
‑
18via interferon
‑
gamma.)《关节炎与风湿病(arthritisrheum)》50,3856
‑
3865(2004)。
[0962]
10.roelofs,m.f.等人toll样受体3和7在类风湿性关节炎滑膜中的表达增加且toll 样受体、3、4和7/8的共刺激导致通过树突状细胞的协同细胞因子产生(the expressionof toll
‑
like receptors 3and 7in rheumatoid arthritis synovium is increased and costimulationof toll
‑
like receptors 3,4,and 7/8results in synergistic cytokine production by dendriticcells.)《关节炎与风湿病》52,2313
‑
2322(2005)。
[0963]
11.sacre,s.m.等人toll样受体接附蛋白myd88和mal/tirap促进类风湿性关节炎的人类模型中的发炎性和破坏性方法(the toll
‑
like receptor adaptor proteins myd88 andmal/tirap contribute to the inflammatory and destructive processes in a human model ofrheumatoid arthritis.)《美国病理学杂志(am j pathol)》170,518
‑
525(2007)。
[0964]
12.choe,j.y.,crain,b.,wu,s.r.和corr,m.血清转移性关节炎的白介素1受体依赖性可通过toll样受体4信号传导规避(interleukin 1receptor dependence of serumtransferred arthritis can be circumvented by toll
‑
like receptor 4signaling.)《实验医学杂志(jexp med)》197,537
‑
542(2003)。
[0965]
13.lee,e.k.,kang,s.m.,paik,d.j.,kim,j.m.和youn,j.toll样受体
‑
4信号传导在通过ii型胶原蛋白抗体和lps诱导的关节炎中的重要角色(essential roles of toll
‑
likereceptor
‑
4signaling in arthritis induced by type ii collagen antibody and lps.)《国际免疫学杂志(int immunol)》17,325
‑
333(2005)。
[0966]
14.abdollahi
‑
roodsaz,s.等人toll样受体4的抑制打破自身免疫破坏性关节炎中的发炎性回路(inhibition of toll
‑
like receptor 4breaks the inflammatory loop in autoimmunedestructive arthritis.)《关节炎与风湿病》56,2957
‑
2967(2007)。
through toll
‑
likereceptor 4.)《免疫学杂志(j immunol)》167,2887
‑
2894(2001)。
[0978]
26.fitzgerald,k.a.,rowe,d.c.和golenbock,d.t.通过tlr4/md2复合体的内毒素识别和信号转导(endotoxin recognition and signal transduction by thetlr4/md2
‑
complex.)《微生物感染(microbes infect)》6,1361
‑
1367(2004)。
[0979]
27.jiang,z.等人myd88非依赖性lps信号传导需要cd14(cd14 is required formyd88
‑
independent lps signaling.)《自然
·
免疫学(nat immunol)》6,565
‑
570(2005)。
[0980]
28.coats,s.r.,do,c.t.,karimi
‑
naser,l.m.,braham,p.h.和darveau,r.p.拮抗脂多醣经由与人类md
‑
2脂多醣结合位点的相互作用阻断人类tlr4处的大肠杆菌脂多醣功能(antagonistic lipopolysaccharides block e.coli lipopolysaccharide function at humantlr4 via interaction with the human md
‑
2lipopolysaccharide binding site.)《细胞微生物学 (cell microbiol)》9,1191
‑
1202(2007)。
[0981]
29.siri,a.等人人类腱生蛋白:通过两个单克隆抗体识别的抗原决定基的初级结构、预mrna剪接模式和定位(human tenascin:primary structure,pre
‑
mrna splicing patternsand localization of the epitopes recognized by two monoclonal antibodies.)《核酸研究 (nucleic acids res)》19,525
‑
531(1991)。
[0982]
30.gondokaryono,s.p.等人纤维结合蛋白的外域a经由toll样受体4刺激鼠类肥大细胞(the extra domain a of fibronectin stimulates murine mast cells via toll
‑
like receptor 4.)《白血球生物学杂志(j leukoc biol)》82,657
‑
665(2007)。
[0983]
31.taylor,k.r.等人无菌损伤中释放的透明质酸的识别涉及依赖于toll样受体4、 cd44和md
‑
2的独特受体复合物(recognition of hyaluronan released in sterile injuryinvolves a unique receptor complex dependent on toll
‑
like receptor 4,cd44,and md
‑
2.)《jbiol chem》282,18265
‑
18275(2007)。
[0984]
32.kim,h.m.等人tlr4
‑
md
‑
2与结合内毒素拮抗剂eritoran的复合物的晶体结构 (crystal structure of the tlr4
‑
md
‑
2complex with bound endotoxin antagonist eritoran.) 《细胞》130,906
‑
917(2007)。
[0985]
33.schaefer,l.等人基质成分双糖链蛋白多糖具促炎性且通过巨噬细胞中的toll样受体4和2发信号(the matrix component biglycan is proinflammatory and signals throughtoll
‑
like receptors 4and 2in macrophages.)《临床研究杂志(j clin invest)》115,2223
‑
2233 (2005)。
[0986]
34.foell,d.,wittkowski,h.和roth,疾病机制:发炎性关节炎的
‘
damp’观点(j. mechanisms of disease:a'damp'view of inflammatory arthritis.)《自然风湿病学临床应用》3,382
‑
390(2007)。
[0987]
35.taniguchi,n.等人高迁移率族染色体蛋白1以新细胞因子形式在类风湿性关节炎的发病机理中起作用(high mobility group box chromosomal protein 1plays a role in thepathogenesis of rheumatoid arthritis as a novel cytokine.)《关节炎与风湿病》48,971
‑
981 (2003)。
[0988]
36.pullerits,r.等人高迁移率族染色体蛋白1,一种dna结合细胞因子,诱发关节炎(high mobility group box chromosomal protein 1,a dna binding cytokine,inducesarthritis.)《关节炎与风湿病》48,1693
‑
1700(2003)。
[0989]
37.kokkola,r.等人通过靶向细胞外高迁移率族染色体蛋白1活性的小鼠和大鼠中的胶原蛋白诱导的关节炎的成功治疗(successfultreatmentofcollagen
‑
inducedarthritisinmiceandratsbytargetingextracellularhighmobilitygroupboxchromosomalprotein1activity)《关节炎与风湿病》48,2052
‑
2058(2003)。
[0990]
38.gutowski,n.j.,newcombe,j.和cuzner,m.l.多发性硬化症病变中的腱生蛋白r和c:与细胞外基质重塑的相关性(tenascin
‑
randcinmultiplesclerosislesions:relevancetoextracellularmatrixremodelling.)《神经病理学与应用神经生物学(neuropatholapplneurobiol)》25,207
‑
214(1999)。
[0991]
39.amin,k.等人患有原发性干燥综合症的患者的气管中的发炎和结构变化(inflammationandstructuralchangesintheairwaysofpatientswithprimarysjogren'ssyndrome.)《呼吸道医学(respirmed)》95,904
‑
910(2001)
[0992]
40.loots,m.a.等人慢性糖尿病性和静脉溃疡相对于急性伤口的细胞浸润和细胞外基质的差异(differencesincellularinfiltrateandextracellularmatrixofchronicdiabeticandvenousulcersversusacutewounds.)《皮肤病学研究杂志(jinvestdermatol)》111,850
‑
857(1998)。
[0993]
41.lange,k.等人b型内皮素受体抵消腱生蛋白c诱导的a型内皮素受体依赖性焦点粘连和肌动蛋白应力纤维结构紊乱(endothelinreceptortypebcounteractstenascin
‑
c
‑
inducedendothelinreceptortypea
‑
dependentfocaladhesionandactinstressfiberdisorganization.)《癌症研究(cancerres)》67,6163
‑
6173(2007)。
[0994]
42.saga,y.,yagi,t.,ikawa,y.,sakakura,t.和aizawa,s.小鼠在无腱生蛋白的情况下正常发育(micedevelopnormallywithouttenascin.)《基因与发育(genesdev)》6,1821
‑
1831(1992)。
[0995]
43.hoshino,k.等人优势:toll样受体4(tlr4)缺陷性小鼠对脂多醣具低反应性:tlr4作为lps基因产物的证据(cuttingedge:toll
‑
likereceptor4(tlr4)
‑
deficientmicearehyporesponsivetolipopolysaccharide:evidencefortlr4asthelpsgeneproduct.)《免疫学杂志》162,3749
‑
3752(1999)。
[0996]
44.takeuchi,o.等人tlr2和tlr4在识别革兰氏阴性和革兰氏阳性细菌细胞壁组分中的差异性角色(differentialrolesoftlr2andtlr4inrecognitionofgram
‑
negativeandgram
‑
positivebacterialcellwallcomponents.)《免疫性(immunity)》11,443
‑
451(1999)。
[0997]
45.keystone,e.c.,schorlemmer,h.u.,pope,c.和allison,a.c.酵母聚糖诱导性关节炎:补体的替代路径激活之后的慢性增生性关节炎的模型(zymosan
‑
inducedarthritis:amodelofchronicproliferativearthritisfollowingactivationofthealternativepathwayofcomplement.)《关节炎与风湿病》20,1396
‑
1401(1977)。
[0998]
46.vanlent,p.l.等人fcγ受体直接介导鼠类抗原诱导性关节炎中的软骨(并非骨骼)破坏:将软骨损伤于骨骼侵蚀和关节发炎分开(fcgammareceptorsdirectlymediatecartilage,butnotbone,destructioninmurineantigen
‑
inducedarthritis:uncouplingofcartilagedamagefromboneerosionandjointinflammation.)《关节炎与风湿病》54,3868
‑
3877(2006)。
[0999]
47.foxwell,b.等人用iκbα的有效腺病毒感染展现类风湿性关节炎中的巨噬细胞肿瘤坏死因子α产生为nf
‑
κb依赖性的(efficient adenoviral infection with ikappab alphareveals that macrophage tumor necrosis factor alpha production in rheumatoid arthritis isnf
‑
kappab dependent.)《美国国家科学院院刊(proc natl acad sci usa)》95,8211
‑
8215 (1998)。
[1000]
48.kurt
‑
jones,e.a.等人鼠类胚胎成纤维细胞界定toll样受体活化和特异性的用途 (use of murine embryonic fibroblasts to define toll
‑
like receptor activation and specificity.) 《内毒素研究杂志(j endotoxin res)》10,419
‑
424(2004)。
[1001]
49.todaro,g.j.和green,h.小鼠胚胎细胞在培养物中的生长和其发育为确立的细胞系的定量研究(quantitative studies of the growth of mouse embryo cells in culture andtheir development into established lines.)《细胞生物学杂志(j cell biol)》17,299
‑
313 (1963)。
[1002]
50.butler,d.m.,malfait,a.m.,maini,r.n.,brennan,f.m.和feldmann,m.抗il
‑
12 和抗tnf抗体协同地抑止鼠类胶原蛋白诱导性关节炎的进展(anti
‑
il
‑
12and anti
‑
tnfantibodies synergistically suppress the progression of murine collagen
‑
induced arthritis.)《欧洲免疫学杂志(eur j immunol)》29,2205
‑
2212(1999)。
[1003]
51.ho,s.n.,hunt,h.d.,horton,r.m.,pullen,j.k.和pease,l.r.使用聚合酶链反应通过重叠延伸的定点突变诱发(site
‑
directed mutagenesis by overlap extension using thepolymerase chain reaction.)《基因(gene)》77,51
‑
59(1989)。
[1004]
52.clark,r.a.,erickson,h.p.和springer,t.a.腱生蛋白支持淋巴细胞滚动(tenascinsupports lymphocyte rolling.)《细胞生物学杂志(j cell biol)》137,755
‑
765(1997)。
[1005]
53.el
‑
karef,a.等人腱生蛋白c的缺乏减轻小鼠的免疫介导慢性肝炎中的肝纤维化(deficiency of tenascin
‑
c attenuates liver fibrosis in immune
‑
mediated chronic hepatitis inmice.)《病理学杂志(j pathol)》211,86
‑
94(2007)。
[1006]
54.loike,j.d.,cao,l.,budhu,s.,hoffman,s.和silverstein,s.c.α5β1整合素的皮下阻断通过细胞外基质蛋白的三维凝胶逆转腱生蛋白对人类单核细胞和多形核白细胞的趋化性(blockade of alpha 5beta 1integrins reverses the inhibitory effect of tenascin onchemotaxis of human monocytes and polymorphonuclear leukocytes throughthree
‑
dimensional gels of extracellular matrix proteins.)《免疫学杂志(j immunol)》166, 7534
‑
7542(2001)。
[1007]
55.talts,j.f.,wirl,g.,dictor,m.,muller,w.j.和fassler,r.腱生蛋白c调节肿瘤基质和单核细胞/巨噬细胞补充但不调节患有自发性乳腺癌的小鼠品系中的肿瘤生长或癌转移(tenascin
‑
c modulates tumor stroma and monocyte/macrophage recruitment but nottumor growth or metastasis in a mouse strain with spontaneous mammary cancer.)《细胞科学杂志(j cell sci)》112(pt 12),1855
‑
1864(1999)。
[1008]
56.jones(2000)《基质生物学(matrix biol.)》,19,581
‑
96
[1009]
57.harandi(2009)《疫苗专家评述(expert review of vaccines)》,8,293
‑
298
[1010]
58.mcintyre(2006)《bmc生物技术(bmc biotechnol.)》6:1
[1011]
59.paddison(2002)《基因与发育(genes dev.)》16(8):948
‑
58
[1012]
60.andreakos(2004)《血液(blood)》,103,2229
‑
37
[1013]
61.goh,f.g.,piccinini,a.m.,krausgruber,t.,udalova,i.a.和midwood,k.s.内源性危险信号腱生蛋白c的转录调节:发炎中的新自分泌环路(transcriptional regulation ofthe endogenous danger signal tenascin
‑
c:a novel autocrine loop in inflammation.)《免疫学杂志(j immunol)》184,2655
‑
2662(2010)。
[1014]
62.midwood,k.等人腱生蛋白c为维持关节炎性关节疾病中的发炎必需的toll样受体4的内源性活化剂(tenascin
‑
c is an endogenous activator of toll
‑
like receptor 4that isessential for maintaining inflammation in arthritic joint disease.)《自然
·
医学》15,774
‑
780 (2009)。
[1015]
63.lafleur,d.w.等人主动脉平滑肌细胞经由其纤维蛋白原样域与腱生蛋白c相互作用(aortic smooth muscle cells interact with tenascin
‑
c through its fibrinogen
‑
likedomain.)《生物化学杂志(j biol chem)》272,32798
‑
32803(1997)。
[1016]
64.taylor,p.c.和feldmann,m.抗tnf生物制剂:仍为类风湿性关节炎的所选疗法 (anti
‑
tnf biologic agents:still the therapy of choice for rheumatoid arthritis.)《自然评论风湿病学(nat rev rheumatol)》5,578
‑
582(2009)。
[1017]
65.yokoyama,k.,erickson,h.p.,ikeda,y.和takada,y.识别对于结合至整合素αvβ 3重要的纤维蛋白原γ
‑
链和腱生蛋白c c端域中的氨基酸序列(identification of aminoacid sequences in fibrinogen gamma
‑
chain and tenascin c c
‑
terminal domains critical forbinding to integrin alpha vbeta 3.)《生物化学杂志(j biol chem)》275,16891
‑
16898(2000)。
[1018]
66.angal s等人(1993)单一氨基酸取代消除嵌合小鼠/人类(igg4)抗体的异质性 (a single amino acid substitution abolishes the heterogeneity of chimeric mouse/human (igg4)antibody.)《分子免疫学(mol.immunology)》30(1):105
‑
108。
[1019]
67.chapple sd等人(2006)用于哺乳动物细胞中的重组蛋白产生的多重表达和筛选(multiplexed expression and screening for recombinant protein production in mammaliancells.)《bmc生物技术(bmc biotechnol.)》6:49。
[1020]
68.dyson mr等人(2011)通过组合抗体亲和力成熟和质谱映射蛋白质相互作用 (mapping protein interactions by combining antibody affinity maturation and massspectrometry.)《分析生物化学(anal biochem.)》417(1):25
‑
35。
[1021]
69.falk r等人(2012)产生抗notch抗体和其在阻断神经干细胞中的notch信号传导中的应用(generation of anti
‑
notch antibodies and their application in blocking notchsignalling in neural stem cells.)《方法(methods)》58(1):69
‑
78。
[1022]
70.fellouse fa和sidhu,ss(2007)在细菌中制造抗体(making antibodies inbacteria.)《制造和使用抗体(making and using antibodies)》(g.c.howard和m.r.kaser 编),第157
‑
180页,crc press,boca raton,fl。
[1023]
71.hawkins re,russell sj和winter,g(1992)通过结合亲和力选择噬菌体抗体,
模拟亲和力成熟(selection of phage antibodies by binding affinity.mimicking affinitymaturation.)《分子生物学杂志(j.mol.biol)》226:889
‑
896。
[1024]
72.kunkel ta,roberts jd和zakour ra(1987)在无表现型选择的情况下的快速和有效定点突变诱发(rapid and efficient site
‑
specific mutagenesis without phenotypicselection.)《酶学方法(meth.enzymol.)》154:367
‑
382。
[1025]
73.martin cd等人(2006)改进重组抗体的效能和利用的简单载体系统(a simplevector system to improve performance and utilisation of recombinant antibodies.)《bmc生物技术》6:46。
[1026]
74.schofield dj等人(2007)噬菌体呈现的高通量抗体产生和表征的应用 (application of phage display to high throughput antibody generation and characterization.) 《基因组生物学(genome biol.)》8(11):r254。
[1027]
75.sidhu ss和weiss ga(2004)通过寡核苷酸定向突变诱发构筑噬菌体呈现库 (constructing phage display libraries by oligonucleotide
‑
directed mutagenesis.)《噬菌体呈现:实用方法(phage display:a practical approach.)》
[1028]
76.zahnd c,sarkar ca和pl
ü
ckthun a(2010)解离速率选择实验的计算分析以通过定向演化优化亲和力成熟(computational analysis of off
‑
rate selection experiments tooptimize affinity maturation by directed evolution)《蛋白质工程设计与选择(protein eng. des.sel.)》23:175
‑
184。
[1029]
77.ehrenmann f.,kaas q.和lefranc m.p.《核酸研究(nucleic acids res.)》,38, d301
‑
307(2010)。
[1030]
78.page等人(2012).《关节炎研究和疗法arthritis research&therapy》14:r260
[1031]
现将在下文编号段落中描述本发明的实施例:
[1032]
1.一种能够结合至腱生蛋白c的fbg域的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体包含:一或多个选自seq id no: 1
‑
8、48
‑
91和112
‑
114的序列;和/或一或多个选自seq id no:5、9
‑
15、30
‑
47和115
‑
118 的序列;和/或一或多个选自seq id no:5、13、16
‑
21和119
‑
121的序列;和/或一或多个选自seq id no:22
‑
29和122
‑
123的序列。
[1033]
2.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其中抗体或抗原结合片段、其衍生物或变异体包含:一或多个选自seq id no:1
‑
3、5
‑
7、48、50、52、54、 56、58、60、62、64、66、68、70、72、74、76、78、80、82、84、86、88、90和114 的cdr序列;和/或一或多个选自seq id no:9
‑
11、5、13
‑
14、30、32、34、36、38、 40、42、44、46、116和118的cdr序列;和/或一或多个选自seq id no 16
‑
18、5、 13、20和121的cdr序列;和/或一或多个选自seq id no 22
‑
24和26
‑
28的cdr序列。
[1034]
3.根据第1段或第2段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体包含:一或多个选自seq id no:3、7、48、 50、52、54、56、58、60、62、64、66、68、70、72、74、76、78、80、82、84、86、 88和90的cdr3序列;和/或一或多个选自seq id no:11、14、30、32、34、36、38、 40、42、44和46的cdr3序列;和/或一或多个选自seq id no 18和20的cdr3序列;和/或一或多个选自seq id no 24和28的cdr3序列。
[1035]
4.根据第3段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗
原结合片段、其衍生物或变异体包含:一或多个选自seq id no:3、54、66和70的cdr3 序列;和/或一或多个选自seq id no:7、76、88和90的cdr3序列;和/或一或多个选自seq id no:11、30、34和36的cdr3序列。
[1036]
5.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体包含:选自seq id no:3、48、50、52、54、56、58、 60、62、64、66、68和70的vh cdr3序列;选自seq id no:3、54、66和70的vhcdr3序列;或选自seq id no:3和54的vh cdr3序列。
[1037]
6.根据第1段或第5段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、衍生物或变异体包含:选自seq id no:7、72、74、76、78、80、 82、84、86、88和90的vl cdr3序列;选自seq id no:7、76、88和90的vl cdr3 序列;或seq id no 7的vl cdr3序列。
[1038]
7.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体包含含seq id no:4或112的序列的vh序列,且其中 vh序列包含经以下各者置换的cdr3序列:选自seq id no:48、50、52、54、56、58、 60、62、64、66、68和70的vh cdr3序列;选自seq id no:54、66和70的vh cdr3 序列;或seq id no:54的vh cdr3序列。
[1039]
8.根据第1段或第7段所述的抗体或抗原结合片段、其衍生物或变异体,其中抗体或抗原结合片段、其衍生物或变异体包含含seq id no:8或113的序列的vl序列,且其中vl序列包含经以下各者置换的cdr3序列:选自seq id no:72、74、76、78、 80、82、84、86、88和90的vl cdr3序列;或选自seq id no:76、88和90的vl cdr3 序列。
[1040]
9.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体包含:选自seq id no:11、30、32、34、36、38、40、 42、44和46的vh cdr3序列;选自seq id no:11、30、34和36的vh cdr3序列;或选自seq id no 11、30和36的vh cdr3序列。
[1041]
10.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体包含含seq id no:15或117的序列的vl序列。
[1042]
11.根据第1段或第10段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体包含含seq id no:12或115的序列的vh 序列,且其中vh序列包含经以下各者置换的cdr3序列:选自seq id no:30、32、 34、36、38、40、42、44和46的vh cdr3序列;选自seq id no:30、34和36的vhcdr3序列;或选自seq id no 30和36的vh cdr3序列。
[1043]
12.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体包含:seq id no:7的vl cdr3序列和选自seq id no: 3和48
‑
70的vh cdr3序列;或包含seq id no:3的vh cdr3序列和选自seq id no: 7和72
‑
90的vl cdr3序列;或包含seq id no:14的vl cdr3序列和选自seq id no: 11和30
‑
46的vh cdr3序列;或包含seq id no:18的vh cdr3序列和seq id no:20 的vl cdr3序列;或包含seq id no:24的vh cdr3序列和seq id no:28的vl cdr3 序列。
[1044]
13.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体包含:至少一个cdr选自seq id no:1
‑
3和5
‑
7的序列;或
至少一个选自seq id no:1、2、48和5
‑
7的cdr序列;或至少一个选自seq idno:1、2、50和5
‑
7的cdr序列;或至少一个选自seq id no:1、2、52和5
‑
7的cdr 序列;或至少一个选自seq id no:1、2、54和5
‑
7的cdr序列;或至少一个选自seqid no:1、2、56和5
‑
7的cdr序列;或至少一个选自seq id no:1、2、58和5
‑
7的 cdr序列;或至少一个选自seq id no:1、2、60和5
‑
7的cdr序列;或至少一个选自seq id no:1、2、62和5
‑
7的cdr序列;或至少一个选自seq id no:1、2、64和 5
‑
7的cdr序列;或至少一个选自seq id no:1、2、66和5
‑
7的cdr序列;或至少一个选自seq id no:1、2、68和5
‑
7的cdr序列;或至少一个选自seq id no:1、2、 70和5
‑
7的cdr序列;或至少一个选自seq id no:1
‑
3、5、6和72的cdr序列;或至少一个选自seq id no:1
‑
3、5
‑
6和74的cdr序列;或至少一个选自seq id no:1
‑
3、5、6和76的cdr序列;或至少一个选自seq id no:1
‑
3、5、6和78的cdr序列;或至少一个选自seq id no:1
‑
3、5、6和80的cdr序列;或至少一个选自seq id no: 1
‑
3、5、6和82的cdr序列;或至少一个选自seq id no:1
‑
3、5、6和84的cdr序列;或至少一个选自seq id no:1
‑
3、5、6和86的cdr序列;或至少一个选自seq idno:1
‑
3、5、6和88的cdr序列;或至少一个选自seq id no:1
‑
3、5、6和90的cdr 序列;或至少一个选自seq id no:1
‑
3、5、7和114的cdr;或至少一个选自seq idno:9
‑
11和5、13和14的cdr序列;或至少一个选自seq id no:9、10、30、5、13 和14的cdr序列;或至少一个选自seq id no:9、10、32、5、13和14的cdr序列;或至少一个选自seq id no:9、10、34、5、13和14的cdr序列;或至少一个选自seqid no:9、10、36、5、13和14的cdr序列;或至少一个选自seq id no:9、10、38、 5、13和14的cdr序列;或至少一个选自seq id no:9、10、40、5、13和14的cdr 序列;或至少一个选自seq id no:9、10、42、5、13和14的cdr序列;或至少一个选自seq id no:9、10、44、5、13和14的cdr序列;或至少一个选自seq id no:9、 10、46、5、13和14的cdr序列;或至少一个选自seq id no:9、11、116、5、14和 118的cdr;或至少一个选自seq id no:16
‑
18和5、13和20的cdr序列;或至少一个选自seq id no:16
‑
18和5、121和20的cdr序列;或至少一个选自seq id no:22
‑
24 和26
‑
28的cdr序列。
[1045]
14.根据第3段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体包含:选自seq id no:3和54的vh cdr3序列;或选自seq id no:11、30和36的vh cdr3序列。
[1046]
15.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体包含含以下各者的vh和/或vl序列:一或多个选自seqid no:4、8、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、 81、83、85、87、89、91、112和113的序列;和/或一或多个选自seq id no 12、15、 31、33、35、37、39、41、43、45、47、115和117的序列;和/或一或多个选自seq idno 19、21、119和120的序列;和/或一或多个选自seq id no 25、29、122和123的序列。
[1047]
16.根据第15段所述的抗体或抗原结合片段、其衍生物或变异体,其中vh序列选自seq id no:4、49、51、53、55、57、59、61、63、65、67、69、71和112;和/或选自seq id no 12、31、33、35、37、39、41、43、45、47和115;和/或选自seq idno:19和119;和/或选自seq id no 25和122。
[1048]
17.根据第15段或第16段所述的抗体或抗原结合片段、其衍生物或变异体,其中 vl序列选自seq id no:8、73、75、77、79、81、83、85、87、89、91和113;和/或选自seq id no:15和117;和/或选自seq id no:21和120;和/或选自seq id no:29 和123。
[1049]
18.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体包含含vh和vl序列对的序列的vh和vl序列,所述序列对选自以下序列对:seq id no 4和8;seq id no 49和8;seq id no 51和8; seq id no 53和8;seq id no 55和8;seq id no 57和8;seq id no 59和8;seqid no 61和8;seq id no 63和8;seq id no 65和8;seq id no 67和8;seq id no 69和8;seq id no 71和8;seq id no 112和8;seq id no 4和113;seq id no 49 和113;seq id no 51和113;seq id no 53和113;seq id no 55和113;seq id no 57和113;seq id no 59和113;seq id no 61和113;seq id no 63和113;seq idno 65和113;seq id no 67和113;seq id no 69和113;seq id no 71和113;seqid no 4和73;seq id no 4和75;seq id no 4和77;seq id no 4和79;seq id no 4和81;seq id no 4和83;seq id no 4和85;seq id no 4和87;seq id no 4 和89;seq id no和4和91;seq id no 112和73;seq id no 112和75;seq id no 112和77;seq id no 112和79;seq id no 112和81;seq id no 112和83;seq idno 112和85;seq id no 112和87;seq id no 112和89;seq id no和112和91; seq id no和112和113;或选自以下序列对:seq id no 12和15;seq id no 31和 15;seq id no 33和15;seq id no 35和15;seq id no 37和15;seq id no 39 和15;seq id no 41和15;seq id no 43和15;seq id no 45和15;seq id no 47 和15;seq id no 115和15;seq id no 12和117;seq id no 31和117;seq id no 33和117;seq id no 35和117;seq id no 37和117;seq id no 39和117;seq idno 41和117;seq id no 43和117;seq id no 45和117;seq id no 47和117;和 seq id no 115和117;或选自以下序列对:seq id no 19和21;seq id no 19和120; seq id no 119和21;和seq id no 119和120;或选自以下序列对:seq id no 25 和29;seq id no 25和123;seq id no 122和29;和seq id no 122和123。
[1050]
19.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其包含含选自seqid no:4、49、51、53、55、57、59、61、63、65、67、69、71和112的序列的vh序列。
[1051]
20.根据第1段或第19段所述的抗体或抗原结合片段、其衍生物或变异体,其包含含选自seq id no:8、73、75、77、79、81、83、85、87、89、91和113的序列的vl 序列。
[1052]
21.根据第1段或第20段所述的抗体或抗原结合片段、其衍生物或变异体,其包含含seq id no:4或112的序列的vh序列。
[1053]
22.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其包含含seq idno:55的序列的vh序列。
[1054]
23.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其包含含选自seqid no:12、31、33、35、37、39、41、43、45、47和115的序列的vh序列。
[1055]
24.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其包含含seq idno:12或115的序列的vh序列。
[1056]
25.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其包含含seq idno:31的序列的vh序列。
[1057]
26.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其包含含seq idno:37的序列的vh序列。
[1058]
27.根据第19段或第21到22段所述的抗体或抗原结合片段、其衍生物或变异体,其另外包含含seq id no:8或113的序列的vl序列。
[1059]
28.根据第23到26段中任一段所述的抗体或抗原结合片段、其衍生物或变异体,其另外包含seq id no:15或117的序列的vl序列。
[1060]
29.根据第1段所述的抗体或抗原结合片段、其衍生物或变异体,其包含:包含seqid no:37的序列的vh序列;和包含seq id no:15的序列的vl序列。
[1061]
30.根据前述段落中任一段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体为多克隆或单克隆抗体或抗原结合片段、其衍生物或变异体。
[1062]
31.根据第30段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体选自由以下组成的群组:fv片段、scfv片段、fab、单一可变域和域抗体。
[1063]
32.根据任何前述段落所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体为人类化的。
[1064]
33.根据任何前述段落所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体对于腱生蛋白c或其域具有特异性。
[1065]
34.根据第33段中任一段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体对腱生蛋白c的fbg域具有特异性。
[1066]
35.根据第34段中任一段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体中和腱生蛋白c的fbg域的活性。
[1067]
36.根据任何前述段落所述的抗体或抗原结合片段、其衍生物或变异体,其中所述腱生蛋白c为瓜氨酸化腱生蛋白c。
[1068]
37.根据第36段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述瓜氨酸化腱生蛋白c在fbg域处经瓜氨酸化。
[1069]
38.根据第37段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述瓜氨酸化腱生蛋白c仅在fbg域处经瓜氨酸化。
[1070]
39.根据任何前述段落所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体用于调节慢性发炎性反应。
[1071]
40.根据第39段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体调节腱生蛋白c的生物活性。
[1072]
41.根据第40段所述的抗体或抗原结合片段、其衍生物或变异体,其中所述药剂通过更改腱生蛋白c的转录、翻译和/或结合特性而调节腱生蛋白c的生物活性。
[1073]
42.根据任何前述段落所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体下调腱生蛋白c的生物活性。
[1074]
43.根据任何前述段落所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体上调腱生蛋白c的生物活性。
[1075]
44.根据任何前述段落所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体为腱生蛋白c的转录、翻译和/或结合特性的抑制剂。
[1076]
45.根据任何前述段落所述的抗体或抗原结合片段、其衍生物或变异体,其中所述抗体或抗原结合片段、其衍生物或变异体为腱生蛋白c的竞争性结合抑制剂。
[1077]
46.一种组合物,其包含根据第1到45段中任一段所定义的抗体或抗原结合片段、其衍生物或变异体和药学上可接受的载剂、赋形剂和/或稀释剂。
[1078]
47.根据第46段所述的组合物,其进一步包含至少一种其它药剂。
[1079]
48.根据第47段所述的组合物,其中所述至少一种其它药剂为消炎剂、抑制素、生物剂(生物制剂)、免疫抑制剂、水杨酸盐和/或杀微生物剂。
[1080]
49.根据第48段所述的组合物,其中所述消炎剂选自由非类固醇消炎剂(nsaid)、皮质类固醇、疾病改善抗风湿药物(dmard)或免疫抵制剂组成的群组。
[1081]
50.根据第1到49段所定义的抗体或抗原结合片段、其衍生物或变异体或组合物,其用作药剂。
[1082]
51.根据第1到49段所定义的抗体或抗原结合片段、其衍生物或变异体或组合物,其用于治疗慢性发炎性病况。
[1083]
52.一种根据第1到49段所定义的抗体或抗原结合片段、其衍生物或变异体或组合物的用途,其用于制造用于治疗或诊断慢性发炎性病况的药剂。
[1084]
53.一种治疗慢性发炎性病况的方法,其包含向个体投与有效量的根据第1到49段所定义的抗体或抗原结合片段、其衍生物或变异体或组合物。
[1085]
54.根据第1到49段所定义的抗体或抗原结合片段、其衍生物或变异体或组合物,其用于诊断慢性发炎性病况和/或测定患有慢性发炎性病况的患者的预后。
[1086]
55.一种诊断慢性发炎性病况和/或确定患有慢性发炎性病况的患者的预后的方法,其包含使用根据第1到49段所定义的抗体或抗原结合片段、其衍生物或变异体或组合物检测腱生蛋白c的fbg域的存在或不存在或量。
[1087]
56.根据第54或55段所定义的抗体或抗原结合片段、其衍生物或变异体或方法,其中检测的腱生蛋白c的fbg域的量的增加指示慢性发炎性病况测定和/或患有慢性发炎性病况的患者的预后。
[1088]
57.根据第56段所述的抗体或抗原结合片段、其衍生物或变异体或方法,其中检测的腱生蛋白c的fbg域的量相比于正常水准增加至少50%指示慢性发炎性病况测定和/ 或患有慢性发炎性病况的患者的预后。
[1089]
58.根据第1到49段所定义的抗体或抗原结合片段、其衍生物或变异体或组合物,其用于测定用于个体的适当治疗,其中检测的腱生蛋白c的fbg域的量指示用于个体的适当治疗。
[1090]
59.一种测定用于个体的适当治疗的方法,其包含使用根据第1到49段所定义的抗体或抗原结合片段、其衍生物或变异体或组合物检测腱生蛋白c的fbg域的存在或不存在或量,其中检测的腱生蛋白c的fbg域的量指示用于个体的适当治疗。
[1091]
60.根据第58或59段所述的抗体或抗原结合片段、其衍生物或变异体或组合物或方法,其中所述适当治疗包含投与有效量的药剂或组合物,所述药剂或组合物可为以下中一或多种:根据第1到49段所定义的抗体或抗原结合片段、其衍生物或变异体或组合物;dmards(如甲胺喋呤);抗tnf药物;抗il17疗法;t细胞共刺激调节剂(如 orencia
tm
‑
阿巴西普(abatacept)):白介素
‑
6(il
‑
6)抑制剂(如actemra
tm
‑
托西利单抗 (tocilizumab));抗cd20抗体(如rituxan
tm
‑
rituxumab;b细胞活化因子(如抗baff);janus激酶(jak)的抑制剂(如tofacitinib
tm
);脾酪氨酸激酶(syk)的抑制剂(如 fostamatinib
tm
);抗tnc抗体或瓜氨
酸化腱生蛋白c域的抗体;和/或调节瓜氨酸化和/ 或非瓜氨酸化腱生蛋白c的生物活性的药剂。
[1092]
61.根据第58到60段所述的抗体或抗原结合片段、其衍生物或变异体或组合物方法,其中所述适当治疗靶向腱生蛋白c的fbg域。
[1093]
62.根据第58到61段所述的抗体或抗原结合片段、其衍生物或变异体或组合物或方法,其中适当治疗为投与有效量的根据第1到49段所定义的抗体或抗原结合片段、其衍生物或变异体或组合物。
[1094]
63.根据第58到62段所述的抗体或抗原结合片段、其衍生物或变异体或组合物或方法,其中所述个体患有慢性发炎性病况。
[1095]
64.根据第58到63段所述的抗体或抗原结合片段、其衍生物或变异体或组合物或方法,其中检测的腱生蛋白c的fbg域的量的增加指示适当治疗。
[1096]
65.根据第64段所述的抗体或抗原结合片段、其衍生物或变异体或组合物或方法,其中检测的腱生蛋白c的fbg域的量的增加指示需要增加量的适当治疗。
[1097]
66.根据第64或65段所述的抗体或抗原结合片段、其衍生物或变异体或组合物或方法,其中检测的腱生蛋白c的fbg域的量的增加为相比于腱生蛋白c的fbg域的正常水准的至少50%增加。
[1098]
67.根据第56到66段所述的抗体或抗原结合片段、其衍生物或变异体或组合物或方法,其中腱生蛋白c的fbg域的量是通过使用以下中的一或多者测定:免疫分析;光谱测定法;西方墨点法;elisa;免疫沉淀;狭缝印迹或斑点印迹分析;等电聚焦; sds
‑
page;抗体微阵列;免疫组织学染色;放射免疫分析(ria)、荧光免疫分析;和/ 或使用抗生素蛋白
‑
生物素和/或抗生蛋白链菌素
‑
生物素系统的免疫分析。
[1099]
68.根据第51到67段所述的抗体或抗原结合片段、其衍生物或变异体、组合物、用途或方法,其中所述慢性发炎性反应与特征在于不当发炎的病况相关。
[1100]
69.根据第51到67段所述的抗体或抗原结合片段、其衍生物或变异体、组合物、用途或方法,其中所述慢性发炎性反应与类风湿性关节炎(ra)、自身免疫病况、发炎性肠病(包括克罗恩氏病(crohn's disease)和溃疡性结肠炎)、非愈合伤口、多发性硬化症、癌症、动脉粥样硬化、修格连氏病(sjogrens disease)、糖尿病、红斑狼疮(包括全身性红斑狼疮)、哮喘、纤维化疾病(包括肝硬化)、肺纤维化、uv损伤、牛皮癣、强直性脊柱炎和心血管疾病相关。
[1101]
70.一种分试剂盒,其包含:
[1102]
(i)根据第1到49段所定义的抗体或抗原结合片段、其衍生物或变异体或组合物;
[1103]
(ii)投与构件;和
[1104]
(iii)使用说明书
[1105]
71.根据第70段所述的分试剂盒,其任选地包含
[1106]
(iv)至少一种其它药剂。
[1107]
72.一种用于测定个体的慢性发炎性病况状态的分试剂盒,其包含:
[1108]
(i)根据第1到49段所定义的抗体或抗原结合片段、其衍生物或变异体或组合物;和
[1109]
(ii)使用说明书
[1110]
应理解,对本文中所述的本发明优选实施例的各种改变和修改将为所述领域的技术人员显而易知。此类改变和修改可以在不脱离本发明的精神和范围的情况下并且在不减小其预期优势的情况下作出。因此,预期此类改变和修改由以下权利要求书涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1