羧基盐引发环内酸酐单体的快速开环聚合方法
1.本发明属于氨基酸类聚合物合成或制备方法技术领域,具体地,涉及羧基盐引发环内酸酐类单体的快速开环聚合方法及其应用。
背景技术:
2.氨基酸类聚合物(聚肽或者聚类肽)具有良好的生物相容性以及独特的生物活性,因此在诸多领域有着广泛的应用前景,包括蛋白质/多肽模拟、抗菌剂开发、组织工程、药物/基因传递等多种生物工程领域。多肽和类肽可通过固相合成和液相合成方法合成,但固相合成费时费力且成本高,合成产品序列短并难大量制备。液相合成中n-羧基羰基环内酸酐的开环聚合产率高、成本低、可制备不同种类的聚合物,因此最为常用也最有前景。
3.但是α-氨基酸n-羧基羰基环内酸酐单体(nca)最常用的引发剂(伯胺、过渡金属催化剂、六甲基二硅氮烷等)会受脱羧限速或催化剂怕水的影响,nca的开环聚合体系在聚合速度等方面还有大量改善的空间。例如对于n-取代α-氨基酸n-羧基羰基环内酸酐单体(nnca),伯胺引发侧链带有大位阻的单体(例如环己基)的时间需要六天以上;对于单体稳定性更高、聚合难度更大的n-取代α-氨基酸n-羧基硫代羰基环内酸酐单体(nnta),伯胺引发侧链带有苄基的单体一直无法获得大分子量的聚合物;对于β-氨基酸n-羧基(硫代羰基)环内酸酐单体更是处于初步探索阶段。
4.综上,需要一种具有突破性的、聚合速度快、针对多种单体(包括低活性单体)、可聚合多种结构聚合物的新引发剂体系。
技术实现要素:
5.本发明的目的就是提供一种具有突破性的、聚合速度快、针对多种单体(包括低活性单体)、可聚合多种结构聚合物的新引发剂体系以制备氨基酸类聚合物。
6.在本发明的第一方面,提供了一种聚合物的制备方法,包括步骤:
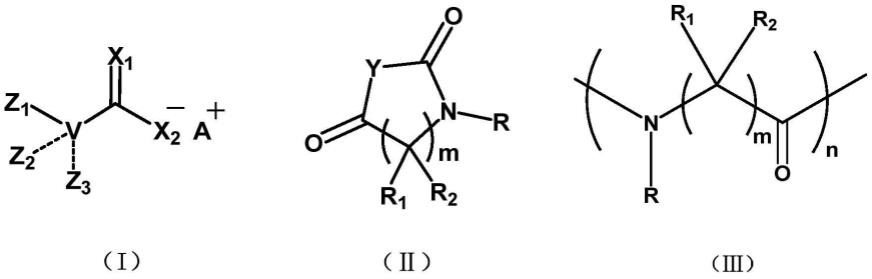
7.(a)在式i化合物引发剂存在下,将一种或多种式ii化合物单体进行聚合反应,从而形成一聚合物,所述聚合物含有式iii所示的聚合单元;
[0008][0009]
其中,
[0010]
x1、x2各自独立地为o或s;
[0011]
a为li、na、k、nh4、nw1w2w3w4、pw1w2w3w4;
[0012]
w1、w2、w3、w4各自独立地选自取代或未取代的下组基团:氢、c
1-c
12
烷基、c
1-c
12
卤代烷基、c
1-c
12
硫代烷基、c
1-c
12
烷基氨基、c
1-c
12
烷基硅基、c
1-c
12
烷氧基、c
1-c
12
卤代烷氧基、c
3-c
12
环烷基、具有1-3个选自下组n、s和o的杂原子的3-12元杂环基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂芳基、c
1-c6烷基酯基;或w1、w2、w3、w4与它们连接的碳原子共同构成取代或未取代的3-12元碳环或杂环(包括单环、螺环、桥环或并环);其中,所述的取代是指被一个或多个rm取代;
[0013]
v选自下组:c、n、o;
[0014]
v为c时,z1、z2、z3各自独立地选自取代或未取代的下组基团:氢、氨基、c
1-c
12
烷基、c
1-c
12
卤代烷基、c
1-c
12
烷基氨基、c
1-c
12
烷基硅基、c
1-c
12
烷基羟基、c
1-c
12
烷基羧基、c
1-c
12
烷氧基、2-12元杂烷基、c
1-c
12
烷基磺酰基、c
2-c
12
烯基、c
2-c
12
炔基、c
3-c
12
环烷基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂芳基、具有1-3个选自下组n、s和o的杂原子的3-12元杂环基、c
1-c6烷基胍基、c
1-c6烷基酯基、硫代c
1-c6烷基酯基,或聚合物链段;或z1、z2、z3与它们连接的碳原子共同构成取代或未取代的3-12元碳环或杂环(包括单环、螺环、桥环或并环);其中,所述的取代是指被一个或多个rm(例如2个、3个、4个等)取代;
[0015]
v为n时,z1、z2各自独立地选自取代或未取代的下组基团:氢、氨基、c
1-c
12
烷基、c
1-c
12
卤代烷基、c
1-c
12
烷基氨基、c
1-c
12
烷基硅基、c
1-c
12
烷基羟基、c
1-c
12
烷基羧基、c
1-c
12
烷氧基、2-12元杂烷基、c
1-c
12
烷基磺酰基、c
2-c
12
烯基、c
2-c
12
炔基、c
3-c
12
环烷基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂芳基、具有1-3个选自下组n、s和o的杂原子的3-12元杂环基、c
1-c6烷基胍基、c
1-c6烷基酯基、硫代c
1-c6烷基酯基,或聚合物链段;或z1、z2、z3与它们连接的碳原子共同构成取代或未取代的3-12元碳环或杂环(包括单环、螺环、桥环或并环);其中,所述的取代是指被一个或多个rm(例如2个、3个、4个等)取代;
[0016]
v为o时,z1各自独立地选自取代或未取代的下组基团:氢、氨基、c
1-c
12
烷基、c
1-c
12
卤代烷基、c
1-c
12
烷基氨基、c
1-c
12
烷基硅基、c
1-c
12
烷基羟基、c
1-c
12
烷基羧基、c
1-c
12
烷氧基、2-12元杂烷基、c
1-c
12
烷基磺酰基、c
2-c
12
烯基、c
2-c
12
炔基、c
3-c
12
环烷基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂芳基、具有1-3个选自下组n、s和o的杂原子的3-12元杂环基、c
1-c6烷基胍基、c
1-c6烷基酯基、硫代c
1-c6烷基酯基,或聚合物链段;或z1、z2、z3与它们连接的碳原子共同构成取代或未取代的3-12元碳环或杂环(包括单环、螺环、桥环或并环);其中,所述的取代是指被一个或多个rm(例如2个、3个、4个等)取代;
[0017]
y为s或o;
[0018]
m为1或2;
[0019]
n为≥2的正整数(如3-20000);
[0020]
r、r1、r2各自独立地选自取代或未取代的下组基团:氢、氨基、c
1-c
12
烷基、c
1-c
12
卤代烷基、c
1-c
12
烷基氨基、c
1-c
12
烷基羟基、c
1-c
12
烷氧基、c
1-c
12
烷硫基、2-12元杂烷基、c
1-c
12
烷基磺酰基、c
2-c
12
烯基、c
2-c
12
炔基、c
3-c
12
环烷基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂芳基、具有1-3个选自下组n、s和o的杂原子的3-12元杂环基、c
1-c6烷基胍基、c
1-c6烷基酯基、硫代c
1-c6烷基酯基、-(c
1-c8亚烷基)-ra;或r1和r2与它们连接的碳原子共同构成取代或未取代的3-12元碳环或杂环;其中,
所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0021]
l独立地为化学键、-chr'
1-、-o-、-s-、-co-、-coo-、-s(=o)
2-;
[0022]
q为1-10的整数;
[0023]
r'1独立地选自取代或未取代的下组基团:氢、氨基、c
1-c
15
烷基、c
1-c
15
烷氧基、c
1-c
15
烷基氨基、c
6-c
15
芳基、c
2-c
15
烯基、c
2-c
15
炔基、c
1-c
15
烷基羟基、c
1-c
15
烷基醛基、c
1-c
15
烷基酯基、硫代c
1-c
15
烷基酯基、-rc-coo-rc”、-rc-co-rc”、-rc-o-rc”、-rc-s-rc”、具有1-3个选自下组n、s和o的杂原子的的5-15元杂芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂环基;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0024]
ra和rb各自独立地选自取代或未取代的下组基团:氢、c
1-c
15
烷基、c
1-c
15
烷氧基、c
1-c
15
烷基氨基、c
2-c
15
烯基、c
2-c
15
炔基、c
1-c
15
烷基羟基、c
1-c
15
烷基醛基、c
1-c
15
烷基磺酰基、-rc-coo-rc”、-rc-co-rc”、-rc-o-rc”、-rc-s-rc”、c
3-c
12
环烷基、c
4-c
12
环烯基、5-12元杂环基、c
6-c
12
芳基、5-12元杂芳基、叔丁氧羰基(boc)、苄氧羰基(cbz)、芴甲氧羰基(fmoc)、邻苯二甲酰基(pht)、乙酰基(ac)、三氟乙酰基(tfa)、苄基(bn)、三苯基甲基(tr);或者ra和rb与其连接的n原子结合形成3-8元取代或未取代的杂环基;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0025]
rc独立地选自取代或未取代的下组基团:无、c
1-c
15
亚烷基、c
2-c
15
亚烯基、c
2-c
15
亚炔基、c
3-c
12
亚环烷基、c
4-c
12
亚环烯基、具有1-3个选自下组n、s和o的杂原子的3-12元亚杂环基、c
6-c
12
亚芳基、具有1-3个选自下组n、s和o的杂原子的5-12元亚杂芳基;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0026]
rc”选自取代或未取代的下组基团:c
1-c
15
烷基、c
1-c
15
烷基氨基、c
2-c
15
烯基、c
2-c
15
炔基、c
3-c
12
环烷基、c
4-c
12
环烯基、3-12元杂环基、c
6-c
12
芳基、5-12元杂芳基;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0027]rm
选自取代或未取代的下组基团:卤素、羟基、氨基、硝基、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、c
1-c6卤代烷氧基、甲基砜基、-s(=o)2nh2、氧代(=o)、-cn、-n3、c
3-c8环烷基、卤代的c3-c8环烷基、c
4-c8环烯基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-10元杂芳基、具有1-3个选自下组n、s和o的杂原子的5-10元杂环基、c1-c6胺基、c1-c6酰胺基、-cooh、-sh、ph-、-phoh、苄氧羰基(cbz)、三苯甲基(trt)、三氟甲基、葡萄糖基、ch3(o-ch
2-ch2)y,且y为1-6的整数;
[0028]
附加条件是所述化合物为化学上稳定的结构。
[0029]
在另一优选例中,w1、w2、w3、w4各自独立地选自下组:h、c
1-c
10
烷基,优选c
1-c6烷基,更优选c
1-c4烷基。
[0030]
在另一优选例中,a为li、na、k、nh4、n(bu)4。
[0031]
在另一优选例中,z1、z2、z3各自独立地选自下组:h、c
1-c
10
烷基,优选c
1-c6烷基。
[0032]
在另一优选例中,z1、z2、z3与它们连接的碳原子共同构成取代或未取代的3-12元芳环或杂芳环(包括单环、螺环、桥环或并环),优选c
6-c
12
芳环。
[0033]
在另一优选例中,z1、z2、z3各自独立地为聚合物链段,所述的聚合物链段选自下组:聚谷氨酸、聚天冬氨酸,或其组合;
[0034]
在另一优选例中,所述聚合物链段的分子量≤10万。
[0035]
在另一优选例中,所述的式i化合物引发剂选自下组:羧基盐、硫代羧基盐,或其组
合。
[0036]
在另一优选例中,所述的式i化合物引发剂选自下组:乙酸锂、乙酸钠、乙酸钾、乙酸铵、四丁基醋酸铵、四丁基苯甲酸铵、聚天冬氨酸四丁胺(分子量≤10万),或其组合。
[0037]
在另一优选例中,所述的式i化合物引发剂为四丁基醋酸铵。
[0038]
在另一优选例中,所述的式ii化合物单体选自下组:n-羧基羰基环内酸酐、n-羧基硫代羰基环内酸酐,或其组合。
[0039]
在另一优选例中,所述的式ii化合物单体选自下组:氨基酸n-羧基羰基环内酸酐、氨基酸n-羧基硫代羰基环内酸酐,或其组合。
[0040]
在另一优选例中,所述的式ii化合物单体选自下组:l型氨基酸n-羧基羰基环内酸酐、d型氨基酸n-羧基羰基环内酸酐、l型氨基酸n-羧基硫代羰基环内酸酐、d型氨基酸n-羧基硫代羰基环内酸酐,或其组合。
[0041]
在另一优选例中,所述的式ii化合物单体选自下组:α-氨基酸n-羧基羰基环内酸酐、β-氨基酸n-羧基羰基环内酸酐、α-氨基酸n-羧基硫代羰基环内酸酐、β-氨基酸n-羧基硫代羰基环内酸酐,或其组合。
[0042]
在另一优选例中,所述的氨基酸是天然氨基酸或非天然氨基酸。
[0043]
在另一优选例中,所述的氨基酸选自下组:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、色氨酸、酪氨酸、天冬氨酸、天冬酰胺、谷氨酸、赖氨酸、谷氨酰胺、甲硫氨酸、丝氨酸、苏氨酸、半胱氨酸、脯氨酸、组氨酸、精氨酸,或其组合。
[0044]
在另一优选例中,所述的式ii化合物单体还包括通过链结构连接的式ii化合物二体结构。
[0045]
在另一优选例中,所述的式ii化合物单体还包括通过二硫键连接的式ii化合物二体结构。
[0046]
在另一优选例中,所述的r、r1、r2各自独立地选自下组:
[0047][0048]
在另一优选例中,所述的式ii化合物单体选自下组:
[0049][0050]
在另一优选例中,所述反应的式ii化合物单体是提纯的或未经提纯的。
[0051]
在另一优选例中,所述反应的式ii化合物单体是未提纯的n-羧基羰基环内酸酐。
[0052]
在另一优选例中,所述式ii化合物单体与式i化合物引发剂的当量比为5-2000:1。
[0053]
在另一优选例中,所述式ii化合物单体与式i化合物引发剂的当量比为5-1500:1,
优选5-1000:1,例如5:1、10:1、100:1、500:1、1000:1。
[0054]
在另一优选例中,所述的聚合物的分子量由单体的活性、单体与引发剂的投料比决定,优选mn≥1000。
[0055]
在另一优选例中,所述的聚合反应在无强碱引发剂(如双三甲基硅基胺基锂、1,8-二氮杂环[5,4,0]十一烯-7)的存在下进行。
[0056]
在另一优选例中,所述反应在惰性气体保护环境(如手套箱)或在无任何保护的仪器或装置中进行。
[0057]
在另一优选例中,所述反应在敞口条件下进行。
[0058]
在另一优选例中,将一种或更多种(如两种、三种、四种或更多种)式ii化合物单体进行聚合反应,得到聚合物。
[0059]
在另一优选例中,所述聚合物为均聚物或共聚物。
[0060]
在另一优选例中,所述共聚物为无规共聚物或嵌段共聚物。
[0061]
在另一优选例中,所述聚合物为多段的嵌段聚合物。
[0062]
在另一优选例中,当所述式ii化合物单体为两种或更多种(如三种、四种或更多种)时,所述方法包括步骤:
[0063]
在式i化合物引发剂存在下,将两种或更多种(如三种、四种或更多种)式ii化合物单体混合后进行聚合反应,从而形成无规共聚物。
[0064]
在另一优选例中,当所述式ii化合物单体为两种或更多种(如三种、四种或更多种)时,所述方法包括步骤:
[0065]
(a)在式i化合物引发剂存在下,将式ii化合物单体a进行聚合反应;
[0066]
(b)待上述聚合反应结束后,再加入式ii化合物单体b进行聚合反应;
[0067]
和任选地(c)重复(b)0-p次,附加条件为步骤(c)中每一步骤的单体与上一步骤的单体不同,从而形成嵌段共聚物;
[0068]
其中,p≥1;
[0069]
式ii化合物单体a和式ii化合物单体b不同,且各自独立地为任一种式ii化合物单体。
[0070]
在另一优选例中,所述的式ii化合物单体a和式ii化合物单体b各自独立地为n-羧基羰基环内酸酐。
[0071]
在另一优选例中,所述的步骤(c)中,p≥5,优选p≥13。
[0072]
在另一优选例中,所述的反应方法中,至少一种式ii化合物单体a参与反应之后,待反应完,后续的加料包括上述任意的单体添加顺序。
[0073]
在另一优选例中,所述的嵌段共聚物的分子量可达50万以上。
[0074]
在另一优选例中,所述的嵌段共聚物可进一步组装,得到聚合物的自组装结构;其中,所述的嵌段共聚物为两亲性的两嵌段共聚物。
[0075]
在另一优选例中,当所述式ii化合物单体为两种时,所述方法包括步骤:
[0076]
(a-1)在惰性溶剂存在下,在式i化合物引发剂存在下,将式ii化合物单体c进行聚合反应;
[0077]
(b-1)待上述聚合反应结束后,再加入式ii化合物单体d进行聚合反应,得到两嵌段共聚物;
[0078]
(c-1)在脱保护剂存在下,所述的两嵌段共聚物的侧链脱保护,再进行自组装,得到聚合物的自组装结构;
[0079]
其中,所述式ii化合物单体c和式ii化合物单体d的添加顺序可互换;
[0080]
所述的式ii化合物单体c为侧链含有氨基的式ii化合物,式ii化合物单体d为侧链为疏水基团的式ii化合物。
[0081]
在另一优选例中,所述的式ii化合物单体c和式ii化合物单体d为n-羧基羰基环内酸酐。
[0082]
在另一优选例中,所述的步骤(c-1)中,在脱保护剂存在下,单体a形成的聚合物嵌段的侧链脱保护,得到侧链带有正电荷的聚合物嵌段。
[0083]
在另一优选例中,所述的式ii化合物单体c选自下组:在另一优选例中,所述的式ii化合物单体c选自下组:
[0084]
在另一优选例中,所述的式ii化合物单体d侧链的疏水基团选自下组:c
1-c
12
烷基、c
1-c
12
卤代烷基、c
1-c
12
烷基酯基、c
3-c
12
环烷基、c
6-c
12
芳基、(c
0-c6亚烷基)-叔丁氧羰基(boc)、(c
0-c6亚烷基)-苄氧羰基(cbz),或其组合。
[0085]
在另一优选例中,所述的式ii化合物单体d选自下组:在另一优选例中,所述的式ii化合物单体d选自下组:
[0086]
在另一优选例中,所述的惰性溶剂为有机溶剂和水。
[0087]
在另一优选例中,所述反应在有机溶剂和水的两相体系中进行。
[0088]
在另一优选例中,所述的有机溶剂选自下组:四氢呋喃、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、乙腈、二氧六环、二甲基亚砜、二氯甲烷、氯仿、丙酮、n-甲基吡咯烷酮,或其组合,优选二甲基亚砜。
[0089]
在另一优选例中,所述的脱保护剂为酸性化合物,选自下组:硫酸、盐酸、对甲苯磺酸、三氟乙酸,或其组合,优选三氟乙酸。
[0090]
在另一优选例中,所述的侧链包含选自下组基团的聚合物可通过侧链的功能化进一步引发式ii化合物单体进行聚合反应;
[0091]
其中,所述基团选自下组:c1-c12酯基、c1-c12羧基、c1-c12硫代羧基、c1-c12硫代酯基。
[0092]
在另一优选例中,当所述式ii化合物单体为两种时,所述方法包括步骤:
[0093]
(a-2)在溶剂存在下,在式i化合物引发剂a存在下,将式ii化合物单体e进行聚合反应;
[0094]
(b-2)将步骤(a-2)得到的聚合物侧链功能化,得到具有式i化合物结构的聚合物盐,作为引发剂b;
[0095]
(c-2)在式i化合物引发剂b存在下,将式ii化合物单体f进行聚合反应,得到共聚物;
[0096]
其中,式ii化合物单体e的侧链包括选自下组的基团:c1-c12酯基、c1-c12羧基、c1-c12硫代羧基、c1-c12硫代酯基。
[0097]
在另一优选例中,所述的步骤(b-2)中,侧链功能化是指将步骤(a-2)得到的聚合物先脱保护,再进行成盐反应,得到具有式i化合物结构的聚合物盐作为引发剂b。
[0098]
在另一优选例中,所述的引发剂b为聚合物的羧酸铵盐,优选聚合物的羧酸季铵盐。
[0099]
在另一优选例中,所述的式ii化合物单体e的侧链包含c1-c12酯基。
[0100]
在另一优选例中,所述的式ii化合物单体e为
[0101]
在另一优选例中,所述方法的反应时间为20秒-120小时。
[0102]
在另一优选例中,所述方法的反应时间为1分钟-72小时,较佳地,为1分钟-48小时;较佳地,为1分钟-12小时;更佳地,为1分钟-6小时;更佳地,为1分钟-1小时;更佳地,为1-5分钟。
[0103]
在另一优选例中,当所述式ii化合物单体为α-氨基酸n-羧基羰基环内酸酐单体时,所述方法的反应时间为1小时;较佳地为10分钟;更佳地为小于1分钟。
[0104]
在另一优选例中,当所述式ii化合物单体为n-羧基硫代羰基环内酸酐单体时,所述方法的反应时间为30分钟~72小时;较佳地为30分钟~48小时;更佳地为30分钟~12小时。
[0105]
在另一优选例中,所述方法的反应时间由单体的活性、单体与引发剂的投料比决定。
[0106]
在另一优选例中,所述反应的动力学常数k
p
[i]超过30h-1
。
[0107]
在另一优选例中,所述反应在10~60℃下进行,优选在20~40℃下进行。
[0108]
在另一优选例中,所述反应在惰性溶剂中进行;
[0109]
其中,所述的惰性溶剂选自下组:四氢呋喃、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、乙腈、二氧六环、二甲基亚砜、二氯甲烷、氯仿、丙酮、n-甲基吡咯烷酮、酯类、芳香烃、烷烃、水,或其组合。
[0110]
在另一优选例中,所述惰性溶剂为四氢呋喃。
[0111]
在另一优选例中,当所述反应在惰性溶剂中进行时,所述方法包括如下步骤:
[0112]
(i)提供单体溶液、引发剂溶液;
[0113]
(ii)将步骤(i)所述的引发剂溶液加入搅拌的单体溶液中,进行聚合反应,从而得到聚合物;
[0114]
其中,单体溶液的溶剂和引发剂溶液的溶剂相同或不同,且各自独立地为上述惰性溶剂。
[0115]
在另一优选例中,所述单体溶液的浓度为0.02~0.5mol/l,较佳地为0.1~0.5mol/l,更佳地为0.1~0.25mol/l,例如0.1mol/l、0.125mol/l、0.2mol/l、0.25mol/l。
[0116]
在另一优选例中,所述引发剂溶液的浓度为0.01~1.5mol/l,较佳地为0.1~0.5mol/l,更佳地为0.1mol/l。
[0117]
在另一优选例中,所述引发剂溶液和单体溶液的体积比为1:3~100,较佳地为1:4~80,例如1:5、1:15、1:50。
[0118]
在另一优选例中,所述引发剂溶液和单体溶液的溶剂各自独立地为有机溶剂,选自下组:四氢呋喃、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、乙腈、二氧六环、二甲基亚砜、二氯甲烷、氯仿、丙酮、n-甲基吡咯烷酮、酯类、芳香烃、烷烃,或其组合。
[0119]
在另一优选例中,所述引发剂溶液的溶剂为水;
[0120]
所述单体溶液的溶剂为选自上述溶剂的有机溶剂。
[0121]
在另一优选例中,所述方法在无溶剂的环境中进行。
[0122]
在另一优选例中,所述方法在无溶剂的环境中在固态条件或固液条件下进行聚合反应。
[0123]
在另一优选例中,所述方法在机械力存在的无溶剂环境中进行。
[0124]
在另一优选例中,当所述方法在无溶剂环境中进行时,包括如下步骤:
[0125]
在研磨条件下,将固态的引发剂与固态的单体混合进行研磨,得到聚合物。
[0126]
在另一优选例中,所述的研磨在选自下组的条件中进行:组织研磨机研磨、球磨机研磨、手动研磨,或其组合。
[0127]
在另一优选例中,将固态的引发剂与固态的单体混合研磨1-10分钟,得到聚合物。
[0128]
在另一优选例中,所述反应在搅拌或不搅拌的反应瓶、孔板、反应釜、反应管道或微流道中进行。
[0129]
在另一优选例中,当所述反应在微流道环境中进行时,所述方法包括如下步骤:
[0130]
(a)提供单体、引发剂;
[0131]
(b)将引发剂和单体加入微流道中进行聚合反应,使反应在一定速度下进行一段时间,从而得到聚合物。
[0132]
在另一优选例中,所述引发剂和单体为引发剂溶液和单体溶液。
[0133]
在另一优选例中,所述引发剂溶液和单体溶液在微流道中的的流速为200μl~1200μl/min。
[0134]
在另一优选例中,当所述反应在微流道环境中进行时,获得的聚合物的分子量可由微流道的流速调控。
[0135]
在本发明的第二方面,提供了一种聚合物,所述聚合物含有式iii所示聚合单元中的一种或多种,
[0136][0137]
m为1或2;
[0138]
n为≥2的正整数(如3-20000);
[0139]
r、r1、r2各自独立地选自取代或未取代的下组基团:氢、氨基、c
1-c
12
烷基、c
1-c
12
卤代烷基、c
1-c
12
烷基氨基、c
1-c
12
烷基羟基、c
1-c
12
烷氧基、2-12元杂烷基、c
1-c
12
烷基磺酰基、c
2-c
12
烯基、c
2-c
12
炔基、c
3-c
12
环烷基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂芳基、具有1-3个选自下组n、s和o的杂原子的3-12元杂环基、c
1-c6烷基胍基、c
1-c6烷基酯基、硫代c
1-c6烷基酯基、-(c
1-c8亚烷基)-ra;或r1和r2与它们连接的碳原子共同构成取代或未取代的3-12元碳环或杂环;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0140]
l独立地为化学键、-chr'
1-、-o-、-s-、-co-、-coo-、-s(=o)
2-;
[0141]
q为1-10的整数;
[0142]
r'1独立地选自取代或未取代的下组基团:h、氨基、c
1-c
15
烷基、c
1-c
15
烷氧基、c
1-c
15
烷基氨基、c
6-c
15
芳基、c
2-c
15
烯基、c
2-c
15
炔基、c
1-c
15
烷基羟基、c
1-c
15
烷基醛基、c
1-c
15
烷基酯基、硫代c
1-c
15
烷基酯基、-rc-coo-rc”、-rc-co-rc”、-rc-o-rc”、-rc-s-rc”、具有1-3个选自下组n、s和o的杂原子的5-15元杂芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂环基;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0143]
ra和rb各自独立地选自取代或未取代的下组基团:氢、c
1-c
15
烷基、c
1-c
15
烷氧基、c
1-c
15
烷基氨基、c
2-c
15
烯基、c
2-c
15
炔基、c
1-c
15
烷基羟基、c
1-c
15
烷基醛基、c
1-c
15
烷基磺酰基、-rc-coo-rc”、-rc-co-rc”、-rc-o-rc”、-rc-s-rc”、c
3-c
12
环烷基、c
4-c
12
环烯基、5-12元杂环基、c
6-c
12
芳基、5-12元杂芳基、叔丁氧羰基(boc)、苄氧羰基(cbz)、芴甲氧羰基(fmoc)、邻苯二甲酰基(pht)、乙酰基(ac)、三氟乙酰基(tfa)、苄基(bn)、三苯基甲基(tr);或者ra和rb与其连接的n原子结合形成3-8元取代或未取代的杂环基;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0144]
rc独立地选自取代或未取代的下组基团:无、c
1-c
15
亚烷基、c
2-c
15
亚烯基、c
2-c
15
亚炔基、c
3-c
12
亚环烷基、c
4-c
12
亚环烯基、具有1-3个选自下组n、s和o的杂原子的3-12元亚杂环基、c
6-c
12
亚芳基、具有1-3个选自下组n、s和o的杂原子的5-12元亚杂芳基;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0145]
rc”选自取代或未取代的下组基团:c
1-c
15
烷基、c
1-c
15
烷基氨基、c
2-c
15
烯基、c
2-c
15
炔基、c
3-c
12
环烷基、c
4-c
12
环烯基、具有1-3个选自下组n、s和o的杂原子的3-12元杂环基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂芳基;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0146]rm
选自取代或未取代的下组基团:卤素、羟基、氨基、硝基、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、c
1-c6卤代烷氧基、甲基砜基、-s(=o)2nh2、氧代(=o)、-cn、-n3、c
3-c8环烷基、c
3-c8杂环烷基、卤代的c3-c8环烷基、c
4-c8环烯基、c
6-c
10
芳基、具有1-3个选自下组n、s和o的杂原子的5-10元杂芳基、具有1-3个选自下组n、s和o的杂原子的5-10元杂环基、c1-c6胺基、c1-c6酰胺基、-cooh、-sh、ph-、-phoh、苄氧羰基(cbz)、三苯甲基(trt)、三氟甲基、葡萄糖基、ch3(o-ch
2-ch2)y,且y为1-6的整数;
[0147]
附加条件是所述聚合物为化学上稳定的结构。
[0148]
在另一优选例中,所述聚合物含有式iv和式v所示的聚合单元:
[0149][0150]
式中,
[0151]
m1为1或2;各r1和r2相同或不同;r、r1和r2的定义如上所述。
[0152]
在另一优选例中,所述聚合物含有式vi所示的聚合单元
[0153][0154]
式中,
[0155]
n1为3-20000的整数;
[0156]
m2为1或2;
[0157]
0%<l≤100%;0%≤k<100%;其中,l、k的计算方式为相对应的聚合单元数除以总聚合单元数;
[0158]
r、r1、r2、r”、r”1
和r”2
各自独立地选自取代或未取代的下组基团:氢、氨基、c
1-c
12
烷基、c
1-c
12
卤代烷基、c
1-c
12
烷基氨基、c
1-c
12
烷基羟基、c
1-c
12
烷氧基、2-12元杂烷基、c
1-c
12
烷基磺酰基、c
2-c
12
烯基、c
2-c
12
炔基、c
3-c
12
环烷基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂芳基、具有1-3个选自下组n、s和o的杂原子的3-12元杂环基、c
1-c6烷基胍基、c
1-c6烷基酯基、硫代c
1-c6烷基酯基、-(c
1-c8亚烷基)-ra;或r1和r2与它们连接的碳原子共同构成取代或未取代的3-12元碳环或杂环;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0159]
其中,l、q、ra、rb和rm的定义如上所述。
[0160]
在另一优选例中,所述聚合物含有下列聚合单元中的一种或多种:
[0161]
[0162][0163]
其中,n2为≥2的整数(例如3-20000),较佳地为3~10000,更佳地为3~5000。
[0164]
在另一优选例中,所述聚合物含有下列聚合单元中的一种或多种:
[0165][0166]
其中,0%<x1≤100%;0%≤y1<100%;n3为3-20000的整数
[0167]
在另一优选例中,x1+y1=1。
[0168]
在另一优选例中,所述聚合物还包括聚合物的盐;当所述聚合物的结构中包含氨基时,所含氨基还包括其各种成盐形式,如磺酸盐、碘化盐、溴化盐、盐酸盐、三氟乙酸盐;当所述聚合物的结构中包含羧基时,结构中所含羧基还包括其各种成盐形式,如钠盐、钾盐、锂盐。
[0169]
在本发明的第三方面,提供了如本发明第二方面所述的聚合物的用途,所述聚合物(a)用于制备一材料,所述材料具有选自下组的一种或多种功能:抗菌、抗肿瘤、促细胞粘附、组织工程、药物修饰、蛋白修饰、蛋白保护、细胞保护、组织和器官冷冻保护、药物修饰、药物协同、药物递送、基因递送和自组装、表面防污、表面抗菌、表面改性;和/或(b)用于制备一修饰材料,所述修饰材料用于修饰医用材料基材。
[0170]
在另一优选例中,所述医用材料基材选自下组:pla、plga、ha、pcl、pds、pu、ptfe、pvp、pvc、pdms、peek、不锈钢、钛、钛合金,或其组合。
[0171]
在另一优选例中,所述修饰医用材料基材是指所述聚合物通过物理(如掺杂)或化学方法修饰医用材料基材。
[0172]
在另一优选例中,所述的表面抗污包括抗蛋白吸附、抗细胞、细菌、真菌、血小板粘附。
[0173]
在另一优选例中,所述聚合物还包括聚合物衍生物,所述聚合物衍生物是指对包含氨基的聚合物进行修饰得到的聚合物,所述修饰是指将氨基改性成为胍基、二胍基、季铵盐等。
[0174]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0175]
图1显示了四丁基醋酸铵引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)聚合获得的不同链长均聚物的凝胶渗透色谱图;
[0176]
图2显示了四丁基醋酸铵引发n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐
(单体2)聚合获得的均聚物的凝胶渗透色谱图;
[0177]
图3显示了四丁基醋酸铵引发l-谷氨酸-5-乙酯-n-羧基羰基环内酸酐(单体3)聚合获得的均聚物的凝胶渗透色谱图;
[0178]
图4显示了四丁基醋酸铵和四丁基苯甲酸铵引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐聚合的单体转化率随时间变化图(a)和ln(m0/m)随时间变化图(b);
[0179]
图5显示了四丁基醋酸铵引发未重结晶提纯的n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(单体2)聚合获得的聚合物的实物图及其凝胶渗透色谱图;
[0180]
图6显示了四丁基醋酸铵引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)和n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(单体2)的无规共聚获得的无规共聚物的凝胶渗透色谱图;
[0181]
图7显示了四丁基醋酸铵引发n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(单体2)和l-谷氨酸-5-乙酯-n-羧基羰基环内酸酐(单体3)的无规共聚获得的无规共聚物的凝胶渗透色谱图;
[0182]
图8显示了四丁基苯甲酸铵引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)和l-谷氨酸-5-乙酯-n-羧基羰基环内酸酐(单体3)的无规共聚获得的无规共聚物的凝胶渗透色谱图;
[0183]
图9显示了四丁基醋酸铵引发n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(单体2)和l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)的嵌段聚合的合成示意图(a)、不同嵌段数所得到的聚合物的分子量(b)和凝胶渗透色谱图(c);
[0184]
图10显示了四丁基醋酸铵引发n-羧基羰基环内酸酐在有机溶剂/水环境中聚合及一锅法自组装过程的示意图(a)和得到的自组装结构的微观结构和尺寸分析图(b);
[0185]
图11显示了四丁基醋酸铵引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)在无溶剂环境中聚合获得的聚合物的凝胶渗透色谱图;
[0186]
图12显示了四丁基醋酸铵引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)微流道聚合的微流道聚合装置图(a)和获得的聚合物的凝胶渗透色谱图(b)。
具体实施方式
[0187]
本发明人经过广泛而深入的研究,首次意外地开发了一种使用羧基盐或硫代羧基盐引发羰基环内酸酐或硫代羰基环内酸酐单体的快速开环聚合制备氨基酸类聚合物方法。所述方法的聚合速度相比传统方法显著提升,动力学常数可达传统方法的535倍,适用于多种单体(包括低活性单体)的聚合,可进行传统引发剂无法引发的单体聚合反应,可制备结构丰富的氨基酸类均聚物和共聚物(包括无规共聚物、多段的嵌段共聚物和嵌段共聚物的组装结构),并且制备方法简单,对合成环境的要求低,合成场景丰富(包括无溶剂环境、含有大量水的环境、微流道聚合)。
[0188]
基于该方法,不仅可以快速且方便地制备氨基酸类聚合物,而且聚合物产品的结构丰富,可以为生物工程领域的诸多领域提供帮助。在此基础上完成了本发明。
[0189]
术语
[0190]
除非另外定义,否则本文中所用的全部技术与科学术语均具有如本发明所属领域的普通技术人员通常理解的相同含义。
[0191]
如本文所用,术语“含有”或“包括(包含)”可以是开放式、半封闭式和封闭式的。换言之,所述术语也包括“基本上由
…
构成”、或“由
…
构成”。
[0192]
如本文所用,术语“n-羧基羰基环内酸酐”、“nca”可互换使用。
[0193]
如本文所用,术语“n-取代n-羧基羰基环内酸酐”、“nnca”可互换使用。
[0194]
如本文所用,术语“n-取代n-羧基硫代羰基环内酸酐”、“nnta”可互换使用。
[0195]
如本文所用,术语“四丁基醋酸铵”、“tbaa”可互换使用。
[0196]
如本文所用,术语“n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐”、“bll nca”、“bll”可互换使用。
[0197]
如本文所用,术语“l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐”、“blg nca”、“blg”可互换使用。
[0198]
定义
[0199]
如本文所用,术语“烷基”包括直链或支链的烷基。例如c
1-c
12
烷基表示具有1-12个碳原子的直链或支链的烷基,例如甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基等。
[0200]
如本文所用,术语“烯基”包括直链或支链的烯基。例如c
2-c
12
烯基指具有2-12个碳原子的直链或支链的烯基,例如乙烯基、烯丙基、1-丙烯基、异丙烯基、1-丁烯基、2-丁烯基、或类似基团。
[0201]
如本文所用,术语“炔基”包括直链或支链的炔基。例如c
2-c
12
炔基是指具有2-12个碳原子的直链或支链的炔基,例如乙炔基、丙炔基、丁炔基、或类似基团。
[0202]
如本文所用,术语“c
3-c
12
环烷基”指具有3-12个碳原子的环烷基。其可以是单环,例如环丙基、环丁基、环戊基、环己基、或类似基团。也可以是双环形式,例如桥环或螺环形式。
[0203]
如本文所用,术语“c
1-c
12
烷氧基”是指具有1-12个碳原子的直链或支链的烷氧基;例如,甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、异丁氧基、叔丁氧基等。
[0204]
如本文所用,术语“具有1-3个选自下组n、s和o的杂原子的3-12元杂环基”是指具有3-10个原子的且其中1-3个原子为选自下组n、s和o的杂原子的饱和或部分饱和的环状基团。其可以是单环,也可以是双环形式,例如桥环或螺环形式。具体的实例可以为氧杂环丁烷、氮杂环丁烷、四氢-2h-吡喃基、哌啶基、四氢呋喃基、吗啉基和吡咯烷基等。
[0205]
如本文所用,术语“c
6-c
12
芳基”是指具有6-12个碳原子的芳基,例如,苯基或萘基等类似基团。
[0206]
如本文所用,术语“具有1-3个选自下组n、s和o的杂原子的5-12元杂芳基”指具有5-12个原子的且其中1-3个原子为选自下组n、s和o的杂原子的环状芳香基团。其可以是单环,也可以是稠环形式。具体的实例可以为吡啶基、哒嗪基、嘧啶基、吡嗪基、三嗪基、吡咯基、吡唑基、咪唑基、(1,2,3)-三唑基以及(1,2,4)-三唑基、四唑基、呋喃基、噻吩基、异恶唑基、噻唑基、恶唑基等。
[0207]
如本文所用,术语“3-12元碳环”是指由3-12个碳原子构成的环结构,包括环烷烃、芳香环。
[0208]
如本文所用,术语“3-12元杂环”是指具有3-12个原子的且其中1-3个原子为选自n、s和o的杂原子的环状结构,包括杂环、杂芳环。
[0209]
除非特别说明,否则本发明的基团均可被选自下组的取代基所取代:卤素、腈基、
硝基、羟基、氨基、c
1-c6烷基-胺基、c
1-c6烷基、c
2-c6烯基、c
2-c6炔基、c
1-c6烷氧基、卤代c
1-c6烷基、卤代c
2-c6烯基、卤代c
2-c6炔基、卤代c
1-c6烷氧基、烯丙基、苄基、c
6-c
12
芳基、c
1-c6烷氧基-c
1-c6烷基、c
1-c6烷氧基-羰基、苯氧羰基、c
2-c6炔基-羰基、c
2-c6烯基-羰基、c
3-c6环烷基-羰基、c
1-c6烷基-磺酰基等。
[0210]
如本文所用,“卤素”或“卤原子”指f、cl、br和i。更佳地,卤素或卤原子选自f、cl和br。“卤代的”是指被选自f、cl、br和i原子所取代。
[0211]
本发明的引发剂
[0212]
引发剂(initiator)是指用于引发本发明的单体进行快速开环聚合的小分子化合物。
[0213]
本发明提供了一种如式i所示的化合物,作为本发明的快速开环聚合方法的引发剂:
[0214][0215]
其中,
[0216]
x1、x2各自独立地为o或s;
[0217]
a为li、na、k、nh4、nw1w2w3w4、pw1w2w3w4;
[0218]
w1、w2、w3、w4各自独立地选自取代或未取代的下组基团:氢、c
1-c8烷基、c
1-c8卤代烷基、c
1-c8硫代烷基、c
1-c8烷基氨基、c
1-c8烷基硅基、c
1-c8烷氧基、c
1-c8卤代烷氧基、c
3-c
12
环烷基、具有1-3个选自下组n、s和o的杂原子的3-12元杂环基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂芳基、c
1-c6烷基酯基;或w1、w2、w3、w4与它们连接的碳原子共同构成取代或未取代的3-12元碳环或杂环(包括单环、螺环、桥环或并环);其中,所述的取代是指被一个或多个rm取代;
[0219]
v选自下组:c、n、o;
[0220]
v为c时,z1、z2、z3各自独立地选自取代或未取代的下组基团:氢、氨基、c
1-c8烷基、c
1-c8卤代烷基、c
1-c8烷基氨基、c
1-c8烷基硅基、c
1-c8烷基羟基、c
1-c8烷基羧基、c
1-c8烷氧基、3-12元杂烷基、c
1-c8烷基磺酰基、c
2-c
12
烯基、c
2-c
12
炔基、c
3-c
12
环烷基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂芳基、具有1-3个选自下组n、s和o的杂原子的3-12元杂环基、c
1-c6烷基胍基、c
1-c6烷基酯基、硫代c
1-c6烷基酯基,或聚合物链段;或z1、z2、z3与它们连接的碳原子共同构成取代或未取代的3-12元碳环或杂环(包括单环、螺环、桥环或并环);其中,所述的取代是指被一个或多个rm(例如2个、3个、4个等)取代;
[0221]
v为n时,z1、z2各自独立地选自取代或未取代的下组基团:氢、氨基、c
1-c8烷基、c
1-c8卤代烷基、c
1-c8烷基氨基、c
1-c8烷基硅基、c
1-c8烷基羟基、c
1-c8烷基羧基、c
1-c8烷氧基、2-12元杂烷基、c
1-c8烷基磺酰基、c
2-c
12
烯基、c
2-c
12
炔基、c
3-c
12
环烷基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂芳基、具有1-3个选自下组n、s和o的杂原子的3-12元杂环基、c
1-c6烷基胍基、c
1-c6烷基酯基、硫代c
1-c6烷基酯基,或聚合物链段;或z1、z2、z3与它
们连接的碳原子共同构成取代或未取代的3-12元碳环或杂环(包括单环、螺环、桥环或并环);其中,所述的取代是指被一个或多个rm(例如2个、3个、4个等)取代;
[0222]
v为o时,z1各自独立地选自取代或未取代的下组基团:氢、氨基、c
1-c8烷基、c
1-c8卤代烷基、c
1-c8烷基氨基、c
1-c8烷基硅基、c
1-c8烷基羟基、c
1-c8烷基羧基、c
1-c8烷氧基、2-12元杂烷基、c
1-c8烷基磺酰基、c
2-c
12
烯基、c
2-c
12
炔基、c
3-c
12
环烷基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂芳基、具有1-3个选自下组n、s和o的杂原子的3-12元杂环基、c
1-c6烷基胍基、c
1-c6烷基酯基、硫代c
1-c6烷基酯基,或聚合物链段;或z1、z2、z3与它们连接的碳原子共同构成取代或未取代的3-12元碳环或杂环(包括单环、螺环、桥环或并环);其中,所述的取代是指被一个或多个rm(例如2个、3个、4个等)取代;
[0223]rm
选自取代或未取代的下组基团:卤素、羟基、硝基、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、c
1-c6卤代烷氧基、甲基砜基、-s(=o)2nh2、氧代(=o)、-cn、c
3-c8环烷基、c
4-c8环烯基、c
6-c
10
芳基、具有1-3个选自下组n、s和o的杂原子的5-10元杂芳基、具有1-3个选自下组n、s和o的杂原子的5-10元杂环基、c1-c6胺基、c1-c6酰胺基、-cooh、-sh、ph-、-phoh、葡萄糖基、ch3(o-ch
2-ch2)y,且y为1至6之间的整数;
[0224]
附加条件是所述引发剂为化学上稳定的结构。
[0225]
所述的w1、w2、w3、w4各自独立地选自下组:h、c
1-c6烷基。
[0226]
所述的z1、z2、z3各自独立地选自下组:h、c
1-c6烷基、聚合物链段。
[0227]
所述的z1、z2、z3与它们连接的碳原子共同构成取代或未取代的3-12元芳环或杂芳环(包括单环、螺环、桥环或并环)。
[0228]
所述的聚合物链段选自下组:聚谷氨酸、聚天冬氨酸,或其组合。
[0229]
所述的引发剂选自下组:乙酸锂、乙酸钠、乙酸钾、乙酸铵、四丁基醋酸铵、四丁基苯甲酸铵、聚天冬氨酸四丁胺(分子量≤10万),或其组合。
[0230]
所述的引发剂的用量由所需要制备的聚合物的链长决定,所需要的制备的聚合物的链长越长,引发剂用量越少。
[0231]
所述的引发剂不是强碱性引发剂,如双三甲基硅基胺基锂、1,8-二氮杂环[5,4,0]十一烯-7。
[0232]
本发明的单体
[0233]
本发明的单体是如式ii所示化合物中的一种或多种:
[0234][0235]
其中,
[0236]
y为s或o;
[0237]
m为1或2;
[0238]
r、r1、r2各自独立地选自取代或未取代的下组基团:氢、氨基、c
1-c
12
烷基、c
1-c
12
卤代烷基、c
1-c
12
烷基氨基、c
1-c
12
烷基羟基、c
1-c
12
烷氧基、c
1-c
12
烷硫基、2-12元杂烷基、c
1-c
12
烷基磺酰基、c
2-c
12
烯基、c
2-c
12
炔基、c
3-c
12
环烷基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂芳基、具有1-3个选自下组n、s和o的杂原子的3-12元杂环基、c
1-c8烷基胍基、c
1-c8烷基酯基、硫代c
1-c8烷基酯基、-(c
1-c8亚烷基)-ra;或r1和r2与它们连接的碳原子共同构成取代或未取代的3-12元碳环或杂环;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0239]
l独立地为化学键、-chr'
1-、-o-、-s-、-co-、-coo-、-s(=o)
2-;
[0240]
q为1-10的整数;
[0241]
r'1独立地选自取代或未取代的下组基团:h、氨基、c
1-c
10
烷基、c
1-c
10
烷氧基、c
1-c
10
烷基氨基、c
6-c
10
芳基、c
2-c
10
烯基、c
2-c
10
炔基、c
1-c
10
烷基羟基、c
1-c
10
烷基醛基、c
1-c
10
烷基酯基、硫代c
1-c
10
烷基酯基、-rc-coo-rc”、-rc-co-rc”、-rc-o-rc”、-rc-s-rc”、具有1-3个选自下组n、s和o的杂原子的的5-12元杂芳基、具有1-3个选自下组n、s和o的杂原子的5-12元杂环基;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0242]
ra和rb各自独立地选自取代或未取代的下组基团:氢、c
1-c
10
烷基、c
1-c
10
烷氧基、c
1-c
10
烷基氨基、c
2-c
10
烯基、c
2-c
10
炔基、c
1-c
10
烷基羟基、c
1-c
10
烷基醛基、c
1-c
10
烷基磺酰基、-rc-coo-rc”、-rc-co-rc”、-rc-o-rc”、-rc-s-rc”、c
3-c
12
环烷基、c
4-c
12
环烯基、5-12元杂环基、c
6-c
12
芳基、5-12元杂芳基、叔丁氧羰基(boc)、苄氧羰基(cbz)、芴甲氧羰基(fmoc)、邻苯二甲酰基(pht)、乙酰基(ac)、三氟乙酰基(tfa)、苄基(bn)、三苯基甲基(tr);或者ra和rb与其连接的n原子结合形成3-12元取代或未取代的杂环基;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0243]
rc独立地选自取代或未取代的下组基团:无、c
1-c
10
亚烷基、c
2-c
10
亚烯基、c
2-c
10
亚炔基、c
3-c
10
亚环烷基、c
4-c
10
亚环烯基、具有1-3个选自下组n、s和o的杂原子的3-12元亚杂环基、c
6-c
12
亚芳基、具有1-3个选自下组n、s和o的杂原子的5-12元亚杂芳基;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0244]
rc”选自取代或未取代的下组基团:c
1-c
10
烷基、c
1-c
10
烷基氨基、c
2-c
10
烯基、c
2-c
10
炔基、c
3-c
12
环烷基、c
4-c
12
环烯基、3-12元杂环基、c
6-c
12
芳基、5-12元杂芳基;其中,所述的取代是指被一个或多个(例如2个、3个、4个等)rm取代;
[0245]rm
选自取代或未取代的下组基团:卤素、羟基、氨基、硝基、c
1-c6烷基、c
1-c6卤代烷基、c
1-c6烷氧基、c
1-c6卤代烷氧基、甲基砜基、-s(=o)2nh2、氧代(=o)、-cn、-n3、c
3-c8环烷基、卤代的c3-c8环烷基、c
4-c8环烯基、c
6-c
12
芳基、具有1-3个选自下组n、s和o的杂原子的5-10元杂芳基、具有1-3个选自下组n、s和o的杂原子的5-10元杂环基、c1-c6胺基、c1-c6酰胺基、-cooh、-sh、ph-、-phoh、苄氧羰基(cbz)、三苯甲基(trt)、三氟甲基、葡萄糖基、ch3(o-ch
2-ch2)y,且y为1-6的整数;
[0246]
附加条件是所述化合物为化学上稳定的结构。
[0247]
所述的r取代或未取代的选自下组的基团:c1-c8烷基、c1-c8烷氧基、c3-c12环烷
基、-(c1-c4亚烷基)-(具有1-3个选自n、o或s的杂原子的5-10元杂芳基)、-(c1-c4亚烷基)-(6-12元芳基)。
[0248]
所述的r、r1、r2各自独立地选自下组:
[0249][0250]
所述单体可选自下组:
[0251][0252]
所述单体选自下组:
[0253][0254]
所述的单体选自下组:n-羧基羰基环内酸酐、n-羧基硫代羰基环内酸酐,或其组合。
[0255]
所述的单体选自下组:氨基酸n-羧基羰基环内酸酐、氨基酸n-羧基硫代羰基环内酸酐,或其组合。
[0256]
所述的单体选自下组:l型氨基酸n-羧基羰基环内酸酐、d型氨基酸n-羧基羰基环内酸酐、l型氨基酸n-羧基硫代羰基环内酸酐、d型氨基酸n-羧基硫代羰基环内酸酐,或其组合。
[0257]
发明人给出的单体的结构式或名称,可能仅仅示例性给出一种具体构型或未给出具体构型,该单体也可以包括该给出的构型所对应的其他所有构型。
[0258]
所述的单体选自下组:α-氨基酸n-羧基羰基环内酸酐、β-氨基酸n-羧基羰基环内酸酐、α-氨基酸n-羧基硫代羰基环内酸酐、β-氨基酸n-羧基硫代羰基环内酸酐,或其组合。
[0259]
所述的氨基酸是天然氨基酸或非天然氨基酸。
[0260]
所述的氨基酸选自下组:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、色氨酸、酪氨酸、天冬氨酸、天冬酰胺、谷氨酸、赖氨酸、谷氨酰胺、甲硫氨酸、丝氨酸、苏氨酸、
半胱氨酸、脯氨酸、组氨酸、精氨酸,以及衍生自上述氨基酸的衍生物,或其组合。
[0261]
所述的单体选自下组:l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐、n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐、l-谷氨酸-5-乙酯-n-羧基羰基环内酸酐、l-天冬氨酸-4-叔丁酯-n-羧基羰基环内酸酐、n-环己基取代的α-氨基酸-n-羧基羰基环内酸酐、n-甲基取代的α-氨基酸-n-羧基羰基环内酸酐、l-谷氨酸-5-苄酯-n-羧基硫代羰基环内酸酐、n-甲基取代α-氨基酸-n-羧基硫代羰基环内酸酐、n-苄基取代α-氨基酸-n-羧基硫代羰基环内酸酐、l-天冬氨酸-1-苄酯-β-氨基酸-n-羧基硫代羰基环内酸酐(bn-β
3-lchg nta)、n-乙基噻吩取代-β-氨基酸-n-羧基硫代羰基环内酸酐、n-环辛基取代α-氨基酸-n-羧基羰基环内酸酐、n-cbz-乙基氨基取代-n-羧基羰基环内酸酐、n-甲氧基取代-n-羧基硫代羰基环内酸酐,或其组合。
[0262]
所述反应使用的单体是提纯的或未经提纯的。
[0263]
优选地,当m为2,y为o且r1=r2=h时,r不为甲基、乙基、苄基。
[0264]
所述单体还包括难以(或无法)使用常规引发剂的制备方法进行开环聚合的低活性单体。
[0265]
所述低活性的单体选自下组:
[0266][0267]
本发明的聚合物制备方法
[0268]
本发明提供了一种快速开环聚合获得氨基酸类聚合物的制备方法,包括步骤;
[0269]
(a)在式i化合物引发剂存在下,将一种或多种式ii化合物单体进行聚合反应,从而形成一聚合物,所述聚合物含有式iii所示的聚合单元;
[0270][0271]
其中,所述引发剂为羧基盐、或硫代羧基盐,具有如式(i)所示的结构;所述单体为氨基酸n-羧基羰基环内酸酐单体或氨基酸n-羧基硫代羰基环内酸酐单体,具有如式(ⅱ)所示的结构;
[0272]
x1、x2、a、z1、z2、z3、y、r、r1、r2、m、n的定义如上所述。
[0273]
所述的聚合物为氨基酸类聚合物。
[0274]
所述反应在无任何保护的仪器或装置(例如敞口的烧杯、烧瓶或者各种工业上常用的敞口反应器)中进行。
[0275]
所述反应在氮气保护的仪器或装置(例如手套箱)中进行。
[0276]
所述反应中,可以是一种式ii化合物单体进行聚合反应,也可以是两种、三种或四种不同的式ii化合物单体进行聚合反应。
[0277]
所述反应中,得到的聚合物为均聚物或共聚物。
[0278]
所述反应中,得到的共聚物为无规共聚物或嵌段共聚物。
[0279]
所述反应中,得到的共聚物的类型取决于式ii化合物单体的种类及其添加顺序。
[0280]
优选地,当所述式ii化合物单体为两种时,所述反应包括步骤:
[0281]
在有机溶剂中,在引发剂存在下,首先将一种式ii化合物单体进行聚合反应;
[0282]
待上述聚合反应结束后,再加入另一种式ii化合物单体,进行聚合反应,从而形成嵌段共聚物(嵌段单元q=2)。
[0283]
依次类推,重复上述步骤,从而得到多段的嵌段共聚物(嵌段单元为q),其中q≥1,更佳地q≥15。
[0284]
优选地,得到的嵌段共聚物根据不同嵌段单体的性质可以进一步组装,从而得到组装结构的聚合物(如聚合物纳米微球)。
[0285]
优选地,当所述氨基酸n-羧基环内酸酐单体为三种时,所述方法包括步骤:
[0286]
在有机溶剂中,在引发剂存在下,首先将第一种式ii化合物单体进行聚合反应;
[0287]
待上述第一种式ii化合物单体聚合反应结束后,再加入第二种式ii化合物单体,进行聚合反应;
[0288]
待上述第二种式ii化合物单体聚合反应结束后,再加入第三种式ii化合物单体,进行聚合反应;
[0289]
从而形成嵌段共聚物。
[0290]
相应地,当所述式ii化合物单体为四种时,在上述方法中,待上述第三种式ii化合物单体聚合反应结束后,可再加入第四种式ii化合物单体,进行聚合反应;从而形成嵌段共聚物。
[0291]
依次类推,当所述式ii化合物单体为更多种时,可依次加入各种单体进行聚合反应。
[0292]
优选地,所述反应包括步骤:在引发剂存在下,将两种或更多种单体混合后进行聚合反应,从而形成无规共聚物。
[0293]
所述反应中,可以是聚合物引发剂引发单体聚合,从而得到多结构聚合物(如刷状聚合物、纳米颗粒)。
[0294]
优选地,所述反应包括步骤:
[0295]
(a)在引发剂存在下,将第一种式ii化合物单体进行聚合反应,得到聚合物引发剂的前体;
[0296]
(b)将聚合物引发剂的前体的侧链羧基进行成盐反应,得到聚合物引发剂;
[0297]
(c)在聚合物引发剂存在下,将第二种式ii化合物单体进行聚合反应,得到多结构聚合物。
[0298]
所述单体与引发剂的当量比为5-1000:1,引发剂的用量根据所需要制备的聚合物的链长决定。
[0299]
所述反应的反应时间为几秒钟到数天,视所需制备的聚合物的链长和单体自身的活性决定。
[0300]
优选地,所述反应的时间为1分钟-48小时。优选为1分钟-12小时;较佳地,为1分钟-6小时;更佳地,为1分钟-1小时;更佳地,为1-5分钟。
[0301]
根据所需聚合物的链长不同,反应时间在数分钟至数小时不等。对于不同的聚合物和不同的单体,相对于采用传统引发剂的制备方法,本发明的制备方法反应速率大幅增快,反应时间大幅降低。
[0302]
当所述单体为α-氨基酸n-羧基羰基环内酸酐单体时,所述反应可使用未经重结晶提纯的单体。
[0303]
所述反应在存在溶剂的条件下进行,其中,所述溶剂选自下组:四氢呋喃、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、乙腈、二氧六环、二甲基亚砜、二氯甲烷、氯仿、丙酮、n-甲基吡咯烷酮、酯类、芳香烃、烷烃、水,或其组合。
[0304]
所述反应在含有大量水的有机溶剂/水的环境中进行。
[0305]
所述反应的溶剂根据所需要制备的聚合物的单体性质和链长决定。
[0306]
所述反应在无溶剂的环境中进行,优选在机械力存在的无溶剂的固体状态进行。
[0307]
所述反应在搅拌或不搅拌的反应瓶、孔板、反应釜、反应管道或微流道中进行。
[0308]
所述反应在10~60℃下进行,优选在20~40℃下进行。
[0309]
本发明的主要优点包括:
[0310]
1)本发明所述的方法相比传统的开环聚合方法极大的提高了聚合速度,使反应最快可以在一分钟之内结束,动力学常数可达51.65h-1
;
[0311]
2)本发明所述的方法适用于多种单体(包括低活性单体和未提纯的单体),对于低活性单体(如n-大空阻取代基取代α-氨基酸n-羧基硫代羰基环内酸酐单体、n-取代α-氨基酸n-羧基硫代羰基环内酸酐单体)的聚合相对于现有聚合方法有突出优势;
[0312]
3)本发明所述的方法可制备结构丰富的聚合物(包括均聚物、共聚物和聚合物的组装结构),拓宽了本发明所述方法的应用领域;
[0313]
4)本发明所述方法可适用于多种合成场景(包括无溶剂环境、含有大量水的环境和微流道环境),反应对环境的要求低,大降低了操作人员的要求和设备要求。
[0314]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
[0315]
以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
[0316]
单体的合成
[0317]
1.l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)的制备
[0318][0319]
将三光气(6.5g,22mmol)用干燥四氢呋喃溶解待用。在冰水浴中,在氮气的保护下,将三光气溶液加入l-谷氨酸-5-苄酯(11.8g,50mmol)的干燥四氢呋喃悬浮液中,混合搅拌;再转移到50℃油浴下,并在氮气条件下搅拌反应约2小时;然后减压旋蒸除去溶剂,之后用乙酸乙酯溶解,再分别用冰水与冰饱和食盐水进行淬洗,并用无水硫酸镁干燥;粗产物用
干燥的乙酸乙酯、正己烷重结晶三次,得到无色晶体10.5g。
[0320]
2.n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(单体2)的制备
[0321][0322]
实验方法同步骤1,不同之处在于用n-ε-叔丁氧羰基-l-赖氨酸替换l-谷氨酸-5-苄酯,反应温度为45℃且另需加入α-蒎烯(20.5ml,132mmol)作为敷酸剂。
[0323]
3.l-谷氨酸-5-乙酯-n-羧基羰基环内酸酐(单体3)的制备
[0324][0325]
实验方法同步骤1,不同之处在于用l-谷氨酸-5-乙酯替换l-谷氨酸-5-苄酯。
[0326]
4.l-天冬氨酸-4-叔丁酯-n-羧基羰基环内酸酐(单体4)的制备
[0327][0328]
实验方法同步骤1,不同之处在于用l-天冬氨酸-4-叔丁酯替换l-谷氨酸-5-苄酯,反应温度为45℃且另需加入α-蒎烯(20.5ml,132mmol)作为敷酸剂。
[0329]
5.n-环己基取代的α-氨基酸-n-羧基羰基环内酸酐(单体5)的制备
[0330][0331]
将环己胺(12.0g,121mmol)溶于200ml二氯甲烷中,然后将2-溴乙酸乙酯(20.2g,121mmol)和三乙胺(24.5g,242.0mmol)的溶液添加到反应烧瓶中。将反应混合物在室温搅拌12小时。将混合物冷却至室温,然后用去离子水洗涤3次(3
×
200ml),并用盐水洗涤一次(200ml),干燥真空除去溶剂后,获得粗产物并通过硅胶柱色谱法纯化。将上一步中间体(12.0g,65.1mmol)溶解在100ml甲醇(meoh)中,然后将二碳酸二叔丁酯(15.6g,71.6mmol)加入反应烧瓶中。将反应混合物加热至回流过夜。在真空下除去溶剂meoh后直接用于下一步。将获得的中间体溶解在60ml甲醇和20ml四氢呋喃(thf)的混合溶液中,然后将naoh溶液(0.1m,1.8ml)滴加到该混合物中,并将该反应在室温搅拌5小时。之后,用hcl溶液将混合物调节至中性ph。在真空下除去有机溶剂后酸化至ph 3-4,然后用乙酸乙酯萃取,然后通过硅胶柱色谱法纯化。
[0332]
将化合物n-boc-n-环己基-氨基乙酸(5.0g,19.4mmol)溶于100ml无水二氯甲烷中。然后在氮气保护下将三溴化磷溶液(5.8g,21.4mmol)滴加到圆底烧瓶中。升温至室温并在氮气下搅拌1小时后,将混合物用冷的去离子水迅速洗涤并干燥然后在真空下浓缩。使用干燥的二氯甲烷/己烷重结晶,得到产物晶体(2.9g,产率58.0%)。
[0333]
6.n-甲基取代的α-氨基酸-n-羧基羰基环内酸酐(单体6)的制备
[0334][0335]
将肌氨酸(5.0g,56.1mmol)溶于375ml去离子水中,然后依次加入三乙胺(23.5ml,168.3mmol)和二碳酸二叔丁酯(12.9ml,56.1mmol),并将反应混合物搅拌6小时。加入hcl水溶液(4m,320ml),然后用乙酸乙酯萃取三次并干燥,然后在真空下浓缩。使用干燥的乙酸乙酯/正己烷将粗产物重结晶,得到白色中间体。
[0336]
将白色中间体溶解在150ml无水二氯甲烷中,然后在冰水浴和氮气保护下将三氯化磷(7.2g,26.4mmol)滴加到反应圆底烧瓶中,将反应混合物搅拌2小时。真空除去有机溶剂,然后用无水二氯甲烷萃取三次。使用干燥的二氯甲烷/己烷重结晶,得到产物晶体(产率53.0%)。
[0337]
7.l-谷氨酸-5-苄酯-n-羧基硫代羰基环内酸酐(单体7)的制备
[0338][0339]
将s-乙氧基硫代羰基巯基乙酸(xaa,9.0g,50.0mmol)溶解于500ml去离子水的烧瓶中,将固体碳酸氢钠(16.8g,200.0mmol)加入烧瓶中混合搅拌,溶解后再加入l-谷氨酸-5-苄酯(11.8g,50.0mmol)混合搅拌反应,并在50℃下搅拌反应约48小时;然后缓慢滴加1m的盐酸溶液,调节ph至3左右,用乙酸乙酯萃取水相的有机物三次,合并有机相,有机相再用饱和食盐水进行淬洗,并用无水硫酸镁干燥;粗产物用乙酸乙酯、正己烷重结晶提纯,得到白色固体中间体12g。
[0340]
在氮气保护下,将干燥的白色中间体(1.6g,5.0mmol)溶于干燥的二氯甲烷溶液(50ml)中,在0℃冰浴条件下混合搅拌,然后滴加三溴化磷(1.4g,5.0mmol)溶液,滴加完成后,升温至25℃,继续反应6小时,待反应结束后,用0℃的去离子水洗有机相三次,无水硫酸镁干燥有机相后,过滤,浓缩除去溶剂,得到粗产物,在氮气保护下,用乙酸乙酯、正己烷重结晶提纯,得到白色固体产物1.0g。
[0341]
8.n-甲基取代α-氨基酸-n-羧基硫代羰基环内酸酐(单体8)的制备
[0342][0343]
将s-乙氧基硫代羰基巯基乙酸(xaa,1.8g,10.1mmol)溶解于50ml水的烧瓶中,将氢氧化钠(3.0g,30.3mmol)加入烧瓶中混合搅拌,溶解后再加入肌氨酸(10.1mmol)混合搅拌反应,并在室温下搅拌反应约48小时;然后缓慢滴加1m的盐酸溶液,调节ph至3左右,用乙酸乙酯萃取水相的有机物三次后,合并有机相,有机相再用饱和食盐水进行淬洗,并用无水硫酸镁干燥;粗产物用石油醚、乙酸乙酯体系快速分离纯化得到白色中间体。
[0344]
在氮气保护下,将干燥的白色中间体(5.0mmol)溶于干燥的二氯甲烷溶液(120ml)中,在0℃冰浴条件下,混合搅拌,然后滴加三溴化磷(1.3g,5.0mmol)溶液,滴加完成后升至
室温继续反应3小时,待反应结束后,用0℃的去离子水洗有机相三次,无水硫酸镁干燥有机相后,过滤,浓缩除去溶剂得到粗产物,在氮气保护下,用乙酸乙酯、正己烷重结晶提纯,得到液体产物(1.1g,产率73%)。
[0345]
9.n-苄基取代α-氨基酸-n-羧基硫代羰基环内酸酐(单体9)的制备
[0346][0347]
实验方法同步骤8,不同之处在于用n-苄基甘氨酸替换肌氨酸。
[0348]
10.l-天冬氨酸-1-苄酯-β-氨基酸-n-羧基硫代羰基环内酸酐(bn-β
3-lchg nta)(单体10)的制备
[0349][0350]
将s-乙氧基硫代羰基巯基乙酸(9.0g,50.0mmol)溶解于200ml去离子水的烧瓶中,将固体碳酸氢钠(16.8g,200.0mmol)加入烧瓶中混合搅拌,溶解后再加入l-天冬氨酸1-苄酯(11.2g,50.0mmol)混合搅拌反应,并在室温下搅拌反应约48小时;然后缓慢滴加1m的盐酸溶液,调节ph至3左右,用乙酸乙酯萃取水相的有机物三次,合并有机相,有机相用饱和食盐水进行淬洗,用无水硫酸镁干燥;粗产物用乙酸乙酯、正己烷重结晶提纯,得到白色固体中间体(12.0g,产率为77%)。
[0351]
在氮气保护下,将干燥的白色中间体(1.6g,5.0mmol)溶于干燥的二氯甲烷溶液(50ml)中,在0℃冰浴条件下混合搅拌,然后滴加三溴化磷(1.4g,5.0mmol)溶液,滴加完成后,升温至25℃,继续反应6小时,待反应结束后,用0℃的去离子水洗有机相三次,无水硫酸镁干燥有机相后,过滤,浓缩除去溶剂,得到粗产物,在氮气保护下,用乙酸乙酯、正己烷重结晶提纯,得到白色固体产物(1.0g,产率为75%)。
[0352]
11.n-乙基噻吩取代-β-氨基酸-n-羧基硫代羰基环内酸酐(单体11)的制备
[0353][0354]
将3-氨基乙基噻吩(20.9g,164mmol)溶解于700ml二氯甲烷中,加入三乙胺(25ml,178mmol),0℃冰浴条件下,混合搅拌,然后滴加溴丙酸乙酯(29.7g,164mmol),滴加完成后,升温至25℃反应24小时。反应结束后,去离子水洗有机相三次,无水硫酸镁干燥有机相后,过滤,浓缩除去溶剂得到粗产物,用石油醚、乙酸乙酯体系快速分离纯化得到淡黄色油状中间体(13.4g,产率为36%)。然后将中间体化合物重新溶解在四氢呋喃/甲醇/水(120ml/80ml/40ml)的混合液中,然后滴加含有9.4g的1m浓度的氢氧化钠溶液,室温搅拌5h后,反应液用1m的盐酸溶液调节ph到7左右,用200ml乙酸乙酯萃取水相3遍,有机相用无水硫酸镁干燥过滤,然后旋掉溶剂得到中间体化合物(11.4g,产率97%)。
[0355]
将s-乙氧基硫代羰基巯基乙酸(xaa,3.6g,20.2mmol)溶解于100ml去离子水的烧
瓶中,将氢氧化钠(2.4g,60.0mmol)加入烧瓶中混合搅拌,溶解后再加入中间体化合物(4.0g,20.2mmol)混合搅拌反应,并在室温下搅拌反应约48小时;然后缓慢滴加1m的盐酸溶液,调节ph至3左右,用乙酸乙酯萃取水相的有机物三次后,合并有机相,有机相再用饱和食盐水进行淬洗,并用无水硫酸镁干燥;粗产物用石油醚、乙酸乙酯体系快速分离纯化得到白色固体(3.9g,产率为67%)。在氮气保护下,将干燥的白色固体(3.3g,11.6mmol)溶于干燥的二氯甲烷溶液(120ml)中,在0℃冰浴条件下,混合搅拌,然后滴加三溴化磷(1.1ml,11.6mmol)溶液,滴加完成后升至室温继续反应1小时,待反应结束后,用0℃的去离子水洗有机相三次,无水硫酸镁干燥有机相后,过滤,浓缩除去溶剂得到粗产物,在氮气保护下,用乙酸乙酯、正己烷重结晶提纯,得到白色固体产物(2.4g,产率85%)。
[0356]
12.n-环辛基取代α-氨基酸-n-羧基羰基环内酸酐(单体12)的制备
[0357]
实验方法同步骤5,不同之处在于用环辛胺替换环己胺。
[0358]
13.n-cbz-乙基氨基取代-n-羧基羰基环内酸酐(单体13)的制备
[0359]
实验方法同步骤5,不同之处在于用n-苄氧羰基乙二胺盐酸盐替换环己胺。
[0360]
14.n-甲氧基取代-n-羧基硫代羰基环内酸酐(单体14)的制备
[0361]
实验方法同步骤8,不同之处在于用n-乙基-2-甲氧基甘氨酸替换肌氨酸。
[0362]
实施例1.四丁基醋酸铵引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)聚合获得不同链长聚合物
[0363]
将四丁基醋酸铵(30.1mg,0.1mmol)准确称量,并用四氢呋喃(1ml)配置成0.1m浓度的溶液,备用。
[0364]
将l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(52.6mg,0.2mmol)准确称量,用干燥四氢呋喃(1.6ml)溶解于装有搅拌子的反应瓶中。在搅拌的反应瓶中,加入0.4ml浓度为0.1m的四丁基醋酸铵溶液。将混合物搅拌反应1分钟并加入盐酸进行淬灭。通过凝胶渗透色谱(gpc)法鉴定得到的聚合物的分子量mn=16,000及分子量分布mw/mn=1.29。
[0365]
将l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(52.6mg,0.2mmol)准确称量,用干燥四氢呋喃(1ml)溶解于装有搅拌子的反应瓶中。在搅拌的反应瓶中,加入20μl浓度为0.1m的四丁基醋酸铵溶液。将混合物搅拌反应10分钟并加入盐酸进行淬灭。通过凝胶渗透色谱(gpc)法鉴定得到的聚合物的分子量mn=95,000及分子量分布mw/mn=1.22。
[0366]
将l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(52.6mg,0.2mmol)准确称量,用干燥四氢呋喃(0.2ml)溶解于装有搅拌子的反应瓶中。在搅拌的反应瓶中,加入20μl浓度为0.01m的预先稀释的四丁基醋酸铵溶液。将混合物搅拌反应80分钟并加入盐酸进行淬灭。通过凝胶渗透色谱(gpc)法鉴定得到的聚合物的分子量mn=868,700及分子量分布mw/mn=1.17。
[0367]
在上述所有反应混合物分别倒入冷石油醚(40ml),析出的白色絮状物经离心收集,在气流中干燥,并重新溶于四氢呋喃(1.5ml)中,再加入大量冷石油醚沉淀。溶解-沉淀过程共重复三次,得到收率80%的不同链长的聚谷氨酸苄酯均聚物。得到的不同链长聚谷氨酸苄酯均聚物的凝胶渗透色谱图如图1所示。
[0368]
对比例1.正己胺引发单体1
[0369]
将正己胺用四氢呋喃配置成0.1m浓度的溶液,备用。将l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(52.6mg,0.2mmol)准确称量,用干燥四氢呋喃(1.6ml)溶解于装有搅拌子的反应瓶中。在搅拌的反应瓶中,加入20μl浓度为0.1m的正己胺溶液。搅拌反应3天。通过凝胶
渗透色谱(gpc)法鉴定得到的聚合物的分子量mn=27,800及分子量分布mw/mn=1.23。
[0370]
反应时间明显长于实施例1。
[0371]
实施例2.四丁基醋酸铵引发n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(单体2)聚合
[0372]
将四丁基醋酸铵(30.1mg,0.1mmol)准确称量,并用四氢呋喃(1ml)配置成0.1m浓度的溶液,备用。
[0373]
将n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(27.2mg,0.1mmol)准确称量,用干燥四氢呋喃(1ml)溶解于装有搅拌子的反应瓶中。在搅拌的反应瓶中,加入10μl浓度为0.1m的四丁基醋酸铵溶液。将混合物搅拌反应7分钟并加入盐酸进行淬灭。通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。mn=36,700,mw/mn=1.25。
[0374]
在上述所有反应混合物分别倒入冷石油醚(40ml),析出的白色絮状物经离心收集,在气流中干燥,并重新溶于四氢呋喃(1.5ml)中,再加入大量冷石油醚沉淀。这个溶解-沉淀过程共重复三次,得到聚n-ε-叔丁氧羰基-l-赖氨酸均聚物。得到的n-ε-叔丁氧羰基-l-赖氨酸均聚物的凝胶渗透色谱图如图2所示。
[0375]
对比例2.正己胺引发单体2
[0376]
实验方法同实施例2,不同之处在于,用正己胺替换四丁基醋酸铵。反应需3天,得到的聚合物的分子量mn=25,000及分子量分布mw/mn=1.24。
[0377]
反应时间明显长于实施例1。
[0378]
实施例3.四丁基醋酸铵引发l-谷氨酸-5-乙酯-n-羧基羰基环内酸酐(单体3)聚合
[0379]
实验方法同实施例2,不同之处在于,用单体3(20.1mg,0.1mmol)代替单体2。反应时间约为6分钟。通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。mn=52,000,mw/mn=1.21。得到的l-谷氨酸-5-乙酯均聚物的凝胶渗透色谱图如图3所示。
[0380]
对比例3.正己胺引发单体3
[0381]
实验方法同实施例3,不同之处在于,用正己胺替换四丁基醋酸铵。反应需3天,得到的聚合物的分子量mn=45,000及分子量分布mw/mn=1.24。
[0382]
反应时间明显长于实施例1。
[0383]
实施例4.四丁基醋酸铵和四丁基苯甲酸铵引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)聚合的动力学
[0384]
通过原位红外测试,测量1788cm-1
处的羧基环内酸酐羰基与1734cm-1
处的侧链羰基之间的峰面积的相对比,对残留的l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐进行实时监测,从而监控l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐的聚合动力学。
[0385]
实验步骤:将单体1(26.3mg,0.1mmol)准确称量,用干燥四氢呋喃(0.49ml)溶解。在原位红外探头上,加入单体1的四氢呋喃溶液,随即加入10μl浓度为0.1m的四丁基醋酸铵溶液或相同浓度的四丁基苯甲酸铵溶液。
[0386]
测试方法:红外光谱采样范围为2000cm-1
至1000cm-1
,采样间隔为20s。根据公式得到聚合动力学数据。其中[i]是引发剂的浓度,等于链增长物种的总浓度,而k
p
是链增长的速率常数。[m]是单体的残留浓度,[m]0是单体的初始浓度。k
p
[i]代表反映了聚合速率,由曲线的线性拟合计算得出。
[0387]
四丁基醋酸铵和四丁基苯甲酸铵引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐的聚合动力学如图4所示。结果表明,四丁基苯甲酸铵引发的动力学常数k
p
[i]为51.65h-1
,四丁基醋酸铵引发的动力学常数k
p
[i]为37.47h-1
。
[0388]
对比例4.正己胺引发单体1聚合的动力学
[0389]
实验方法同实施例4,不同之处在于,用正己胺替换四丁基醋酸铵溶液或四丁基苯甲酸铵溶液,结果表明,正己胺引发的动力学常数k
p
[i]为0.07h-1
,反映了其聚合速率很慢。而实施例4中的四丁基苯甲酸铵引发的动力学常数是其738倍,四丁基醋酸铵引发的动力学常数是其535倍。
[0390]
实施例5.四丁基醋酸铵引发未重结晶提纯的n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(单体2)聚合
[0391]
未经重结晶纯化的单体合成的不同之处在于,单体2在水萃取后直接进行聚合。具体的步骤为将n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(6.90g,28.0mmol)和α蒎烯(11.74ml,73.92mmol)悬浮在无水乙酸乙酯中,然后在冰水浴下将三光气(3.66g,12.32mmol)溶液加入到反应烧瓶中。将反应加热至45℃,并在氮气下搅拌2小时。将反应混合物用冷的去离子水和冷的碳酸氢钠溶液快速洗涤,得到粗的未提纯单体溶液,将其直接进行聚合而无需进一步纯化。聚合前,将已知量的内标三苯甲烷添加后通过hplc分析计算单体浓度,得到结果为0.47mmol/ml(3.86g,30ml)。
[0392]
根据计算的单体浓度,将四丁基醋酸铵溶液(850mg,2ml)在搅拌下加入到未提纯单体溶液中。聚合完成后(通过tlc监测),通过将反应混合物倒入冷石油醚中沉淀出聚合物。通过过滤收集沉淀物,并在真空下干燥得到聚合物(2.33g)。通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。mn=4,900,mw/mn=1.11。未提纯单体2聚合得到的聚合物的实物图及其凝胶渗透色谱图如图5所示。
[0393]
实施例6.四丁基醋酸铵引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)和n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(单体2)的无规共聚
[0394]
实验方法同实施例2,不同之处在于,用单体1(26.3mg,0.1mmol)和单体2(27.2mg,0.1mmol)代替单体2,用干燥四氢呋喃(2ml)代替干燥四氢呋喃(1ml),用0.1m的四丁基醋酸铵溶液(20μl)代替0.1m的四丁基醋酸铵溶液(10μl)。反应时间约为5分钟。通过凝胶渗透色谱(gpc)法鉴定得到的无均共聚物。mn=39,200,mw/mn=1.17。得到的单体1和单体2的无规共聚物的凝胶渗透色谱图如图6所示。
[0395]
实施例7.四丁基醋酸铵引发n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(单体2)和l-谷氨酸-5-乙酯-n-羧基羰基环内酸酐(单体3)的无规共聚
[0396]
实验方法同实施例2,不同之处在于,用单体3(20.1mg,0.1mmol)和单体2(27.2mg,0.1mmol)代替单体2,用干燥四氢呋喃(2ml)代替干燥四氢呋喃(1ml),用0.1m的四丁基醋酸铵溶液(20μl)代替0.1m的四丁基醋酸铵溶液(10μl)。反应时间约为5分钟。通过凝胶渗透色谱(gpc)法鉴定得到的无均共聚物。mn=36,800,mw/mn=1.13。得到的单体2和单体3的无规共聚物的凝胶渗透色谱图如图7所示。
[0397]
实施例8.四丁基苯甲酸铵引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)和l-谷氨酸-5-乙酯-n-羧基羰基环内酸酐(单体3)的无规共聚
[0398]
将四丁基苯甲酸铵(39.3mg,0.1mmol)准确称量,并用四氢呋喃(1ml)配置成0.1m
浓度的溶液,备用。
[0399]
实验方法同实施例2,不同之处在于,用单体1(26.3mg,0.1mmol)和单体3(20.1mg,0.1mmol)代替单体2,用干燥四氢呋喃(2ml)代替干燥四氢呋喃(1ml),用0.1m的四丁基苯甲酸铵溶液(20μl)代替0.1m的四丁基醋酸铵溶液(10μl)。反应时间约为5分钟。通过凝胶渗透色谱(gpc)法鉴定得到的无均共聚物。mn=55,100,mw/mn=1.29。得到的单体1和单体3的无规共聚物的凝胶渗透色谱图如图8所示。
[0400]
实施例9.四丁基醋酸铵引发n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(单体2)和l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)的嵌段聚合
[0401]
将单体1(263mg,1mmol)和单体2(272mg,1mmol)准确称量,分别配置成1mmol/ml的母液以备每段聚合时加入。首先用干燥四氢呋喃(1ml)溶解单体2(27.2mg,0.1mmol)于装有搅拌子的反应瓶中。在搅拌的反应瓶中加入20μl浓度为0.1m的四丁基醋酸铵溶液。将混合物搅拌反应5分钟取一部分液体(总液体量的1/10)加入盐酸淬灭并通过凝胶渗透色谱(gpc)鉴定得到第一段的聚合物的分子量及分子量分布。将剩下的反应物中加入单体1(0.1
×
0.9=0.09mmol,90μl)继续进行反应5分钟,反应结束后取一部分液体(总液体量的1/10)加入盐酸淬灭并通过凝胶渗透色谱(gpc)鉴定得到第二段的聚合物的分子量及分子量分布。
[0402]
将剩下的反应物中加入单体2(0.09
×
0.9=0.081mmol)继续进行反应5分钟。这样交替加入反应物液体并取走一部分混合物进行gpc监测,重复15次后,得到n-ε-叔丁氧羰基-l-赖氨酸和l-谷氨酸-5-苄酯嵌段聚合物。图9显示了多段嵌段共聚物的合成示意图(图9中的a)、不同数量嵌段所得到的聚合物的分子量(图9中的b)和gpc谱图(图9中的c)。该嵌段共聚物的分子量可达到50万以上,由于本方法的反应时间短,使得该嵌段共聚物的制备总时长不超过90分钟,对大规模合成氨基酸类共聚物具有很高的应用价值。
[0403]
实施例6-9表明,本发明的聚合方法可适用于制备各种共聚物,且制备方法简单,分子量大,分子量分布窄。
[0404]
实施例10.四丁基醋酸铵引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)在不同溶剂中的聚合
[0405]
将四丁基醋酸铵(30.1mg,0.1mmol)准确称量,并用四氢呋喃、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、乙腈、二氧六环、二甲基亚砜、二氯甲烷、氯仿、丙酮、n-甲基吡咯烷酮、乙酸乙酯配置成0.1m浓度的溶液备用。
[0406]
将l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(52.6mg,0.2mmol)准确称量,分别用四氢呋喃、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二氧六环、二甲基亚砜、二氯甲烷、n-甲基吡咯烷酮溶解于装有搅拌子的反应瓶中。在搅拌的反应瓶中,加入20μl浓度为0.1m的四丁基醋酸铵溶液。将混合物搅拌反应5分钟并加入盐酸进行淬灭。通过凝胶渗透色谱(gpc)法鉴定得到的聚合物的分子量及分子量分布。在不同溶剂中合成的本发明的聚合物如表1所示。
[0407]
表1在不同溶剂条件下合成的聚合物的和相应的分子量和分子量分布
[0408][0409]
结果表明,本发明的聚合方法在多种有机溶剂中,包括强极性溶剂(二甲基亚砜)和非极性溶剂(二氧六环)等,均可以进行。并且合成的聚合物的分子量和溶剂的偶极矩有关,偶极矩大的溶剂可能会导致聚合物的分子量降低。因此,可以通过使用不同的溶剂来方便地调节产物聚合物的分子量。
[0410]
实施例11.四丁基醋酸铵引发n-羧基羰基环内酸酐在溶剂/水环境中聚合及一锅法自组装过程
[0411]
将单体1(26.3mg,0.1mmol)和单体2(27.2mg,0.1mmol)准确称量。将四丁基醋酸铵(30.1mg,0.1mmol)准确称量,并用水(1ml)配置成0.1m浓度的溶液备用。
[0412]
二甲基亚砜(1ml)溶解单体2(27.2mg,0.1mmol)于装有搅拌子的反应瓶中。向搅拌的反应瓶中加入1ml四丁基醋酸铵水溶液。将反应混合物在室温搅拌5分钟,得到第一嵌段。聚合完成后(通过tlc监测),将单体1(26.3mg,0.1mmol)在dmso(0.1ml)中的溶液添加到反应混合物中,继续反应2分钟直至反应完成,得到单体1和单体2的嵌段共聚物。然后将三氟乙酸(2ml)直接加入到混合物中,并将反应溶液搅拌2小时。随后,向混合物中添加大量水(10ml),与dmso均匀混合,然后将溶液保持过夜,得到嵌段共聚物的组装结构。图10显示了本发明的引发剂引发n-羧基羰基环内酸酐在溶剂/水环境中聚合及一锅法自组装过程的示意图(图10中的a)和得到的自组装结构的微观结构和尺寸分析图(图10中的b)。
[0413]
结果表明,本发明的方法可以含有大量水的油水两相的体系中进行,并且通过选择两种性质不同的单体得到嵌段共聚物,利用该嵌段共聚物的性质可以实现界面组装,得到纳米尺度的球形自组装结构。此外,由于本发明所述方法得到的嵌段共聚物的分子量分布窄,使得得到的自组装结构的尺寸均一,呈规则的球形,因此,本发明所述方法在界面组装领域具有很高的应用价值。
[0414]
实施例12.四丁基醋酸铵引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)在无溶剂环境中聚合
[0415]
将四丁基醋酸铵(12.1mg,0.04mmol)准确称量,将单体1(52.6mg,0.2mmol)准确称量。将引发剂(固态)和单体(固态)倒入玛瑙研钵中进行手动研磨;或将二者倒入组织研磨机、球磨机中进行自动研磨。经过手动研磨5分钟或者自动研磨2分钟后,取一部分固体直接测试红外光谱检测,结果表明单体反应完全(避免加入溶剂后在溶剂中反应)。
[0416]
将获得聚合物通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。mn=5,000,mw/mn=
1.22。在无溶剂环境中合成的聚合物的gpc谱图如图11所示。
[0417]
结果表明,本发明的方法可以在完全不借助溶剂的条件下而仅在固态条件下就可进行聚合反应。经过组织研磨机、球磨机研磨,甚至手动研磨的条件下也可以快速进行反应。
[0418]
实施例13.四丁基醋酸铵引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)微流道聚合
[0419]
将四丁基醋酸铵(12.1mg,0.04mmol)准确称量,将单体1(52.6mg,0.2mmol)准确称量。将引发剂和单体分别用2ml四氢呋喃溶解,并加入到注射器中预先置于注射泵上,然后连接注射器与微流道管道并确保没有液体泄漏。开启注射泵,使反应在一定速度下进行一段时间,在微流道收集口收集获得的聚合物溶液并沉淀于石油醚中。将获得聚合物通过凝胶渗透色谱(gpc)法表征。mn范围在10000至5000,mw/mn=1.22-1.25,图12显示了使用微流道聚合的装置图(图12中的a)和反应结果(图12中的b)。
[0420]
结果表明,本发明的方法可以在微流道中持续的进行反应,并且通过控制流道的流速和单体的初始浓度,可以实现产物分子量的调控。
[0421]
实施例11-13表明,本发明的聚合方法对合成环境的要求低,不需要严格的超干溶剂和超干环境下,甚至可以在含有水的溶剂中进行聚合。此外,本发明的聚合方法可以在多种合成场景中进行(如无溶剂环境、微流道环境中)。
[0422]
实施例14.甲基碳酸酯四甲基铵(tetramethylammonium methylcarbonate)引发n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(单体2)聚合
[0423][0424]
实验方法同实施例2,不同之处在于,用0.1m的甲基碳酸酯四甲基铵溶液(100μl)替换0.1m的四丁基醋酸铵溶液(10μl)。反应时间约为5分钟。通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。mn=6280,mw/mn=1.26。
[0425]
实施例15苯硫代羧酸四丁基铵(tetrabutylammonium benzenecarbothioate)引发n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(单体2)聚合
[0426][0427]
实验方法同实施例2,不同之处在于,用0.1m的苯硫代羧酸四丁基铵溶液(100μl)替换0.1m的四丁基醋酸铵溶液(10μl)。反应时间约为5分钟。通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。mn=7200,mw/mn=1.23。
[0428]
实施例16.乙酸盐类引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)聚合
[0429]
实验方法同实施例2,不同之处在于,用单体1(26.3mg,0.1mmol)代替单体2,用乙酸盐类(乙酸锂、乙酸钠、乙酸钾、乙酸铵)替换四丁基醋酸铵;加入200μl浓度为0.1m的乙酸盐类(乙酸锂、乙酸钠、乙酸钾、乙酸铵)替换加入10μl浓度为0.1m的四丁基醋酸铵溶液。通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。使用不同的引发剂得到的聚合物的分子量及分子量分布如表2所示。
[0430]
表2使用不同的引发剂得到的聚合物的分子量及分子量分布
[0431][0432]
实施例17.聚合物侧链-聚天冬氨酸四丁胺引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐(单体1)聚合
[0433][0434]
实施例17.1聚天冬氨酸四丁胺的制备
[0435]
将四丁基醋酸铵(30.1mg,0.1mmol)准确称量,并用四氢呋喃(1ml)配置成0.1m浓度的溶液备用。将l-天冬氨酸-4-叔丁酯-n-羧基羰基环内酸酐(21.5mg,0.1mmol)准确称量,用干燥四氢呋喃(1ml)溶解于装有搅拌子的反应瓶中。在搅拌的反应瓶中加入200μl浓度为0.1m的四丁基醋酸铵溶液。将混合物搅拌反应5分钟加入盐酸淬灭并通过凝胶渗透色谱(gpc)鉴定得到的聚合物的分子量及分子量分布mn=2830,mw/mn=1.27。上述反应混合物倒入冷石油醚(40ml),析出的白色絮状物经离心收集,在气流中干燥,并重新溶于四氢呋喃(1.5ml)中,再加入大量冷石油醚沉淀。这个溶解-沉淀过程共重复三次,得到聚l-天冬氨酸-4-叔丁酯。
[0436]
将聚l-天冬氨酸-4-叔丁酯加入2ml三氟乙酸脱除侧链叔丁基保护,后加入45ml冰冻甲基叔丁基醚使之析出白色沉淀,溶解-沉淀过程重复三次,从而得到侧链羧基脱保护的聚合物。得到的聚l-天冬氨酸与四丁基氢氧化铵反应调ph值为7后,溶于去离子水并冻干得到聚天冬氨酸四丁胺。
[0437]
实施例17.2聚天冬氨酸四丁胺引发l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐聚合
[0438]
将得到的聚天冬氨酸四丁胺准确称量,按照侧链羧基当量的5倍加入l-谷氨酸-5-苄酯-n-羧基羰基环内酸酐,反应在四氢呋喃中进行反应,在10s内立刻取样监测发现单体完全反应结束,加入盐酸淬灭并通过凝胶渗透色谱(gpc)鉴定得到的聚合物的分子量及分
子量分布mn=27700,mw/mn=1.33。上述反应混合物倒入冷石油醚(40ml),析出的白色絮状物经离心收集,在气流中干燥,并重新溶于四氢呋喃(1.5ml)中,再加入大量冷石油醚沉淀。这个溶解-沉淀过程共重复三次,最终得到聚合物侧链-聚天冬氨酸四丁胺引发的聚l-谷氨酸-5-苄酯。
[0439]
结果表明,四丁基醋酸铵引发得到的聚合物可以继续通过侧链羧基引发环内酸酐单体,从而形成结构更加多样(类似于刷状聚合物、纳米颗粒)的产物,并且引发速率进一步加快。
[0440]
实施例18.四丁基醋酸铵引发n-环己基取代的α-氨基酸-n-羧基羰基环内酸酐(单体5)聚合
[0441][0442]
将四丁基醋酸铵(30.1mg,0.1mmol)准确称量,并用四氢呋喃(0.2ml)配置成0.5m浓度的溶液,备用。将n-环己基取代的α-氨基酸-n-羧基羰基环内酸酐(单体5)(18.3mg,0.1mmol)准确称量,用干燥四氢呋喃(0.4ml)溶解于装有搅拌子的反应瓶中。在搅拌的反应瓶中,加入40μl浓度为0.5m的四丁基醋酸铵溶液。反应10小时结束后通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。mn=3700,mw/mn=1.13。
[0443]
对比例5.正己胺引发单体5
[0444]
实验方法同实施例18,不同之处在于,用正己胺替换四丁基醋酸铵。反应需6天,得到的聚合物的分子量mn=1470及分子量分布mw/mn=1.15。
[0445]
结果表明,正己胺引发低活性单体5的反应时间明显长于实施例18。
[0446]
实施例19.四丁基醋酸铵引发n-甲基取代的α-氨基酸-n-羧基羰基环内酸酐(单体6)聚合
[0447][0448]
实验方法同实施例18,不同之处在于,用单体6替换单体5,反应30分钟结束后通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。mn=3000,mw/mn=1.19。
[0449]
实施例20.四丁基醋酸铵引发l-谷氨酸-5-苄酯-n-羧基硫代羰基环内酸酐(单体7)聚合
[0450][0451]
实验方法同实施例18,不同之处在于,用单体7替换单体5,反应24小时结束后通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。mn=15000,mw/mn=1.29。
[0452]
实施例21.四丁基醋酸铵引发n-甲基取代α-氨基酸-n-羧基硫代羰基环内酸酐(单体8)聚合
[0453][0454]
实验方法同实施例18,不同之处在于,用单体8替换单体5,反应30分钟结束后通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。mn=2700,mw/mn=1.11。
[0455]
实施例22.四丁基醋酸铵引发n-苄基取代α-氨基酸-n-羧基硫代羰基环内酸酐(单体9)聚合
[0456][0457]
实验方法同实施例18,不同之处在于,用n-苄基取代α-氨基酸-n-羧基硫代羰基环内酸酐(单体9)替换单体5。反应2天结束后通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。mn=4200,mw/mn=1.18。
[0458]
对比例6.正己胺引发单体9
[0459]
实验方法同实施例22,不同之处在于,用正己胺替换四丁基醋酸铵。反应需6天,得到的产物分子量小于1000,超过gpc表征下限。
[0460]
结果表明,相比使用传统引发剂正己胺引发低活性单体9无法得到大分子量产物,本发明所述的引发剂可以引发低活性单体聚合。
[0461]
实施例23.四丁基醋酸铵引发l-天冬氨酸1-苄酯-β-氨基酸-n-羧基硫代羰基环内酸酐(bn-β
3-lchg nta)(单体10)聚合
[0462][0463]
实验方法同实施例18,不同之处在于,用单体10替换单体5,反应12小时结束后通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。mn=7200,mw/mn=1.28。
[0464]
实施例24.四丁基醋酸铵引发n-丙基噻吩取代-β-氨基酸-n-羧基硫代羰基环内酸酐(单体11)聚合
[0465][0466]
实验方法同实施例18,不同之处在于,用单体11替换单体5,反应24小时结束后通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。mn=6800,mw/mn=1.30。
[0467]
实施例25.四丁基醋酸铵引发n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(单体2)和n-环己基取代的α-氨基酸-n-羧基羰基环内酸酐(单体5)聚合
[0468][0469]
实验方法同实施例18,不同之处在于,用单体2和单体5替换单体5,反应约10小时结束后通过凝胶渗透色谱(gpc)法鉴定得到的共聚物。约mn=5000,mw/mn=1.20。
[0470]
当单体2形成的聚合物链段脱除ε-叔丁氧羰基boc保护后,形成带有正电荷的聚合物,具有溶液抗菌/抗癌、表面涂层修饰抗菌、表面涂层修饰促细胞黏附的功能,另外正电荷/疏水性的两亲结构具备自组装功能。
[0471]
实施例26.四丁基醋酸铵引发n-ε-叔丁氧羰基-l-赖氨酸-n-羧基羰基环内酸酐(单体2)和n-环辛基取代的α-氨基酸-n-羧基羰基环内酸酐聚合
[0472][0473]
实验方法同实施例18,不同之处在于,用单体2和单体12替换单体5,反应约10小时结束后通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。约mn=5000,mw/mn=1.20
[0474]
当单体2形成的聚合物链段脱除ε-叔丁氧羰基boc保护后,形成带有正电荷的化合物,具有溶液抗菌/抗癌、表面涂层修饰抗菌、表面涂层修饰促细胞黏附的功能,另外正电荷/疏水性的两亲结构具备自组装功能。
[0475]
实施例27.四丁基醋酸铵引发n-cbz-乙基氨基取代-n-羧基羰基环内酸酐和n-环己基取代的α-氨基酸-n-羧基羰基环内酸酐(单体5)聚合
[0476][0477]
实验方法同实施例18,不同之处在于,用单体13和单体5替换单体5,反应约10小时结束后通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。约mn=5000,mw/mn=1.20
[0478]
当n-cbz-乙基氨基取代-n-羧基羰基环内酸酐形成的聚合物链段脱除cbz保护后,形成带有正电荷的化合物,具有溶液抗菌/抗癌、表面涂层修饰抗菌、表面涂层修饰促细胞黏附的功能,另外正电荷/疏水性的两亲结构具备自组装功能。
[0479]
实施例28.四丁基醋酸铵引发n-甲氧基取代-n-羧基硫代羰基环内酸酐聚合
[0480][0481]
实验方法同实施例18,不同之处在于,用单体14替换单体5,反应约48小时结束后通过凝胶渗透色谱(gpc)法鉴定得到的聚合物。约mn=4200,mw/mn=1.18
[0482]
得到的聚合物侧链带有甲氧基基团,具有阻止特异性黏附、抗异物反应的功能。
[0483]
讨论
[0484]
1.本发明所述方法的聚合速度快,普遍在5分钟内完成,最快可达1分钟以内,相比于传统的开环聚合(例如伯胺引发α-氨基酸n-羧基羰基环内酸酐单体nca需3天)提升效果明显。
[0485]
2.本发明所述方法可适用于多种单体(包括低活性的单体和未提纯的单体)(如单体5-10),而传统伯胺引发低活性n-取代α-氨基酸n-羧基羰基环内酸酐单体nnca需6天,伯
胺引发n-苄基取代α-氨基酸n-羧基硫代羰基环内酸酐单体nnta无法获得大分子量聚合物产物;
[0486]
3.本发明所述方法可适用于多种结构的聚合物的制备,包括无规共聚物、嵌段共聚物、刷状聚合物,以及利用共聚物组装的聚合物纳米组装结构,且操作简便,反应迅速(90分钟内可合成多嵌段的高分子量的嵌段共聚物);
[0487]
4.本发明所述方法敞口操作即可,对环境要求低,相比传统的聚合方法(需超干溶剂和超干环境下反应)大大降低了操作人员和技术和经验要求,和设备要求。
[0488]
5.本发明所述方法可适用于多种合成场景,可以在无溶剂的固态环境、微流道环境中进行反应,大大拓宽了本发明所述方法的应用范围,适用于工业化生产。
[0489]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1