一种精确定量袋栽平菇菌丝生物量的方法及其应用
本发明属于食用菌菌丝生物量测定技术领域,尤其涉及一种精确定量袋栽平菇菌丝生物量的方法及其在平菇生产中的应用。
背景技术:
平菇是我国主栽食用菌品种之一,其栽培受到外界环境因素和培养料营养组成的影响,在不同的培养条件下及不同的生长发育时期,平菇菌丝生物量存在一定差异。目前,对平菇菌丝生长的描述仅限于对气生菌丝长势(菌丝颜色、浓密度、粗细等)和长速的定性描述,对生长于培养料内部的大量基内菌丝仍无法准确定性描述。然而,平菇菌丝对培养料的降解率主要取决于基内菌丝的含量,此外,平菇子实体的产量与其菌丝生物量之间也存在一定的相关性。因此,为了揭示不同培养条件下及不同生长发育时期平菇菌丝生物量的变化,需要建立一套科学合理的菌丝生物量定量评价体系。
目前,dna浓度测定法已被用于工厂化金针菇、熟料栽培香菇的菌丝定量研究中,但该方法的测定结果易受栽培基质来源dna样品的影响。尤其在平菇发酵料栽培中,培养料是由平菇菌丝、其它微生物、栽培基质共同组成的复杂混合体,从平菇发酵料中提取的dna既包含了平菇菌丝来源的dna,也包含了栽培基质及其它微生物来源的dna。那么采用dna浓度定量法对发酵料栽培平菇菌丝进行定量时必然产生较大的误差。因此,开发一种特异性强的定量方法是解决上述问题的有效途径。
技术实现要素:
本发明的目的在于:提供一种精确定量袋栽平菇菌丝生物量的方法及其应用,旨在解决现有技术中对平菇菌丝生物量定量不准确、误差较大的问题。
本发明采用的技术方案如下:
一种精确定量袋栽平菇菌丝生物量的方法。所述方法包括以下步骤:
(1)平菇特异性phos基因扩增和测序
(2)phos基因荧光定量pcr引物设计和扩增条件优化
(3)平菇菌丝制备
(4)平菇菌丝-培养料混合样品制备及基因组dna提取
(5)平菇菌丝dna拷贝数-生物量标准曲线的构建
利用平菇特异性的grtphos-f和grtphos-r引物,通过荧光定量pcr对不同浓度菌丝-培养料混合样品的dna拷贝数进定量,并建立菌丝dna拷贝数与生物量之间的标准曲线。
进一步,所述步骤(1)具体包括以下步骤:
①设计引物扩增平菇特异性phos基因片段;
②构建pmd19t-phos重组质粒;
③pmd19t-phos重组质粒测序,phos基因的序列如seqidno.1所示。
进一步,所述步骤(2)具体包括以下步骤:
①根据phos基因的序列和荧光定量pcr引物设计原则,设计位于内含子中的上游引物grtphos-f:5’…gtctcgcccctttatctgaatg…3’,位于外显子中的下游引物grtphos-r:5’…ggacttgaacgctgcgatatttg…3’;
②利用温度梯度pcr,筛选优化grtphos-f/grtphos-r引物的退火温度。更进一步,所述步骤②中,所述退火温度为53~58℃,优选为58℃。
进一步,所述步骤(3)具体包括以下步骤:将活化好的平菇液体菌种转接至液体培养基,黑暗震荡培养,过滤收集菌丝体,并用无菌水冲洗。更进一步,所述菌种为平菇新831菌株。
进一步,所述步骤(4)具体包括以下步骤:将不同湿重的平菇菌丝与恒定重量的培养料混匀,制备菌丝-培养料混合样品,在液氮条件下迅速研磨成粉末状,采用ctab法提取混合样品的基因组dna。
进一步,所述步骤(5)具体包括以下步骤:
①phos基因绝对荧光定量pcr标准曲线的构建
将步骤(1)构建的pmd19t-phos质粒作为标准质粒,通过实时荧光定量pcr测定了各稀释度下的phos基因拷贝数,并建立log10(拷贝数)与ct值之间的标准曲线;
②平菇菌丝dna拷贝数-生物量标准曲线的构建
以步骤(4)中提取的各样品基因组dna作为模板,利用grtphos-f/grtphos-r引物测定各样品中的phos基因ct值,将ct值带入log10(拷贝数)-ct值标准曲线中算出各样品的dna拷贝数,建立平菇菌丝dna拷贝数与生物量之间的标准曲线。
更进一步,所述步骤①具体包括以下步骤:a.提取pmd19t-phos质粒,并测定质粒浓度;b.将提取的pmd19t-phos质粒进行10倍梯度稀释,计算各稀释度样品的dna拷贝数,并进一步计算log10(拷贝数)值;c.以稀释后的pmd19t-phos质粒为模板,利用grtphos-f/grtphos-r引物进行荧光定量pcr扩增,测定各稀释度样品的ct值,每个样品重复三次;d.建立log10(拷贝数)与ct值之间的标准曲线。
具体的,其中:栽培基质组成为70%棉籽壳+30%麦麸中分别添加0%、0.2%、0.4%、0.6%、1.0%、1.2%(w/w)的磷元素,含水量60%左右。
其中:料袋制作步骤为:按照配方比例准确称取棉籽壳、麦麸,翻版均匀;根据配方准确称取二水磷酸氢二钠和十二水磷酸二氢钠,将其加入称好的温水中,搅拌溶解;将溶解的磷酸盐溶液加至棉籽壳和麦麸混合样品中,翻拌均匀;装入22cm×36cm×0.004cm的聚丙烯折角袋中,套环封口;100℃常压灭菌16h;料袋冷却后,无菌条件下,一端接入平菇固体菌种,菌种封面;将菌袋搬至25℃培养室,培养至某一处理组菌丝长至半袋。
其中:菌丝长势定性分析为:在距离菌丝尖端1cm处摆开菌袋,拍照记录横截面菌丝长势;
其中:菌丝基因组dna提取步骤为:将有菌丝端培养料揉碎,随机称取5g;液氮速冻后研磨成粉末;称取0.2g粉末,利用ctab法提取基因组dna;
其中:培养料中平菇菌丝生物量定量步骤为:利用grtphos-f/grtphos-r引物测定各样品中的phos基因ct值,将ct值代入log10(拷贝数)-ct值标准曲线中,计算得到log10(拷贝数),并进一步计算出dna拷贝数;将dna拷贝数代入平菇菌丝dna拷贝数-生物量标准曲线中,计算得到平菇菌丝干重。
另外,本发明还提供了以上所述的精确定量袋栽平菇菌丝生物量的方法在平菇生产中应用。
综上所述,由于采用了上述技术方案,本发明的有益效果是:
本发明以平菇菌株的phos基因作为目标基因,通过荧光定量pcr建立phos基因的绝对荧光定量pcr标准曲线。通过将不同重量的平菇菌丝与恒定重量的培养料混匀,来制备含有不同生物量菌丝的混合样品,以模拟平菇袋栽实验。然后,提取各样品的基因组dna,通过荧光定量pcr测定各基因组样品中phos基因的拷贝数。最后,换算建立菌丝生物量与dna拷贝数之间的标准曲线。本发明的研究结果不仅为熟料或发酵料栽培平菇菌丝的精确定量提供了很好的方法,而且将为后续探究平菇菌丝生物量与子实体产量之间的关系、揭示平菇不同生长发育时期菌丝生物量的动态变化提供方法借鉴。
附图说明
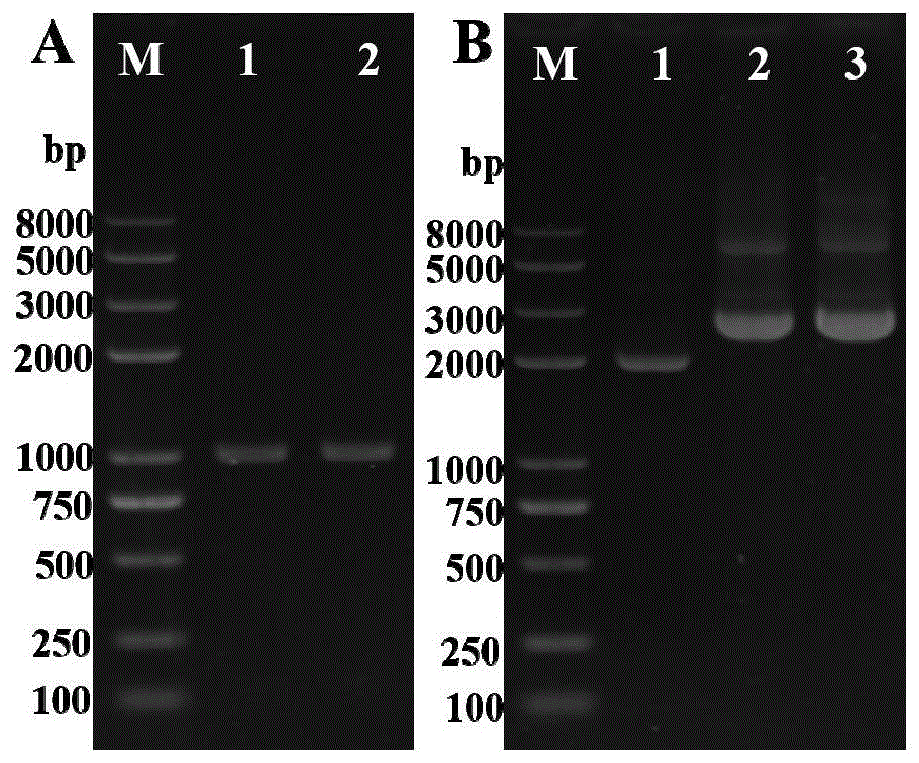
图1phos基因gdna片段扩增电泳图(a)和pmd19t-phos重组质粒电泳图(b),(a)m,tans2kplusiidnamarker;1和2,phos基因gdna片段,(b)m,tans2kplusiidnamarker;1,pmd19-t空载质粒;2和3,pmd19t-phos重组质粒;
图2phos基因荧光定量pcr引物的设计原理;
图3grtphos-f/grtphos-r引物退火温度筛选,m,tans2kplusiidnamarker;1至3,退火温度为53℃、56℃、58℃时gdna片段扩增结果;4至6,退火温度为53℃、56℃、58℃时引物二聚体扩增结果;
图4phos基因绝对荧光定量pcr标准曲线;
图5平菇菌丝dna拷贝数与生物量之间的大范围标准曲线;
图6平菇菌丝dna拷贝数与生物量之间的小范围标准曲线;
图7平菇菌丝dna拷贝数-生物量标准曲线的准确性检验;
图8平菇菌丝dna拷贝数-生物量标准曲线的应用。
具体实施方式
下面结合具体实施方式对本发明作进一步的说明。本发明不限于以下的实施例。
本发明以平菇新831菌株的phos基因作为目标基因,以平菇菌丝作为试验材料,通过荧光定量pcr法建立了phos基因的绝对荧光定量pcr标准曲线,并进一步建立了dna拷贝数与平菇菌丝生物量之间的线性关系。试验结果显示,平菇phos基因绝对荧光定量pcr标准曲线为y=-2.8917x+34.231,平菇dna拷贝数-菌丝生物量之间的标准曲线(大范围)为y=0.2973x-0.33347,r2=0.9987,平菇dna拷贝数-菌丝生物量之间的标准曲线(小范围)为y=0.1719x-0.0.039,r2=0.993。平菇菌丝生物量与dna拷贝数之间均存在较好的线性关系,可用于袋栽平菇菌丝生物量的精确定量,尤其适用于发酵料栽培平菇菌丝生物量的测定。
实施例
(一)试验材料
供试菌株和质粒
平菇新831菌株为本实验室保藏,pmd19t-phos质粒为本发明构建。
培养基
(1)gye液体培养基:2%葡萄糖、0.5%酵母粉、0.1%kh2po4、0.05%mgso4·7h2o、0.01‰vb1,蒸馏水1l。115℃高压蒸汽灭菌30min备用。
(2)纯棉籽壳培养料配方:100%棉籽壳,含水量60%。
(3)含磷培养料配方:70%棉籽壳、30%麦麸,分别添加不同浓度的磷元素,制备磷元素含量分别为0%、0.2%、0.4%、0.6%、1.0%、1.2%的栽培基质,含水量60%。100℃常压灭菌16h。
(二)试验方法
1.平菇特异性phos基因的扩增和测序
(1)根据p.ostreatuspc15基因组序列设计扩增平菇新831菌株phos基因的引物,引物序列如下:
phos-f:5'...ggtgatagtattgatcggcgttattg...3'
phos-r:5'...catgatcgagaacttcatggaac...3'
(2)以平菇新831菌株基因组dna为模板进行扩增,反应体系如下:ddh2o34μl,5xpsbuffer10μl,dntps4μl,phos-f0.5μl,phos-r0.5μl,基因组dna0.5μl,primerstardna聚合酶0.5μl。
反应条件为:98℃3min;98℃10s,58℃15s,72℃1min10s,30个循环;72℃5min。
(3)按照上海生工胶回收试剂盒说明书对pcr产物进行胶回收;
(4)按照pmd19-t载体(takara)试剂盒说明书进行酶联反应;
(5)按照常规分子克隆步骤进行大肠杆菌转化和pmd19t-phos重组质粒筛选;
(6)将pmd19t-phos重组质粒送华大基因测序(phos基因的序列如seqidno.1所示)。
2phos基因特异性荧光定量pcr扩增引物设计和退火温度筛选
2.1扩增引物设计
按照图2所示引物设计原理,根据pmd19t-phos重组质粒测序结果,设计phos基因特异性实时荧光定量pcr扩增引物,其中上游引物grtphos-f位于内含子中,下游引物grtphos-r位于外显子中,消除rna为模板扩增带来的影响。引物序列如下:
grtphos-f:5’…gtctcgcccctttatctgaatg…3’
grtphos-r:5’…ggacttgaacgctgcgatatttg…3’
2.2扩增退火温度筛选
反应体系为:ddh2o20μl,10×buffer2.5μl,dntp2μl,grtphos-f0.4μl,grtphos-r0.4μl,gdna0.25μl。阴性对照组不添加gdna。
设置53℃、56℃、58℃三个退火温度。反应条件为:94℃预变性3分钟;94℃变性30秒,53℃、56℃、58℃退火30秒,72℃延伸20秒,35个循环;72℃保温5分钟。pcr结束,取5μl扩增产物进行1.2%琼脂糖凝胶电泳检测(图3)。
3.平菇菌丝制备
(1)按照5%接种量,将活化好的平菇液体菌种转接至gye液体培养基中,25℃,180rpm黑暗震荡培养5天左右。
(2)采用真空抽滤法收集菌丝体,并用无菌水冲洗一遍。
4平菇菌丝-培养料混合样品制备及基因组dna提取
4.1平菇菌丝-培养料混合样品制备
(1)为了模拟平菇菌丝栽培条件下的生活环境,本发明采用将不同湿重的平菇菌丝(0、0.02、0.04、0.06、0.08、0.1、0.3、0.6、1.5g)与恒定重量(4g)的纯棉籽壳培养料混匀,制备菌丝-培养料混合样品,每个处理三个重复。(袋栽平菇菌丝生物量特别低,不会超过1.5g。)
(2)将菌丝-培养料混合样品加入液氮预冷的研钵中,倒入适当体积的液氮,迅速研磨至样品成粉末状。
(3)菌丝干重测定:准确称取0、0.02、0.04、0.06、0.08、0.1、0.3、0.6、1.5g平菇菌丝放入65℃烘箱中烘干至恒重,称量菌丝干重。
(4)纯培养料干重测定:准确称取4g纯棉籽壳培养料放入65℃烘箱中烘干至恒重,称量纯培养料干重。
4.2平菇菌丝基因组dna提取
本发明采用ctab法对菌丝-培养料混合样品的dna进行提取。
(1)溶液的配制
1)2×ctab缓冲液(500ml):2%ctab,100mmtris-hcl,20mmedta,1.4mnacl,1%ph8.0聚乙烯吡咯烷酮(pvp)。
2)soildnaextractionbuffer(500ml):100mmnacl,50mmedta,0.25mtris-hcl,5%sds,灭菌后室温保存。
3)tebuffer:10mmtris-hcl,1mmedta(ph8.0),配好后121℃用立式高压蒸汽灭菌锅灭菌20min,室温保存。
4)tebuffer(containingrnasea1):取20μlrnasea1(50mg/ml)至1mltebuffer中,rnasea1终浓度为1mg/ml。-20℃冰箱保存。
5)3m醋酸钠溶液(ph5.2)(100ml):称取24.61g无水乙酸钠,加入80ml超纯水,用冰醋酸调节ph至5.2,定容至100ml,121℃灭菌20min,室温保存。
6)70%乙醇(200ml):量取140ml无水乙醇(分析纯)至试剂瓶中,加入60ml灭菌超纯水,4℃冰箱中保存,备用。
(2)平菇菌丝基因组dna提取
1)准确称取0.2g用液氮研磨成粉末的样品于液氮预冷的2ml离心管中。
2)加入400μlsoildnaextractionbuffer缓冲液,剧烈颠倒+旋涡震荡混匀。
3)加入400ml2×ctab缓冲液,剧烈颠倒+旋涡震荡混匀;55℃放置5min,使细胞充分裂解。
4)加入500μl苯酚:氯仿:异戊醇(25:24:1)溶液,剧烈颠倒+旋涡震荡混匀;12,000rpm,4℃,离心10min。
5)用移液枪移取650μl左右的上清液至1.5ml离心管中;加入455μl异丙醇,颠倒混匀,使dna沉淀;12,000rpm,4℃,离心10min,弃去上清液。
6)加入1ml预冷的70%乙醇,旋涡震荡;12,000rpm,4℃,离心10min,弃去上清液;通风橱内放置3~5min,除尽酒精。
7)加入50μl预热的tebuffer(containingrnasea1)溶解dna沉淀,65℃孵育10min,灭活dnase;37℃孵育30min,除去在dna样品中的rna。
8)加入5μl的3msodiumacetatebuffer(ph5.2)和125μl的无水乙醇,-80℃冰箱中放置30min;12,000rpm,4℃,离心10min,弃去上清液;
9)重复步骤6);
10)加入50μl65℃预热的tebuffer,轻弹使沉淀溶解在缓冲液中,-80℃冰箱保存。
5平菇菌丝dna拷贝数与生物量之间标准曲线的建立
5.1phos基因绝对荧光定量pcr标准曲线的构建
(1)利用上海生工质粒小量提取试剂盒提取pmd19t-phos质粒,并测定质粒浓度;
(2)将提取的pmd19t-phos质粒进行10倍梯度稀释(101、102、103、104、105、106、107、108、109);
(3)以稀释后的pmd19t-phos质粒为模板,利用grtphos-f和grtphos-r引物进行荧光定量pcr扩增,每个样品重复三次。
反应体系为:2×sybgreen10μl,不同稀释度的pmd19t-phos质粒0.5μl,grtphos-f0.4μl,grtphos-r0.4μl,ddh2o9μl。
反应条件为:95℃2min;95℃20s、56℃20s、72℃20s,40个循环;95℃5s,4.4℃/s;65℃1min,2.2℃/s;65℃to95℃continuous,0.1℃/s;40℃cooling,2.2℃/s。
(4)phos基因标准曲线制备
计算出各稀释度pmd19t-phos质粒的拷贝数,然后以log10(拷贝数)为横坐标,ct值为纵坐标绘制phos基因的标准曲线(图4)。
5.2平菇菌丝dna拷贝数-生物量标准曲线的构建
(1)以1μl样品dna为模板,利用grtphos-f/grtphos-r引物进行荧光定量pcr扩增,每个样品重复三次。
(2)将各样品对应的ct值代入phos基因绝对荧光定量标准曲线中,计算出各样品phos基因的log10(拷贝数)数值;进一步计算出各样品中phos基因的拷贝数。为了消除不同样品菌丝含水量的不同,本发明以菌丝干重表征菌丝生物量。以菌丝干重为横坐标、dna拷贝数为纵坐标绘制dna拷贝数-平菇菌丝生物量标准曲线(图5和图6)。
6平菇菌丝dna拷贝数与生物量之间标准曲线的准确性检验
准确称取0g(t1)、0.4g(t2)、1g(t3)、2g(t4)平菇菌丝与4g培养料混匀制备平菇菌糠,称取0.2g混匀后的培养料提取基因组dna。按照前述方法进行荧光定量pcr扩增。将各样品phos基因的ct值依次代入phos基因标准曲线中计算出phos基因的拷贝数,进一步将phos基因拷贝数代入dna拷贝数-菌丝生物量标准曲线中,计算平菇菌糠中平菇菌丝干重,与实际平菇菌丝干重作对比(图7)。
利用本发明建立的phos基因绝对荧光定量标准曲线和平菇菌丝dna拷贝数-生物量标准曲线计算得到的平菇菌丝干重与实际平菇菌丝干重间存在正相关,由此可见,本发明建立的精确定量袋栽平菇菌丝生物量的方法具有很高的准确性,可广泛应用于平菇生产中。与传统的测定菌丝dna浓度、蛋白浓度等方法相比,本发明建立的平菇菌丝定量方法可消除培养料dna以及其它微生物dna的干扰,能够准确定量平菇菌丝的生物量。
7平菇菌丝dna拷贝数与生物量之间标准曲线的应用
(1)料袋制作
1)按照配方比例准确称取棉籽壳、麦麸,翻拌均匀;
2)根据配方准确称取二水磷酸氢二钠和十二水磷酸二氢钠,将其加入称好的温水中,搅拌溶解;
3)将溶解的磷酸盐溶液加至棉籽壳和麦麸混合样品中,翻拌均匀;
4)将培养料装入22cm×36cm×0.004cm的聚丙烯折角袋中,套环封口;
5)100℃常压灭菌16h;
6)料袋冷却后,无菌条件下,一端接入平菇固体菌种,菌种封面;
7)将菌袋搬至25℃培养室,培养至某一处理组菌丝长至半袋。
(2)菌丝长势定性分析
在距离菌丝尖端1cm处摆开菌袋,拍照记录横截面菌丝长势。
(3)菌丝基因组dna提取
1)将有菌丝端培养料揉碎,随机称取5g;
2)液氮速冻后研磨成粉末;
3)准确称取0.2g粉末至离心管中,利用ctab法提取基因组dna。
(4)培养料中平菇菌丝生物量定量
1)利用grtphos-f/grtphos-r引物测定各样品中的phos基因ct值;
2)将ct值带入phos基因绝对荧光定量标准曲线中,计算得到log10(拷贝数);
3)进一步计算出dna拷贝数;
4)将dna拷贝数代入平菇菌丝dna拷贝数-生物量标准曲线中,计算得到平菇菌丝干重;
5)培养料干重占比计算:准确称取100g培养料放入65℃烘箱中烘干至恒重,称量培养料干重,计算干重占比;
6)利用培养料干重对各处理组平菇菌丝生物量归一化,以消除培养料含水量不同造成的误差,最终求得菌丝干重(mg/g干料)(图8)。
利用本发明建立的phos基因绝对荧光定量标准曲线和平菇菌丝dna拷贝数-生物量标准曲线计算得到的平菇菌丝干重与定性观察的平菇菌丝长势间存在正相关,由此可见,本发明建立的精确定量袋栽平菇菌丝生物量的方法具有很高的准确性,可广泛应用于平菇生产中。与传统的测定菌丝dna浓度、蛋白浓度等方法相比,本发明建立的平菇菌丝定量方法可消除培养料dna以及其它微生物dna的干扰,能够准确定量平菇菌丝的生物量。
另外,本发明分别构建了平菇菌丝dna拷贝数与生物量之间的大范围标准曲线(图5)和小范围标准曲线(图6),可根据实际测得的dna拷贝数大小,选择适合的标准曲线计算平菇菌丝生物量。
序列表
<110>河南农业大学
<120>一种精确定量袋栽平菇菌丝生物量的方法及其应用
<141>2021-03-05
<160>1
<170>siposequencelisting1.0
<210>1
<211>1003
<212>dna
<213>平菇(pleurotusostreatus)
<400>1
ggtgatagtattgatcggcgttattggcggtagcggcctgtatcacttggataacttgtc60
gatcgtgtaagtgagcgatttatgttgctgcccgcggttactgattttgaatgataggaa120
ggaagtcaatccagagactgtacggtctcgcccctttatctgaatggctggctggctgac180
cctcgattagccctggggcttcccaagctctccgatcatcatctgtgccctcccttctgg240
caccaaagtcgctttcctcgcgcgacatgggcagggacacatccacgcaccgtctgccgt300
gccagctcgcgcaaatatcgcagcgttcaagtccctcggcgtgcgcgcgatcttggcctt360
ctcagcggtgggctccttgcgcgaggaaatatccccaggatcctttgtcctcccatcgca420
aatcatcgatcgcaccaagggcgtgcgcccggcgagcttcttcgaggggaccagcatcgt480
ggcccacgctgcgtttggcgatccgttcagcaacaaattggtgcattggctggagagccg540
cgtgcagaaggcgttggatgcggagggacgcggtgtgcagctattcactgggaagacgat600
cgtctgcatggagggacctcagttctctacgagagcagagagcattatgtaccgccagtg660
gggaggggacttgattaacatgagcgtcctccctgaagcaaagctggctcgcgaggccga720
gttgaggtacgtctttcttctcgtatggtctccttcgggtgctcagcagtgtcgtagcta780
cgcgcttgtagccaccgctacggactacgattcgtggcgcccccaatctgaggcggtcac840
agcgatggaggtgttcaaaacattgcaggcaaacgctgacacatcgcgccatgtctgcgc900
tacgattctcgacgagctgcatgaagccgtcgacaataacgctgcctcggaagatgccga960
tatcttatgtgaggaagtgggttccatgaagttctcgatcatg1003
- 还没有人留言评论。精彩留言会获得点赞!