一种玉米赤霉烯酮模拟抗原表位及其应用的制作方法
本发明涉及生物技术领域,特别是涉及一种玉米赤霉烯酮模拟抗原表位及其应用。
背景技术:
随着国家经济发展水平的提高,食品安全问题也越来越多地被人们所关注,霉菌污染是造成食品安全问题的一个重要因素。霉菌毒素主要通过谷物作物以及经过加工的农副产品进入人和动物体内,引起人和动物的中毒症状,其中对生殖系统以及内分泌系统等造成的伤害最为严重,摄入过量将会造成生命危险,给人类以及动物的健康造成一定的危害。
目前已经鉴定出的霉菌毒素已经超过了300种,较为常见的主要有6种,分别为黄曲霉毒素(aflatoxin,aft)、赭曲霉毒素(ochratoxin,ot)、玉米赤霉烯酮(zearalenone,zen)、t-2毒素(trichothecenes,ts)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,don)以及伏马毒素(fumonisins,fb)。其中zen对粮食作物的污染情况较为严重,zen是由镰刀菌种产生的一种有强雌激素效应的真菌毒素,普遍存在于受污染的谷物和谷物产品中。zen具有强毒性,对生殖系统、内分泌系统以及免疫系统有很大的危害,严重时可能导致肿瘤的发生,对人类和动物的健康造成潜在的危害。因此需要采取有效的措施来预防和消除zen的毒性作用,并建立一种安全无毒的方法来检测zen的残留。
使用化学方法合成抗原的过程中避免不了毒素分子的使用,毒素标准品价格十分昂贵而且容易对实验人员的健康构成威胁。相比较而言,利用噬菌体展示技术筛选模拟表位来代替化学合成的抗原,在实验研究中具有很大的优势。在噬菌体展示技术的基础上创建噬菌体展示随机肽库技术,通过生物淘选过程,可以获得能识别靶标的模拟表位序列,抗原表位通过结合到相应抗原受体上从而引起机体产生针对抗原的抗体。
技术实现要素:
本发明的目的是提供一种玉米赤霉烯酮模拟抗原表位及其应用,以解决上述现有技术存在的问题,基于模拟抗原表位建立的直接竞争荧光免疫分析方法用于检测zen,具有低毒性、成本低且灵敏度高的优点。
为实现上述目的,本发明提供了如下方案:
本发明提供一种玉米赤霉烯酮的模拟抗原表位,其氨基酸序列为:hlnlniyitqkh(seqidno:1)、atlhsahrsthv(seqidno:2)和aeawtgfsasgv(seqidno:3)。
本发明还提供一种编码所述的玉米赤霉烯酮的模拟抗原表位的核苷酸。
优选的是,其序列如seqidno:4-seqidno:6所示。
本发明还提供一种抗体,其利用展示有所述的模拟抗原表位序列或者所述的核苷酸序列的噬菌体克隆免疫小鼠产生。
本发明还提供一种基于所述的模拟抗原表位或者所述的核苷酸检测玉米赤霉烯酮的方法,其特征在于,包括以量子点为荧光染料制备荧光探针,通过直接竞争荧光免疫分析方法检测玉米赤霉烯酮的步骤。
本发明还提供一种基于所述的模拟抗原表位或者所述的核苷酸在检测玉米赤霉烯酮中的应用。
优选的是,应用所述的方法检测所述玉米赤霉烯酮含量。
本发明公开了以下技术效果:
本发明以4d7mab为配基,对噬菌体展示随机十二肽库进行4轮的亲和淘选、噬菌斑的扩增和纯化以及zen模拟表位的鉴定等,对玉米赤霉烯酮抗原表位进行了深入研究,得到了zen的模拟抗原表位,其中3个出现频率较高模拟抗原表位的ic50值分别为0.918ng/ml、1.972ng/ml以及1.29ng/ml。
利用本发明的模拟抗原表位建立了一种直接竞争荧光免疫分析方法用于检测zen。以本发明的模拟抗原表位为基础建立的直接竞争荧光免疫分析方法检测zen,通过线性方程计算出其ic50值为0.158ng/ml。与未使用qds作为荧光标记物的p-elisa相比,p-flisa(phagefluorescence-linkedimmunosorbentassay,p-flisa)灵敏度有了很大的提高。因此,本发明基于噬菌体肽库淘选的zen模拟抗原表位,对于预防和消除zen的毒性作用提供了新的方向和方法。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为elisa鉴定噬菌体克隆;
图2为阳性噬菌体克隆z8,z21和z35的竞争抑制曲线,(a)z8标准曲线;(b)z21标准曲线;(c)z35标准曲线;b/b0值代表抑制率,b是指存在zen标准品溶液时的od450值;b0是不含zen标准品溶液时的od450值;
图3为血清样品中抗体的效价;
图4为血清样品中抗体的敏感性;
图5为sds-page鉴定结果;
图6为琼脂糖凝胶电泳图;
图7为qds和qds-mab荧光光谱图;
图8为p-elisa与p-flisa标准曲线,(a)p-elisa标准曲线;(b)p-flisa标准曲线;f/f0代表抑制率,f为在有zen标准品溶液时的荧光值(去除空白孔后的荧光值),f0为无zen标准品溶液时的荧光值(去除空白孔后的荧光值);
图9为玉米赤霉烯酮的单克隆抗体的sds-page鉴定;其中,linem为标准分子量marker;line1为纯化前腹水;line2为纯化后igg;
图10为抗zen单克隆抗体的效价测定结果。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本申请说明书和实施例仅是示例性的。
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
实施例1玉米赤霉烯酮模拟表位的淘选
本发明以4d7mab为配基,对噬菌体展示随机十二肽库进行4轮的亲和淘选过程,经phage-elisa和间接竞争elisa鉴定后获得能与靶分子有较高结合力的噬菌体,测序后得到插入的氨基酸序列(即模拟表位)。
1.抗zen单克隆抗体的制备
分别采用肟化法合成免疫原玉米赤霉烯酮完全抗原zen-bsa和完全抗原ota-bsa作为免疫原;经紫外扫描及sds-page电泳进行鉴定后使用。
分别选择zen-bsa作为免疫原,采取皮下多点注射的方式免疫6~8周龄的雌性balb/c小鼠,免疫剂量为30μg/只;首免时免疫原与弗氏完全佐剂混合乳化;加强免疫与弗氏不完全佐剂混合乳化;免疫间隔为14天,四免后剪尾采血,间接elisa测定免疫小鼠血清效价,竞争elisa测定免疫鼠多抗血清的敏感性(ic50);选取敏感性最好的免疫小鼠脾脏进行细胞融合,3~5轮亚克隆制备阳性杂交瘤细胞株,体内诱生腹水分别制备得到抗zen单克隆抗体maba1(4d7),保存备用。
结果显示:用narodrop2000c分光光度计测得抗zen单抗的浓度为4.12mg/ml。纯化效果如图9所示,一条为重链带约为50kda,另一条为轻链带约为25kda。抗zen单抗的效价为1:5.12×105(图10),
2.腹水的制备与纯化
复苏上述制备的分泌抗zen单克隆抗体的杂交瘤细胞系4d7,对细胞上清进行检测以确保其单克隆来源。在两只12周龄的经产balb/c小鼠腹腔内注射500μl石蜡进行预处理,一周后经腹腔注射1.0×107个杂交瘤细胞。通过辛酸-硫酸铵方法对收集的腹水进行纯化,利用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodiumdodecylsulfate-polyacrylamidegelelectrophoresis,sds-page)对腹水纯化的效果进行鉴定。使用考马斯亮蓝蛋白浓度试剂盒对纯化后的腹水的浓度进行测定。用常规的elisa方法对单克隆抗体的效价以及敏感性进行分析,具体步骤如下:
在96孔微孔板上每孔包被2μgzen-ova(100μl/孔),在4℃孵育过夜;
次日,去除包被液,用pbst清洗板孔3次,每孔加入用pbst稀释的5%猪血清溶液,在37℃封闭2h;
除去封闭溶液后,将zen标准品溶液用pbs进行倍比稀释,然后添加到孔中,随后每孔中加入等体积的4d7mab溶液,然后在37℃恒温培养箱中竞争反应1h;
用pbst洗涤板孔,洗去未与包被原结合的4d7mab溶液,拍干后加入经过稀释的羊抗鼠igg,37℃反应1h;
配制tmb显色液,混合底物a液和b液后加入板孔中室温避光进行显色(100μl/孔),反应进行约8min;
最后,每孔中添加100μl2mol/lh2so4进行终止,用自动elisa读数仪(thermo,usa)确定450nm处的吸光度值,建立标准抑制曲线。
3.zen模拟表位的淘选
本发明采用固相亲和淘选法,以4d7mab为靶标,对随机十二肽库进行筛选,鉴定能与4d7mab特异性结合的噬菌体,淘选过程共进行四轮。
3.1zen模拟表位的第一轮生物淘选
(1)用na2hco3包被缓冲液稀释纯化后的4d7mab至100μg/ml。每孔150μl加入到酶联反应板中,4℃孵育12h;
(2)弃去未与板底结合的4d7mab,用tbst(含0.1%tween-20的tbs)缓冲液洗涤微孔板3次,排干后加入封阻缓冲液(200μl/孔),在恒温培养箱中封阻2h;
(3)封闭结束后使用tbst清洗板孔6次,排干后加入经tbst稀释的原始噬菌体十二肽库(2×1011pfu/ml),每孔100μl加入到微孔板中,室温下用水平摇床温和摇动1h;
(4)弃去板孔中未结合的肽库溶液,用tbst清洗板孔10次,彻底洗去未结合的噬菌体肽库溶液;
(5)加入洗脱缓冲液(100μl/孔)将能与4d7mab结合的噬菌体进行洗脱。室温下在水平摇床上震荡15min左右,随后用移液器反复吹打板孔数次,然后用移液器将洗脱下来的溶液吸取到1.5ml的离心管中;
(6)在洗脱下来的溶液中添加15μltris-hcl溶液进行中和;
(7)留取10μl中和后的洗脱缓冲液用于噬菌体滴度的确定,剩余部分全都用于噬菌体洗脱产物的扩增和纯化。
3.2噬菌体的扩增和纯化
(1)用lb-tet平板对er2738菌种划线接种在37℃培养箱中培养12h,次日将平板取出4℃保存,存放时间最好不要超过两周,避免抗生素失效;
(2)在过夜培养的平板上随机挑选单个菌落到含tet抗性的培养基内,在37℃水平摇床中培养12-14h;
(3)次日将200μl过夜培养的菌液加入到含有tet的20mllb培养基中,进行菌种的二次活化,摇床培养至对数生长前期;
(4)将第一轮洗脱下来的噬菌体(洗脱产物)加入od600值到达0.5的er2738菌液中,220r/min,37℃培养5.5h左右;
(5)将震荡培养后的噬菌体扩增产物,4℃、11000r/min离心8min,先将细菌细胞沉降,随后将上清液转到另一个50ml的离心管中,加入3.5ml的peg/nacl溶液,震荡混匀后4℃过夜,目的是为了沉降噬菌体;
(6)第二天,将过夜沉降的培养基在4℃条件下,12000r/min离心15min,弃去上清;
(7)用1ml的tbs溶液将沉淀的噬菌体重悬,随后转移至新的1.5ml离心管内,加入165μl的peg/nacl溶液,冰孵2.5h;
(8)冰孵后将重悬液以12000r/min离心15min,加入200μl的tbs缓冲液重悬沉淀,短暂离心20s以沉淀未溶解的物质,收取上清液到另一个离心管里。这时即得到噬菌体的扩增产物,长期保存应以1:1的比例加入灭菌后的甘油,储存于-20℃。
3.3噬菌体洗脱与扩增产物的滴度测定
(1)在划线接种的er2738平板上挑取单个菌落至lb-tet培养基,37℃、220r/min培养至菌液od600值到达0.5左右;
(2)将提前制备好的lb/iptg/x-gal平板在37℃恒温培养箱中进行预温并将配制好的上层琼脂在55℃的水浴锅中保温;
(3)使用液体培养基对噬菌体的洗脱产物以及扩增产物进行稀释,洗脱和扩增产物分别稀释至101-104和108-1011倍;
(4)把处于对数生长期的er2738菌液分每等份90μl于灭菌的离心管中,然后加入10μl提前稀释好的噬菌体溶液,用移液器吹打数次使混合均匀,在37℃培养箱中孵育3-5min;
(5)将预温的上层琼脂取出,每等份5ml于10ml离心管中,随后加入孵育过的噬菌体,上下翻转混合均匀,快速平摊在lb/iptg/x-gal平板上。在培养箱中过夜培养;
(6)次日,对过夜培养的平板上出现的蓝色噬菌斑进行计数,根据公式:噬菌体滴度(pfu/ml)=噬菌斑个数/(10μl×10-3)×噬菌体稀释倍数,得到噬菌体洗脱产物与扩增产物的富集情况。
3.4zen模拟表位第二至第四轮淘选
第二、三和四轮的淘选过程与第一轮类似,除了将第一轮淘选时加入的原始噬菌体十二肽库变成上一轮的扩增产物之外,其余步骤均未发生改变。为了淘选到与靶分子有较高亲和力的噬菌体,每轮包被4d7mab的浓度逐渐减少,第二、三和四轮的包被浓度依次为75μg/ml、50μg/ml和25μg/ml;tbst中tween-20的含量在逐轮增加,第二、三和四轮分别为0.2%、0.3%和0.5%。最后一轮洗脱下来的噬菌体不再进行扩增,直接对洗脱产物的滴度进行测定。
3.5噬菌斑的扩增和纯化
噬菌斑的扩增与纯化,其与噬菌体的扩增纯化步骤类似:
(1)在划线接种的er2738平板上挑取单个菌落至lb-tet培养基,37℃、220r/min培养至er2738菌液od600值到达0.5左右;
(2)次日,用移液器吸取10μl菌液加入到990μl的lb-tet液体培养基中,然后在最后一轮洗脱下来的噬菌体的滴度测定平板上随机选取单个的噬菌斑加入上述的液体培养基内;
(3)将加入有噬菌斑克隆的lb-tet培养基在37℃水平摇床中培养5.5h;
(4)10000r/min短暂离心30s,用电动移液器将上清转移到另一个1.5ml管中,得到了噬菌体储液。长期保存应加入等量的甘油,-20℃储存;
(5)取10μl储液加入至er2738菌液(od600值为0.4-0.5)中,37℃、220r/min培养5.5h;
(6)最后重悬得到的即为扩增纯化后的噬菌体产物。
4.zen模拟表位的鉴定
4.1phage-elisa鉴定阳性噬菌体克隆
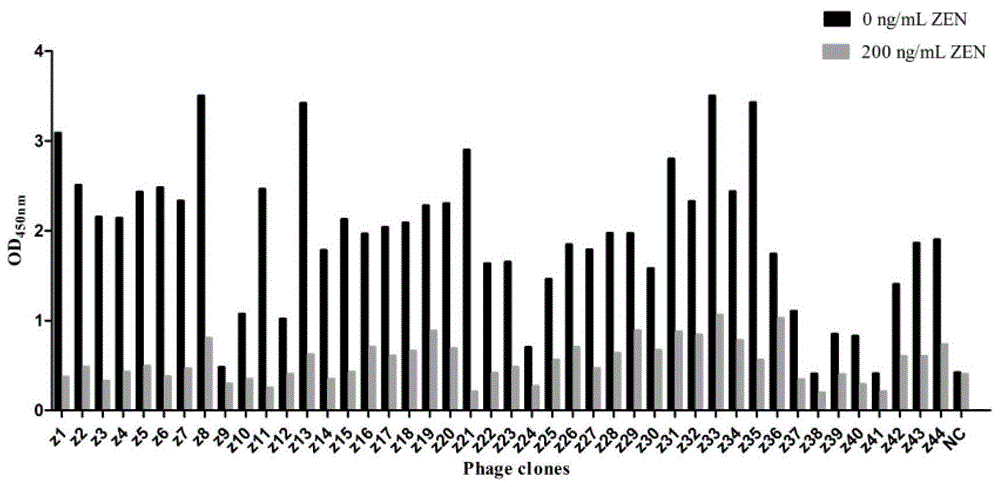
从第四轮生物淘选测定滴度的平皿上随机选择44个噬菌斑克隆,通过噬菌体elisa初步确定了单个噬菌体克隆与4d7mab的结合能力。
(1)用nahco3缓冲液稀释4d7mab使终浓度为10μg/ml,包被在微孔板(100μl/孔)中,随后将微孔板于4℃孵育12h;
(2)pbst洗涤板孔3次,随后加入200μl经pbst稀释后的5%猪血清封闭液,37℃恒温箱中封闭2h;
(3)去除封闭液后,将扩增纯化后的单个克隆添加到板孔中(1×109pfu/孔),37℃下孵育1h;
(4)用tbst洗涤5次后,加入hrp偶联的抗m13mab(1:5000的稀释度)并在37℃下孵育1h;
(5)用tbst洗涤板孔7次。将tmb显色底物添加到孔中(100μl/孔),避光显色5min;
(6)最后,使用2mol/lh2so4溶液(100μl/孔),终止显色反应。用自动elisa读数器测定波长在450nm处的od值。
4.2间接竞争elisa确定噬菌体克隆的特异性
将zen标准品稀释液(200ng/ml)和等量的阳性噬菌体(1×109pfu/孔)加入包被有4d7mab的酶标板中,37℃竞争反应1h;
弃去孔中液体用tbst洗涤板孔5次,每孔加入100μl稀释过的hrp标记的抗m13mab,37℃反应1h;
用tbst洗涤板孔7次,将tmb显色底物添加到板孔内(100μl/孔),避光显色5min;
最后,使用2mol/lh2so4溶液(100μl/孔),终止显色反应。用自动elisa读数器测定波长在450nm处的od值。对存在和不存在zen标准品溶液时的od值表现出相当大差异的克隆,认为是阳性噬菌体克隆,随后对这些阳性克隆进行测序。
4.3阳性噬菌体克隆的序列分析
扩增阳性噬菌体克隆并用于信号链dna分离。取50μl扩增后的噬菌体,使用-96giii测序引物(5'-hoccctcatagttagcgtaacg-3')对信号链dna进行测序,在天津金唯智生物科技公司进行整个测序过程。将测序得到的dna序列经过噬菌体简易遗传密码表翻译出噬菌体展示肽的氨基酸残基序列。
整个亲和淘选过程共进行了4轮,4d7mab包被浓度随着淘选轮数逐渐降低,tbst中tween-20的含量随着淘选轮数而逐渐增加。通过投入的噬菌体的量与产出的噬菌体的量之比获得噬菌体的回收率。
淘选结果如表1所示,可以看出每一轮的回收比率均有所提高。噬菌体产出量从5×103pfu/ml提高至1.1×107pfu/ml,回收率从2.5×10-8提高至5.5×10-5,可以看出特异性噬菌体富集较为明显。与前三轮的回收率相比,第四轮回收率增加相对减半,这说明富集可能正在趋于饱和。
表1噬菌体富集情况
从第四轮洗脱产物测定滴度的平皿上挑选出44个蓝色的噬菌斑,并用于感染大肠杆菌er2738进行噬菌体扩增和纯化,44个噬菌体克隆依次命名为z1-z44。通过phage-elisa对这些噬菌体克隆进行初步鉴定。
如图1所示,结果表明44个噬菌体克隆中有38个能够与4d7mab结合。随后通过间接竞争elisa实验进一步验证这些与4d7mab有较高亲和力的噬菌体,发现均能被zen标准品溶液不同程度地抑制,表明这些噬菌体在体外可以被4d7mab特异性识别,随后将鉴定得到的38个阳性噬菌体克隆用于dna测序。
表2列出了测序得到的阳性噬菌体克隆的dna序列以及通过遗传密码表翻译后得到的插入序列。可以看出38个阳性克隆共展示了6个不同的十二肽序列。从表2中可以看出,噬菌体克隆展示的氨基酸序列为hlnlniyitqkh和aeawtgfsasgv的个数最多,分别为15个和13个。其次是atlhsahrsthv,共计有7个噬菌体克隆展示该序列。序列yppfymegflge,sarevmllgdrt和hpnlniyitqkh仅有一个噬菌体克隆所展示。
表2阳性噬菌体克隆的核苷酸和氨基酸序列
对出现频率较高的三个噬菌体克隆z8、z21和z35绘制其竞争抑制曲线。结果如图2所示,通过线性方程可以计算出z8、z21和z35的ic50值分别为0.918ng/ml、1.972ng/ml和1.29ng/ml。结果表明了zen对噬菌体z8、z21和z35有较好的抑制作用并且呈浓度依赖性。初步确定z8、z21和z35展示的序列是zen的模拟表位。
实施例2玉米赤霉烯酮模拟表位的免疫原性分析
zen是小分子化合物,如果单独作为抗原免疫动物不能使机体产生足够的免疫反应,必须要和载体蛋白偶连后免疫动物。但是,化学合成的抗原可能在体内解离并释放有毒分子,对动物和人类健康构成高风险,并且zen毒素的标准品价格昂贵。有报道表明afb1模拟表位可代替人工抗原在小鼠体内引起免疫反应。目前尚未有关于zen模拟表位免疫原性的研究,这对于发展真菌毒素的免疫学防控方法非常重要。
1.展示有模拟表位序列的噬菌体克隆免疫小鼠
为了鉴定淘选得到的模拟表位的免疫原性,将balb/c小鼠(8-12周龄)随机分为6个小组,每组6只。第1-3组的小鼠分别免疫1×1012pfu的z8、z21和z35三种不同的阳性噬菌体克隆;第4组注射1×1012pfu的以1:1:1混合的三个阳性噬菌体克隆的混合物;第5组免疫化学合成抗原zen-bsa作为阳性对照,每只小鼠用100μl弗氏佐剂与50μg的zen-bsa进行乳化后用于免疫;第6组为阴性对照组,接种1×1012pfu剂量的野生型m13噬菌体。所有实验组动物均采用背部皮下多点的方法进行免疫。首次免疫后的第二周以及第四周进行两次加强免疫。首次免疫后的第五周从小鼠尾静脉收集血液用以制备血清样品,然后在-70℃下保存,用于测定小鼠体内是否产生了特异性抗体。
2.elisa测定小鼠体内产生的特异性抗体
2.1间接elisa测定小鼠血清中的抗体效价
首先通过间接elisa检测小鼠血清中产生的抗体,具体步骤如下:
(1)用cbs包被缓冲液稀释zen-ova,使终浓度为2μg/ml,随后每孔100μl加入到微孔板中,4℃包被12h;
(2)次日,用pbst洗涤板孔3次,去除多余包被液,将板孔用5%猪血清封闭缓冲液(200μl/孔)在37℃恒温培养箱中封闭2h;
(3)弃去封闭液,将血清样品用pbs进行稀释,然后添加到每个孔中(100μl/孔),将微孔板在37℃恒温培养箱反应1h;
(4)弃去未结合的血清样品,将板孔用pbst清洗5次,拍干,将经过稀释的hrp标记的羊抗鼠igg添加到板孔中,37℃恒温箱反应1h;
(5)pbst洗涤板孔7次,配置tmb显色液,混合底物a液和b液后加入板孔中室温避光进行显色(100μl/孔),反应进行约8min;
(6)最后,每孔中添加100μl的2mol/lh2so4进行终止,用自动elisa读数仪(thermo,usa)确定450nm处的吸光度值。
2.2间接竞争elisa测定小鼠血清样品中抗体的敏感性
为了进一步鉴定淘选到的模拟表位的免疫原性,用间接竞争elisa对血清样品进行鉴定。具体步骤如下:
在96孔微孔板中加入100μl用cbs稀释后的zen-ova(2μg/ml),4℃条件下过夜包被;
次日,用pbst洗涤板孔3次,去除多余包被液,将板孔用pbst稀释后的5%猪血清(200μl/孔)封闭2h;
除去封闭溶液后,将zen标准品溶液(2000ng/ml,500ng/ml,200ng/ml,50ng/ml)添加到孔中(100μl/孔),然后向每孔中加入等体积的小鼠血清,37℃反应1h;
弃去孔中剩余液体,用pbst清洗板孔5次,将稀释过的hrp标记的羊抗鼠igg加入到板孔中(100μl/孔),37℃孵育1h;
经pbst洗涤板孔7次后,加入tmb显色底物(100μl/孔),避光反应8min,随后用2mol/lh2so4(100μl/孔)终止反应,用自动elisa读数仪(thermo,usa)确定在450nm处的吸光度值。
用实施例1鉴定得到的阳性噬菌体克隆免疫balb/c小鼠,每个噬菌体克隆均显示出单一的氨基酸序列。balb/c小鼠随机分布在六组中(每组六只小鼠),每组用不同的免疫原进行免疫。三免一周后采集小鼠血清用以制备血清样本,先用间接elisa测定小鼠血清样品中抗体效价,所测的效价结果如图3所示。测得在首次免疫后的第35天,各个免疫组的血清样品中zen抗体的效价分别为1:3200(z8)、1:3200(z21)、1:6400(z35)以及1:6400(1:1:1混合的z8、z21和z35),免疫zen-bsa的小鼠产生了高滴度的zen抗体,免疫原始噬菌体肽库组的小鼠未检测到zen特异性抗体,这表明淘选得到的模拟表位都具有不同水平的免疫原性,并且具有免疫原性是由于噬菌体所插入的模拟表位序列,而不是由于噬菌体的组分。
使用间接竞争elisa检测血清样品中抗体的敏感性,进一步验证所淘选的模拟表位的免疫原性。结果如图4所示,在该实验中,zen-bsa免疫组小鼠和所有噬菌体免疫组小鼠的血清在zen标准品溶液存在时的od450值均低于无zen标准品溶液时的od450值,并且随着zen标准品溶液浓度的变化而变化,从中可以得出zen标准品溶液可以明显抑制实验组血清抗体与zen-ova的结合,血清样品中存在zen特异性抗体,其中模拟表位z8组抑制效果最好。
实施例3基于噬菌体模拟表位z8的荧光免疫分析方法的建立
zen是一种真菌毒素,广泛分布于食品和环境中,对人类和动物健康构成严重威胁。建立快速、灵敏的检测真菌毒素方法对食品安全检测非常重要。免疫分析方法是目前较为常用的用于检测zen污染的一种分析方法,在这个基础上开发了以量子点作为荧光标记染料的荧光免疫分析法,节省了elisa中酶与底物的作用时间。
1.量子点与单克隆抗体的偶连
采用碳二亚胺法将量子点与单克隆抗体进行偶连制备荧光探针,其原理是首先活化量子点上的羧基位点,然后与单克隆抗体的氨基共价结合形成酰胺键。具体步骤如下:
(1)12.5μl的羧基水溶性量子点(8μm)与38.3μledc(1mg/ml)溶液,25℃、220r/min反应30min;
(2)加入36.6μl4d7mab,25℃、220r/min反应3h;
(3)补加pb缓冲液至250μl,放于4℃备用。
2.荧光探针的鉴定
2.1sds-page对荧光探针进行鉴定
首先用sds-page验证量子点与单克隆抗体是否偶连成功。分别取2.5μlqds和qds-mab,加入7.5μl的1×pbs中吹打数次使混合均匀,分别加入加样孔中,120v、30min,电泳结束后,在凝胶成像仪中观察结果。
2.2琼脂糖凝胶对荧光探针进行鉴定
qds-mab是否成功偶连还可以通过琼脂糖凝胶来验证。制备好凝胶放在电泳槽内,分别加入2.5μlqds和qds-mab至加样孔中,100v、20min,通过凝胶成像仪进行观察结果。
2.3荧光光谱的鉴定
用荧光光谱法对qds-mab进行荧光图谱鉴定。将qds-mab和qds稀释至一定的倍数,加入到黑色不透明酶标反应板内(100μl/孔),在激发波长为450nm,扫描范围为540nm-680nm内对样品进行荧光图谱鉴定。
3.噬菌体包被浓度与qds-mab的稀释倍数
采用棋盘法对噬菌体最佳包被浓度与qds-mab的最佳稀释倍数进行研究,噬菌体包被浓度分别为8×1011pfu/ml、4×1011pfu/ml、2×1011pfu/ml以及1×1011pfu/ml;qds-mab的稀释比例分别为1:25、1:50、1:100、1:200。具体步骤如下:
(1)将稀释后的噬菌体(100μl/孔)加入到黑色酶标反应板中,4℃过夜;
(2)弃去包被液并用pbst轻轻的洗涤板孔3次,每孔200μl加入5%的猪血清,37℃恒温箱封闭2h;
(3)pbst清洗3次,加入稀释后的qds-mab,37℃,反应1.5h;
(4)反应结束后用pbst洗涤板孔3次,拍干后加入pbs(100μl/孔),另外设置三个仅加入pbs的空白孔,用于去除背景荧光的影响,在450nm激发波长下读取荧光值。
4.p-elisa的标准曲线的建立
用噬菌体模拟表位z8代替化学合成抗原进行传统elisa的研究,建立其标准曲线。具体步骤如下:
用cbs包被缓冲液对噬菌体进行稀释,使其终浓度为2×1011pfu/ml,每孔100μl加入到酶联反应板中,4℃反应12h;
pbst清洗板孔3次,加入5%的猪血清溶液(200μl/孔),37℃下封闭2h;
弃去封闭液,加入梯度稀释的标准品溶液以及4d7mab,37℃下竞争反应1h;
pbst洗涤板孔5次,每孔加入100μl的hrp标记的羊抗鼠,37℃反应1h;
pbst清洗板孔7次,配置tmb显色液(1:1混合均匀的a液和b液),每孔100μl加入到酶标板中,黑暗避光反应8min;
用2mol/lh2so4进行终止,用elisa自动读数仪测定在450nm处的吸光值;
p-elisa标准曲线的建立。以zen标准品溶液的浓度的对数值作横坐标,以b/b0的值作为纵坐标,建立标准曲线,通过线性方程计算出ic50值。b/b0代表抑制率。b是zen标准品溶液存在时的od450值;b0是不含zen标准品时的od450值。
5.p-flisa的标准曲线的建立
随后建立了基于模拟表位的直接竞争荧光免疫分析方法,与p-elisa相比,将量子点与单克隆抗体偶连制备荧光探针用于免疫分析,省去了酶与底物的反应时间。p-flisa的主要原理是包被的噬菌体与毒素标准品溶液竞争结合荧光探针,然后根据荧光值建立标准抑制曲线,具体操作步骤如下:
(1)用cbs缓冲液将噬菌体稀释至终浓度为2×1011pfu/ml,加入到黑色不透明微孔板中(100μl/孔),4℃孵育12h;
(2)pbst清洗板孔,随后向孔中加入200μl的5%的猪血清溶液,37℃下封闭2h;
(3)去除封闭液,加入梯度稀释的zen标准品和等量的qds-mab(1:50稀释),37℃反应1h;
(4)pbst轻轻清洗板孔3次,排干后加入过滤除菌后的pbs缓冲液(100μl/孔),另外设置3个空白孔作为对照以去除背景荧光,测量在激发波长为450nm,发射波长为610nm时板孔的荧光值;
(5)以f/f0为纵坐标,以zen标准品溶液的浓度的对数值作为横坐标建立标准曲线。f为在有zen标准品溶液时的荧光值(去除空白孔后的荧光值),f0为无zen标准品溶液时的荧光值(去除空白孔后的荧光值),通过线性方程计算出ic50值。
偶连成功的qds-mab的分子质量与单一的qds相比,分子质量更大,携带的电荷更多,所以在电泳中迁移较慢。
6、结果与分析
sds-page结果如图5所示,从图中可以看出,与单一的qds相比,qds-mab有明显滞后现象,表明量子点和抗体偶连成功。
琼脂糖凝胶验证结果如图6所示,相对于qds泳道来说,qds-mab泳动速度较慢,并且有轻微的弥散现象,表明量子点与单克隆抗体偶连成功。
随后对qds-mab荧光图谱进行了鉴定。如图7所示,在激发波长为450nm,扫描波长为540nm-680nm时,单一的量子点与偶连后的qds-mab最大发射波长均在610nm处,这说明偶连前后的最大发射波长没有发生改变,但与qds相比,qds-mab的荧光强度相对较弱,这可能是由于在偶连的过程中,量子点发生了轻微的荧光猝灭造成了一定的荧光损失。
用棋盘法测定了噬菌体的最佳包被浓度以及qds-mab的最佳稀释倍数。结果如表3所示,最终确定在噬菌体包被浓度为2×1011pfu/ml、qds-mab的稀释倍数为1:50时作为研究条件进行后续的实验。
表3棋盘法探索包被浓度和荧光探针稀释倍数
本实施例中先后建立了p-elisa与p-flisa的标准曲线,如图8所示,(a)图为p-elisa的标准曲线,(b)为p-flisa的标准曲线。通过线性方程计算出p-elisa与p-flisa的ic50值分别为1.158ng/ml和0.159ng/ml。从以上结果可以看出,与p-elisa相比,p-flisa的ic50值降低了7倍左右。这种方法不仅节省了酶与底物作用的时间,还在一定程度上提高了检测的灵敏度。表明了量子点作为荧光染料在免疫分析中有较好的应用前景。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
序列表
<110>河南中泽生物工程有限公司
<120>一种玉米赤霉烯酮模拟抗原表位及其应用
<160>6
<170>siposequencelisting1.0
<210>1
<211>12
<212>prt
<213>人工序列(artificialsequence)
<400>1
hisleuasnleuasniletyrilethrglnlyshis
1510
<210>2
<211>12
<212>prt
<213>人工序列(artificialsequence)
<400>2
alathrleuhisseralahisargserthrhisval
1510
<210>3
<211>12
<212>prt
<213>人工序列(artificialsequence)
<400>3
alathrleuhisseralahisargserthrhisval
1510
<210>4
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>4
catctgaatttgaatatttatatvbtacgcagaagcat38
<210>5
<211>36
<212>dna
<213>人工序列(artificialsequence)
<400>5
gcgactcttcattcggctcataggtcgacgcatgtg36
<210>6
<211>36
<212>dna
<213>人工序列(artificialsequence)
<400>6
aacacccgaagcactaaaccccgtccaagcctccgc36
- 还没有人留言评论。精彩留言会获得点赞!