靶向PDCD4的配体小分子在制备抗抑郁药物中的应用
靶向pdcd4的配体小分子在制备抗抑郁药物中的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及以免疫分子为靶点的pdcd4配体小分子化合物、包含所述化合物的药物组合物、药物及其在制备抗抑郁药物中的应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.抑郁症是一种严重危害人类健康的神经退行性疾病,随着社会的发展,生存压力的不断增加,持续慢性刺激而诱导的抑郁症发病率不断升高、发病年龄不断降低。抑郁症已经成为当前我国致残的主要诱因,严重影响人们的工作和生活。
4.20世纪50年代末,单胺氧化酶抑制剂(maoi)和三环类抗抑郁药(tca) 被发现并且成为抑郁症治疗的特效药物,这些药物主要通过抑制胺类神经递质的代谢或阻断神经元的再摄取以此来增加突触间隙神经递质的浓度以维持兴奋性神经信号的传导。然而这两类抗抑郁药都存在显著的毒副作用和严重不良反应,其中包括血压升高、心率失常、记忆障碍内分泌紊乱。第二代抗抑郁药物研究主要集中在调节5-羟色胺和去甲肾上腺素酶单胺系统的转运体和受体,选择性5
‑ꢀ
羟色胺再摄取抑制剂(ssri)、5-羟色胺-去甲肾上腺素再摄取抑制剂(snri)被认为是目前抑郁症治疗的首选药物,然而临床研究发现二代抗抑郁药物只有在数周或者数月的服用后才能使受损神经元产生微妙的改变表现出情绪提升作用,其药效存在严重的滞后性,同时这也意味着单纯增强5-羟色胺能和去甲肾上腺素能神经传递只能延缓并不能从根本上治疗抑郁症。目前特异性抗抑郁靶点的缺乏,是制约抑郁症治疗的主要瓶颈。因此,探索研究高效低副反应的抗抑郁药物具有重要意义。
5.抑郁症的发生受单一或多种复合因素影响,而炎性损伤导致的神经修复障碍和慢性应激(crs)是当今诱导抑郁症发生的易感因素。长期的压力刺激下hpa 轴激活,糖皮质激素表达持续升高,过高的糖皮质激素损伤神经组织诱导组织炎症。与此同时中枢神经系统驻留的免疫细胞(小胶质细胞)活化会分泌促炎性细胞因子在神经中枢营造炎性微环境,进一步损伤神经修复机制,降低神经突触可塑性。目前,关于抑郁症的诱发的分子机制中,“神经营养因子(neurotrophicfactor,nef)假说”最受关注。神经突触可塑性降低是抑郁症发生和发展的重要病理学基础,bdnf(brain-derived neurotrophic factor)是人身体内含量最多的 nef,对于维持神经突触可塑性,促进神经细胞间交流及神经元修复再生发挥重要的作用。临床抑郁症病人的尸检结果显示抑郁症患者海马(hip)及前额皮质 (pfc)中bdnf的含量显著降低,给予以抗抑郁药物干预后患者hip及pfc 中bdnf水平明显回升,并且越来越多的研究表明,经典的抗抑郁药物发挥抗抑郁作用一方面通过维持突触间隙神经递质的浓度保证神经信号的传导,另一方面通过上调bdnf的表达完善神经元损伤修复机制,因此上调抑郁症患者神经系统bdnf的表达水平,是开展抑郁症治疗的理想靶点。采用电刺激(ect)提升脑部bdnf水平的治疗方式目前已经获得fda认可,但目前尚缺乏相关的治疗药
物。
6.细胞程序性死亡-4(programmed cell death-4,pdcd4)是一个重要的调控分子,研究表明pdcd4直接或者间接调控基因组30%基因的表达。发明人前期研究表明pdcd4通过抑制bdnf的表达促进抑郁样行为的产生。1)首先发明人在临床样本与疾病相关性分析中发现,抑郁病人海马组织pdcd4表达显著上调,在crs诱导的抑郁症小鼠中也表现同样的结果;2)动物实验结果显示,pdcd4 敲除小鼠和于海马区特异性沉默pdcd4的表达能够抵抗crs诱导的焦虑和抑郁样行为。3)机制探索中发现,持续的慢性应激刺激会抑制神经细胞mtorc1的活性引发pdcd4的降解通路障碍导致pdcd4的高表达,累积的pdcd4通过竞争性结合eif4a负向调控bdnf表达促进抑郁症的发生。相关成果发表于 molecular psychiatry(if=12.45)。
技术实现要素:
7.针对上述研究背景,发明人认为针对pdcd4开发相应的抑制剂有望实现对抑郁等神经退行性疾病的治疗作用。在前期的工作中,发明人以pdcd4为靶分子,以pdcd4调控bdnf表达的分子机制为理论基础,筛选并且设计了干扰 pdcd4与eif4a结合的多肽,体内实验证明干扰多肽能够缓解抑郁样行为的产生,相关成果已经申请国家专利并获得授权(专利号.zl 2019 1 0421651.0)。基于上述机制的验证,本发明联想到开发相应的小分子化合物抑制剂,具有生产成本低、用药途径丰富等优势,提供更强的市场应用性,对于抗抑郁症的治疗具有重要的意义。
8.基于上述技术目的,本发明针基于pdcd4筛选对于神经退行性疾病具有抑制作用的小分子化合物,经筛选,式ⅰa、式ⅱb两化合物与pdcd4具有中度至高度的结合活性,在体内及体外均能够显著上调神经细胞bdnf的表达,够逆转pdcd4过表达和神经细胞mtorc1失活(抑郁症体外细胞模型)对bdnf 的抑制作用,式ⅱb所示化合物能够上调抑郁症小鼠hip和pfc中bdnf的表达,缓解慢性应激诱导的抑郁样行为。
[0009][0010]
基于本领域常规研究思路,上述化合物进行常规替换、变换或修饰得到化合物也可能表现相同的药物活性,因此,本发明第一方面,提供一种化合物,其选自如式ⅰ或式ⅱ所示的化合物,或其药学上可接受的盐或酯或溶剂化物、互变异构体、内消旋体、外消旋体、立
体异构体、代谢产物或前药;
[0011][0012][0013]
其中,r1为h、c
1-c6烷氧基、c
1-c6烷基或卤素;
[0014]
r2为h、c
1-c6烷氧基、c
1-c6烷基或卤素;
[0015]
r3为h、c
1-c6烷氧基、c
1-c6烷基或卤素;
[0016]
r4为h、c
1-c4烷基或卤素;
[0017]
r为h、c
1-c4烷基或卤素。
[0018]
上述化合物分子量较小,作为一种神经系统用药有望更好的透过血脑屏障,开发成为相应的治疗药物,因此,本发明还提供包含上述化合物的药物组合物、药物及其在治疗pdcd4或bdnf相关疾病中的应用。
[0019]
具体的,本发明提供的药物组合物中,第一方面所述化合物作为活性成分。
[0020]
本发明提供的药物中,第一方面所述化合物和/或第二方面所述药物组合物作为活性成分。
[0021]
在所述应用方面,本发明提供第一方面所述化合物、第二方面所述药物组合物和/或第三方面所述药物在治疗肿瘤、炎症、器官移植排斥、神经退行性疾病、注意力相关疾病或自身免疫性疾病的药物中的应用。
[0022]
除上述药物开发的技术方案,本发明还提供上述药物在疾病治疗及作为研究试剂中的使用方式。
[0023]
所述疾病的治疗方面,本发明提供一种预防和/或治疗神经退行性疾病的方法,包括向有此需要的个体施用第一方面所述的化合物、第二方面所述药物组合物和/或第三方面所述药物。
[0024]
或提供一种预防和/或治疗可通过激动bdnf蛋白抑制pdcd4来预防和/或治疗疾病的方法,其包括向有需要的个体施用第一方面所述的化合物、第二方面所述药物组合物和/或第三方面所述药物。
[0025]
作为研究试剂使用方面,本发明还提供一种激动bdnf蛋白或抑制pdcd4的方法,所述方法包括向有需要的个体使用第一方面所述的化合物、第二方面所述药物组合物和/或
第三方面所述药物。
[0026]
以上一个或多个技术方案的有益效果是:
[0027]
本发明提供的pdcd4配体小分子化合物具备活性高、分子量低,易透过血脑屏障等优势。目前用于抑郁治疗的药物上存在副作用严重或药效滞后的缺陷,本发明提供的小分子化合物有望克服上述缺陷,是一种前景良好的抗神经退行性疾病药物开发活性成分。
附图说明
[0028]
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
[0029]
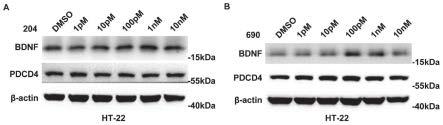
图1为实施例1中所述pdcd4配体小分子对神经细胞bdnf表达的影响;
[0030]
图1a为配体小分子ai-204对海马神经元细胞ht-22中bdnf表达的影响;
[0031]
图1b为配体小分子ag-690对海马神经元细胞ht-22中bdnf表达的影响;
[0032]
图2为配体小分子ai-204对抑郁小鼠海马(hip)和前额叶皮质(pfc)中 bdnf的表达变化;
[0033]
图3为配体小分子ai-204对小鼠抑郁样行为的影响。
具体实施方式
[0034]
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
[0035]
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
[0036]
术语解释:
[0037]
术语“激动剂”意指与受体例如h3组胺受体相互作用并活化所述受体以及引起所述受体的特征性生理学或药理学应答的部分(moiety)。
[0038]
术语“拮抗剂”意指如下部分,所述部分在与激动剂(例如,内源性配体)相同的位点竞争性结合所述受体,但不活化由所述受体的活化形式引起的细胞内应答并可由此抑制由激动剂或部分激动剂引起的细胞内应答。在缺少激动剂或部分激动剂的情况下,拮抗剂不减少基线细胞内应答。
[0039]
术语“施予”意指将所指明的部分放在一起,无论是在体外系统中还是在体内系统中。因此,向有需要的个体中施予本发明化合物,包括向具有pdcd4抑制或bdnf促进需要的个体(优选为人类)给药本发明化合物。
[0040]
当术语“用于治疗”,其意指由护理者(例如就人类而言为医师、护士、从业护士等;就动物(包括非人类哺乳动物)而言为兽医)作出的有关个体或动物需要治疗或将受益于治疗的判断。这种判断基于各种因素而作出,所述因素在护理者的专业知识范围内而且包括有关个体或动物由于可用本发明化合物治疗的疾病、病症或障碍而生病或将要生病的知识。因此,本发明化合物可按保护性或预防性方式来使用;或本发明化合物可用于缓解、抑
制或改善所述疾病、病症或障碍。
[0041]
术语“个体”意指任意动物包括哺乳动物,优选小鼠、大鼠、其它啮齿动物、兔、狗、猫、猪、牛、羊、马或灵长类动物,以及最优选为人类。
[0042]
术语“调节(modulate or modulating)”意指在具体活性、功能或分子的数量、质量、应答或效果方面增加或减少。
[0043]
术语“药物组合物”意指包含至少一种活性成分的组合物,所述活性成分包括但不限于本发明化合物的盐、溶剂化物和水合物,由此所述组合物可在哺乳动物 (例如但不限于人类)中经受得住有关具体有效结果的研究。本领域技术人员应该理解和知晓适于确定活性成分是否基于技术人员需要而具有所需有效结果的技术手段。
[0044]
术语“治疗有效量”意指在组织、系统、动物、个体或人类中引起生物应答或医药应答的活性化合物或药物的量,所述生物应答或医药应答是研究人员、兽医、医师或其他临床医师所寻找的,其包括如下的一种或多种:
[0045]
(1)预防疾病,例如在可能易患所述疾病、病症或障碍但尚未经历或表现出所述疾病的病理或症状的个体中预防所述疾病、病症或障碍;
[0046]
(2)抑制疾病,例如在正在经历或正在表现出所述疾病、病症或障碍的病理学或症状学的个体中抑制所述疾病、病症或障碍(即阻止所述病理和/或症状的进一步发展);和
[0047]
(3)缓解疾病,例如在正在经历或正在表现出所述疾病、病症或障碍的病理学或症状学的个体中缓解所述疾病、病症或障碍(即逆转所述病理和/或症状)。
[0048]
术语“tst”:悬尾实验,tail suspension test。
[0049]
术语“fst”:强迫游泳实验,forced swim test。
[0050]
术语“spt”:糖水偏爱实验,sucrose preference test。
[0051]
正如背景技术所介绍的,bdnf是神经退行性疾病的治疗靶点,但目前尚缺乏能够直接作用于bdnf的用药方式,发明人前期研究证实pdcd4能够抑制 bdnf的表达促进抑郁样行为产生。因此,本发明提供了一种pdcd4的小分子化合物抑制剂,经证实,所述化合物能够上调经元细胞及胶质细胞中bdnf的表达,改善动物模型的抑郁样行为。
[0052]
本发明第一方面,一种化合物,其选自如式ⅰ或式ⅱ所示的化合物,或其药学上可接受的盐或酯或溶剂化物、互变异构体、内消旋体、外消旋体、立体异构体、代谢产物或前药;所述
[0053][0054]
其中,r1为h、c
1-c6烷氧基、c
1-c6烷基或卤素;
[0055]
r2为h、c
1-c6烷氧基、c
1-c6烷基或卤素;
[0056]
r3为h、c
1-c6烷氧基、c
1-c6烷基或卤素;
[0057]
r4为h、c
1-c4烷基或卤素;
[0058]
r为h、c
1-c4烷基或卤素。
[0059]
上述第一方面所述描述的化合物中,所述“c
1-c6烷基”意指含有1至6个碳的直链或支链碳基。一些实施方案是1至5个碳。一些实施方案是1至4个碳。一些实施方案是1至3个碳。一些实施方案是1至2个碳。一些实施方案是1个碳。其实例包括但不限于甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基、叔丁基、戊基、异戊基、叔戊基、新戊基、1-甲基丁基[即,-ch(ch3)ch2ch2ch3]、2-甲基丁基[即,-ch2ch(ch3)ch2ch3]、正己基等。
[0060]
所述“c
1-c4烷基”意指含有1至4个碳的直链或支链碳基。一些实施方案是1至 3个碳。一些实施方案是1或2个碳。一些实施方案是1个碳。c
1-c4烷基的实例包括甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基和叔丁基。
[0061]
所述“c
1-c6烷氧基”意指直接与氧原子相连的如本文所定义的c
1-c6烷基,一些实施方案中是1至5个碳,一些实施方案是1至4个碳,一些实施方案是1至3个碳,以及一些实施方案是1至2个碳。实例包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、叔丁氧基、异丁氧基、仲丁氧基等。
[0062]
所述“卤素”意指氟、氯、溴或碘基团。
[0063]
优选的,所述r1为直链碳基;进一步的为甲基、乙基或正丙基。
[0064]
优选的,所述r2为直链碳基;进一步的为甲基、乙基或正丙基。
[0065]
本发明化合物也可包括互变异构形式,例如酮-烯醇互变异构体等。互变异构形式可处于平衡中,或通过合适的取代被立体性锁定成一种形式。应当理解的是,不同互变异构形式在本发明化合物的范围内。
[0066]
本发明化合物也可包括在中间体和/或最终化合物中出现的原子的所有同位素。同位素包括具有相同原子数但不同质量数的那些原子。例如,氢的同位素包括氘和氚。
[0067]
本发明化合物还包括上述化合物的修饰物,如改善溶解性所进行的基团修饰,或为了改善透膜性能与穿膜活性成分偶联后的修饰物。
[0068]
另外,还应当明确一个方面在于,本发明所述化合物还包括上述通式所示化合物的晶型化合物,以及包含上述化合物的共晶结构等。
[0069]
优选的方案中,式ⅱ所示化合物结构如下式ⅱa所示:
[0070][0071]
本发明经验证的一种实施方式中,所述r3及r4处于上述取代位点时具有更好的结合效果。进一步的,在该取代位点时,所述r3及r4优选为卤素。
[0072]
在上述技术方案的一种具体的实施方式中,式ⅰ所述化合物结构如下:
[0073][0074]
在上述技术方案的一种具体的实施方式中,式ⅱ所述化合物结构如下:
[0075]
或
[0076][0077]
本发明第二方面,提供一种药物组合物,所述药物组合物中,第一方面所述化合物作为活性成分。
[0078]
优选的,所述药物组合物中,还包括其他活性成分,所述活性成分为包括但不限于抗肿瘤药物、抗炎药物、免疫调节药物、神经退行性疾病治疗药物中的一种。
[0079]
现有技术中相当pdcd4在肿瘤、炎症及免疫系统疾病中发挥的作用已经被证实。本发明提供的上述化合物作为一种pdcd4的拮抗剂可常规的应用于抗肿瘤、抗炎或免疫调节药物的开发。另一方面,上述化合物还可作为bdnf的激动剂应用于神经退行性疾病治疗药物的开发,如抑郁症、阿尔茨海默症及老年痴呆等。具体的,本发明验证的一个实例中,可以
用于抗抑郁药物的开发。
[0080]
优选的,所述药物组合物中,还包括药学上所必需的辅料。
[0081]
本发明第三方面,提供一种药物,所述药物中,第一方面所述化合物和/或第二方面所述药物组合物作为活性成分。
[0082]
上述药物中,所述活性成分含量占药物总量的1~99%,并应当能够达到治疗有效剂量;另外,所述药物为适合单次施予精确剂量的单位剂型。
[0083]
在其它实施方式中,所述药物的量在约0.001mg/kg体重/天-约1000mg/kg体重 /天的范围内。
[0084]
在其它实施方式中,所述药物的量的范围为约0.5mg/kg体重/天-约50mg/kg 体重/天。
[0085]
在一些实施方式中,所述药物的量为约0.001g/天-约7g/天。
[0086]
在其它实施方式中,所述药物的量为约0.002g/天-约6g/天。
[0087]
在其它实施方式中,所述药物的量为约0.005g/天-约5g/天。
[0088]
在其它实施方式中,所述药物的量为约0.01g/天-约5g/天。
[0089]
在其它实施方式中,所述药物的量为约0.02g/天-约5g/天。
[0090]
在其它实施方式中,所述药物的量为约0.05g/天-约2.5g/天。
[0091]
在其它实施方式中,所述药物的量为约0.1g/天-约1g/天。
[0092]
在其它实施方式中,低于上述范围下限的剂量水平可能已经是足够的。
[0093]
在其它实施方式中,可能需要高于上述范围上限的剂量水平。
[0094]
本发明第四方面,提供第一方面所述化合物、第二方面所述药物组合物和/ 或第三方面所述药物在治疗肿瘤、炎症、器官移植排斥、神经退行性疾病、注意力相关疾病或自身免疫性疾病的药物中的应用。
[0095]
本发明第五方面,提供一种预防和/或治疗神经退行性疾病的方法,包括向有此需要的个体施用第一方面所述的化合物、第二方面所述药物组合物和/或第三方面所述药物。
[0096]
优选的,所述神经退行性疾病包括脑缺血(ci)、脑损伤(bi)、癫痫,阿尔茨海默病(ad)、帕金森病(pd)、亨廷顿病(hd)、肌萎缩性侧索硬化 (als)、不同类型脊髓小脑共济失调(sca)、pick病。进一步的,为抑郁症;更进一步的,为慢性应激导致的抑郁症。
[0097]
本发明第六方面,提供一种预防和/或治疗可通过激动bdnf蛋白抑制 pdcd4来预防和/或治疗疾病的方法,其包括向有需要的个体施用第一方面所述的化合物、第二方面所述药物组合物和/或第三方面所述药物。
[0098]
本发明第七方面,提供一种激动bdnf蛋白或抑制pdcd4的方法,所述方法包括向有需要的个体使用第一方面所述的化合物、第二方面所述药物组合物和/ 或第三方面所述药物。
[0099]
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
[0100]
实施例1
[0101]
为了获取bdnf的抑制剂,本实施例中尝试从pdcd4入手,筛选具有bdnf 调节作用的小分子化合物。根据pdcd4的空间结构,通过ftmap computationalsolvent mapping确定了配体小分子与pdcd4结合的热区,主要筛选了5个主要结合位置,如附图2所示。
[0102]
基于高斯过程的定量结构-活性关系回归预测(qsar),从类药物小分子文库中筛选到了6个可能于pdcd4相互结合的配体小分子(如表1所示),通过亲和力实验,发现配体小分子zinc20031600(ai-204)与pdcd4具有高亲和力(kd =350nm),主要与pdcd4的360、363和338号氨基端相连接。经验证,上述六个化合物中,zinc5556455(ag-690)和zinc8441538与pdcd4具有中等亲和力(kd =12.4 and 12.7μm),主要与pdcd4的331、366、338和351相互作用。
[0103]
表1
[0104]
[0105][0106]
为了进一步验证上述化合物是否能够影响脑部bdnf的表达,本实施例还通过western blotting验证了上述化合物对海马神经元细胞及小鼠小胶质细胞中 bdnf的表达作用。
[0107]
其中,化合物zinc20031600(ai-204)、zinc5556455(ag-690)表现出对海马神经元细胞ht-22中bdnf表达的促进作用(结果如附图1所示)。
[0108]
本实施例中,为了探究上述化合物在体内是否能够有效的改善抑郁症状,本实施例通过慢性束缚应激诱导小鼠抑郁模型,抑郁症诱导成功后给与抑郁小鼠 pdcd4配体小分子ai-204治疗,结束后检测抑郁小鼠海马(hip)和前额叶皮质(pfc)中bdnf的表达变化。检测结果如附图2所示。同时,通过小鼠行为学统计结果(附图3所示)也验证了化合物ai-204与ag-690能够改善小鼠抑郁性行为。
[0109]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技
术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1