一种与肾细胞癌相关的环状RNA及其应用
一种与肾细胞癌相关的环状rna及其应用
技术领域
1.本发明属于生物医药领域,具体涉及一种与肾细胞癌相关的环状rna及其应用。
背景技术:
2.肾细胞癌(rcc)是起源于肾脏的泌尿系统常见恶性肿瘤,其发病率仅次于前列腺癌及膀胱癌,约占全身恶性肿瘤的3%,占肾脏恶性肿瘤的80%~85%,并且近十年来其发病率呈上升趋势。据统计,2018年全球新发病例超过40万,死亡病例超过17万。在我国,2015年肾癌的发病率为66.8人/10万人,死亡率为23.4人/10万人。肾细胞癌具有较高的恶性转移倾向,据报道,初诊为肾细胞癌的患者中约有25%~30%出现远处转移,其余约一半的患者在术后随访中发现了转移性病变。由于肾细胞癌对放疗、化疗不敏感,因此靶向治疗成为肾癌治疗的新的方向,并且越来越多的靶向药物运用于临床中。虽然靶向治疗对肾癌有一定的疗效,但是目前研究显示靶向治疗的效果仍有限。一方面靶向治疗药物存在明显毒副作用,另一方面靶向治疗最终会发展为药物抵抗。因此,临床上迫切需要用于肾细胞癌早期诊断和监测的生物标志物,研究肾细胞癌的转移和进展的生物机制,早期识别肾细胞癌转移机制有助于更准确地预测临床结果和研发靶向药物。
3.聚
‑
β氨基酯[poly(β
‑
amino ester)s,pbae]类聚合物分子是一类新近合成的高效聚合物基因载体材料。它含有伯胺、仲胺、叔胺及可水解的酯键,因此其细胞亲和更高、转染效率更好。此外,pbae能够通过改变其亚基位置而具备对某种细胞的特异性亲和力,例如选择性转染肿瘤细胞,进而避免损伤周围正常组织。上述这些优点都使得该类聚合物成为构建聚合物基因传递纳米颗粒用以治疗肿瘤的理想选择。
[0004]
环状rna(circrnas)是一种新发现的非编码rna,在许多物种中普遍存在。circrnas通过特殊的选择性剪切从外显子或内含子中产生,具有共价闭环结构,没有末端5
′
端和3
′
聚a尾。由于这种特殊的闭环结构,circrnas在核酸外切酶rnase r的降解下表现出比线性rnas更大的稳定性。circrnas最初被认为是剪接错误的副产品。然而,高通量测序和生物信息学分析的广泛使用表明,circrnas是内源性的、丰富的、和保守的表达在哺乳动物细胞内,这表明它们很可能有特定的生物功能。有研究显示circrna可以通过以下五种方式发挥重要功能:作为mirna海绵抑制其功能;作为转录和翻译调节因子;影响pre
‑
mrnas的选择性剪接;与rbps相互作用以调节基因表达;具有编码蛋白质的潜力。目前,有大量研究报道circrna参与肿瘤的发生发展过程,其生物学特性使其可以作为肿瘤诊断和预后的生物标志物及精准治疗的靶点。虽然在以往的研究中,肾细胞癌组织样本中的circrna已被报道,但circrna对于肾细胞癌分子诊断的意义及治疗应用尚不清楚。因此急需寻找新的circrnas,并探讨其对肾细胞癌的生物学效应,以获得用于诊断标志和治疗的潜在靶点。
技术实现要素:
[0005]
解决的技术问题:针对目前诊断肾细胞癌预后和治疗效果不佳的技术问题,本发明提供一种与肾细胞癌相关的环状rna及其应用。通过基因芯片筛查与肾细胞癌相关的环
状rna生物标志物,选择差异表达明显的cirs
‑
7,在肾癌组织和正常组织中检测其表达差异,通过检测该circrna的表达水平,判断受试者是否与肾细胞癌的预后相关,为临床上判断肾癌是否发生转移提供支持。此外,通过纳米技术构建基于cirs
‑
7的pbae/si
‑
cirs
‑
7纳米材料复合物作为肾细胞癌的分子靶向药物。
[0006]
技术方案:一种与肾细胞癌相关的环状rna,核苷酸序列如seq id no.1所示。
[0007]
上述环状rna作为肾细胞癌诊断标志物在制备试剂盒中的应用。
[0008]
上述环状rna在制备靶向药物中的应用。
[0009]
一种用于验证上述环状rna相对表达的试剂盒,该试剂中包含用于检测肾细胞癌组织中cirs
‑
7表达的引物序列:上游引物如seq id no.2所示:5
’‑
acgtctccagtgtgctga
‑3’
;下游引物如seq id no.3所示:5
’‑
cttgacacaggtgccatc
‑3’
。
[0010]
荧光定量pcr检测试剂盒,包含内参基因gapdh的pcr引物:上游引物如seq id no.4所示:5
’‑
caggaggcattgctgatgat
‑3’
;下游引物如seq id no.5所示:5
’‑
gaaggctggggctcattt
‑3’
。
[0011]
肾细胞癌的分子靶向药物,合成能够特异性敲低cirs
‑
7的小干扰rna:si
‑
cirs
‑
7,将其与聚
‑
β氨基酯(pbae)类聚合物载体材料复合,制得pbae/si
‑
cirs
‑
7复合物纳米材料,所述si
‑
cirs
‑
7序列如seq id no.6所示,为:gtctgcaatatccagggtt。
[0012]
有益效果:本发明环状rna cirs
‑
7在肾细胞癌组织中特异性表达上调,可以作为肾细胞癌的诊断标志物;同时,高表达cirs
‑
7与预后不良相关,可以作为肾细胞癌患者的预后标志物;本发明成功合成了pbae/si
‑
cirs
‑
7复合物纳米材料,可以作为肾细胞癌的分子靶向药物。
附图说明
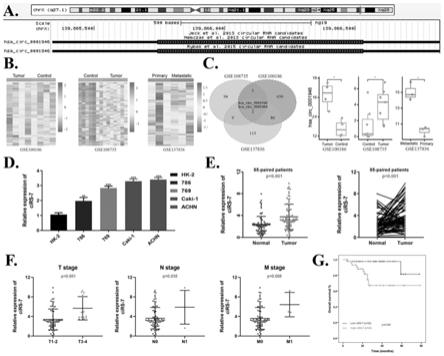
[0013]
图1.环状rna cirs
‑
7是肾细胞癌中高表达的环状rna。a.cirs
‑
7在染色体中的位置。b、c.geo肾细胞癌数据库中cirs
‑
7的表达水平。d.qrt
‑
qpcr检测cirs
‑
7在人正常肾小管上皮细胞株hk
‑
2和多种肾癌细胞株(786
‑
o,769
‑
p,caki
‑
1和achn)中的表达水平。e.qrt
‑
qpcr检测cirs
‑
7在85对肾细胞癌组织和邻近正常肾组织中表达水平。f.qrt
‑
qpcr检测cirs
‑
7在不同t分期、n分期、m分期的表达水平。g.fish实验检测cirs
‑
7的定位情况。g.cirs
‑
7与肾细胞癌患者总生存期的关系。
[0014]
图2.环状rna cirs
‑
7促进肾细胞癌细胞增殖、侵袭和迁移能力。a.qrt
‑
qpcr检测786
‑
o和achn细胞在转染oe
‑
cirs
‑
7、si
‑
cirs
‑
7#1和si
‑
cirs
‑
7#2后cirs
‑
7的mrna水平。b.786
‑
o和achn细胞转染oe
‑
cirs
‑
7、control和si
‑
cirs
‑
7#2后cck8实验。c.786
‑
o和achn细胞转染oe
‑
cirs
‑
7、control和si
‑
cirs
‑
7#2后细胞划痕实验。d.786
‑
o和achn细胞转染oe
‑
cirs
‑
7、control和si
‑
cirs
‑
7#2后transwell实验。e.786
‑
o和achn细胞转染oe
‑
cirs
‑
7、control和si
‑
cirs
‑
7#2后edu实验。
[0015]
图3.pbae/si
‑
cirs
‑
7复合物纳米材料的制备。a.不同pbae/si
‑
cirs
‑
7比例的复合物的粒径与电位。b.不同pbae/si
‑
cirs
‑
7比例的复合物包封率电泳图。c.pbae/si
‑
cirs
‑
7复合物电镜图。d.pbae/si
‑
cirs
‑
7复合物粒径电位(pbae/si
‑
cirs
‑
7=80:1)。
具体实施方式
[0016]
下面展示具体实施方式,结合附图说明来进一步详细描述本发明的技术方案。本领域技术人员应该明了,所述具体实施方式是为了能够更透彻地理解本发明,不应视为对本发明的具体限制。
[0017]
实施例1cirs
‑
7在肾细胞癌中表达情况
[0018]
1、环状rna cirs
‑
7在染色体中的位置如图1
‑
a所示,具体序列信息见seq id no.1。
[0019]
2、本发明所采用的肾细胞癌组织和正常组织标本均来自东南大学附属中大医院泌尿外科治疗的出诊肾细胞癌患者,未经放疗和化疗治疗。新鲜肾细胞癌组织手术切除后,立即置于液氮中保存,避免rna降解。所收取的样本均经病理学检查确诊。
[0020]
3、提取组织总rna:
[0021]
(1)将研磨组织所用的研钵、研杵等用品在200℃烤4h,冷却后待用;
[0022]
(2)研磨前将研钵、研杵预冷,从液氮中取出组织样本,在液氮中将组织研磨成粉末,趁液氮未挥发完将粉末转移至1.5ml无酶ep管内;
[0023]
参照epicenter公司的rnase r酶(rnr07250)试剂说明书进行操作,具体步骤如下:
[0024]
(3)ep管中加入1ml trizol,用组织匀浆器进行组织细胞裂解,待液体五明显组织块后12000rpm,5min,上清转至新1.5ml无酶ep管内,室温放置5min;
[0025]
(4)离心管中加入氯仿200μl,剧烈震荡15s,室温放置5min,12000rpm,4℃离心15min;
[0026]
(5)上清转至新1.5ml无酶ep管内,加入异丙醇500μl,轻颠倒混匀5次,室温放置10min,12000rpm,4℃离心10min;
[0027]
(6)吸弃上清,加入无水乙醇1ml,振荡均匀,7500rpm,4℃离心5min,弃上清,干燥沉淀;
[0028]
(7)加入depc水30μl溶解沉淀;
[0029]
(8)组织总rna电泳鉴定其质量,a260/a280为1.8
‑
2.0且28s:18s为1.8
‑
2.0时,提示提取总rna质好,可用于后续研究。
[0030]
4、rnase r酶消化总rna中线性rna:
[0031]
(1)取1.5ml无酶ep管,向管中加入总rna 10μg,rnase r酶10u和10
×
rnase rbuffer2μl,加depc水至20μl,37℃孵育15min;
[0032]
(2)trizol法提取(1)中非线性rna后,加入depc水30μl溶解沉淀。
[0033]
5、反转录
[0034]
参照诺唯赞公司的逆转录试剂盒说明书进行操作,具体步骤如下:
[0035]
(1)rna预变性:microtube管中加入以下反应液体,如表1所示:
[0036]
表1
[0037]
试剂体积rnase r酶消化后的rna2μgrandom primer1μldepc水补至14μl
[0038]
反应条件:65℃孵育5min,后将混合物置于冰上2min。
[0039]
(2)rna逆转录:microtube管中加入以下反应液体,如表2所示:
[0040]
表2
[0041]
试剂体积上述rna混合物14μl5
×
m
‑
mlv buffer4μldntp mix(10mm)0.5μl逆转录酶1μlrnase inhibitor0.5μl
[0042]
反应条件:25℃,5min;42℃,60min;70℃,15min;4℃保持冷却,产物即cdna。
[0043]
6、qrt
‑
pcr:
[0044]
采用诺唯赞公司的sybr
‑
green染料法(real
‑
time qpcr master mix)进行实时荧光定量pcr,以检测细胞株、正常和肾癌组织中cirs
‑
7的表达水平。具体操作如下:
[0045]
(1)microtube管中加入以下反应液体,如表3所示:
[0046]
表3
[0047]
试剂体积上述cdna2μlsybr qpcr mix10μl上游引物(100mm)0.5μl下游引物(100mm)0.5μldepc水补至20μl
[0048]
反应条件:95℃,预变性30s;95℃,5s;60℃,20s;72℃,10s;40个反应循环。
[0049]
(2)环状rna cirs
‑
7的qrt
‑
pcr引物,上下游引物序列如:
[0050]
上游引物如seq id no.2所示,为:5
’‑
acgtctccagtgtgctga
‑3’
[0051]
下游引物如seq id no.3所示,为:5
’‑
cttgacacaggtgccatc
‑3’
[0052]
(3)内参基因gapdh的pcr引物,上下游引物序列如:
[0053]
上游引物如seq id no.4所示,为:5
’‑
caggaggcattgctgatgat
‑3’
[0054]
下游引物如seq id no.5所示,为:5
’‑
gaaggctggggctcattt
‑3’
[0055]
(4)采用2
‑
δδ
ct
计算表达差异。
[0056]
7、786
‑
o和achn细胞的核质分离实验:
[0057]
参照ambion公司的paristm kit试剂盒说明书进行操作,具体步骤如下:
[0058]
(1)收集处于指数生长的786
‑
o和achn细胞株,用1
×
pbs清洗细胞,胰酶消化后800rpm,常温离心5min,弃上清;
[0059]
(2)预冷的1
×
pbs重悬细胞,800rpm,4℃离心5min;
[0060]
(3)向上述(2)中细胞中添加400μl预冷的cell fractionation buffer,混匀后冰浴10min,待其裂解完成后,800rpm,4℃离心5min,收集上清为细胞浆裂解液;
[0061]
(4)向上述(3)中离心后沉淀中加入400μl预冷的cell disruption buffer,保持冰浴至裂解液均一;
[0062]
(5)向上述(3)、(4)裂解液中加入400μl 2
×
lysis buffer,室温反复吹打至完全
裂解,10000g,4℃离心1min,收集上清至新的1.5ml无酶ep管内;
[0063]
(6)加入400μl无水乙醇,轻柔吹打混匀,将上清液转移至吸附柱中,室温静置2min,10000g,4℃离心1min,弃收集液;
[0064]
(7)加入400μl wash solution 1至吸附柱中,10000g,4℃离心1min,弃收集液;
[0065]
(8)加入500μl wash solution 2/3至吸附柱中,10000g,4℃离心1min,弃收集液;重复洗涤3次,室温静置30s;
[0066]
(9)向吸附柱中加入40μl 95℃elution solution,10000g,4℃离心1min,将收集液加入吸附柱内,二次收集,10000g,4℃离心1min,
‑
80℃保存。
[0067]
8、786
‑
o和achn细胞的荧光原位杂交(fish)实验
[0068]
设计针对cirs
‑
7的特异探针。将探针在75℃恒温水浴中温育5min,立即置0℃,5
‑
10min,使双链探针变性。烤片2
‑
3h后浸入70%甲酰胺/2
×
ssc的变性液中变性2
‑
3min,冰乙醇系列脱水,每次5min,空气干燥。将探针10μl滴玻片上,盖上盖玻片,封片,暗盒中37℃杂交过夜,洗脱除去非特异性结合的探针,在玻片的杂交部位加150μl封闭液i,用保鲜膜覆盖,37℃温育20min。再加150μl avidin
‑
fitc于标本上,用保鲜膜覆盖,37℃温育40min。洗涤3次,再加150μl封闭液ii,37℃温育20min。加150μl antiavidin于标本上,温育40min。洗涤3次,每次5min。干燥后,取200μl pi/antifade染液滴加在玻片标本上,封片。
[0069]
9、收集肾细胞癌患者的临床预后资料,将所有患者根据cirs
‑
7的表达水平分为高cirs
‑
7组和低cirs
‑
7组,采用kaplan
‑
meier进行生存曲线分析。
[0070]
实施例2环状rna cirs
‑
7促进肾细胞癌细胞增殖、侵袭和迁移能力
[0071]
1、cck8实验
[0072]
将转染oe
‑
cirs
‑
7、si
‑
cirs
‑
7#1和si
‑
cirs
‑
7#2的786
‑
o和achn稳转细胞接种于96孔板中,密度为2000个/孔。将cck8与培养基原液以1:10的比例配制,pbs洗涤细胞,加入含cck8的培养基100μl。96孔板在37℃黑暗中孵育2h后,测od值。细胞贴壁培养后连续监测0h、12h、24h、48h、72h和96h各时间位点,绘制增殖曲线。
[0073]
2、细胞划痕实验
[0074]
将转染oe
‑
cirs
‑
7、si
‑
cirs
‑
7#1和si
‑
cirs
‑
7#2的786
‑
o和achn稳转细胞接种于6孔板中,使细胞贴壁达到80%时,用200μl移液管的顶端对细胞进行连续刮除,然后用1
×
pbs清洗3次,清除细胞碎片,然后加入无血清培养基。分别于划痕后0小时和24小时拍照,并计算划痕宽度变化。
[0075]
3、transwell实验
[0076]
迁移实验:将含约5
×
104个转染细胞的200μl无血清培养基加入transwell上室后,下室中加入500μl含10%血清的培养基。37℃培养箱培养16h,弃去上室液体,棉签擦净上室腔内细胞,对侧用乙醇固定、0.1%结晶紫染色,于200倍光镜下计数细胞。
[0077]
侵袭实验:将matrigel胶铺于上室底层,培养箱中放置1h后,按照上述实验方法,进行侵袭实验。
[0078]
4、edu实验
[0079]
参照翌圣生物科技(上海)有限公司的yefluor 488edu细胞成像试剂盒(cat no.40275)说明书进行操作,具体步骤如下:
[0080]
4.1edu标记细胞:
[0081]
(1)将转染oe
‑
cirs
‑
7、si
‑
cirs
‑
7#1和si
‑
cirs
‑
7#2的786
‑
o和achn稳转细胞以每孔4
×
103‑1×
105细胞接种于96孔板中;
[0082]
(2)准备一份2
×
的edu工作液(组分a);
[0083]
(3)预热2
×
的edu工作液,加入等体积的培养基,使浓度变为1
×
;
[0084]
(4)将96孔板置于温箱内孵育2小时。
[0085]
4.2细胞固定及促渗
[0086]
(1)孵育完成后,去除培养基,加入50μl 4%中性多聚甲醛至各孔,室温孵育15
‑
30min,去除固定液;
[0087]
(2)每孔加入50μl 2mg/ml甘氨酸溶液,室温孵育5min,中和残留的固定液;
[0088]
(3)以每孔0.1ml 3%bsa in pbs的洗涤液洗涤细胞2次;
[0089]
(4)去除洗涤液,加入0.1ml 0.5%triton x
‑
100in pbs到每个孔,室温孵育20min。
[0090]
4.3edu检测
[0091]
(1)准备1
×
click
‑
itedu反应缓冲液(组分c):将10
×
组分c稀释10倍;
[0092]
(2)制备一份5
×
的click
‑
itedu反应添加储液(组分e):加0.3ml去离子水至30mg的e组分试管中;
[0093]
(3)准备1
×
click
‑
itedu缓冲液添加物:以去离子水稀释5
×
储液(组分e)至1
×
;
[0094]
(4)准备click
‑
it反应混合物,如表4所示:
[0095]
表4
[0096]
试剂体积(10孔)1
×
click
‑
itedu反应缓冲液(组分c)860μlcuso4(组分d)40μlyefluor 488azide(组分b)2μl1
×
click
‑
itedu反应缓冲液添加物100μl总体积1ml
[0097]
(5)去除促渗剂,以每孔0.1ml的3%bsa in pbs的洗涤液洗涤2次,去除洗涤液;
[0098]
(6)加入0.1ml click
‑
it反应混合物至每个孔,简短摇晃培养板以确保反应物均匀覆盖细胞;
[0099]
(7)室温避光孵育30min;
[0100]
(8)去除反应混合物,每孔以0.1ml 3%bsa in pbs洗涤两次,去除洗涤液。
[0101]
4.4dna复染
[0102]
(1)以0.1ml pbs洗涤每孔1次,去掉洗涤液;
[0103]
(2)以pbs稀释hoechst 33342(组分f)储液1:2000至1
×
hoechst 33342溶液;
[0104]
(3)每孔加0.1ml 1
×
hoechst 33342溶液,室温避光孵育15
‑
30min,除去hoechst 33342溶液;
[0105]
(4)0.1ml pbs洗涤每孔2次,去除洗涤液;
[0106]
(5)拍照分析。
[0107]
实施例3pbae/si
‑
cirs
‑
7复合物纳米材料的制备
[0108]
pbae购自西安瑞禧公司,si
‑
cirs
‑
7购自广州锐博生物公司。
[0109]
1、pbae/si
‑
cirs
‑
7复合物定量检测
[0110]
取0.04μl,0.2μl,0.4μl,0.8μl,1.6μl,2.4μl,3.2μl,4.0μl,4.8μl(25μg/μl)分别加入187.96μl,187.8μl,187.6μl,187.2μl,186.4μl,185.6μl,184.8μl,184.0μl,183.2μl水中,与12μl si
‑
cirs
‑
7(0.5μg/μl)混合,室温放置20分钟后,将不同混合物放置于0.5ml超滤离心管中,12000转/分钟,离心10min,测定超滤液中si
‑
cirs
‑
7的浓度,并计算si
‑
cirs
‑
7的包封率。
[0111]
2、pbae/si
‑
cirs
‑
7复合物定性观察
[0112]
取0.04μl,0.2μl,0.4μl,0.8μl,1.6μl,2.4μl,3.2μl,4.0μl,4.8μl pbae(25μg/μl)分别加入17.96μl,17.8μl,17.6μl,17.2μl,16.4μl,15.6μl,14.8μl,14.0μl,13.2μl水中,再分别加入2μl si
‑
cirs
‑
7(0.5μg/μl),混合均匀,放置20min。取0.5g琼脂糖,加入50ml
×
tae缓冲液,煮沸,稍冷却后加入2.5μl goldview染液,导入梳子制胶器中,待琼脂糖凝固后,取20μl不同浓度的pbae/si
‑
cirs
‑
7复合物与4μl 6
×
dna上样缓冲液混合后,分别加入不同的疏齿孔隙中,并以裸si
‑
cirs
‑
7作为对照,电泳电压为130v,电泳时间为15min,并采用凝胶成像系统观察,并采用软件tanon gel image system 4.2对所有样品进行半定量。
[0113]
3、pbae/si
‑
cirs
‑
7复合物粒径电位测定
[0114]
取0.04μl,0.2μl,0.4μl,0.8μl,1.6μl,2.4μl,3.2μl,4.0μl,4.8μl pbae(25μg/μl)分别加入17.96μl,17.8μl,17.6μl,17.2μl,16.4μl,15.6μl,14.8μl,14.0μl,13.2μl水中,再分别加入2μl si
‑
cirs
‑
7(0.5μg/μl),混合均匀,室温放置20min。将制备得到的复合物用蒸馏水稀释到2ml,采用粒径电位仪测定复合物的粒径和电位。
[0115]
4、pbae/si
‑
cirs
‑
7复合物电镜拍照
[0116]
采用透射电子显微镜(134内)(jeol jem
‑
1400flash)对pbae/si
‑
cirs
‑
7复合物进行拍照。
[0117]
发现当pbae与si
‑
cirs
‑
7比例为80:1时,复合物有着最高的包封率,包封率达到98%,并且当pbae:si
‑
cirs
‑
7=80:1时,纳米复合物有着最低的粒径大小和分散系数(pdi),其中粒径大小约为165.36nm,pdi约为0.12。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1