一种口腔鳞癌单细胞悬液的制备方法与流程
本发明涉及生物医学技术领域,更具体地说,涉及一种口腔鳞癌单细胞悬液的制备方法。
背景技术:
随着研究深入,通过获得肿瘤微环境中不同细胞类型(肿瘤细胞、成纤维细胞、免疫细胞等)单细胞层面的多组学信息(转录组、蛋白组等),以获得不同细胞亚型的差异情况,能够对肿瘤微环境中不同亚群细胞功能、彼此交互对话作用进行单细胞层面的研究和阐述。但在进行单细胞相关研究之前,获得高质量的单细胞悬液是实验成功的第一步,也是关键一步。
另一方面,尽管获得活性良好的单细胞悬液是研究的前提,但不同组织具有其独特的生理特征,使得同样的解离条件无法适合所有的解离组织,其中肿瘤组织解离面临的一个重要难题是如何获得高活性的肿瘤及间质细胞。对于口腔鳞癌而言,肿瘤位于体表,且为带菌环境,所以坏死组织较多,使用常规单细胞悬液获得的活细胞以造血细胞居多,而肿瘤细胞及间质细胞捕获量较低,活性不足,难以满足实际需求。
技术实现要素:
本发明旨在提供一种口腔鳞癌单细胞悬液的制备方法,旨在解决现有技术中使用常规单细胞悬液获得的肿瘤细胞及间质细胞捕获量较低,活性不足,难以满足实际需求的问题。
为实现此目的,本发明提供了一种口腔鳞癌单细胞悬液的制备方法,包括以下步骤:
s1、配置解离试剂:以含0.04%bsa的1640培养基为溶剂配置解离试剂,该解离试剂的各功能组分在培养基中的终浓度组成为:胶原酶i,5mg/ml;dna酶i,1-3mg/ml;透明质酸酶,2-6mg/ml;中性蛋白酶,1mg/ml;
s2、组织采集和预处理:通过取材或肿瘤切除手术,获得口腔鳞癌组织,使用无菌刀片上下切割,快速切取黄豆大小组织,用无菌预冷生理盐水冲洗,后浸入预装有0.04%bsa的1640培养基的无菌离心管中,在4度的温度下冰上保存;
s3、解离前预处理:将获得的待解离组织倾倒于无菌6孔板中,用步骤s1中配置好的含0.04%bsa的1640培养基漂洗3遍,最后吸尽漂洗液;后加入步骤s1中配置好的1ml解离试剂,采用无菌圆刀上下切割组织,使得各个组织块均小于1mm3;
s4、组织消化解离:采用宽口枪头反复捶打组织块沉淀使其重悬混匀,吸去上清转移至全新的无菌15ml离心管中,冰上保存;在剩余的组织沉淀中再次加入3ml预冷的步骤s1中的解离试剂,采用宽口枪头反复捶打混匀,在37度的温度下放入恒温摇床继续震荡消化15分钟,重复3次,最终将3次获得的含有解离细胞的上清混合,冰上保存;
s5、细胞过滤器过滤:将步骤s4中获得的细胞悬液离以300g转速离心7分钟获得细胞沉淀,用步骤s1中含有0.04%bsa的1640培养基将细胞沉淀重悬,通过40um无菌过滤器过滤超过40um直径的碎片或大细胞,再次以300g转速离心7分钟获得沉淀,培养基重悬,并用过滤器再次过滤,重复3遍以保证过滤效果;
s6、裂解去除红细胞后获得目的细胞:3次洗涤后,离心后吸去上清,获得目的细胞的沉淀,加入红细胞裂解液摇匀静置,以300g转速离心7分钟获得细胞沉淀,若沉淀仍泛红,可重复红细胞裂解步骤直至最终获得目的细胞的单细胞悬液。
优选的,还包括以下步骤,s7、测量活细胞得率:吸取20ul单细胞悬液与20ul台盼蓝染色液充分混匀,吸入计数板中,计算获得细胞浓度及获得细胞比例。
优选的,步骤s4中,恒温摇床的转速为180rpm。
优选的,步骤s6中,离心的转速为300g。
优选的,步骤s1中,配置解离试剂后冰上保存。
优选的,解离试剂的各功能组分在培养基中的终浓度组成为:胶原酶i,5mg/ml;dna酶i,1mg/ml;透明质酸酶,2.5mg/ml;中性蛋白酶,1mg/ml。
优选的,解离试剂的各功能组分在培养基中的终浓度组成为:胶原酶i,5mg/ml;dna酶i,2.5mg/ml;透明质酸酶,2.5mg/ml;中性蛋白酶,1mg/ml。
优选的,解离试剂的各功能组分在培养基中的终浓度组成为:胶原酶i,5mg/ml;dna酶i,1mg/ml;透明质酸酶,5mg/ml;中性蛋白酶,1mg/ml。
相比于现有技术,本发明的优点在于:
采用本发明的口腔鳞癌单细胞悬液制备方法可提高cd45-细胞(肿瘤细胞及间质细胞大部分均为cd45-细胞)的活性和比例,且获得细胞总体活性大于70%,碎片率低于5%,稳定性较好;采用含0.04%bsa的预冷的1640培养基而非单纯的培养基作为溶剂,具有稳定细胞状态、保持细胞活性的效果;组织预处理中不采用剪刀,以避免牵拉组织,单纯使用无菌刀片上下切割,减少对组织的损伤从而减少了碎片形成,可以将组织尽量切碎以加强后续的酶解效果;在解离酶配方中,胶原酶i是主要的解离酶,dna酶能减少组织粘性,而透明质酸酶也辅助降解组织中的透明质酸成分,中性蛋白酶帮助结构更加松散,从而帮助解离出更多的肿瘤及成纤维细胞;在解离方案实施中,每次消化解离时吸出原有消化液,加入新鲜的消化液进行新一轮消化,以保持酶活性,提高酶解效果,并避免单细胞悬液和组织块一同离心时引入更多坏死组织碎片;在吹打细胞悬液过程中,采用宽口的枪头,可以避免因枪头的切割作用对细胞造成损伤以及导致细胞活性下降或引入更多细胞碎片,提高了工作效率。
附图说明
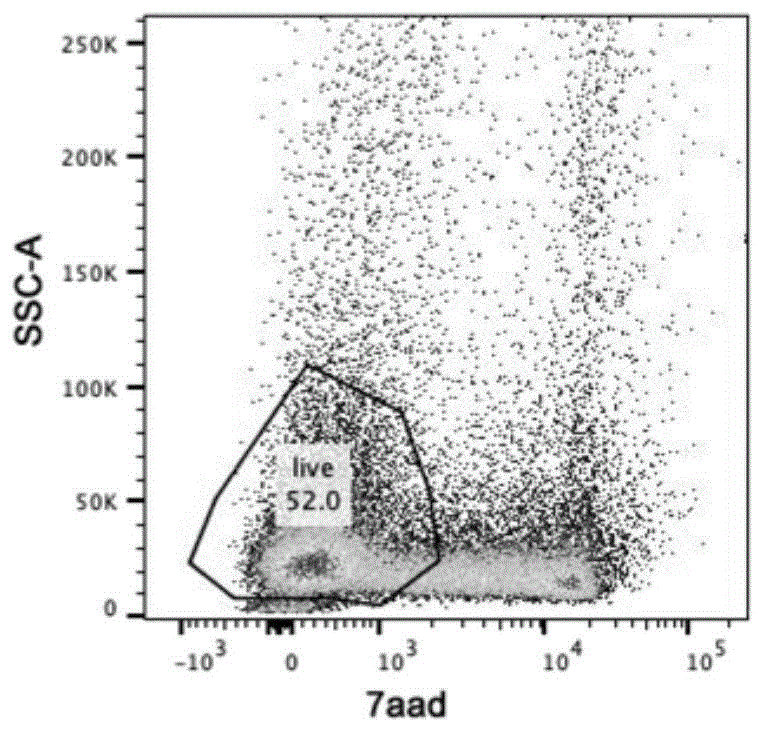
图1为现有的口腔鳞癌单细胞悬液中cd45-细胞占比的示意图;
图2为现有的口腔鳞癌单细胞悬液中活细胞占比的示意图;
图3为现有的口腔鳞癌单细胞悬液中死细胞和细胞碎片占比的示意图;
图4为采用本发明的口腔鳞癌单细胞悬液的制备方法制备的悬液中cd45-细胞占比的示意图;
图5为采用本发明的口腔鳞癌单细胞悬液的制备方法制备的悬液中活细胞占比的示意图;
图6为为采用本发明的口腔鳞癌单细胞悬液的制备方法制备的悬液中死细胞和细胞碎片占比的示意图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述;显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例,基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
本实例提供了一种提高非造血细胞活性的口腔鳞癌单细胞悬液制备的方法,步骤如下:
s1、配制试剂与培养基:配置含有0.04%牛血清白蛋白(bsa)的1640培养基,解离试剂:胶原酶i,5mg/ml;dna酶i,1mg/ml;透明质酸酶,2.5mg/ml;中性蛋白酶,1mg/ml。以含0.04%bsa的1640培养基为溶剂配置解离试剂,冰上保存;
s2、组织采集和预处理:通过取材或肿瘤切除手术,获得舌鳞癌组织后,快速切取黄豆大小组织,无菌预冷pbs冲洗,后浸入预装有0.04%bsa的1640培养基的无菌离心管中,4度冰上保存,并在2小时内进行解离操作;
s3、解离前预处理:将获得的待解离组织倾倒于无菌培养皿中,无菌预冷pbs冲洗3遍,最后一遍吸尽漂洗液。后加入1ml配置好的解离试剂,采用无菌圆刀上下切割组织(不采用剪刀,避免牵拉组织),使得各个组织块均小于1mm3;
s4、组织消化解离:再加入2ml新解离酶,宽口枪头吹打混匀组织块悬液,将预处理好的组织连同预加入的解离酶一起转移至无菌的15ml离心管中。后放入恒温摇床进行震荡消化(37度,180rpm)15分钟。后采用宽口枪头反复捶打组织块沉淀使其重悬混匀,吸去上清转移至全新的15ml离心管中,冰上保存。在剩余的组织沉淀中再次加入3ml预冷的组织解离试剂,宽口枪头反复捶打混匀,放入恒温摇床继续震荡消化(37度,180rpm)15分钟,重复3次。最终将3次获得的含有解离细胞的上清混合,冰上保存;
s5、细胞过滤器过滤:将上述步骤中获得的细胞悬液离以300g转速离心7分钟获得细胞沉淀,用预冷的含有0.04%bsa的1640培养基将细胞沉淀重悬,通过40um无菌过滤器过滤超过40um直径的碎片或大细胞,再次以300g转速离心7分钟获得沉淀,培养基重悬,并用过滤器再次过滤,重复3遍以保证过滤效果;
s6、裂解去除红细胞后获得目的细胞:3次洗涤后,离心后吸去上清,获得目的细胞的沉淀。加入红细胞裂解液摇匀静置,300g离心7分钟获得细胞沉淀。若沉淀仍泛红,可重复红细胞裂解步骤。最终获得目的细胞的单细胞悬液。吸取20ul单细胞悬液与20ul台盼蓝染色液充分混匀,吸入计数板中,计算获得细胞浓度及获细胞比例。
实施例2
本实例提供了一种提高非造血细胞活性的口腔鳞癌单细胞悬液制备的方法,步骤如下:
s1、配制试剂与培养基:配置含有0.04%牛血清白蛋白(bsa)的dmem培养基。解离试剂:胶原酶i,5mg/ml;dna酶i,2.5mg/ml;透明质酸酶,2.5mg/ml;中性蛋白酶,1mg/ml。以含0.04%bsa的dmem培养基为溶剂配置解离试剂,冰上保存;
s2、组织采集和预处理:通过肿瘤切除手术,获得颊癌组织后,快速切取黄豆大小组织,无菌预冷生理盐水冲洗,后浸入预装有0.04%bsa的dmem培养基的无菌离心管中,4度冰上保存,并在2小时内进行解离操作;
s3、解离前预处理:将获得的待解离组织倾倒于无菌培养皿中,无菌预冷生理盐水冲洗3遍,最后一遍吸尽漂洗液。后加入1ml配置好的解离试剂,采用无菌圆刀上下切割组织(不采用剪刀,避免牵拉组织),使得各个组织块均小于1mm3;
s4、组织消化解离:用宽口枪头将预处理好的组织连同预加入的解离酶一起转移至无菌的15ml离心管中,在离心管中再补充2ml解离酶。后放入恒温摇床进行震荡消化(37度,180rpm)15分钟。后采用宽口枪头反复捶打组织块沉淀使其重悬混匀,吸去上清转移至全新的15ml离心管中,冰上保存。在剩余的组织沉淀中再次加入3ml预冷的组织解离试剂,宽口枪头反复捶打混匀,放入恒温摇床继续震荡消化(37度,180rpm)15分钟,重复3次。最终将3次获得的含有解离细胞的上清混合,冰上保存;
s5、细胞过滤器过滤:将上述步骤中获得的细胞悬液离以300g转速离心7分钟获得细胞沉淀,用预冷的含有0.04%bsa的dmem培养基将细胞沉淀重悬,通过100um无菌过滤器过滤超过100um的大碎片,后通过40um无菌过滤器过滤超过40um直径的碎片或大细胞,再次以300g转速离心7分钟获得沉淀,培养基重悬,并用过滤器再次过滤,重复3遍以保证过滤效果;
s6、裂解去除红细胞后获得目的细胞:3次洗涤后,离心后吸去上清,获得目的细胞的沉淀。加入红细胞裂解液摇匀静置,300g离心7分钟获得细胞沉淀。若沉淀仍泛红,可重复红细胞裂解步骤。最终获得目的细胞的单细胞悬液。吸取20ul单细胞悬液与20ul台盼蓝染色液充分混匀,吸入计数板中,计算获得细胞浓度及获细胞比例。
实施例3
本实例提供了一种提高非造血细胞活性的口腔鳞癌单细胞悬液制备的方法,步骤如下:
s1、配制试剂与培养基:配置含有0.04%牛血清白蛋白(bsa)的1640培养基。解离试剂:胶原酶i,5mg/ml;dna酶i,1mg/ml;透明质酸酶,5mg/ml;中性蛋白酶,1mg/ml。以含0.04%bsa的1640培养基为溶剂配置解离试剂,冰上保存;
s2、组织采集和预处理:通过取材或肿瘤切除手术,获得舌鳞癌组织后,快速切取黄豆大小组织,无菌预冷生理盐水冲洗,后浸入预装有0.04%bsa的1640培养基的无菌离心管中,4度冰上保存,并在2小时内进行解离操作;
s3、解离前预处理:将获得的待解离组织倾倒于无菌培养皿中,无菌预冷生理盐水冲洗3遍,最后一遍吸尽漂洗液。后加入1ml配置好的解离试剂,采用无菌圆刀上下切割组织(不采用剪刀,避免牵拉组织),使得各个组织块均小于1mm3;
s4、组织消化解离:再加入2ml新解离酶,宽口枪头吹打混匀组织块悬液,将预处理好的组织连同预加入的解离酶一起转移至无菌的15ml离心管中。后放入恒温摇床进行震荡消化(37度,180rpm)15分钟。后采用宽口枪头反复捶打组织块沉淀使其重悬混匀,吸去上清转移至全新的15ml离心管中,冰上保存。在剩余的组织沉淀中再次加入3ml预冷的组织解离试剂,宽口枪头反复捶打混匀,放入恒温摇床继续震荡消化(37度,180rpm)15分钟,重复3次。最终将3次获得的含有解离细胞的上清混合,冰上保存;
s5、细胞过滤器过滤:将上述步骤中获得的细胞悬液离以250g转速离心10分钟获得细胞沉淀,用预冷的含有0.04%bsa的1640培养基将细胞沉淀重悬,通过40um无菌过滤器过滤超过40um直径的碎片或大细胞,再次以250g转速离心10分钟获得沉淀,培养基重悬,并用过滤器再次过滤,重复3遍以保证过滤效果;
s6、裂解去除红细胞后获得目的细胞:3次洗涤后,离心后吸去上清,获得目的细胞的沉淀。加入红细胞裂解液摇匀静置,250g离心10分钟获得细胞沉淀。若沉淀仍泛红,可重复红细胞裂解步骤。最终获得目的细胞的单细胞悬液。吸取20ul单细胞悬液与20ul台盼蓝染色液充分混匀,吸入计数板中,计算获得细胞浓度及获细胞比例。
如附图所示,图1为采用现有的口腔鳞癌单细胞悬液,通过流式细胞仪进行检测,结果显示造血细胞(cd45+)细胞占比为76.8%,cd45-细胞占比为9.4%;图2为采用现有的口腔鳞癌单细胞悬液,通过流式细胞仪结合7aad染色检测解离后组织中细胞活性情况,结果显示解离后活细胞比例为52%;图3为采用现有的口腔鳞癌单细胞悬液,台盼蓝染色后镜下观察解离细胞活性情况,结果显示死细胞(台盼蓝染为蓝色)比例接近50%,并存在较多细胞碎片;图4为采用本发明的口腔鳞癌单细胞悬液的制备方法制备的悬液,通过流式细胞仪检测,结果显示造血细胞(cd45+)细胞占比为23.1%,cd45-细胞占比为61.5%;图5为采用本发明的口腔鳞癌单细胞悬液的制备方法制备的悬液,通过流式细胞仪结合7aad染色检测解离后组织中细胞活性情况,结果显示解离后活细胞比例为82.7%;图6为采用本发明的口腔鳞癌单细胞悬液的制备方法制备的悬液,通过台盼蓝染色后镜下观察解离细胞活性情况,结果显示死细胞(台盼蓝染为蓝色)比例约为10%,细胞碎片不足5%。
由此可见,采用本发明的口腔鳞癌单细胞悬液制备方法可提高cd45-细胞(肿瘤细胞及间质细胞大部分均为cd45-细胞)的活性和比例,细胞总体活性(活细胞比例)大于70%,且碎片率低于5%,稳定性较好。
进一步的,采用含0.04%bsa的预冷的1640培养基而非单纯的培养基作为溶剂,具有稳定细胞状态、保持细胞活性的效果;组织预处理中不采用剪刀,以避免牵拉组织,单纯使用无菌刀片上下切割,以减少对组织的损伤从而减少碎片形成,可以将组织尽量切碎以加强后续酶解效果;在解离酶配方中,胶原酶i是主要的解离酶,dna酶能减少组织粘性,而透明质酸酶也辅助降解组织中的透明质酸成分,中性蛋白酶帮助结构更加松散,从而帮助解离出更多的肿瘤及成纤维细胞;在解离方案实施中,每次消化解离时吸出原有消化液,加入新鲜的消化液进行新一轮消化,保持酶活性,提高酶解效果,以避免单细胞悬液和组织块一同离心时引入更多坏死组织碎片,在吹打细胞悬液过程中,采用宽口的枪头,可以避免因枪头的切割作用对细胞造成损伤以及导致细胞活性下降或引入更多细胞碎片,提高了效率。
以上所述,仅为本发明较佳的具体实施方式;但本发明的保护范围并不局限于此。任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其改进构思加以等同替换或改变,都应涵盖在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!