一株耐镉促生雷氏普罗威登斯菌菌株及其应用
1.本发明属于微生物技术领域,具体涉及雷氏普罗威登斯菌菌株mrp36及其 应用。
背景技术:
2.镉不是植物生长发育所必需的元素。当其体内含量超过某一浓度时,植物就 会受到严重的危害,如植株萎蔫发黄、长势较弱等症状。植物根系很容易吸收镉, 继而向地上部转运,这样就会使植物中毒,影响营养元素的吸收,进而抑制植物 生长。镉也会破坏根结构,从而影响植物养分的吸收。
3.磷是植物最重要的必需营养元素之一,是植物细胞分裂、能量生成、大分子 生物合成、膜完整性、信号转导和光合作用等关键代谢过程所必需的常量营养元 素。它还在植物的呼吸作用和豆科作物的固氮作用中发挥作用。虽然土壤中含有 大量磷化合物,然而植物能真正利用的可溶性磷却非常少。因为土壤中的大部分 的磷以难溶态形式存在,而只有磷酸盐形式的磷源能被植物吸收。
4.微生物和植物紧密相关,微生物或正面或负面的影响植物的生长发育。受植 物根系分泌物的影响,土壤中的微生物与植物根际及根系建立稳定的共生关系, 有一些细菌能够侵染植物根系,定殖到植株内部。中国发明专利, cn104830728a,公开了一种雷氏普罗威登斯菌,该菌株能够与海水鱼类盾纤 毛虫病原共培养时,能够在24小时内杀灭共培养体系中97%以上的盾纤毛虫。 但该菌株不耐镉,不能溶解难溶性磷而让植物吸收利用磷,不能解决植物的镉毒 胁迫和低磷胁迫的技术问题。
技术实现要素:
5.本发明的目的是提供一株新的雷氏普罗威登斯菌(providencia sp.)菌株 mrp36,该菌株与植物共生,能解决植物低磷胁迫和镉毒胁迫的技术问题。该菌 株具有分泌生长素、耐酸、耐镉、溶磷和产铁载体的特性。大豆接种该雷氏普罗 威登斯菌能提高大豆的生物量(干重)、显著提高叶绿素spad值和磷含量、促 进大豆根生长;而且能克服镉对大豆生长抑制的作用,尤其是克服镉对大豆根系 生长的抑制作用。
6.本发明的目的是提供雷氏普罗威登斯菌(providencia sp.)菌株mrp36。
7.本发明的另一目的是提供雷氏普罗威登斯菌(providencia sp.)菌株mrp36 在培育耐镉毒植物方面的应用。
8.本发明的另一目的是提供雷氏普罗威登斯菌(providencia sp.)菌株mrp36 在减弱镉抑制植物生长方面的应用。
9.本发明的另一目的是提供雷氏普罗威登斯菌(providencia sp.)菌株mrp36 在促进植物叶片合成叶绿素方面的应用。
10.本发明的另一目的是提供雷氏普罗威登斯菌(providencia sp.)菌株mrp36 在促进植物吸收磷方面的应用。
11.本发明的另一目的是雷氏普罗威登斯菌(providencia sp.)菌株mrp36在制 备适
mgso4·
7h2o,4.5
×
10
‑3mm mncl2·
4h2o,0.3
×
10
‑3mmznso4·
7h2o,0.16
×
10
‑3mm cuso4·
5h2o,0.16
×
10
‑3mm(nh4)6mo7o
24
·
4h2o, 20
×
10
‑3mm h3bo3,50
×
10
‑3mm kh2po4。
29.本发明具有以下有益效果:
30.本发明提供了一株耐镉促生雷氏普罗威登斯菌菌株mrp36,其与植物共生, 能够:
31.(1)促进植物生长,促进植物吸收磷含量,提高其生物量和叶绿素spad, 尤其适用于大豆科植物。
32.(2)提高植物的耐镉毒能力,克服镉对植物的生长抑制作用,尤其是克服 镉对大豆的生长抑制作用。
33.(3)该菌株具有分泌生长素、耐酸、耐隔、溶磷和产铁载体的特性。
附图说明
34.图1显示雷氏普罗威登斯菌菌株mrp36的溶磷圈。
35.图2显示雷氏普罗威登斯菌菌株mrp36在不同色氨酸浓度下产生iaa。
36.图3显示雷氏普罗威登斯菌菌株mrp36产生iaa的定量图,图中字母a、b、 c和d代表方差分析后各样本平均数间是否有显著差异,组间字母相同代表组间 差异不显著(p>0.05),字母不相同代表组间差异显著(p<0.05)。
37.图4显示雷氏普罗威登斯菌菌株mrp36的耐镉曲线(od
600
‑
镉浓度),图 中字母a、b和c代表方差分析后各样本平均数间是否有显著差异,组间字母相 同代表组间差异不显著(p>0.05),字母不相同代表组间差异显著(p<0.05)。
38.图5显示雷氏普罗威登斯菌菌株mrp36的耐酸曲线(od
600
‑
ph),图中字 母组合a、ab、bc和c代表方差分析后各样本平均数间是否有显著差异,组间字 母相同代表组间差异不显著(p>0.05),字母不相同代表组间差异显著(p<0.05)。
39.图6显示雷氏普罗威登斯菌菌株mrp36的发育进化树。
40.图7显示雷氏普罗威登斯菌菌株mrp36的大豆在镉毒胁迫下,其植株干重 (a)、株高(b)和spad值(c)的变化。
41.图8显示接种雷氏普罗威登斯菌菌株mrp36的大豆在镉毒胁迫下,其根长 (a)、根表面积(b)、根直径(c)和根体积(d)的变化。
42.图9显示接种雷氏普罗威登斯菌菌株mrp36的大豆在镉毒胁迫下,其地上 部镉浓度(a)和根部镉浓度(b)的变化。
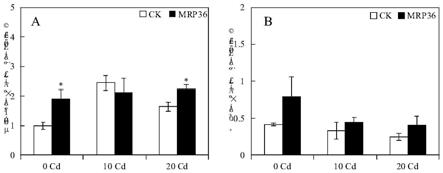
43.图10显示接种雷氏普罗威登斯菌菌株mrp36的大豆在镉毒胁迫下,其地上 部磷含量(a)和根部磷含量(b)的变化。
44.图中*:0.01<p<0.05,**:0.001<p<0.01,***:p<0.001。
具体实施方式
45.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本 发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技 术领域常规试剂、方法和设备。除非特别说明,以下实施例所用试剂和材料均为 市购。
46.实施例1:菌株的分离纯化
47.1.菌株的分离及纯化
48.在韶关市曲江区北约村,从镉污染土上种植的玉米(正甜68)的玉米根际 分离菌株。分别剪取5g玉米根,用小刷子刷去表层土壤,无菌水漂洗多次至无 附着土后,置于盛有100ml灭菌水的250ml编号序号的三角形瓶中,180r/min, 37℃摇床,摇30min。锥形瓶内添加10
‑
20颗玻璃珠帮助打碎土壤,使细菌能 够从土壤中释放出来,震荡结束后,将土壤悬液静置10min,得到土壤悬浮液, 取上清液,进行10倍系列梯度浓度稀释,稀释至10
‑1、10
‑2、10
‑3、10
‑4、10
‑5、 10
‑6,然后吸取稀释液0.1ml涂布于lb平板,每个浓度梯度三次重复,37℃条 件下倒置培养,观察菌落生长情况,挑取不同表型的单克隆,给每种菌落在培养 基背面编号,并记录菌落形态和长出菌落的时间,每种类型挑取单克隆到1.5ml 离心管中摇菌,在180r/min,37℃条件下培养,再经lb固体培养基划线纯化 3
‑
4次后(直至显微镜下菌落形态一致,说明已纯化完成),加入浓度为25%灭 菌甘油于
‑
80℃保藏待用。
49.结果在玉米根际离到55株菌株,编号mrp1~55,此为分离纯化出来的待测 菌株。
50.实施例2:菌株筛选
51.2.1溶磷菌的初筛
52.将筛选出的菌株接种于pko固体培养基上,每个平板点接三次,28℃培养 箱培养,在第7d测量菌株溶磷圈外直径(d)和菌落直径(d)的大小并拍照, 有溶磷圈的即能够溶磷。然后比较(d/d)的比值,对菌株的溶磷能力进行判断。
53.吸取1ml具溶磷圈的菌株的菌液,接种于20ml lb液体培养基中(50ml 的离心管),24h培养后,测定od
600
为1.0左右,取1ml菌重悬液接种于20mlpko液体培养基中(50ml的离心管),每个菌株三次重复,ck对照组为接种 等量的无菌水,放置在28℃,180r/min摇床中培养。在第7d测定pko液体培 养基的ph值,并吸取1ml上清液(1200r/min,离心5min)到25ml容量瓶 待测,吸取5ml钼锑抗显色液,用二级水定容至25ml,反应30min后,使用 酶标仪测定880nm处的吸光度值(为了去除培养基颜色的影响,应用880nm测 定,通过换算公式,得出在标准曲线(y=0.4833x+0.0002(r2=0.9997)。换 算得到相应的磷浓度(mg/l)。
54.结果:发现菌株mrp36的溶磷圈比值大于1.5(图1和表1)。在溶磷定量 试验中,菌株mrp36表现出较强的溶磷能力,可溶解到33.42
±
1.46mg/ml的磷。
55.表1
56.菌株编号d(cm)d(cm)d/d溶解磷浓度(mg/ml)mrp361.000.701.4333.42
±
1.46
57.2.2分泌iaa的筛选
58.配制含l
‑
色氨酸浓度分别为0、100、200、500mg/l lb液体培养基,将筛 选出的菌株接种于液体培养基中,每个菌株三次重复(以不接菌的相同培养基作 为空白对照),在28℃,180r/min下培养2d,每个重复取200μl上清液,加 入200μl的salkowski显色液到96孔酶标板中,并以加入未接菌相同液体培养 基与200μl的salkowski显色液为对照,室温避光放置20min后,使用酶标仪 在530nm下测其波长。在标准曲线上查出相应的iaa产量。iaa产量单位为 mg/ml。
59.定性结果显示(图2),在0
‑
500mg/l的l
‑
色氨酸浓度条件下,随着l
‑
色 氨酸浓度的提高,各菌株分泌iaa的能力也越强。其中菌株mrp36产iaa含 量最高,最高可产生48.27mg/l的iaa,即使在色氨酸浓度为0的条件下,依 然能够产生较高的iaa(图3),说明其能够利用非色氨酸途径来产生iaa。
60.2.3产铁载体能力的筛选
61.吸取1ml待测菌株的菌悬液,接种于mkb液体培养基中。在28℃,180r/min 下培养48h。培养液离心10min(1200r/min),取200μl上清液(参比值(ar) 为测定时加入200μl未接种的mkb液体培养基),按照1:1的比例与cas检 测液混合。常温反应1h后,酶标仪测定630nm下波长od值(a)。实验中, 若不产铁载体,则cas液体培养基和对照一样呈蓝色,若菌株产铁载体,则cas 液体培养基变化为橘黄色。以a/ar的比值表示样品中铁载体的相对含量,值越 小,则表示菌株产铁载体的能力越强,以(ar
‑
a)/ar的比值表示样品中铁载体 的活性单位,活性单位越高,产铁载体能力越强。
62.结果发现,mrp36菌株在mrp1~55菌株中产铁载体的活性单位较高,达到 37.50%。
63.2.4耐镉能力筛选
64.分别配制镉浓度为0、4、8、12、16、20mg/l的6个lb液体培养基,121℃, 20min灭菌。准备2个96孔灭菌细胞培养板,吸取配制好的不同镉浓度的lb 液体培养基各200μl到培养板。待测菌株活化培养24h后,每个菌株吸取5μl 到不同镉浓度值的培养孔中,每个菌株4次重复,37℃,180r/min下培养48h, 测定菌液在600nm下的吸光值。
65.结果:在0
‑
8mg/l cd浓度条件下,mrp36的生长速度几乎不变,耐镉性较 强(图4)。
66.5.耐酸能力筛选
67.分别配制ph至4.5、5.0、5.5、6.0、6.5、7.0的6个lb培养基,121℃,20 min灭菌。准备2个96孔灭菌细胞培养板,吸取配制好的不同ph的lb液体培 养基各200μl到培养板。待测菌株活化培养24h后,每个菌株吸取5μl到不同 ph值的培养孔中,每个菌株4次重复,37℃,180r/min下培养48h,测定菌液 在600nm下的吸光值。
68.菌株mrp36在ph为4.5
‑
7.0之间生长速度差异不大(图5),说明这该菌 株在弱酸性条件下也能够生长的很好。
69.实施例3菌株鉴定
70.经过多方面综合考虑,对筛选的菌株mrp36进行鉴定。
71.3.1菌株的形态学鉴定
72.将菌株mrp36接种在lb固体培养基上进行培养,并观察记录。在最适生 长条件(ph 7.0,温度37℃)培养5~7天后,将分离并纯化得到的菌株mrp36 进行单菌落状态观察,主要包括菌落的大小、颜色、菌落表面状态和菌落边缘状 态等。另一方面,对处于对数生长期的菌株mrp36,经涂片染色后采用光学显 微镜观察菌体的形态。
73.在lb平板培养基上,形成近似圆状,光滑,突起,乳白色菌落,革兰氏染 色为红色,革兰氏阴性菌。
74.3.2分子鉴定
75.经过多方面筛选和综合考虑,筛选菌株mrp36进行鉴定并继续研究。将菌 株接种于lb培养基中37℃,180r/min培养24小时后,采用细菌总dna提取 试剂盒提取菌株的总dna,送生物公司进行测序,将得到的菌株序列在ncbi 数据库进行blast序列比对分析,使用mega7.0构建系统发育进化树(图6)。
76.根据测序结果显示mrp36为雷氏普罗威登斯菌(providencia sp.),其16s rdna序列如seq id no.1所示;并将该雷氏普罗威登斯菌(providencia sp.)菌 株mrp36于2021年
5月11日保藏于广东省微生物菌种保藏中心,保藏号为 gdmcc no:61650。
77.实施例4雷氏普罗威登斯菌mrp36的回接大豆试验
78.4.1回接试验
79.本研究采用基质土盆栽试验。实验设置三种镉浓度组,分别为0、10、20mg/kgcdcl2·
5/2h2o,接种菌株mrp36,且每盆均为低磷处理,每个处理4个重复, 具体如下。
80.基质和蛭石的混合基质处理方法:称取无肥基质和蛭石按照3:1混合(0.5 kg混合土=0.125kg蛭石+0.375kg基质),121℃灭菌40min,间隔24h后重 复一次灭菌,放置一周后备用。取容量2l的花盆,用10%的次氯酸钠浸泡过夜 后用清水充分冲洗数次,风干备用。称取定量氯化镉溶于水,配制0、10、20mg/kg 的溶液,量取一定体积倒入混合基质中,同时每盆(0.5kg)混入125mg ca3(po4)
2 (相当于纯磷50mg/kg),每盆称取混匀,静置一周待用。
81.种子用盐酸
‑
次氯酸钠产生氯气灭菌4h,用粗砂:中砂=1:2的混合砂来育 苗,育苗一周后,挑选生长基本一致的大豆植株(巴西10),每盆移栽一株。 移苗后1、3、5天浇灌菌悬液,一次100ml,合计3次。
82.菌悬营养液的配制:菌株接种于装有250ml lb培养液,在37℃摇床中, 180r/min振荡培养18h左右,待菌液浑浊测定od
600
在0.6到1.0之间,离心收 集菌体用低磷营养液重悬,用灭菌枪头拨开幼苗根部表面基质。将菌重悬营养液 倒入根部,菌体随营养液浇灌到基质中。
83.其中所述的低磷营养液的配方为:2.5mm kno3,2.5mm ca(no3)2·
4h2o, 0.08mm fe
‑
na
‑
edta,0.25mm k2so4,1mm mgso4·
7h2o,4.5
×
10
‑3mmmncl2·
4h2o,0.3
×
10
‑3mm znso4·
7h2o,0.16
×
10
‑3mm cuso4·
5h2o,0.16
×
10
‑
3 mm(nh4)6mo7o
24
·
4h2o,20
×
10
‑3mm h3bo3,50
×
10
‑3mm kh2po4。
84.4.2指标检测
85.培养大豆30天后收获。在光照充足的条件下用spad仪测量植株倒三叶不 同部位的spad值后取平均值。自来水冲洗干净后先放到冷库,一周内及时进行 扫描。用台式扫描仪(epson1460xl)扫描根系,根系尽量平展铺开,使其不重 叠,根系过大的可剪开扫描,不影响其扫描结果,盖上蓝色遮光板,扫描完成后, 经过根系分析软件winrhizo(regent instruments inc.,加拿大)分析各个样品根 的根系性状,
86.将作物地上部和根部分开,称取地上部和根部鲜重,地上部分放入105℃烘 箱杀青30min后,在烘箱烘干后,取出在室温下放置10min冷却后称量干重。 根部先用根系扫描仪进行扫描,并称重,其余部分同样经过杀青后烘干,称干重。
87.再将大豆根部浸泡在10mmol/l na2‑
edta溶液中5min以除去表面吸附的 cd
2+
,然后用二级水水冲洗干净,将根系与茎叶部分开75℃烘干称取干重后测定 地上部磷含量和镉浓度;根部放冷库用于扫根,扫完后烘干称重,测定根部磷含 量和镉浓度。磷检测采用紫外分光光度法,镉检测采用原子吸收分光光度计火焰 吸收法。
88.结果如下:
89.(1)在0mg/kg cd
2+
和20mg/kg cd
2+
条件下,接种了菌株mrp36的大豆植 株干重显著高于不接菌处理,高出28%和29%,表明接种mrp36能够促进大豆 生长且缓解大豆镉毒害(图7a)。
90.(2)在0mg/kg cd
2+
和20mg/kg cd
2+
条件下,接种mrp36菌株的大豆与 ck大豆株高
相比显著增加了,分别增加了21%和23%(图7b)。
91.(3)mrp36接菌处理的大豆spad值显著高于ck不接菌处理,高出了20% (图7c)。
92.(3)在20mg/kg cd
2+
条件下,接种mrp36菌株处理的大豆总根长与ck 组有极显著差异,增加了180%,根表面积;接菌处理大豆根表面积与ck组有 极显著差异,增加了212%;接菌处理大豆平均根直径与ck组有极显著差异, 增加了25%;接菌处理大豆根体积与ck组有极显著差异,增加了249%,表明 高浓度镉条件下,mrp36菌株能减弱镉对根生长的抑制作用,甚至利用镉促进 根系生长(图8)。
93.(5)0mg/kg cd
2+
条件下,对比ck不接菌,接种mrp36菌株的大豆地上 部镉浓度显著上升,但不影响根的镉浓度,但在20mg/kg cd
2+
条件下,对比ck 不接菌,接菌后根部镉浓度显著减少了38%,表明mrp36能够缓解大豆根部镉 毒害(图9)。
94.(6)0mg/kg cd
2+
条件下,对比ck不接菌,mrp36处理的地上部磷含量 显著提高了93%,根的磷含量显著提高了60%。在高浓度镉(20cd)条件下, mrp36仍能有效提高大豆根部磷含量(图10)。
95.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施 例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替 代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1