一种胶原蛋白-改性壳聚糖双网络水凝胶、生物墨水、制备方法和应用与流程
一种胶原蛋白
‑
改性壳聚糖双网络水凝胶、生物墨水、制备方法和应用
技术领域
1.本发明涉及新材料和生物技术领域,具体而言,涉及一种胶原蛋白
‑
改性壳聚糖双网络水凝胶、生物墨水、制备方法和应用。
背景技术:
2.胶原蛋白(collagen,col)作为人体细胞外基质的主要物质之一,属于结构蛋白质,是构成皮肤、韧带、软骨和肌腱等结缔组织或器官的主要成分。胶原蛋白可以用于制备胶原蛋白水凝胶,其独特的理化性质、优良的生物相容性、可降解性和低免疫原性使其在高端医疗领域和人体组织修复的支架产品等领域应用广泛。目前使用较多的胶原蛋白为猪源胶原和牛源胶原,这些胶原存在价格高、来源少的问题,同时还具有一定致病或致敏因素。
3.通过改变胶原蛋白来源、溶解度、聚合温度和ph值等参数,可以对胶原蛋白水凝胶的纤维结构和机械强度进行调整。以满足不同组织工程应用的需要。经过多年的大量研究,人们提出了胶原蛋白水凝胶的各种不同的制备方法,主要包括物理交联法和化学交联法。物理交联法常用的技术手段包括干热交联处理、辐射、光氧化以及热脱氢等,但这类方法存在辐射、光强度等条件的量不易控制、交联度不均匀的情况;化学方法由于其改性物质的多样性,选择更广,主要有金属离子、戊二醛、环氧化合物碳化二酰亚胺(edc)/n
‑
羟基琥珀酰亚胺(nhs)等,但这些改性剂在体内存在细胞毒性,影响细胞的吸附、增殖和生长。
4.因此,选择何种交联方式对于胶原蛋白水凝胶的医疗性能具有较大的影响。目前使用较为广泛且能解决细胞毒性问题的是天然多糖类物质,这类物质在自然界中广泛存在,价格低廉,由于其上含有高度亲水基团,生物相容性好,但存在机械性能不足等缺陷。
5.因此,如果能将胶原蛋白和壳聚糖有效结合起来,将可能解决两种原料的缺陷,得到一种新型的生物材料。
技术实现要素:
6.本发明的目的在于提供一种胶原蛋白
‑
改性壳聚糖双网络水凝胶,通过以混合胶原蛋白构建刚性第一网络,以改性壳聚糖构建柔性第二网络,其孔径和孔隙率更利于干细胞在其中吸附、增殖和生长,机械性能良好,免疫源性低。
7.本发明的另一目的在于提供一种前述胶原蛋白
‑
改性壳聚糖双网络水凝胶的制备方法,该制备方法在壳聚糖水凝胶的基础上构建胶原蛋白凝胶,便于壳聚糖水凝胶粘附在混合胶原蛋白上,形成三维网状结构。
8.本发明的另一目的在于提供一种含有前述胶原蛋白
‑
改性壳聚糖双网络水凝胶的细胞凝胶。
9.本发明的另一目的在于提供一种胶原蛋白
‑
改性壳聚糖双网络水凝胶在组织支架中的应用。
10.本发明解决其技术问题是采用以下技术方案来实现的。
11.一方面,本技术实施例提供一种胶原蛋白
‑
改性壳聚糖双网络水凝胶,包括由混合胶原蛋白水凝胶构建的第一网络和由改性壳聚糖构建的第二网络,所述混合胶原蛋白包括鱼源胶原蛋白和猪源胶原蛋白,所述改性壳聚糖经柠檬酸改性制备而成。
12.另一方面,本发明实施例提供一种前述胶原蛋白
‑
改性壳聚糖双网络水凝胶的制备方法,将改性壳聚糖水凝胶与混合胶原蛋白溶液共混至均匀,加入胶原蛋白交联剂交联后得到所述胶原蛋白
‑
改性壳聚糖双网络水凝胶。
13.另一方面,本发明实施例提供一种含有前述胶原蛋白
‑
改性壳聚糖双网络水凝胶的细胞凝胶,即为可以用于3d生物打印的生物墨水。
14.另一方面,本发明实施例提供一种前述胶原蛋白
‑
改性壳聚糖双网络水凝胶在组织支架中的应用。
15.综上,相对于现有技术,本发明的实施例至少具有如下优点或有益效果:
16.本发明提供的一种胶原蛋白
‑
改性壳聚糖双网络水凝胶以混合胶原蛋白为第一网络,机械性能良好,脆性低,韧性好,可用作体内软组织的再生等组织支架的制备,其良好的机械性能能为柔性的第二网络提供足够的支撑,便于第二网络与第一网络的交叉支撑形成3d网络结构。同时,本发明提供的胶原蛋白
‑
改性壳聚糖双网络水凝胶以改性壳聚糖为柔性的第二网络,壳聚糖经柠檬酸改性后能够在保留其良好生物相容性的基础上,提升其孔径和孔隙率,进一步增大单位空间内细胞的黏附空间,同时也能便于为细胞提供充足的养分和生物活性因子,促进其增殖。由于该胶原蛋白
‑
改性壳聚糖双网络水凝胶的良好的机械性能、韧性和生物相容性,低免疫原性,使得该胶原蛋白
‑
改性壳聚糖双网络水凝胶可用于制备体内软组织等类器官,细胞生长状态良好,在体内的排异性极低,减少手术风险。
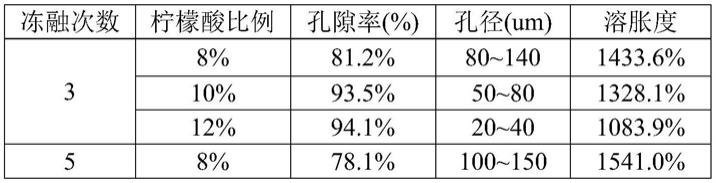
17.本发明提供的前述胶原蛋白
‑
改性壳聚糖双网络水凝胶,先以循环冷冻物理交联方法制备改性壳聚糖水凝胶,再在壳聚糖水凝胶的基础上以混合胶原蛋白构建第一网络,可得到机械性能和韧性好的三维网络支架,同时该制备方法简单,工序少,便于推广。
具体实施方式
18.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
19.一方面,本技术实施例提供一种胶原蛋白
‑
改性壳聚糖双网络水凝胶,包括由混合胶原蛋白水凝胶构建的第一网络和由改性壳聚糖构建的第二网络,所述混合胶原蛋白包括鱼源胶原蛋白和猪源胶原蛋白,所述改性壳聚糖经柠檬酸改性制备而成。
20.在本发明的一些实施例中,上述胶原蛋白
‑
改性壳聚糖双网络水凝胶,所述混合胶原蛋白与改性壳聚糖的质量比为(4~6):1。
21.在本发明的一些实施例中,上述胶原蛋白
‑
改性壳聚糖双网络水凝胶,所述鱼源胶原蛋白和猪源胶原蛋白的重量比为(2~4):1。
22.另一方面,本发明实施例提供一种前述胶原蛋白
‑
改性壳聚糖双网络水凝胶的制备方法,将改性壳聚糖水凝胶与混合胶原蛋白溶液共混至均匀,加入胶原蛋白交联剂交联后得到所述胶原蛋白
‑
改性壳聚糖双网络水凝胶。
23.在本发明的一些实施例中,上述制备方法中,所述冻融包括先于
‑
20℃冷冻12h,再在常温解冻12h。
24.在本发明的一些实施例中,上述制备方法中,所述混合胶原蛋白溶液通过如下步骤制备而成,将鱼源胶原蛋白和猪源胶原蛋白加入1%醋酸溶液中,共混1.5~2h,得到所述混合胶原蛋白溶液。
25.在本发明的一些实施例中,上述制备方法中,所述改性壳聚糖水凝胶通过如下步骤制备而成,将壳聚糖溶于醋酸,得到壳聚糖溶液,向所述壳聚糖溶液中加入8~10wt%柠檬酸,反复冻融3~7次后,向融化后的水凝胶中加入催化剂进行缩合反应,得到所述改性壳聚糖水凝胶。
26.另一方面,本发明实施例提供一种含有前述胶原蛋白
‑
改性壳聚糖双网络水凝胶的细胞凝胶。
27.在本发明的一些实施例中,上述细胞凝胶,所述细胞为干细胞。
28.另一方面,本发明实施例提供一种前述胶原蛋白
‑
改性壳聚糖双网络水凝胶在组织支架中的应用。
29.以下结合实施例对本发明的特征和性能作进一步的详细描述。
30.实施例1
31.本实施例的目的在于制备鱼源蛋白和猪源蛋白的混合胶原蛋白冻干粉。
32.(1)按量称取鱼源胶原蛋白,将鱼源胶原蛋白溶于1wt%的醋酸溶液, 40℃恒温水浴加热,充分溶解鱼源胶原蛋白,得到10wt%鱼源胶原蛋白溶液;
33.(2)按量称取猪源胶原蛋白,将猪源胶原蛋白溶于1wt%的醋酸溶液, 70℃恒温水浴加热,充分溶解猪源胶原蛋白,得到10wt%猪源胶原蛋白溶液;
34.(3)将前述鱼源胶原蛋白溶液和猪源胶原蛋白溶液分别按照体积比 2:1、3:1和4:1混合均匀,得到三种不同比例的混合溶液一;
35.(4)将三种不同比例的混合溶液一于搅拌状态下分别共混1.5h,再加入胶原蛋白交联剂在37℃下反应24h,即为所述混合胶原蛋白凝胶。
36.(5)将所述混合胶原蛋白凝胶排除气泡后,于
‑
20℃预冷冻2h,然后在冷冻干燥机内冷冻干燥,冷冻干燥机内条件为
‑
80℃冷冻12h,然后真空干燥24~48h得到所述混合胶原蛋白海绵冻干粉。
37.(6)取5mg步骤(1)中所用的鱼源胶原蛋白、猪源胶原蛋白,以及步骤(5)中制备的三种不同比例的混合胶原蛋白海绵冻干粉,密封于示意差扫描量热仪(dsc)的坩埚内,并以空坩埚为参比,以5℃/min的升温速率测定混合胶原蛋白的热变形曲线,测试温度范围为20~90℃。
38.(7)取步骤(1)中所用的鱼源胶原蛋白、猪源胶原蛋白,以及步骤 (5)中制备的三种不同比例的混合胶原蛋白海绵冻干粉(分别计为m0),分别于37℃pbs缓冲液(ph 7.3~7.5)中浸泡,6h后除去表面水分,得到溶胀胶原蛋白(分别计为m1),计算各组m1相对于m0的变化率。
39.表1
40.鱼源/猪源比热变性温度热失重率1:048℃16%
2:149.2℃14%3:156℃12.0%4:162℃12.3%0:172℃12.5%
41.当胶原海绵被加热时,随着外界能量的增加,胶原会伴随能量的吸收,存在化学键的断裂。由表1可知,混合胶原蛋白中适当增加猪源胶原蛋白,可以显著提高混合胶原蛋白海绵冻干粉的热变性温度,并且猪源胶原蛋白的加入可以显著增加鱼源胶原蛋白的机械性能,而鱼源胶原蛋白可增加混合胶原蛋白的韧性。两种胶原蛋白混合重组,使得混合胶原蛋白海绵冻干粉的结构更加均匀,利于吸水和保水,其吸水和保水最高值显著高于单一胶原。
42.实施例2
43.本实施例的目的在于探索改性壳聚糖溶液及改性壳聚糖单凝胶冻干粉。
44.(1)称取1g壳聚糖,加入1.2wt%醋酸溶液中溶解,制得3wt%壳聚糖溶液;
45.(2)将步骤(1)中制备的壳聚糖溶液于60℃加入柠檬酸,柠檬酸的添加比例为8%、10%和12%,充分搅拌去除各组气泡;
46.(3)将步骤(2)中去除气泡后的壳聚糖溶液置于
‑
20℃的冰箱中冷冻 12h,再在常温解冻12h;
47.(4)重复步骤(3)3~7次,得到初始的水凝胶;
48.(5)将步骤(4)中最终得到的解冻后的水凝胶进行缩合反应,得到改性壳聚糖水凝胶;
49.(6)将所述改性壳聚糖水凝胶排除气泡后,于
‑
20℃预冷冻2h,然后冷冻干燥机内冷冻干燥,冷冻干燥机内条件为
‑
80℃冷冻12h,然后真空干燥24~48h得到所述改性壳聚糖海绵冻干粉。
50.(7)取步骤(6)中的改性壳聚糖海绵冻干粉,用液氮脆断,再进行喷金,在扫描电镜下对样品进行观察,检测各组改性壳聚糖海绵冻干粉的孔径情况。
51.(8)在比重瓶中装满无水乙醇,称取比重瓶和乙醇的总质量记录为 w1,并将事先称好的冷冻干燥的样品浸没于乙醇中,小心擦去溢出的乙醇,称量此时比重瓶的重量记录为w2,静置40min,取出样品,称取比重瓶和剩余乙醇的量记录为w3,孔隙率=(w2
‑
w3)/(w2
‑
w1)*100%。
52.(9)称取一定质量步骤(6)中制备的改性壳聚糖海绵冻干粉,各组重量记录为w0,将前述各组改性壳聚糖海绵冻干粉制备的水凝胶置于ph 为7.4的pbs溶液中,每隔半小时取出水凝胶,测量其重量w2,直至检测到最大的wd2,溶胀度计算公式为a=(wd2
‑
w0)/w0*100%。
53.不同循环冻融次数得到的改性壳聚糖海绵冻干粉的孔隙率、孔径和溶胀率测定结果如表2所示:
54.表2
[0055][0056][0057]
由上表可知,提高柠檬酸的比例,可以增大改性壳聚糖水凝胶的孔径,同时增加孔隙率,随着孔隙率的增加,溶胀度也随之降低,表明壳聚糖与柠檬酸之间的酰胺反应,可以促使水凝胶的微观结构更为致密,有利于提升其机械性能。增加循环冻融次数,有利于形成更大的孔径。综合来看,以冻融5次,柠檬酸比例为10%时,其孔径、孔隙率和溶胀度性能最优,整体利于后续用于制备支架类材料。
[0058]
实施例3
[0059]
本实施例的目的在于制备一种胶原蛋白
‑
改性壳聚糖双网络凝胶。
[0060]
(1)按量称取鱼源胶原蛋白,将鱼源胶原蛋白溶于1wt%的醋酸溶液, 40℃恒温水浴加热,充分溶解鱼源胶原蛋白,得到10wt%鱼源胶原蛋白溶液;按量称取猪源胶原蛋白,将猪源胶原蛋白溶于1wt%的醋酸溶液,70℃恒温水浴加热,充分溶解猪源胶原蛋白,得到10wt%猪源胶原蛋白溶液;
[0061]
(2)将前述鱼源胶原蛋白溶液和猪源胶原蛋白溶液分别按照体积比3:1混合均匀,得到混合胶原蛋白溶液;
[0062]
(3)称取1g壳聚糖,加入1.2wt%醋酸溶液中溶解,制得3wt%壳聚糖溶液,将所述3wt%壳聚糖溶液于60℃加入柠檬酸,柠檬酸的添加比例为10%,充分搅拌去除各组气泡,置于
‑
20℃的冰箱中冷冻12h,再在常温解冻12h,重复冻融5次,得到初始的水凝胶,再向该水凝胶中加入催化剂进行缩合反应,得到改性壳聚糖水凝胶;
[0063]
(4)将步骤(2)中制备的混合胶原蛋白溶液加入步骤(4)中制备的改性壳聚糖水凝胶中,改性壳聚糖水凝胶的浓度为2wt%,混合胶原蛋白溶液的浓度为8%,于搅拌状态下共混1.5h,再加入胶原蛋白交联剂在37℃下反应24h,得到所述胶原蛋白
‑
改性壳聚糖双网络水凝胶。
[0064]
(5)冷冻干燥机内条件为
‑
80℃冷冻12h,然后真空干燥24~48h得到所述胶原蛋白
‑
改性壳聚糖双网络水凝胶冻干粉。
[0065]
实施例4
[0066]
本实施例的目的在于制备一种胶原蛋白
‑
改性壳聚糖双网络凝胶。
[0067]
(1)按量称取鱼源胶原蛋白,将鱼源胶原蛋白溶于1wt%的醋酸溶液, 40℃恒温水浴加热,充分溶解鱼源胶原蛋白,得到10wt%鱼源胶原蛋白溶液;按量称取猪源胶原蛋白,将猪源胶原蛋白溶于1wt%的醋酸溶液,70℃恒温水浴加热,充分溶解猪源胶原蛋白,得到10wt%猪源胶原蛋白溶液;
[0068]
(2)将前述鱼源胶原蛋白溶液和猪源胶原蛋白溶液分别按照体积比 3:1混合均匀,得到混合胶原蛋白溶液;
[0069]
(3)称取1g壳聚糖,加入1.2wt%醋酸溶液中溶解,制得3wt%壳聚糖溶液,将所述3wt%壳聚糖溶液于60℃加入柠檬酸,柠檬酸的添加比例为10%,充分搅拌去除各组气泡,置于
‑
20℃的冰箱中冷冻12h,再在常温解冻12h,重复冻融5次,得到初始的水凝胶,再向该水凝胶中加入催化剂进行缩合反应,得到改性壳聚糖水凝胶;
[0070]
(4)将步骤(2)中制备的混合胶原蛋白溶液加入步骤(4)中制备的改性壳聚糖水凝胶中,改性壳聚糖水凝胶的浓度为2wt%,混合胶原蛋白溶液的浓度为10%,于搅拌状态下共混1.5h,再加入胶原蛋白交联剂在37℃下反应24h,得到所述胶原蛋白
‑
改性壳聚糖双网络水凝胶。
[0071]
(5)冷冻干燥机内条件为
‑
80℃冷冻12h,然后真空干燥24~48h得到所述胶原蛋白
‑
改性壳聚糖双网络水凝胶冻干粉。
[0072]
实施例5
[0073]
本实施例的目的在于制备一种胶原蛋白
‑
改性壳聚糖双网络凝胶。
[0074]
(1)按量称取鱼源胶原蛋白,将鱼源胶原蛋白溶于1wt%的醋酸溶液, 40℃恒温水浴加热,充分溶解鱼源胶原蛋白,得到10wt%鱼源胶原蛋白溶液;按量称取猪源胶原蛋白,将猪源胶原蛋白溶于1wt%的醋酸溶液,70℃恒温水浴加热,充分溶解猪源胶原蛋白,得到10wt%猪源胶原蛋白溶液;
[0075]
(2)将前述鱼源胶原蛋白溶液和猪源胶原蛋白溶液分别按照体积比 3:1混合均匀,得到混合胶原蛋白溶液;
[0076]
(3)称取1g壳聚糖,加入1.2wt%醋酸溶液中溶解,制得3wt%壳聚糖溶液,将所述3wt%壳聚糖溶液于60℃加入柠檬酸,柠檬酸的添加比例为10%,充分搅拌去除各组气泡,置于
‑
20℃的冰箱中冷冻12h,再在常温解冻12h,重复冻融5次,得到初始的水凝胶,再向该水凝胶中加入催化剂进行缩合反应,得到改性壳聚糖水凝胶;
[0077]
(4)将步骤(2)中制备的混合胶原蛋白溶液加入步骤(4)中制备的改性壳聚糖水凝胶中,改性壳聚糖水凝胶的浓度为2wt%,混合胶原蛋白溶液的浓度为12%,于搅拌状态下分别1.5h,再加入胶原蛋白交联剂在37℃下反应24h,得到所述胶原蛋白
‑
改性壳聚糖双网络水凝胶。
[0078]
(5)冷冻干燥机内条件为
‑
80℃冷冻12h,然后真空干燥24~48h得到所述胶原蛋白
‑
改性壳聚糖双网络水凝胶冻干粉。
[0079]
实施例6
[0080]
本实施例的目的在于比较不同来源凝胶中的干细胞的生长情况。
[0081]
1、制备干细胞
[0082]
将人间充质干细胞从液氮中取出,在37℃水浴锅中预热解冻,除去冻存液,移入培养基中,将培养基置于37℃,5%co2条件下进行培养。
[0083]
2、制备水凝胶
[0084]
对照组1:取实施例1中制备的混合胶原蛋白海绵冻干粉溶于pbs溶液,制成混合胶原蛋白水凝胶。
[0085]
对照组2:取实施例2中制备的改性壳聚糖海绵冻干粉溶于pbs溶液,制成改性壳聚
糖水凝胶。
[0086]
实验组:取实施例3~5中制备的胶原蛋白
‑
改性壳聚糖双网络水凝胶冻干粉溶于pbs溶液,制成3组胶原蛋白
‑
改性壳聚糖双网络水凝胶。
[0087]
3、制备细胞凝胶
[0088]
实验组:将步骤1中培养的间充质干细胞重悬于步骤2中各组凝胶中,并使凝胶内的细胞密度为4
×
106/ml。将凝胶移入12孔板培养,每孔加入 2ml dmem培养基培养,每48h换入新鲜的完全培养基,培养温度为37℃, co2浓度为5%。
[0089]
mtt实验:将各组的凝胶取出置于新的48孔板内,每孔加入300μl mtt工作液,置于培养箱孵育6h。孵育结束后吸出含有mtt的培养基,每孔加入500μl dmso,置于摇床持续晃动60min。待凝胶中的紫色结晶完全溶于dmso后,从每个孔中抽取150μl溶有mtt结晶的dmso移入新的96孔板。将孔板置于酶标仪,检测490nm波长吸光度,统计阳性细胞率,结果如下:
[0090]
表3
[0091]
组别细胞增殖率(%)对照组115对照组225实验组1(实施例3)48实验组2(实施例4)60实验组3(实施例5)54
[0092]
由上表可知,实施例2中提供的胶原蛋白
‑
改性壳聚糖双网络水凝胶更利于间充质干细胞的增殖,增殖率可以达到60%,且实施例3~5提供的胶原蛋白
‑
改性壳聚糖双网络水凝胶中细胞的增殖率均显著大于单一凝胶的细胞增殖率。
[0093]
本发明提供的胶原蛋白
‑
改性壳聚糖双网络水凝胶具有如下优点:
[0094]
效果一,本发明提供的胶原蛋白
‑
改性壳聚糖双网络水凝胶,通过使用鱼源胶原蛋白和猪源胶原蛋白共混制备胶原蛋白凝胶,制备刚性的第一网络,两种胶原蛋白混合,使得重组后的混合胶原蛋白水凝胶的空间结构更加均匀,更利于吸水和保水,同时,鱼源胶原蛋白的加入,改善了现有技术中常用单一猪源胶原蛋白或牛源蛋白价格高、抗原性高和易过敏的缺点,而猪源蛋白相对于牛源蛋白,价格偏低、不易出现疯牛病等致病因素,并且猪源蛋白可以有效改善鱼源胶原蛋白热稳定性差的特点,使得整个混合胶原蛋白比单一组分的胶原蛋白抗原性低,无过敏,热稳定性好,更能适应体内环境,利于干细胞在网络上的增殖和生长,同时也便于存储等。
[0095]
效果二,壳聚糖来源于甲壳素,资源极其丰富,是一种天然多糖,生物相容性好,具有抗菌、止血和生物降解等特点。传统的壳聚糖力学性能较差,因此,壳聚糖一般是作为医用辅料使用。由于壳聚糖的前述特点,目前针对壳聚糖的研究,多集中在如何提升壳聚糖的机械性能,使其在医疗领域发挥更大的作用。在本发明中,以柠檬酸改性壳聚糖,并添加催化剂使其发生缩合反应,柠檬酸和壳聚糖之间的酰胺反应,提升了改性壳聚糖凝胶的机械性能,具体表现在明显提升了壳聚糖凝胶的孔隙率、孔径和溶胀度,在用于制备组织支架类材料时具有优异的性能。此外,改性壳聚糖采用循环冷冻物理交联方式成胶,减少了化学试剂对于细胞的毒性,所形成的凝胶交联度均匀,孔隙大小均匀,利于细胞的吸附、增殖和生长。
[0096]
效果三,本发明提供的胶原蛋白
‑
改性壳聚糖双网络水凝胶以混合胶原蛋白为第一网络,机械性能良好,脆性低,韧性好,可用作体内软组织的再生等组织支架的制备,其良好的机械性能能为柔性的第二网络提供足够的支撑,便于第二网络与第一网络的交叉支撑形成3d网络结构。同时,本发明提供的胶原蛋白
‑
改性壳聚糖双网络水凝胶以改性壳聚糖为柔性的第二网络,壳聚糖经柠檬酸改性后能够在保留其良好生物相容性的基础上,提升其孔径和孔隙率,进一步增大单位空间内细胞的黏附空间,同时也能便于为细胞提供充足的养分和生物活性因子,促进其增殖。由于该胶原蛋白
‑ꢀ
改性壳聚糖双网络水凝胶的良好的机械性能、韧性和生物相容性,低免疫原性,使得该胶原蛋白
‑
改性壳聚糖双网络水凝胶可用于制备体内软组织等类器官,细胞生长状态良好,在体内的排异性极低,减少手术风险。
[0097]
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。例如在实施例7中,选取了间充质干细胞培养,实际上本发明所述的仿生材料同样适用于成纤维细胞、肿瘤细胞等其他各类细胞的培养,以及通过这些细胞培养构建类器官。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1