检测化合物的肺毒性的方法
1.本发明属于细胞生物学与环境毒理学交叉领域,涉及检测化合物的肺毒性的方法。
背景技术:
2.随着世界科技的发展和工业的进步,大量毒性未知的物质正源源不断的被排放到环境当中,其中一部分物质可以游离在空气之中或形成雾霾,进一步的通过空气传播,被人体吸入,对人体健康造成不良影响。因此,亟需一套行之有效的研究手段,用于评估化合物对人肺的影响,在有毒空气污染物对人类健康造成危害之前予以阻止,防患于未然。
3.以往的肺毒性研究大多依赖于动物模型或肺癌细胞模型,然而,动物实验操作困难、实验量大并且结果外推至人时存在跨种属差异;癌细胞实验由于实验材料是已经癌变的细胞,因此不能客观的反应化合物对正常细胞的毒性。此外,从人体中直接分离肺泡细胞作为研究材料的方法也困难重重,虽然前人已经报道了一些从人类胎儿中分离肺泡上皮前体细胞的实验流程,但是肺泡上皮前体细胞通常从孕26周开始出现,此时除非自然流产,否则无法获取样品,并且肺泡上皮细胞的纯化和扩大培养技术也均不成熟。
4.因此,需要一种至少部分解决上述问题的方法,对化合物的肺毒性进行检测。
技术实现要素:
5.人多能干细胞是一种可以近乎无限增殖并且保持正常核型的亚全能性干细胞,通过扩大培养人多能干细胞,随后诱导其分化的方式可以获得大量的人肺前体或肺上皮细胞,这些细胞不仅数量上可以满足高通量毒理学筛查的需求,而且还是正常的人体细胞,非常适合用于研究化合物的人体肺毒性。
6.因此,本发明的目的在于提供一种高效、精准的人体肺毒性体外检测方法,其中利用人多能干细胞诱导的肺前体细胞或肺泡细胞进行检测。
7.本发明提供以下技术方案:
8.一方面,本发明提供肺前体细胞,所述肺前体细胞由诱导人多能干细胞诱导而成。
9.在一些实施方案中,所述肺前体细胞由诱导人多能干细胞经过以下诱导阶段诱导而成:
10.a.诱导人多能干细胞分化为原条细胞;
11.b.诱导原条细胞分化为限定性内胚层细胞;
12.c.诱导限定性内胚层细胞分化为前端前肠细胞;
13.d.诱导前端前肠细胞分化为肺前体细胞。
14.在一些实施方案中,诱导分化使用的基底培养基为含有1
×
glutamax、1
×
青霉素
‑
链霉素、1
×
n2补充剂、1
×
b27补充剂和40
‑
60μg/ml,优选为40、50、60μg/ml,更优选为50μg/ml的抗坏血酸的dmem/f12培养基。
15.在一些实施方案中,诱导人多能干细胞分化为原条细胞所用培养基为上述基底培
养基中加入activin a(20
‑
500ng/ml,优选为20、50、80、100、150、200、250、300、350、400、450、500ng/ml,更优选为100ng/ml)和chir99021(1
‑
12μm,优选为1、2、3、4、5、6、7、8、9、10、11、12μm,更优选为3μm)。
16.在一些实施方案中,诱导人多能干细胞分化为原条细胞的诱导时间为1
‑
3天,优选为1、2、3天,更优选为1天。
17.在一些实施方案中,诱导原条细胞分化为限定性内胚层细胞所用的培养基为上述基底培养基中加入activin a(20
‑
500ng/ml,优选为20、50、80、100、150、200、250、300、350、400、450、500ng/ml,更优选为100ng/ml)。
18.在一些实施方案中,诱导限定性内胚层细胞分化为前端前肠细胞所用的培养基为上述基底培养基中加入sb431542(1
‑
20μm,优选为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20μm,更优选为10μm)和dorsomorphin(1
‑
10μm,优选为1、2、3、4、5、6、7、8、9、10μm,更优选2μm)。
19.在一些实施方案中,诱导限定性内胚层细胞分化为前端前肠细胞的诱导时间为2
‑
4天,优选为2、3、4天,更优选为3天。
20.在一些实施方案中,诱导前端前肠细胞分化为肺前体细胞所用的培养基为上述基底培养基中加入chir99021(1
‑
12μm,优选为1、2、3、4、5、6、7、8、9、10、11、12μm,更优选为3μm)、视黄酸(10
‑
100nm,优选为10、20、30、40、50、60、70、80、90、100nm,更优选为50nm)、bmp4(1
‑
30ng/ml,优选为1、5、8、15、20、25、30ng/ml,更优选为10ng/ml)、fgf7(10
‑
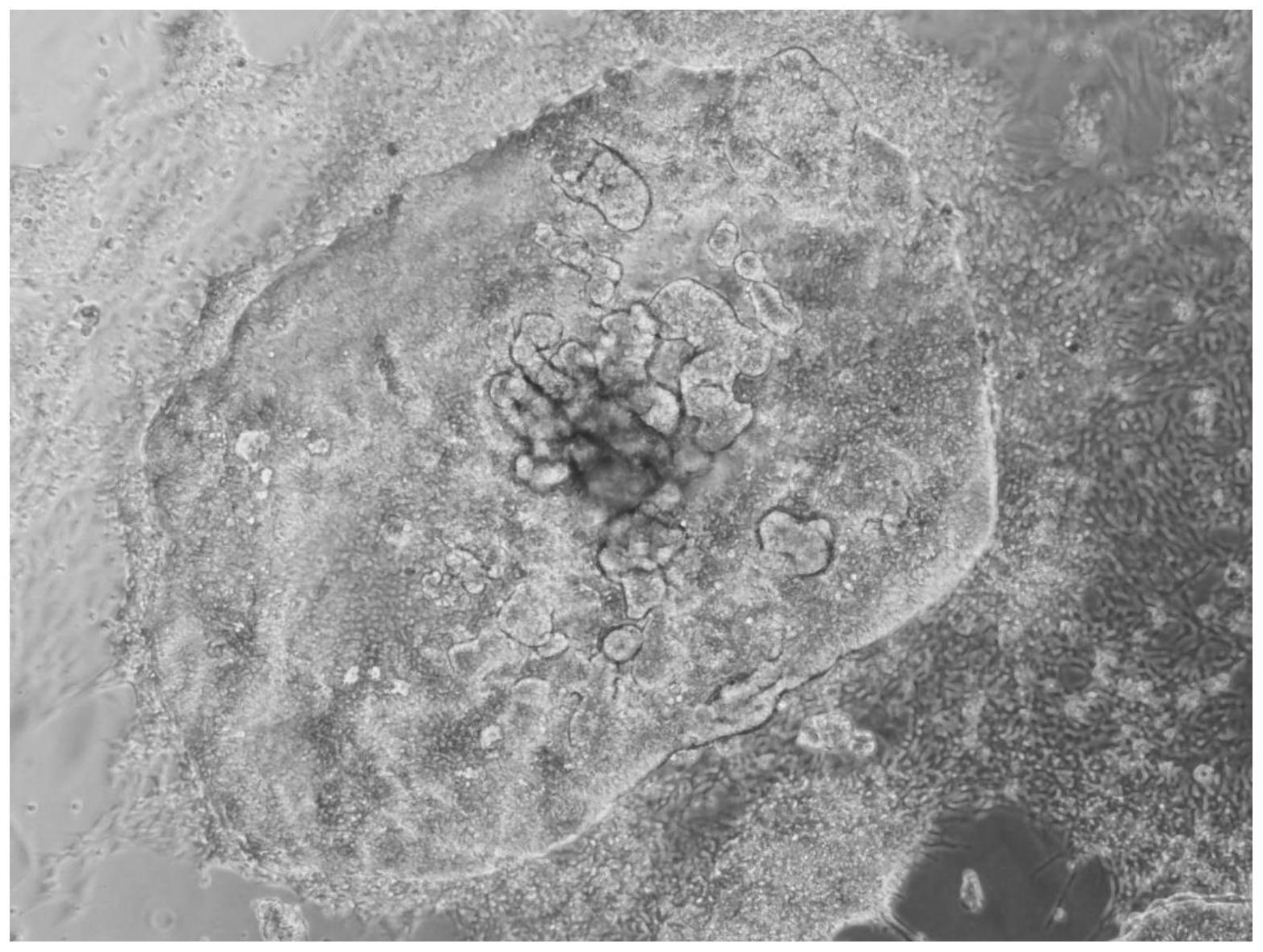
50ng/ml,优选为10、15、20、25、30、35、40、45、50ng/ml,更优选为10ng/ml)、fgf10(10
‑
50ng/ml,优选为10、15、20、25、30、35、40、45、50ng/ml,更优选为10ng/ml)。
21.在一些实施方案中,诱导前端前肠细胞分化为肺前体细胞的诱导时间为8
‑
10天,优选为8、9、10天,更优选为9天。
22.另一方面,本发明提供肺泡细胞,所述肺泡细胞由诱导人多能干细胞诱导而成。
23.在一些实施方案中,所述肺泡细胞由诱导人多能干细胞经过以下诱导阶段诱导而成:
24.a.诱导人多能干细胞分化为原条细胞;
25.b.诱导原条细胞分化为限定性内胚层细胞;
26.c.诱导限定性内胚层细胞分化为前端前肠细胞;
27.d.诱导前端前肠细胞分化为肺前体细胞。
28.e.诱导肺前体细胞分化为肺泡细胞。
29.在一些实施方案中,诱导分化使用的基底培养基为含有1
×
glutamax、1
×
青霉素
‑
链霉素、1
×
n2补充剂、1
×
b27补充剂和40
‑
60μg/ml,优选为40、50、60μg/ml,更优选为50μg/ml的抗坏血酸的dmem/f12培养基。
30.在一些实施方案中,诱导人多能干细胞分化为原条细胞所用培养基为上述基底培养基中加入activin a(20
‑
500ng/ml,优选为20、50、80、100、150、200、250、300、350、400、450、500ng/ml,更优选为100ng/ml)和chir99021(1
‑
12μm,优选为1、2、3、4、5、6、7、8、9、10、11、12μm,更优选为3μm)。
31.在一些实施方案中,诱导人多能干细胞分化为原条细胞的诱导时间为1
‑
3天,优选为1、2、3天,更优选为1天。
32.在一些实施方案中,诱导原条细胞分化为限定性内胚层细胞所用的培养基为上述基底培养基中加入activin a(20
‑
500ng/ml,优选为20、50、80、100、150、200、250、300、350、400、450、500ng/ml,更优选为100ng/ml)。
33.在一些实施方案中,诱导限定性内胚层细胞分化为前端前肠细胞所用的培养基为上述基底培养基中加入sb431542(1
‑
20μm,优选为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20μm,更优选为10μm)和dorsomorphin(1
‑
10μm,优选为1、2、3、4、5、6、7、8、9、10μm,更优选2μm)。
34.在一些实施方案中,诱导限定性内胚层细胞分化为前端前肠细胞的诱导时间为2
‑
4天,优选为2、3、4天,更优选为3天。
35.在一些实施方案中,诱导前端前肠细胞分化为肺前体细胞所用的培养基为上述基底培养基中加入chir99021(1
‑
12μm,优选为1、2、3、4、5、6、7、8、9、10、11、12μm,更优选为3μm)、视黄酸(10
‑
100nm,优选为10、20、30、40、50、60、70、80、90、100nm,更优选为50nm)、bmp4(1
‑
30ng/ml,优选为1、5、8、15、20、25、30ng/ml,更优选为10ng/ml)、fgf7(10
‑
50ng/ml,优选为10、15、20、25、30、35、40、45、50ng/ml,更优选为10ng/ml)、fgf10(10
‑
50ng/ml,优选为10、15、20、25、30、35、40、45、50ng/ml,更优选为10ng/ml)。
36.在一些实施方案中,诱导前端前肠细胞分化为肺前体细胞的诱导时间为8
‑
10天,优选为8、9、10天,更优选为9天。
37.在一些实施方案中,诱导肺前体细胞分化为肺泡细胞所用的培养基为上述基底培养基中加入chir99021(1
‑
12μm,优选为1、2、3、4、5、6、7、8、9、10、11、12μm,更优选为3μm)、fgf7(10
‑
50ng/ml,优选为10、15、20、25、30、35、40、45、50ng/ml,更优选为10ng/ml)、地塞米松(10
‑
50nm,优选为10、15、20、25、30、35、40、45、50nm,更优选为50nm)、camp(0.1
‑
2mm,优选为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0mm,更优选为0.1mm)、3
‑
异丁基
‑1‑
甲基黄嘌呤(0.1
‑
2mm,优选为0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0mm,更优选为0.1mm)。
38.在一些实施方案中,诱导肺前体细胞分化为肺泡细胞的诱导时间为13
‑
15天,优选为13、14、15天,更优选为14天。
39.另一方面,本发明提供上述肺前体细胞或肺泡细胞在检测化合物的肺毒性中的应用。
40.另一方面,本发明提供检测化合物肺毒性的方法,所述方法包括以下步骤:
41.s1.诱导人多能干细胞分化为肺前体细胞或肺泡细胞;
42.s2.使用浓度为1nm
‑
1mm的化合物,优选为10nm、50nm、100nm、500nm、1μm、5μm和10μm处理肺前体细胞或肺泡细胞1
‑
8天,优选为1、2、3、4、5、6、7、8天,更优选为2天、8天;
43.s3.检测化合物在何种浓度下会影响肺前体细胞或肺泡细胞的基础毒性指标;
44.s4.检测非致死浓度下肺前体细胞或肺泡细胞生物标志物的变化。
45.在一些实施方案中,所述基础毒性指标选自由细胞活力、线粒体膜完整性、活性氧产生、钙流变化和乳酸脱氢酶外泄组成的组中的一个或多个,优选为细胞活力和线粒体膜完整性。
46.在一些实施方案中,检测细胞活力的方法选自刃天青法、mtt法、活/死细胞计数检
测法,优选为刃天青法。
47.在一些实施方案中,检测线粒体膜完整性的方法选自jc
‑
1染色法、四甲基罗丹明甲酯染色法、吖啶橙10
‑
溴壬烷染色法,优选为jc
‑
1染色法。
48.在一些实施方案中,所述肺前体细胞或肺泡细胞的生物标志物选自由nkx2.1、id2、sftpc、abca3和napsa基因组成的组中。
49.在一些实施方案中,所述肺前体细胞的生物标志物选自由nkx2.1、id2和sftpc组成的组中。
50.在一些实施方案中,所述肺泡细胞的生物标志物选自由nkx2.1、id2、sftpc、abca3和napsa基因组成的组中。
51.在一些实施方案中,检测肺前体细胞或肺泡细胞生物标志物的变化的方法包括荧光定量pcr。
52.与现有技术相比,本发明具有以下优点:
53.1、本发明提供了一种可行、可靠的人体肺毒性研究方法。
54.2、正常人肺细胞极难获取,因此无法用于毒理学研究。本发明基于诱导人多能干细胞肺分化模型,能够轻易获得大量的正常人肺细胞,能够解决人肺细胞的来源问题,为高通量肺毒性精确检测奠定了基础。
55.3、相比于癌细胞实验,本发明使用的是正常细胞,更贴近健康人体真实情况。
56.4、相比于动物实验,本发明成本低,耗时短,可实时监测,易于控制外部因素影响。
附图说明
57.图1为根据本发明实施方式的肺前体细胞形态;
58.图2为根据本发明实施方式的肺泡细胞形态;
59.图3为根据本发明实施方式的苯并芘对肺前体细胞细胞活力的影响,*p<0.05,**p<0.01,t
‑
test分析;
60.图4为根据本发明实施方式的苯并芘对肺泡细胞细胞活力的影响,*p<0.05,**p<0.01,t
‑
test分析;
61.图5为根据本发明实施方式的苯并芘对肺前体细胞线粒体膜完整性的影响,*p<0.05,**p<0.01,t
‑
test分析;
62.图6为根据本发明实施方式的苯并芘对肺泡细胞线粒体膜完整性的影响,*p<0.05,**p<0.01,t
‑
test分析;
63.图7为根据本发明实施方式的苯并芘对肺前体细胞生物标志物nkx2.1的影响;
64.图8为根据本发明实施方式的苯并芘对肺前体细胞生物标志物id2的影响;
65.图9为根据本发明实施方式的苯并芘对肺前体细胞生物标志物sftpc的影响;
66.图10为根据本发明实施方式的苯并芘对肺泡细胞生物标志物nkx2.1的影响;
67.图11为根据本发明实施方式的苯并芘对肺泡细胞生物标志物id2的影响;
68.图12为根据本发明实施方式的苯并芘对肺泡细胞生物标志物sftpc的影响;
69.图13为根据本发明实施方式的苯并芘对肺泡细胞生物标志物abca3的影响;
70.图14为根据本发明实施方式的苯并芘对肺泡细胞生物标志物napsa的影响。
具体实施方式
71.为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明作进一步的详细说明。
72.实施例1诱导人多能干细胞分化为限定性内胚层细胞
73.本发明中所有的细胞均在37℃,含有5%二氧化碳的细胞培养箱中恒温培养。
74.本发明使用的初始细胞是诱导人多能干细胞dyr0100(中国科学院细胞库/干细胞技术平台,scsp
‑
1301)。在基质胶(corning,356231)包被的24孔板中使用10ml的mtesr1(stemcell technologies,85850)培养基,维持培养dyr0100。dyr0100克隆的汇合度达到90%时,开始诱导分化。
75.本发明诱导分化使用的基底培养基为100ml dmem/f12(gibco,c1410500bt330500bt)培养基中加入1ml 100
×
glutamax(gibco,35050061)、1ml 100
×
青霉素
‑
链霉素(gibco,15140163)、1ml 100
×
n2补充剂(gibco,17502001)、2ml50
×
b27补充剂(gibco,17504044)和0.1ml 50mg/ml抗坏血酸(源叶,s24742)。
76.在分化的第0天,基底培养基中添加100ng/ml的activin a(peprotech,120
‑
14e)和3μm的chir99021(selleck,s2924),诱导细胞向原条细胞分化。
77.在分化的第1天,基底培养基中添加100ng/ml的activin a,诱导原条细胞分化3天,成为限定性内胚层细胞。
78.本发明获得的限定性内胚层细胞为密集单层细胞。
79.实施例2诱导限定性内胚层细胞分化为肺前体细胞
80.使用在实施例1最终获得的限定性内胚层细胞。
81.在基底培养基中添加10μm的sb431542(selleck,s2924)和2μm的dorsomorphin(selleck,s7306),诱导实施例1获得的限定性内胚层细胞分化3天,成为前端前肠细胞。
82.在基底培养基中添加3μm的chir99021、50nm的视黄酸(sigma,r2625)、10ng/ml的bmp4(gibco,phc9531)、10ng/ml的fgf7(r&d,251
‑
kg
‑
050)和10ng/ml的fgf10(r&d,345
‑
fg
‑
025),诱导上述获得的前端前肠细胞分化9天,成为肺前体细胞(图1)。
83.实施例3诱导肺前体细胞分化为肺泡细胞
84.使用在实施例2最终获得的肺前体细胞。
85.在基底培养基中添加3μm的chir99021、10ng/ml的fgf7、50nm的地塞米松、0.1mm的camp(sigma
‑
aldrich,b5386)和0.1mm的3
‑
异丁基
‑1‑
甲基黄嘌呤(sigma
‑
aldrich,i5879
‑
250mg),诱导实施例2获得的肺前体细胞分化约16天,最终成为肺泡细胞(图2)。
86.实施例4使用化合物处理肺前体细胞
87.使用在实施例2最终获得的肺前体细胞。
88.使用tryple消化实施例2获得的肺前体细胞,以15,000个细胞每平方厘米的量将细胞接种至基质胶包被的96孔板。使用添加了3μm的chir99021、50nm的视黄酸、10ng/ml的bmp4、10ng/ml的fgf7、10ng/ml的fgf10和化合物的基础培养基培养肺前体细胞。
89.使用的化合物为大气污染物主要成分苯并芘(bap)。
90.使用96孔板进行,培养基中bap浓度分别为1、5、10、50、100、500和1000nm,对照用dmso处理。
91.实施例5使用化合物处理肺前体细胞
92.实施例5与实施例4相同,除了使用24孔板进行培养,且培养基中bap浓度为10、50、100nm,对照也用dmso处理。
93.实施例6使用化合物处理肺泡细胞
94.使用实施例3最终获得的肺泡细胞。
95.使用tryple消化实施例3获得的肺泡细胞,以15,000个细胞每平方厘米的量将细胞接种至matrigel包被的96孔板。使用添加了3μm的chir99021、10ng/ml的fgf7、50nm的地塞米松、0.1mm的camp、0.1mm的3
‑
异丁基
‑1‑
甲基黄嘌呤和化合物的基础培养基培养肺泡细胞。
96.使用的化合物为bap。
97.使用96孔板进行,培养基中bap浓度分别为1、5、10、50、100、500和1000nm,对照用dmso处理。
98.实施例7使用化合物处理肺泡细胞
99.实施例7与实施例6相同,除了使用24孔板进行培养,且培养基中bap浓度为10nm,50nm,100nm,对照也用dmso处理。
100.实施例8肺前体细胞和肺泡细胞的细胞活力检测
101.正常人的肺泡中一般有肺前体细胞和肺泡细胞,因此优选诱导分化获得的肺前体细胞和肺泡细胞作为试验模型,检测化合物的肺毒性。化合物的细胞毒性一般会引起细胞数量降低或功能受损,通过检测细胞活力和线粒体膜电位,可以简便、快捷的得知细胞的健康状况(细胞活力是否受损)和有无凋亡前兆(线粒体膜电位是否降低)。本实施例中,化合物选择了大气污染物主要成分bap,将所述实施例4的肺前体细胞和实施例6中的肺泡细胞在bap处理2天之后,使用dpbs清洗细胞一遍。向所述dpbs清洗过的细胞培养板中加入100μl的刃天青细胞活力检测工作液(含有10μm刃天青的基底培养基),置于二氧化碳培养箱37℃孵育1h。使用varioskan lux多功能微孔板读数仪检测所述刃天青处理后的细胞的荧光。所述荧光为每个孔在530nm光激发下发出的590nm荧光。荧光检测结果显示1μm以上的苯并芘会抑制肺前体细胞的细胞活力(如图3所示),5μm以上的苯并芘会抑制肺泡细胞的细胞活力(如图4所示)。以上结果说明肺前体细胞比终末分化的肺泡细胞对苯并吡处理更为敏感。由于目前的干细胞毒理学研究显示,同一谱系的前体细胞往往比终末分化细胞对环境中信号的反应更强烈,因此,图4中的现象较为合理。
102.实施例9肺前体细胞和肺泡细胞的线粒体膜完整性检测
103.由于化合物浓度在μm级别时,往往会在0.5
‑
2天时显示出毒性,因此使用苯并芘处理所述实施例4的肺前体细胞和实施例6中的肺泡细胞0.5
‑
2天,优选为0.5、1、1.5、2天,本实施例中处理2天。处理完毕之后,使用dpbs清洗细胞一遍。向所述dpbs清洗过的细胞培养板中每孔加入相同体积的含有2μg/ml jc
‑
1染料的基底培养基,置于二氧化碳培养箱37℃孵育30min。弃去所述jc
‑
1染色后细胞的上清,再次加入等体积基底培养基。使用varioskan lux多功能微孔板读数仪检测所述jc
‑
1染色后细胞在490/530nm处的绿色荧光和525/590nm处的红色荧光。所述绿色荧光显示的是处于细胞质中的游离jc
‑
1,红色荧光显示的是处于完整线粒体中的聚集态jc
‑
1。jc
‑
1染色结果显示,大于1μm的苯并芘处理肺前体细胞会使肺前体细胞线粒体膜电位降低,大于5μm的苯并吡处理会使肺泡细胞线粒体膜电位降低,暗示1μm的苯并芘会造成肺前体细胞线粒体损伤,5μm的苯并芘会造成肺泡细胞线粒体损伤,该
结果与细胞活力检测获得的结果类似,具有干细胞特性的肺前体细胞对苯并芘处理更为敏感。
104.实施例10肺前体细胞生物标志物检测
105.将所述实施例5的肺前体细胞和实施例7中的肺泡细胞在苯并芘处理1、2、3、4、5、6、7、8天,为了放大毒性效应同时保证实验周期较短,本实施例优选8天之后,弃上清。
106.使用trnzol总rna提取试剂(天根生化科技(北京)有限公司,dp424)提取所述化合物处理后样品的rna。
107.使用fastking试剂盒(天根生化科技(北京)有限公司,kr118)去除所述样品中基因组dna污染和反转录。
108.使用fastfire qpcr premix(天根生化科技(北京)有限公司,fp207)对所述样品进行荧光定量pcr。
109.荧光定量pcr实验中使用的引物根据ncbi公布的人类基因组转录本信息设计,产物长度在80~120bp左右,pcr引物信息如下:
110.gapdh
‑
fw:5
′‑
ggtcaccagggctgctttta
‑3′
111.gapdh
‑
rv:5
′‑
ggatctcgctcctggaagatg
‑3′
112.nkx2.1
‑
fw:5
′‑
ctcatgttcatgccgctc
‑3′
113.nkx2.1
‑
rv:5
′‑
gacaccatgaggaacagcg
‑3′
114.id2
‑
fw:5
′‑
gacagcaaagcactgtgtgg
‑3′
115.id2
‑
rv:5
′‑
tcagcacttaaaagattccgtg
‑3′
116.sftpc
‑
fw:5
′‑
agcaaagaggtcctgatgga
‑3′
117.sftpc
‑
rv:5
′‑
cgataagaaggcgtttcagg
‑3′
118.abca3
‑
fw:5
′‑
aagatgtagcggacgagagg
‑3′
119.abca3
‑
rv:5
′‑
ccccggtcagcattttgaaa
‑3′
120.napsa
‑
fw:5
′‑
acgcctccacaaaacttcac
‑3′
121.napsa
‑
rv:5
′‑
tggcaaacttggtcccattg
‑3′
122.荧光定量pcr的反应条件为:预变性95℃,30秒;95℃,5秒,60℃,30秒,50个循环。
123.使用荧光定量pcr检测肺前体细胞中标志基因nkx2.1、id2和sftpc的表达水平。相关检测结果见图7
‑
9。实验结果显示,bap处理会抑制肺前体细胞中转录因子nkx2.1、id2和肺表面活性蛋白编码基因sftpc的表达,并且抑制效果呈现剂量依赖性的增强趋势。bap对关键转录因子nkx2.1、id2和重要肺表面活性蛋白编码基因sftpc的抑制作用,表明其会对肺前体细胞的功能造成很大的影响。
124.由于肺泡细胞从肺前体细胞分化而来,因此nkx2.1、id2和sftpc基因在肺泡细胞内也有表达,在研究中,也可以作为肺泡细胞的标志物,此外,肺泡细胞还具有独有的标志物abca3和napsa。因此本实施例使用荧光定量pcr检测肺泡细胞标志基因nkx2.1、id2、sftpc、abca3和napsa的表达水平。相关检测结果见图10
‑
14。从结果中可以看出nkx2.1、id2、sftpc、abca3和napsa的表达水平都随着bap浓度的上升呈现剂量依赖性的下降趋势,说明bap抑制以上基因的表达,以上基因中napsa编码肺表面活性蛋白成熟需要的蛋白酶,abca3编码肺活性蛋白分泌相关的重要转运蛋白。相关基因表达水平的变化暗示bap暴露会抑制肺表面活性蛋白的合成和转运,从而损害肺泡细胞功能。
125.以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1