一种用于研究管形成的内皮细胞和周细胞共培养模型的构建方法
本发明涉及肿瘤生物学领域,特别涉及一种用于研究管形成的内皮细胞和周细胞共培养模型的构建方法。
背景技术:
在过去的几十年间我们对原发性肿瘤有了更加广泛和深入的认识。尽管部分肿瘤的治疗方式有了实质性的发展,但肿瘤治疗依然是世界性的健康问题。虽然不断有新的化疗药物及手段不断被发现,但化疗耐药仍然是限制化疗效果的一大阻碍。研究发现在实体瘤中,血管对营养、氧气乃至化疗药物的输送至关重要[1]。因此改善肿瘤血管生长,在化疗耐药研究中显得尤为重要。
新肿瘤血管的形成,即肿瘤血管生成,涉及内皮细胞的增殖和迁移增强,血管基底膜的发展,以及随后包括周细胞在内的支持壁细胞的募集[2]。周细胞又称壁细胞,在稳定血管壁、控制血管扩张、调节血管灌注等方面起着重要的调节作用[3-4]。然而在目前的肿瘤治疗研究中,周细胞的作用极少被提及。
正如肿瘤内皮细胞不同于正常组织中的内皮细胞一样,与正常组织中的周细胞相比,肿瘤来源的周细胞显得异常或功能障碍。目前还不清楚癌细胞是否通过导致周细胞的特性变化来促进肿瘤生长。事实上,在许多癌症中,周细胞-内皮细胞相互作用存在缺陷,其特征是血管完整性受损[5-6]。例如,在一些癌症中经常可以观察到周细胞从肿瘤血管中脱落或脱落,这被认为是促进癌症转移的原因[7-8]。另一方面,周细胞已被证明可以保护内皮细胞免受抗血管生成药物(例如贝伐单抗)的影响,因此在一些动物模型中,与pdgfr酪氨酸激酶抑制剂(即排除周细胞)和vegf抑制联合治疗比单独抗vegf治疗更有效地阻止肿瘤血管生成[9-10]。但是该治疗方法在临床上以失败告终。主要原因在于以往的体外人管形成模型并没有共培养周细胞,这影响了筛选靶向血管药物的有效性。同时,周细胞在控制癌症生长和发展中的相关性仍不清楚,并且其调控肿瘤进展背后的分子机制仍然很大程度上是未知的。
因此,研究周细胞对肿瘤血管的调控,可为今后研究肿瘤生长及进展,以及逆转癌症耐药创造有利条件。为解决以上的科学及临床问题,这提示了我们需要开发一种共培养内皮细胞和周细胞用于体外研究管形成的模型体系。
技术实现要素:
本发明的目的在于克服现有技术的缺点与不足,提供一种用于研究管形成的内皮细胞和周细胞共培养模型的构建方法。
本发明的目的通过下述技术方案实现:
一种用于研究管形成的内皮细胞和周细胞共培养模型的构建方法,包括如下步骤:
(1)将脐静脉内皮细胞用胰蛋白酶进行消化,得到脐静脉内皮单细胞;
(2)将周细胞用胰蛋白酶消化为周细胞的单细胞,然后加入终浓度为2~10μmol/l的cfse染料进行染色,得到染色后的周细胞;
(3)将脐静脉内皮单细胞与染色后的周细胞按细胞个数比为5~20:1的比例混合均匀后用支气管上皮细胞培养基(bepicm)进行培养,然后在荧光显微镜观察管形成情况。
步骤(1)中所述的脐静脉内皮细胞优选为人脐静脉内皮细胞(huvec)。
所述的脐静脉内皮细胞可以通过本领域的常规方式获得,如通过商业途径购买得到,或从人脐带静脉分离培养得到;优选为通过如下方法获得:将脐静脉内皮细胞用胰蛋白酶进行消化,得到脐静脉内皮单细胞;更优选为通过如下方法获得:
将人脐带静脉用生理盐水冲洗至无色,然后将37℃预热的胰蛋白酶用灌入人脐带静脉后封口,置于37℃孵育15min,再将人脐静脉内皮细胞吹入dmem完全培养基终止消化,离心,用内皮细胞培养基(ecm)重悬分散,得到脐静脉内皮单细胞。
所述的离心的条件为:300g离心5min。
所述的培养的条件为:37℃培养24小时以上。
所述的内皮细胞培养基(ecm)的配方如下:500ml基础培养基,25ml牛血清(fbs)、5ml内皮细胞生长因子(ecgs)和5ml青霉素/链霉素溶液(p/s);优选为购自sciencell公司的内皮细胞培养基(ecm),货号为1001。
步骤(1)中所述的消化的条件为:37℃消化10~20min;优选为37℃消化15min。
步骤(2)中所述的周细胞优选为人周细胞(pc)。
所述的人周细胞包括肿瘤周细胞(tpc)和癌旁正常组织周细胞(npc);优选为肿瘤周细胞(tpc)。
所述的肿瘤包括肺癌或肝癌等。
所述的周细胞可以通过本领域的常规方式获得,或从肿瘤组织或癌旁正常组织分离培养得到;优选为通过如下方法获得:
(i)将肿瘤组织或癌旁正常组织用生理盐水冲洗至无色,剪碎后加入酶解液进行酶解消化,离心,再用周细胞培养基(pm)分散,得到周细胞的单细胞;
(ii)将周细胞的单细胞置于包被后的培养板中培养至贴壁,得到肿瘤周细胞(tpc)或癌旁正常组织周细胞(npc)。
步骤(i)中所述的酶解液为含2%(w/v)i型胶原酶type1,2%(w/v)ⅲ型胶原酶type3,1%(w/v)dnase酶的dmem培养基。
步骤(i)中所述的周细胞培养基(pm)的配方如下:500ml基础培养基,10ml胎牛血清(fbs),5ml周边细胞生长添加物(pgs)和5ml青霉素/链霉素溶液(p/s);优选为购自sciencell公司的周细胞培养基(pm),货号为1201。
步骤(i)中所述的离心的条件为:300g离心5min。
步骤(i)中所述的消化的条件为:37℃消化1~2小时;优选为37℃消化1.5小时。
步骤(ii)中所述的包被后的培养板通过如下方法获得:将胶原蛋白加入到明胶溶液中,混合均匀,得到涂层溶液;然后将涂层溶液加入到培养板中,置于37℃培养箱培养30min以上,得到包被后的培养板。
所述的胶原蛋白与明胶的质量比优选为1:5。
所述的培养板优选为6孔板。
步骤(ii)中所述的培养所用的培养基为周细胞培养基(pm),其配方如下:500ml基础培养基,10ml胎牛血清(fbs),5ml周边细胞生长添加物(pgs)和5ml青霉素/链霉素溶液(p/s);优选为购自sciencell公司的周细胞培养基(pm),货号为1201。
步骤(ii)中所述的培养的条件为:37℃培养24小时以上。
步骤(2)中所述的cfse染料的用量优选为按其在所述反应体系的终浓度为5μmol/l添加计算(即工作浓度为5μm)。
步骤(3)中所述的脐静脉内皮单细胞与染色后的周细胞按细胞个数比优选为10:1。
步骤(3)中所述的支气管上皮细胞培养基(bepicm)的配方如下:500ml基础培养基,5ml支气管上皮细胞生长添加物(bepicgs)和5ml青霉素/链霉素溶液(p/s),不包含血清;优选为购自sciencell公司的支气管上皮细胞培养基(bepicm),货号为3211。
步骤(3)中所述的培养为在预先用matrigel基质胶包被的培养板上进行培养。
所述的培养板优选为96孔板。
步骤(3)中所述的培养的条件为:37℃培养4~48小时。
上述任一项所述的用于研究管形成的内皮细胞和周细胞共培养模型的构建方法构建得到的内皮细胞和周细胞共培养模型。
本发明相对于现有技术具有如下的优点及效果:
1、本发明公开了一种体外共培养人内皮细胞和周细胞用于研究肿瘤内周细胞对肿瘤血管的影响的方法,为将人脐静脉内皮细胞(huvec)与预先用cfse染色的周细胞和支气管上皮细胞培养基(bepicm)混合,加入到预先用基质胶包被的96孔板进行培养,荧光显微镜观察管形成情况。
2、本发明是首次将人内皮细胞与周细胞共培养,可以通过荧光显微镜动态地观察到周细胞对内皮细胞管形成的影响,通过体外实验反映人体肿瘤内周细胞与对肿瘤血管作用,进一步揭示周细胞调控肿瘤进展背后的分子机制。
3、本发明的共培养方法可用于研究肿瘤周细胞(tpc)和癌旁正常组织周细胞(npc)对血管形成的调控,可通过调节周细胞作用改善肿瘤血管功能,为今后调控肿瘤血管促进抗肿瘤药物递送的研究提供新思路。
4、本发明的共培养方法提供一种更接近正常生理情况的正常或肿瘤血管形成的模型,能更准确测试靶向调控肿瘤血管生成及功能的药物的临床前有效性,减低不必要的动物模型及临床实验测试,具有良好的社会及经济价值。
附图说明
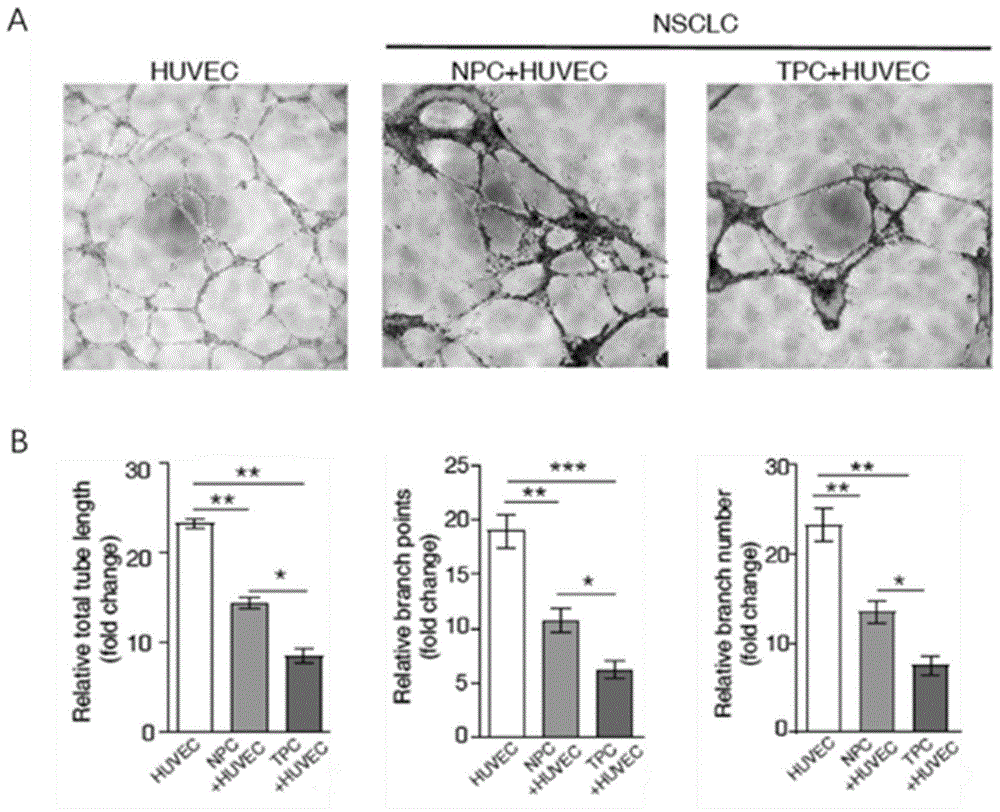
图1是荧光显微镜拍摄huvec和pc共培养生长情况以及其血管长度、分枝数和数目统计结果图;其中a为荧光显微镜拍摄huvec、npc+huvec和tpc+huvec组的生长情况(绿色荧光为pc,白光为huvec和pc共培养照片);b为huvec,npc+huvec和tpc+huvec组的血管长度、分枝数和数目统计结果。
图2是对比例1-3中荧光显微镜拍摄huvec和tpc共培养生长情况图;其中;a为对比例1中huvec和tpc在人内皮无血清培养基中共培养生长情况;b为对比例2中huvec和tpc的比例为1:1的共培养生长情况;c为对比例2中huvec和tpc的比例为50:1的共培养生长情况;d为对比例3中huvec和tpc共培养在cfse浓度为20mμ下观察到的生长情况;e为对比例3中huvec和tpc共培养在cfse浓度为0.5mμ下观察到的生长情况。
具体实施方式
下面结合实施例对本发明作进一步详细的描述,但本发明的实施方式不限于此。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。下列实施例中未注明具体实验条件的试验方法,通常按照常规实验条件或按照制造厂所建议的实验条件。除非特别说明,本发明所用试剂和原材料均可通过市售获得。
本发明实施例中涉及的内皮细胞培养基(ecm)(sciencell,1001)包含500ml基础培养基,25ml牛血清(fbs,cat.no.0025)、5ml内皮细胞生长因子(ecgs,cat.no.1052)、5ml青霉素/链霉素溶液(p/s,cat.no.0503)。
本发明的酶解液为含1~2.5%(w/v)i型胶原酶type1(worthington,ls004194),1~2.5%(w/v)ⅲ型胶原酶type3(worthington,ls004182),0.5~1.5%(w/v)dnase酶(roche,10104159001)的dmem培养基;实施例中涉及的酶解液优选为含2%(w/v)i型胶原酶type1,2%(w/v)ⅲ型胶原酶type3,1%(w/v)dnase酶的dmem培养基。
本发明实施例中涉及的周细胞培养基(pm)(sciencell,1201)包含500ml基础培养基,10ml胎牛血清(fbs,cat.no.0010),5ml周边细胞生长添加物(pgs,cat.no.1252),和5ml青霉素/链霉素溶液(p/s,cat.no.0503)。
本发明实施例中涉及的支气管上皮细胞培养基(bepicm)(sciencell,3211)包含500ml基础培养基,5ml支气管上皮细胞生长添加物(bepicgs,cat.no.3262)和5ml青霉素/链霉素溶液(p/s,cat.no.0503),不包含血清。
实施例1
本实施例提供一种体外共培养人内皮细胞和周细胞用于研究管形成的方法,所有分离培养操作均在生物安全柜中进行,具体包括如下步骤:
(1)用生理盐水冲洗人脐带静脉(来自于广州某医院)至无色,将37℃预热的胰蛋白酶用注射器灌入人脐带静脉后封口,置于37℃孵育15min,将人脐静脉内皮细胞吹入dmem完全培养基终止消化。
(2)将细胞室温300g,5min离心后用内皮细胞培养基(ecm)重悬分散为单细胞,然后将细胞置入6孔板37℃、5%co2培养24小时。吸走悬浮细胞换新培养基,贴壁生长细胞即为人脐静脉内皮细胞(huvec)。
(3)将肺癌组织及其癌旁正常组织(均来自于广州某医院)用生理盐水冲洗至无色,分别剪碎;然后将酶解液分别加入到剪碎的组织中,37℃消化1.5小时;其中,所使用的酶解液为含2%(w/v)i型胶原酶type1,2%(w/v)ⅲ型胶原酶type3,1%(w/v)dnase酶的dmem培养基。
(4)消化组织同时配制培养板涂层溶液,将320μl30μg/ml胶原蛋白(sigma,c7661-25mg)溶液加入到48ml0.1%(w/v)明胶(sigma,v900863-100g)溶液中,混合均匀;然后将涂层溶液加入到6孔板,置于37℃培养箱培养30min以上。加入细胞前吸走多余涂层溶液。
(5)将步骤(3)中消化后的细胞分别于室温300g,5min离心后用周细胞培养基(pm)重悬分散为单细胞,置于步骤(4)中获得的包被过涂层的6孔板上,37℃、5%co2培养24小时。吸走悬浮细胞换新培养基,贴壁生长细胞即为肿瘤周细胞(tpc)和癌旁正常组织周细胞(npc)。
(6)显微镜观察步骤(2)中获得的huvec细胞,以及步骤(5)中获得的tpc和npc细胞,当细胞均生长至80%(融合度)可进行管形成实验。
(7)将96孔板置于冰上,每孔加入50μlmatrigel基质胶(r&d,3432-010-01),铺平后在37℃孵育1小时以上。
(8)分别用胰蛋白酶消化步骤(6)中获得的huvec,tpc和npc细胞;其中,huvec细胞计数后用支气管上皮细胞培养基(bepicm)分散为4×105个/ml,置于冰上保存;tpc和npc细胞分别用2mlpbs缓冲液清洗细胞后,用pbs缓冲液重悬细胞至1×106个/ml;
(9)将步骤(8)中得到的tpc和npc细胞分别加入cfse染料(tonbobiosciences,13-0850-u500)(https://tonbobio.com/products/cfse)至浓度为5μm,避光室温孵育15min;然后再加入5倍体积遇冷含10%(v/v)fbs的rpmi-1640(gibco,c11875500bt)培养基终止染色,冰上孵育5min;离心后分别用pbs缓冲液清洗一遍,再用pbs缓冲液分散计数取合适数量细胞用bepicm培养基重悬为4×104个/ml,得到染色后的tpc和npc细胞悬浮液;
(10)实验分组如下:a.huvec、b.huvec+npc、c.huvec+tpc三组,然后将步骤(8)中得到的huvec细胞(4×105个/ml)用bepicm分散后分别与等体积的bepicm培养基、步骤(9)中染色后用bepicm分散的npc细胞(4×104个/ml)以及tpc细胞(4×104个/ml)混合置于步骤(7)中预先用基质胶包被的96孔板,放入37℃培养箱培养。
(11)分别在铺板4,12,24,48小时用荧光显微镜观察huvec和pc细胞生长情况:白光可用于观察管形成程度,绿色荧光可用于观察pc和huvec细胞的相互作用。
(12)实验结果如图1所示,将白光图片与荧光图片叠加后可看见周细胞都吸附到血管周围。统计结果显示血管长度、分枝数和数目都是huvec>pc>tpc,证明周细胞能够拉扯血管,使血管变小变少,并且肿瘤组织周细胞拉扯作用强于正常组织。结果提示以周细胞为治疗靶点可改善肿瘤药物输送,为肿瘤治疗提供新思路。
实施例2
在管形成过程中其余步骤试剂与实施例1相同,不同之处在于:步骤(10)中人脐静脉内皮细胞(huvec)和tpc比例为5:1、20:1。共培养huvec和tpc细胞后,在荧光显微镜下同样可以观察到网状血管结构(实验结果与实施例1相似,故不再另外给出附图)。
实施例3
在管形成过程中其余步骤试剂与实施例1相同,不同之处在于:步骤(9)中cfse染料的终浓度为2μm、10μm。共培养huvec和tpc细胞后,在荧光显微镜下同样可以观察到网状血管结构(实验结果与实施例1相似,故不再另外给出附图)。
对比例1
在管形成实验过程中其余步骤试剂与实施例1相同,不同之处在于:步骤(10)中共培养所用培养基由bepicm换为添加重组人成纤维细胞生长因子(bfgf;20ng/ml)、表皮细胞生长因子(egf;10ng/ml)、人血浆纤连蛋白(10μg/ml)和1%(v/v)青霉素/链霉素溶液的人内皮无血清培养基(sfm,gibco11111044)培养48小时(这里共培养所用的周细胞为tpc细胞)。
结果如图2a所示,替换培养基后共培养huvec和tpc细胞一直未形成明显网状血管结构,结果证明实施例1所用bepicm培养基是管形成最优条件。
对比例2
在管形成过程中其余步骤试剂与实施例1相同,不同之处在于:步骤(10)中人脐静脉内皮细胞(huvec)和tpc细胞的比例为1:1、50:1。
结果如图2b和2c所示:当huvec和周细胞比例为1:1时,由于周细胞拉扯作用太强,huvec+pc组始终无法形成网状血管结构(图2b)。而将huvec和周细胞比例设为50:1,结果周细胞对血管几乎无拉扯作用(图2c)。
对比例3
在管形成过程中其余步骤试剂与实施例1相同,不同之处在于:步骤(9)中cfse染料的终浓度为20μm和0.5μm。
结果如图2d和2e所示:染料终浓度为20μm时pc活力变弱,无法伸展成正常贴壁形态,无拉伸血管作用(图2d)。而cfse浓度为0.5μm时,荧光强度太弱,未完成两个时间点的拍照就基本上淬灭了(图2e)。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
参考文献
[1]hanahan,d.,andweinberg,r.a.(2011).hallmarksofcancer:thenextgeneration.cell144,646–674.
[2]chung,a.s.,lee,j.,andferrara,n.(2010).targetingthetumourvasculature:insightsfromphysiologicalangiogenesis.nat.rev.cancer10,505–514.
[3]armulik,a.,genove,g.&betsholtz,c.pericytes:developmental,physiological,andpathologicalperspectives,problems,andpromises.devcell21,193-215,doi:10.1016/j.devcel.2011.07.001(2011).
[4]lindahl,p.,johansson,b.r.,leveen,p.&betsholtz,c.pericytelossandmicroaneurysmformationinpdgf-b-deficientmice.science277,242-245,doi:10.1126/science.277.5323.242(1997).
[5]geevarghese,a.&herman,i.m.pericyte-endothelialcrosstalk:implicationsandopportunitiesforadvancedcellulartherapies.translres163,296-306,doi:10.1016/j.trsl.2014.01.011(2014).
[6]bergers,g.&song,s.theroleofpericytesinblood-vesselformationandmaintenance.neurooncol7,452-464,doi:10.1215/s1152851705000232(2005)
[7]xian,x.etal.pericyteslimittumorcellmetastasis.jclininvest116,642-651,doi:10.1172/jci25705(2006).
[8]ribeiro,a.l.&okamoto,o.k.combinedeffectsofpericytesinthetumormicroenvironment.stemcellsint2015,868475,doi:10.1155/2015/868475(2015).
[9]benjamin,l.e.,golijanin,d.,itin,a.,pode,d.&keshet,e.selectiveablationofimmaturebloodvesselsinestablishedhumantumorsfollowsvascularendothelialgrowthfactorwithdrawal.jclininvest103,159-165,doi:10.1172/jci5028(1999).
[10]chen,z.,xu,x.h.&hu,j.roleofpericytesinangiogenesis:focusoncancerangiogenesisandanti-angiogenictherapy.neoplasma63,173-182,doi:10.4149/201_150704n369(2016).
- 还没有人留言评论。精彩留言会获得点赞!