一种蛋白检测试剂盒及检测方法
1.本发明涉及痕量蛋白分子检测领域,尤其涉及一种蛋白检测试剂盒及检测方法。
背景技术:
2.在不同的生物样品中,如血清、血浆、体液(如尿液、泪液)等或细胞裂解液中,对痕量蛋白分子的检测对于预测多种疾病的发生发展、提高临床诊断的准确率和开展有关单细胞蛋白质表达的基础科学研究都是极为重要的。
3.目前我国心血管病患病率处于持续上升阶段,推算心血管病现患人数3.30亿,心血管病死亡率仍居首位,农村和城市心血管病分别占死因的45.91%和43.56%。不少患者在发现时已经错过最佳的治疗时机。因此早发现、早治疗对于挽救患者的生命具有十分重要的意义。超敏c反应蛋白(hs
‑
crp)和心肌肌钙蛋白ⅰ(ctni)是对心血管疾病的早期诊断和预防至关重要的两个蛋白标志物。研究数据表明,1.4ng/μl的crp变化会使心脏病的综合危险因素增加1.7倍,而0.01ng/ml的ctni变化表明存在潜在的心血管缺陷。同理,早期肿瘤患者的血清、血浆、体液中的肿瘤标志物含量往往极低。由于血清成分复杂现有检测技术的灵敏度达不到要求,心血管疾病和癌症的早期检测一直是个世界性难题。
4.单细胞间的异质性存在于dna、rna、蛋白等各个层面。近年来,转录组学和蛋白组学相关研究结果表明,单细胞和细胞群体的rna转录和蛋白表达仍存在显著差异。由于蛋白质在细胞和生命体活动过程中,起着十分重要的作用,蛋白质参与生命活动调节,不仅仅是通过表达量来发挥作用,重要的是通过蛋白的翻译后修饰及与其他蛋白或核酸等的相互作用来完成对生命体的调节。单细胞蛋白质组学应运而生。为了充分理解复杂细胞群体中单个细胞的异质性行为,有必要发展一种新的单细胞蛋白质表达分析技术。
5.单细胞分辨水平上研究细胞的异质性应用范围广泛,在肿瘤研究领域,对高度异质的肿瘤细胞提供定量和高度特异性的靶蛋白检测,可为个体化治疗提供丰富的、关键的蛋白表达信息,对治疗方案的制定和靶向药物的选择和开发具有重要的指导意义。在干细胞研究领域,研究不同细胞的转录本及蛋白表达差异有助于加深对遗传发育以及不同组织和细胞基因表达调控的规律的理解。
6.目前,微流控芯片技术、质谱流式成像技术、单细胞蛋白质印迹术(western blot)、邻位连接技术(pla)(包括基于固体和纳米颗粒的pla以及液相邻位延伸技术(pea))等高通量、高灵敏度、高分辨率的分析手段,为单细胞组学的研究提供了强有力的工具。
7.微流控芯片技术能够高通量的完成单个细胞培养、基因表达谱分析、蛋白质表达水平分析、电泳分离分析、抗原抗体检测等重要分子生物学实验,是一种非常有前景的单细胞蛋白分子研究工具。huang等人在一块微芯片上完成单个细胞的进样、捕获、裂解、电泳等操作,结合激光诱导荧光技术测定单个细胞内b肾上激素能受体分子。white等人设计了一个高通量的单细胞实时定量反转录pcr微芯片,可以同时完成300个细胞的捕获、裂解、cdna合成、定量pcr实验。我国的shi等设计了一种单细胞条码微流控芯片,可以同时检测单个细胞中11种细胞信号通路相关的蛋白。
8.bendall和nolan等人结合流式细胞术和质谱分析,提出一种新的质谱流式细胞分选术(mass cytometry)。应用金属元素标签标记抗体染料,利用质谱原理对单细胞进行多参数定量检测,其通道数量较传统流式细胞技术通道数量增加同时避免了补偿计算,且分辨率极高。这样不仅使实验流程得到简化,也节约了标本和试剂。evan w.newell等人利用质谱流式细胞术细致分析了人的cd8t细胞的25个表面标记(marker)和功能蛋白表达情况及三种不同病毒表位的结合情况,展示了t细胞成熟的连续过程,揭示出t细胞群体内存在复杂的功能多态性。
9.hughes和herr提出一种单细胞的蛋白质印迹术(single
‑
cell western blot),采用基于n
‑
(3
‑
((4
‑
苯甲酰基苯基)甲酰氨基)丙基)甲基丙烯酰胺(bpmac)光敏型凝胶原位固定电泳分离后的蛋白进行免疫印迹,在一块微芯片上实现数千个单细胞蛋白质表达水平的测定和细胞异质性的研究。
10.fredrikson等在2002年提出邻位连接技术(proximity ligation assay,pla)是一种具有高灵敏度和高特异性的体外蛋白分析方法。该技术的基本原理是采用抗体与寡核苷酸结合生成邻位连接探针,当一对邻位探针同时识别相同目标蛋白时,两条寡核昔酸在空间上互相靠近,并在一段新加入的连接序列和dna连接酶的作用下形成一段新的寡核苷酸链,这样对该核酸序列进行实时定量扩増就可实现对目标蛋白的定量分析。我国的jiang等和chen等分别提出基于固相和纳米颗粒的pla。lundberg等人在2011年提出液相的邻位延伸技术(proximity extension assay,pea)分析,用dna聚合酶检测具有高特异性和敏感性的蛋白质分子,以提高蛋白质的检测限值。assarson等人在2014年又对该技术做了进一步的改进。该技术的基本原理与pla类似,同样采用抗体与寡核苷酸结合生成邻位延伸探针,当一对探针同时识别相同目标蛋白时,两条寡核苷酸在空间上互相靠近,并在dna聚合酶的作用下形成一段新的寡核苷酸链,之后对该核酸序列进行实时定量扩増就可实现对目标蛋白的定量分析。
11.以上技术对于检测来自生物样本或细胞裂解液中的痕量蛋白表达已被证明非常重要,但是均存在着缺点。微流控技术具有样品试剂消耗少、结构功能多样化、集成化程度高等优点。但是,芯片制备所用材料生物相容性不够好,可能会引起细胞功能发生改变。同时,由于芯片制备工艺复杂,对单细胞分离检测难以控制,大规模推广仍有较大困难。质谱流式细胞分选技术等对抗体探针的质量和数量有较高的要求,有时可能无法找到靶标所对应的复合检测要求的抗体探针,限制了方法的应用。此外,该方法需要在大型质谱流式细胞分析仪上使用,该设备及配套试剂目前仍以国外进口为主,价格昂贵。单细胞western blot结合了sds
‑
page的分子筛效应,通过蛋白质的分子量和抗原抗体识别双重验证,保证了检测的特异性,同时可检测细胞表面蛋白、跨膜蛋白、胞内及核内的蛋白,可区分经表观遗传修饰蛋白。但该方法主要用于细胞裂解液中的痕量蛋白表达,目前已经能实现100个左右的细胞蛋白检测,但在检测生物样品中游离的痕量蛋白分子中的应用目前未见报道。邻位连接技术(pla)由于t4连接酶在复杂生物样本(包括血清或血浆)中容易失去活性,影响反应效率,导致灵敏度降低,应用仍然受到限制。液相邻位延伸技术不需要额外加入连接序列,并采用dna聚合酶,但不需要洗涤步骤也会导致核苷酸序列的非特异性结合产生假阳性信号。此外,临床样本中的复杂成分会影响taq聚合酶活性和检测效率。同时,液相邻位延伸技术中的探针合成寡核苷酸序列信息和试剂主要成分未在已发表文献中公开。
12.因此,本领域的技术人员致力于开发一种蛋白检测试剂盒及检测方法,可以高效地捕获蛋白,并具有快速、特异性强、背景信号低、适用性广、价格低的特点。
技术实现要素:
13.有鉴于现有技术的上述缺陷,本发明所要解决的技术问题是如何更高效地捕获蛋白和如何实现快速、特异性强、背景信号低、适用性广和低成本地检测目标蛋白。
14.为实现上述目的,本发明提供了一种蛋白检测试剂盒,包括第一抗体
‑
寡核苷酸探针、第二抗体
‑
寡核苷酸探针、上游引物和下游引物,所述第一抗体
‑
寡核苷酸探针和第二抗体
‑
寡核苷酸探针具有靶向不同抗原表位的结合点以及可形成互补链的寡核苷酸,并被配置成可在用戊二醛处理的预包被抗体的固相界面上同时识别并结合待测靶蛋白,以及在dna聚合酶的作用下发生邻位延伸反应,所述上游引物和下游引物被配置成扩增所述邻位延伸反应形成的基因片段。
15.进一步地,所述固相界面为pcr管,所述pcr管的材质为聚丙烯。
16.进一步地,所述第一抗体
‑
寡核苷酸探针由抗体、磺基
‑
smcc、5'
‑
硫醇修饰合成的第一寡核苷酸交联而成,所述第二抗体
‑
寡核苷酸探针由抗体、磺基
‑
smcc、5'
‑
硫醇修饰合成的第二寡核苷酸交联而成。
17.进一步地,所述抗体为c反应蛋白多克隆抗体,所述第一寡核苷酸和第二寡核苷酸的序列分别如seq id no:1和seq id no:2所述。
18.进一步地,所述抗体为心肌肌钙蛋白单克隆抗体,所述第一寡核苷酸和第二寡核苷酸的序列分别如seq id no:5和seq id no:6所述。
19.进一步地,所述上游引物和下游引物的序列分别如seq id no:3和seq id no:4所述。
20.进一步地,所述上游引物和下游引物的序列分别如seq id no:7和seq id no:8所述。
21.进一步地,还包括5
×
荧光定量pcr反应缓冲液、dntp混合物、t4 dna聚合酶和超纯水。
22.进一步地,还包括洗涤缓冲液,所述洗涤缓冲液包括1
×
磷酸缓冲液、牛血清白蛋白和吐温20,所述洗涤缓冲液被配置成可对所述预包被抗体的固相界面进行洗涤。
23.本发明还提供了一种蛋白检测试剂盒的检测方法,其特征在于,使用上述的蛋白检测试剂盒在用戊二醛处理的预包被抗体的固相界面上识别并结合待测靶蛋白,进行固相邻位延伸反应,通过荧光定量pcr扩增反应对待测靶蛋白的特异性进行定量或半定量检测。
24.进一步地,所述pcr扩增反应包括:酶激活,50℃保持2min;预变性,95℃保持2min;循环40次,每次变性95℃保持15s,退火55
‑
60℃保持15s,延伸72℃保持30
‑
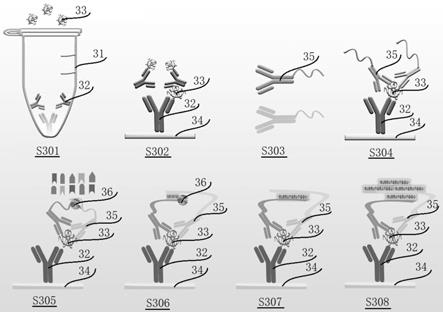
40s。
25.本发明具有以下技术效果:
26.(1)高效固相界面捕获,与蛋白分子的结合速度更快,极大提高蛋白固定效率,避免液相反应中蛋白扩散引起的灵敏度降低;
27.(2)三抗体捕获抗原特异性好,不与其他蛋白发生交叉反应;
28.(3)使用聚合酶进行寡核苷酸延伸反应,不受生物样品中组分的干扰;
29.(4)洗涤步骤不影响抗原抗体结合;
30.(5)本发明所述探针制备方法简便,且单次使用量少;
31.(6)灵敏度高,最低检测下限是现有elisa技术的20000倍;
32.(7)本发明成本低,采用的设备耗材均为实验室常规设备耗材。
33.以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
34.图1是本发明的一个实施例中的抗体上的氨基与寡核苷酸上的巯基交联作用原理示意图;
35.图2a是本发明的一个实施例中的寡核苷酸序列及与crp多克隆抗体结合示意图;
36.图2b是本发明的一个实施例中的寡核苷酸序列及与ctni单克隆抗体结合示意图;
37.图3是本发明的一个实施例中的探针合成反应sds
‑
page胶鉴定图;
38.图4是本发明的一个实施例中的固相邻位延伸反应示意图;
39.图5是本发明的一个实施例中的戊二醛浓度对抗体的捕获效率的关系图;
40.图6是本发明的一个实施例中的不同孵育时间抗原结合探针后反应信号强度图;
41.图7是本发明的一个实施例中的固相邻位延伸技术检测磷酸盐缓冲液中超敏crp蛋白及免疫球蛋白的灵敏度与浓度的线性关系图;
42.图8是本发明的一个实施例中的固相邻位延伸技术检测血清中心肌肌钙蛋白及肌红蛋白的灵敏度与浓度的线性关系图。
具体实施方式
43.以下参考说明书附图介绍本发明的多个优选实施例,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,本发明的保护范围并非仅限于文中提到的实施例。
44.在附图中,结构相同的部件以相同数字标号表示,各处结构或功能相似的组件以相似数字标号表示。附图所示的每一组件的尺寸和厚度是任意示出的,本发明并没有限定每个组件的尺寸和厚度。为了使图示更清晰,附图中有些地方适当夸大了部件的厚度。
45.实施例1:抗体
‑
寡核苷酸探针的合成反应
46.蛋白检测试剂盒的抗体
‑
寡核苷酸探针的合成步骤包括以下内容:
47.步骤1、将分成两部分的匹配单克隆抗体(mab)或多克隆抗体(pab)的抗体以1mg/ml重悬于磷酸盐缓冲液(phosphate buffer saline,pbs)中。100k的超滤管用缀合缓冲液平衡四次,平衡条件为:400μl/孔,3000rpm,1分钟
×
4。缀合缓冲液的成分为:100mm磷酸钠、150mm氯化钠、1
‑
5mm乙二胺四乙酸(edta),ph=7.2。edta的作用为帮助螯合二价金属,从而减少含硫化蛋白中二硫化合物的形成。
48.步骤2、将分子量为436.37的磺基琥珀酰亚胺基
‑4‑
(n
‑
马来酰亚胺甲基)环己烷
‑1‑
羧酸酯钠(磺基
‑
smcc钠)在超纯水(ddh2o)中溶解至4mm(必须现配现用)后,向20μl抗体中加入2μl磺基
‑
smcc钠溶液,混合,并在4℃下孵育2小时,间歇混合三次。抗体用50k离心柱纯化,12000g离心5min,用100μl缀合缓冲液洗涤2次。
49.步骤3、将用5'
‑
硫醇修饰合成的寡核苷酸以100μm重悬于缀合缓冲液中。将2μ
l50mm分子量为286.65的三(2
‑
羧乙基)膦盐酸溶液(tcep
‑
hcl)加入到26μl的每种寡核苷酸中,混合,并在37℃温育1小时。寡核苷酸用10k离心柱纯化,12000g离心5min,用100μl缀合缓冲液洗涤2次。
50.步骤4、将经磺基
‑
smcc钠溶液处理的抗体与tcep
‑
hcl处理的寡核苷酸以3倍摩尔过量的寡核苷酸与抗体混合,充分混匀,抗体
‑
寡核苷酸混合物在4℃避光环境下,缓慢转动培育2h或过夜。
51.步骤5、探针用50k离心柱纯化,12000g离心5min,用100μl缀合缓冲液洗涤2次。
52.步骤6、分析制得的抗体
‑
寡核苷酸探针经十二烷基硫酸钠
‑
聚丙烯酰胺凝胶电泳(sds
‑
page)泳验证核酸是否己连接,然后加入包含4mm edta、35mg/ml单链dna(ssdna,sigma
‑
aldrich公司)、0.1%鱼明胶和20mm三羟甲基氨基甲烷盐酸溶液(tris
‑
hcl)的磷酸盐缓冲液(pbs),保存在
‑
20℃。
53.图1为抗体上的氨基与寡核苷酸上的巯基交联作用原理示意图。
54.磺基
‑
smcc钠盐11与含有氨基nh2的抗体12反应,生成抗体
‑
smcc 13。与含有巯基sh的寡核苷酸14通过巯基sh交联连接起来,生成抗体
‑
寡核苷酸探针15。
55.应用于固相邻位延伸技术的一对抗体
‑
寡核苷酸探针15由两种不同抗原表位的单克隆抗体(或多克隆抗体)与可形成互补链的寡核苷酸共价结合而来。
56.图2a和图2b示出了两种示例抗体
‑
寡核苷酸探针的寡核苷酸序列及与抗体结合的示意图。
57.图2a适用于c反应蛋白分子的检测。5'
‑
硫醇修饰的两种不同抗原表位的c反应蛋白多克隆抗体
‑
寡核苷酸探针21分别为hs
‑
5'
‑
gtgctgcgagagtattatcttgcaccttatgctaccgtgacctgcgaatccagtct
‑
3(seq id no:1)'和hs
‑
5'
‑
caggtagtagtacgtctgtttcacgatgagactggattcgcaggtcacggtagcat
‑
3'(seq id no:2),两者之间可形成互补链,在加入单核苷酸的作用下延伸反应,继而形成双链dna模板,可以通过实时荧光定量pcr反应进行检测,所用的一对引物分别为5'
‑
ccaggtagtagtacgtctgtt
‑
3'(seq id no:3)和5'
‑
cgtgctgcgagagtattatct
‑
3'(seq id no:4)。
58.图2b适用于心肌肌钙蛋白分子的检测。5'
‑
硫醇修饰的两种不同抗原表位的心肌肌钙蛋白单克隆抗体
‑
寡核苷酸探针22分别为hs
‑
5'
‑
gcgagagtactatacataactgcaccgtacagattcgtgcacgtgcaatacagtcc
‑
3'(seq id no:5)和hs
‑
5'
‑
ctgactgtaccagatagtacacctgcatggactgtattgcacgtgcacgaatctgt
‑
3'(seq id no:6),两者之间可形成互补链,在加入单核苷酸的作用下延伸反应,继而形成双链dna模板,可以通过实时荧光定量pcr反应进行检测,所用的一对引物分别为5'
‑
agatagtacacctgcatggactg
‑
3'(seq id no:7)和5'
‑
tgcaccgtacagattcgtg
‑
3'(seq id no:8)。
59.图3为使用sds
‑
page电泳验证探针合成反应的结果图,左图为核酸染料染色的sds
‑
page胶,右图为考马斯亮蓝染色的sds
‑
page胶。图中左侧为核酸染料染色的sds
‑
page胶,右侧为考马斯亮蓝染色的sds
‑
page胶,其中,1为c反应蛋白(crp)抗体;2为第一c反应蛋白探针;3为第二c反应蛋白探针;4为纯化的第一c反应蛋白探针;5为纯化的第二c反应蛋白探针;6为蛋白质标记物。在两种胶的显影图片中,均可以看到第一c反应蛋白探针和第二c反应蛋白探针以及蛋白质标记物,说明该抗体
‑
寡核苷酸探针的两个探针成功连接。
60.实施例2:用戊二醛处理的预包被抗体的qpcr管的制备方法
61.蛋白检测试剂盒的用戊二醛处理的预包被抗体的qpcr管的制备方法包括以下步骤:
62.步骤1、将戊二醛溶液(戊二醛为一种双功能试剂,通过其醛基与免疫球蛋白上的氨基共价结合)用去离子水稀释到0.8%,加入到八联管底部,每管加25μl,置于37℃水浴处理5h。然后用去离子水洗涤三次。
63.步骤2、加入浓度1μg/ml抗体25μl(多抗比单抗效果好)包被缓冲液,在4℃过夜或者37℃孵育1小时。包被缓冲液的成分为:15mm na2co3、35mm nahco3,ph=9.6。
64.步骤3、结合完毕以后用洗涤缓冲液洗三次,管壁上没有结合抗体的位点用50μl用1
×
磷酸盐缓冲液(pbs)稀释的1%牛血清白蛋白(bsa)进行封闭,放入37℃水浴锅封闭一小时,洗三次,放于4℃用于后续实验。洗涤缓冲液的成分为:1
×
磷酸缓冲液、0.5%牛血清白蛋白和0.05%吐温20。
65.实施例3:固相邻位延伸反应
66.图4为本技术的固相邻位延伸反应的示意图。
67.由图可知,固相邻位延伸反应包括:
68.s301、抗体预包被pcr管。具体如实施例2所述,在pcr管31上预包被了抗体32。然后,加入待测靶标蛋白33。
69.s302、捕获待测靶标蛋白。在戊二醛处理的固相界面34上,抗体32将待测靶标蛋白33捕获。
70.s303、加入抗体
‑
寡核苷酸探针。一对抗体
‑
寡核苷酸探针35由两种不同抗原表位的单克隆抗体(或多克隆抗体)与可形成互补链的寡核苷酸共价结合而来。具体如实施例1所述。
71.s304、探针识别待测靶标蛋白。一对抗体
‑
寡核苷酸探针35对待测靶标蛋白33进行识别。
72.s305、加入单核苷酸36。
73.s306、聚合酶作用下延伸反应。
74.s307、形成双链dna模板。
75.s308、实时荧光定量pcr反应。
76.固相邻位延伸反应的具体过程为:
77.步骤1、将待检测抗原在稀释液(磷酸盐缓冲液,0.1%牛血清白蛋白)中稀释至浓度范围为0.5fg/ml至50ng/ml以制备标准曲线。空白对照分别为对应的无抗原稀释液。取实施例2中经过戊二醛处理的预包被抗体的qpcr八联管为固定相,吸附抗体应用于检测。每个反应取25μl样品加入到管子中,室温结合20min,随后用洗涤缓冲液洗涤三次。
78.步骤2、将探针在探针缓冲液孵育5至10min,以在组合探针对之前阻断非特异性结合。探针缓冲液的成分为:0.1%牛血清白蛋白(bsa,新英格兰bio
‑
labs公司)、0.05%吐温(sigma
‑
aldrich公司)、0.1μg/μl鲑鱼精子dna(invitrogen公司)、100nm山羊igg(sigma
‑
aldrich公司)、1mmd
‑
生物素(invitrogen公司)、5mm edta、1
×
pbs。每管加入25μl 1nm(150ng/ml)抗体
‑
寡核苷酸探针室温缓慢震荡20min。没有结合的邻位探针用250μl洗涤缓冲液洗涤5次去掉。然后加入如下25μl延伸体系溶液,混匀后室温反应5min,然后在37℃下进行延伸反应5min,然后在75℃下进行10min热失活步骤。
79.延伸体系溶液的成分及体积见表1所示:
80.试剂体积5
×
反应缓冲液5μl2mm dntp混合物1.25μlt4 dna聚合酶0.25μl超纯水添加至总体积25μl
81.表1.延伸体系溶液的成分及体积配方
82.步骤3、用100μl洗涤缓冲液洗涤三次,将洗涤液吸干后,加入25μl qpcr所需缓冲液、酶和引物,对管壁上连接得到的dna产物进行定量扩增。25μl扩增反应体系见表2所示:
83.试剂体积2x powerup
tm sybr
tm green预混液12.5μl引物f(10um)1μl引物r(10um)1μl水10.5μl
84.表2.扩增反应体系的成分及体积表
85.步骤4、使用lightcycler 96进行qpcr检测。
86.检测流程见表3所示:
[0087][0088]
表3.qpcr检测流程表
[0089]
注:退火温度根据引物的tm值进行设置
[0090]
实施例4:不同浓度戊二醛对抗体的捕获效率的影响
[0091]
1、将戊二醛溶液用去离子水稀释到0.8%、4%、8%加入到八联管底部,每管加25μl,置于37℃水浴处理5h。然后用去离子水洗涤三次。
[0092]
2、加入1μg/ml溶解于包被缓冲液(15mm na2co3,35mm nahco3,ph 9.6)的crp抗体25μl,4℃过夜或者37℃孵育1h。
[0093]
3、结合完毕以后用洗涤缓冲液(1
×
磷酸盐缓冲液、0.5%牛血清白蛋白和0.05%吐温20)洗三次,管壁上没有结合抗体的位点用50μl 1%牛血清白蛋白在1
×
磷酸盐缓冲液中封闭,放入37℃水浴锅封闭1h,洗三次,放于4℃用于后续实验。
[0094]
4、加入浓度0.1pg/ml的crp蛋白。空白对照分别为对应的无抗原稀释液。上述处理过的八联管为固定相,吸附抗体应用于检测。每个反应取25μl样品加入到管子中,室温结合20min,随后用洗涤缓冲液洗涤三次。
[0095]
5、将crp探针在探针缓冲液孵育5至10分钟,以在组合探针对之前阻断非特异性结合。每管加入25μl 1nm(150ng/ml)抗体
‑
寡核苷酸探针室温缓慢震荡20min。没有结合的邻
位探针用250μl洗涤缓冲液洗涤5次去掉。然后加入如表1所示的25μl延伸体系溶液,混匀后室温反应5min,然后在37℃下进行延伸反应5min,然后在75℃下进行10min热失活步骤。
[0096]
6、用100μl洗涤缓冲液洗涤三次,将洗涤液吸干后,加入25μl qpcr所需缓冲液、酶和引物,对管壁上连接得到的dna产物进行定量扩增。25μl扩增反应体系见表2。
[0097]
7、使用lightcycler 96进行qpcr检测,检测步骤见表3所示。
[0098]
不同浓度戊二醛对抗体的捕获效率结果见图5所示,可见戊二醛浓度越高,抗原信号与背景信号的差值越高。
[0099]
实施例5:不同孵育时间对ctni检测效率的影响
[0100]
1、将戊二醛溶液用去离子水稀释到8%加入到八联管底部,每管加25μl,置于37℃水浴处理5h。然后用去离子水洗涤三次。
[0101]
2、加入1μg/ml溶解于包被缓冲液(15mm na2co3,35mm nahco3,ph 9.6)的ctni
‑
tnc抗体25μl,37℃分别孵育20min、40min和60min。
[0102]
3、结合完毕以后用洗涤缓冲液(1
×
磷酸盐缓冲液、0.5%牛血清白蛋白和0.05%吐温20)洗三次,管壁上没有结合抗体的位点用50μl 1%牛血清白蛋白在1
×
磷酸盐缓冲液中封闭,放入37℃水浴锅封闭1h,洗三次,放于4℃用于后续实验。
[0103]
4、加入浓度梯度为0.5fg/ml至0.5μg/ml的ctni蛋白。空白对照分别为对应的无抗原稀释液。上述处理过的八联管为固定相,吸附抗体应用于检测。每个反应取25μl样品加入到管子中,室温结合20min,随后用洗涤缓冲液洗涤三次。
[0104]
5、将ctni探针在探针缓冲液孵育5至10分钟,以在组合探针对之前阻断非特异性结合。每管加入25μl 1nm(150ng/ml)抗体
‑
寡核苷酸探针室温缓慢震荡20min。没有结合的邻位探针用250μl洗涤缓冲液洗涤5次去掉。然后加入如表1所示的25μl延伸体系溶液,混匀后室温反应5min,然后在37℃下进行延伸反应5min,然后在75℃下进行10min热失活步骤。
[0105]
6、用100μl洗涤缓冲液洗涤三次,将洗涤液吸干后,加入25μl qpcr所需缓冲液、酶和引物,对管壁上连接得到的dna产物进行定量扩增。25μl扩增反应体系见表2。
[0106]
7、使用lightcycler 96进行qpcr检测,检测步骤见表3所示。
[0107]
不同孵育时间下对ctni抗体的检测效率的影响结果见图6所示,当抗原ctni蛋白浓度较低时,不同孵育时间的信号强度差别不大;当抗原ctni蛋白浓度较高时,孵育时间20和40min的信号强度比孵育时间60min的高。
[0108]
实施例6:使用crp探针检测磷酸盐缓冲液中crp蛋白及免疫球蛋白的灵敏度和特异性比较
[0109]
1、将戊二醛溶液用去离子水稀释到8%加入到八联管底部,每管加25℃,置于37℃水浴处理5h。然后用去离子水洗涤三次。
[0110]
2、加入1μg/ml溶解于包被缓冲液(15mm na2co3,35mm nahco3,ph 9.6)的crp抗体25μl,4℃过夜或者37℃孵育20min。
[0111]
3、结合完毕以后用洗涤缓冲液(1
×
磷酸盐缓冲液、0.5%牛血清白蛋白和0.05%吐温20)洗三次,管壁上没有结合抗体的位点用50μl 1%牛血清白蛋白在1
×
磷酸盐缓冲液中封闭,放入37℃水浴锅封闭1h,洗三次,放于4℃用于后续实验。
[0112]
4、加入浓度梯度为0.5fg/ml至0.5μg/ml的crp蛋白或免疫球蛋白。空白对照分别为对应的无抗原稀释液。上述处理过的八联管为固定相,吸附抗体应用于检测。每个反应取
25μl样品加入到管子中,室温结合20min,随后用洗涤缓冲液洗涤三次。
[0113]
5、将crp探针在探针缓冲液孵育5至10分钟,以在组合探针对之前阻断非特异性结合。每管加入25μl 1nm(150ng/ml)抗体
‑
寡核苷酸探针室温缓慢震荡20min。没有结合的邻位探针用250μl洗涤缓冲液洗涤5次去掉。然后加入如表1所示的25μl延伸体系溶液,混匀后室温反应5min,然后在37℃下进行延伸反应5min,然后在75℃下进行10min热失活步骤。
[0114]
6、用100μl洗涤缓冲液洗涤三次,将洗涤液吸干后,加入25μl qpcr所需缓冲液、酶和引物,对管壁上连接得到的dna产物进行定量扩增。25μl扩增反应体系见表2。
[0115]
7、使用lightcycler 96进行qpcr检测,检测步骤见表3所示。
[0116]
图7表示使用固相邻位延伸技术检测磷酸盐缓冲液中超敏crp蛋白及免疫球蛋白的灵敏度和浓度的线性关系图。
[0117]
实施例7:使用ctni探针检测血清中心肌肌钙蛋白ⅰ及肌红蛋白的灵敏度和特异性比较
[0118]
1、将戊二醛溶液用去离子水稀释到8%加入到八联管底部,每管加25℃,置于37℃水浴处理5h。然后用去离子水洗涤三次。
[0119]
2、加入1μg/ml溶解于包被缓冲液(15mm na2co3,35mm nahco3,ph 9.6)的ctni抗体25μl,4℃过夜或者37℃孵育20min。
[0120]
3、结合完毕以后用洗涤缓冲液(1
×
磷酸盐缓冲液、0.5%牛血清白蛋白和0.05%吐温20)洗三次,管壁上没有结合抗体的位点用50μl 1%牛血清白蛋白在1
×
磷酸盐缓冲液中封闭,放入37℃水浴锅封闭1h,洗三次,放于4℃用于后续实验。
[0121]
4、加入浓度梯度为0.5fg/ml至0.5μg/ml的心肌肌钙蛋白ⅰ或肌红蛋白。空白对照分别为对应的无抗原稀释液。上述处理过的八联管为固定相,吸附抗体应用于检测。每个反应取25μl样品加入到管子中,室温结合20min,随后用洗涤缓冲液洗涤三次。
[0122]
5、将ctni探针在探针缓冲液孵育5至10分钟,以在组合探针对之前阻断非特异性结合。每管加入25μl 1nm(150ng/ml)抗体
‑
寡核苷酸探针室温缓慢震荡20min。没有结合的邻位探针用250μl洗涤缓冲液洗涤5次去掉。然后加入如表1所示的25μl延伸体系溶液,混匀后室温反应5min,然后在37℃下进行延伸反应5min,然后在75℃下进行10min热失活步骤。
[0123]
6、用100μl洗涤缓冲液洗涤三次,将洗涤液吸干后,加入25μl qpcr所需缓冲液、酶和引物,对管壁上连接得到的dna产物进行定量扩增。25μl扩增反应体系见表2。
[0124]
7、使用lightcycler 96进行qpcr检测,检测步骤见表3所示。
[0125]
图8表示使用固相邻位延伸技术检测血清中心肌肌钙蛋白及肌红蛋白的灵敏度和浓度的线性关系图。
[0126]
在本发明的较佳实施方式中,靶蛋白可以来自于血清、血浆、唾液等体液或提取出的蛋白质或纯化的蛋白质溶液等。
[0127]
在本发明的另一较佳实施方式中,抗体
‑
寡核苷酸探针可以由链霉亲和素
‑
寡核苷酸与生物素化多克隆抗体反应而得来。
[0128]
在本发明的另一较佳实施方式中,蛋白质检测试剂盒可用于一种或多种蛋白质分析物质的同时检测。
[0129]
固相邻位延伸探针蛋白检测方法可以满足以下要求:
[0130]
1、高效捕获靶蛋白。预包被抗体管壁捕获蛋白能力强,效率高,不易被洗脱造成蛋
白损失,可显著提升原方法的灵敏度。
[0131]
2、快速。预包被抗体管壁捕获所需孵育时间缩短,避免引起蛋白抗原位点失活,节省实验时间,降低人力时间成本。
[0132]
3、特异性强。单抗/多抗捕获靶蛋白后,另外两个针对不同位点的单抗
‑
寡核苷酸修饰的探针需要同时结合到靶蛋白上才可发生邻位延伸反应,大大减少了非特异性结合和假阳性信号。
[0133]
4、背景信号低。预包被抗体管壁在捕获抗体结合以外的位置由牛血清白蛋白包被保护,避免固定位点被占用引起的蛋白固定效率降低,同时减少因此产生的背景荧光。
[0134]
5、适用性广。增加了洗涤步骤不与生物样本中的其它分子反应,可适用于多种来源的生物样本痕量蛋白检测,避免影响dna聚合酶和taq酶活性。
[0135]
6、探针与蛋白分子的结合速度更快,极大提高蛋白结合效率,避免因蛋白变性失活引起的灵敏度降低。
[0136]
7、实验材料均为通用材料,价格更低廉。
[0137]
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1