氘代的己酮糖激酶抑制剂及其用途的制作方法
1.本发明涉及医药技术领域,具体涉及氘代的己酮糖激酶抑制剂化合物、其药学上可接受的盐、其酯或其立体异构体,含有所述化合物、其药学上可接受的盐、其酯或其立体异构体的药物组合物及制剂,制备所述化合物、其药学上可接受的盐、其酯或其立体异构体的方法,以及所述化合物、其药学上可接受的盐、其酯或其立体异构体在制备治疗和/或预防由khk介导的疾病及相关疾病的药物中的用途。
背景技术:
2.nafld/nash是代谢综合征的肝脏表现。饮食以及生活方式的改变导致西方国家和许多亚洲国家肥胖和代谢综合征的流行,从而导致nafld的发病率显著增加,已成为颇受关注的公共健康问题之一。非酒精性脂肪肝炎(nonalcoholic steatohepatitis,nash)是单纯性脂肪肝进一步发展的结果,其病理表现为脂质沉积、炎性细胞浸润、肝组织坏死和纤维化病变,进一步病变为更严重的肝硬化和肝细胞癌(hcc)。nafld不仅会影响患者的肝胆系统,还与胰岛素抵抗、血脂紊乱、动脉粥样硬化、脂肪栓塞、血液系统疾病等密切相关。因为代谢综合症的所有组分均与肝脏脂肪含量有关,所以存在代谢综合征的患者应该评估nafld风险。2型糖尿病患者伴随胰岛素抵抗、肥胖、血脂异常、肝脏酶学异常,有2型糖尿病风险的人群nafld的流行亦较高。
3.由于饮料和加工食品中糖添加(通常是蔗糖和高果糖玉米糖浆)不断增加,导致现代人饮食中果糖的含量增加。高果糖摄入已被证明会引起许多不良代谢作用,它在肥胖和代谢综合征的发展中具有一定的作用,如体重增加,高脂血症,高血压和胰岛素抵抗。果糖促进了nafld的发生、发展,加剧了nafld的发展和恶化。同时,高果糖摄入会增加nash和进展期肝纤维化的风险。不同于葡萄糖,果糖的代谢不受负反馈调控。果糖相对于其他碳水化合物优先代谢,其代谢产生各种反应和信号代谢物,促进代谢疾病进展。在没有khk的情况下,果糖消耗引起的体重增加和胰岛素抵抗被阻断。降低糖/hfcs(高果糖玉米糖浆)的摄入量和/或阻断尿酸的产生,有助于减少nafld及其肝硬化和慢性肝病的下游并发症。同时,人类基因诱变导致基本的果糖糖尿症,是一种罕见的无害的异常,其特征在于在摄入含果糖的食物后尿液中出现果糖。t2d、肥胖及nafld/nash及诸如心血管疾病及脑卒中等相关代谢类疾病的高患病率已导致对预防性保健及治疗性干预两者的需求增大。
4.己酮糖激酶(又称果糖激酶)为果糖代谢的基本酶。肝脏中khk酶在atp(三磷酸腺苷)的协助下磷酸化果糖c1位,产生果糖
‑1‑
磷酸(f1p),进入正常代谢路径;同时atp下游产生尿酸。两个替代性mrna剪切体表达的人源性己酮糖激酶(hkhk)编码两个不同区域异构体酶khk
‑
a和khk
‑
c。khk
‑
c具有更低的km值,更高的kcat,高于405倍的催化效率,说明khk
‑
c对果糖磷酸化的亲和力和能力明显比khk
‑
a高。虽然khk
‑
a表达广泛,khk
‑
c分布于肝脏、肾脏、肠,但是khk
‑
c是体内果糖的主要代谢位点。
5.在人体内,葡萄糖通过多元醇通路经过中间体山梨糖醇转化为果糖,产生内源性果糖,并且此通路的活性随高血糖症增加。研究表明敲除khk小鼠被保护免受葡萄糖诱导的
体重增加、胰岛素抗性及脂肪变性,表明在高血糖病况下,内源性产生的果糖可促成胰岛素抗性及脂肪变性。果糖是唯一在其代谢过程中产生尿酸的常见碳水化合物,同时果糖还会刺激氨基酸前体合成尿酸。因此,推测抑制khk对其中涉及内源性或摄入果糖中的任一或两者的改变的许多疾病有益处。
6.肝果糖激酶缺乏症是果糖尿症的基础。与这种良性条件相反,醛缩酶b(果糖经khk代谢途径中的下一种酶)的缺乏导致f1p在果糖摄入中的累积,并且可能导致细胞atp的致死性消耗(遗传性果糖不耐受)。在果糖代谢路径中,紧接着khk步骤下游负责分解f1p的酶为醛缩酶(aldob),该酶的缺失导致遗传性果糖不耐受症(hfi)。在20000人中约有1人患病的罕见病症,该突变导致f1p积累、atp损耗后尿酸形成增加,其组合造成低血糖症、高尿酸血症及乳酸性酸中毒,以及其他代谢紊乱。hfi阻断了果糖的下游代谢而导致急性症状,诸如呕吐、严重低血糖症、腹泻及腹痛,进而导致长期生长缺陷、肝及肾受损及潜在地死亡。患者在诊断之前通常经历一年生存,且唯一治疗方式为避免饮食中的果糖。而体内葡萄糖经过多元醇通路转化为内源性果糖并在体内代谢,对这种治疗方式也是一种挑战。大部分食品中果糖的存在对饮食提出了挑战。除了物理症状,许多患者由于其不同寻常的饮食需面对情感及社会的孤立,同时需要严格遵守饮食限制。此外,含有果糖、山梨糖醇或转化糖的输注还会危及患者生命。此病症有高度未满足的临床需求。
技术实现要素:
7.本发明的目的在于提供一种氘代的己酮糖激酶抑制剂及其应用。具体技术方案如下:
8.本发明首先提供了通式(i)所示的化合物、其药学上可接受的盐、酯或其立体异构体:
[0009][0010]
其中,
[0011]
x、y、z分别独立地选自
‑
cr4‑
和
‑
n
‑
;
[0012]
环a选自3
‑
14元环烷基、3
‑
14元杂环基、6
‑
12元芳基和5
‑
12元杂芳基;
[0013]
r1选自氘,氢,卤素,硝基,氰基,
‑
(l)
m
‑
c(o)or
a
、
‑
(l)
m
‑
conr
a
r
b
、
‑
(l)
m
‑
conhso2r
a
、
‑
(l)
m
‑
so2r
a
、
‑
(l)
m
‑
so2nhcor
a
、
‑
(l)
m
‑
or
a
、
‑
(l)
m
‑
sr
a
、
‑
(l)
m
‑
nr
a
r
b
、
‑
(l)
m
‑
c(o)r
a
、
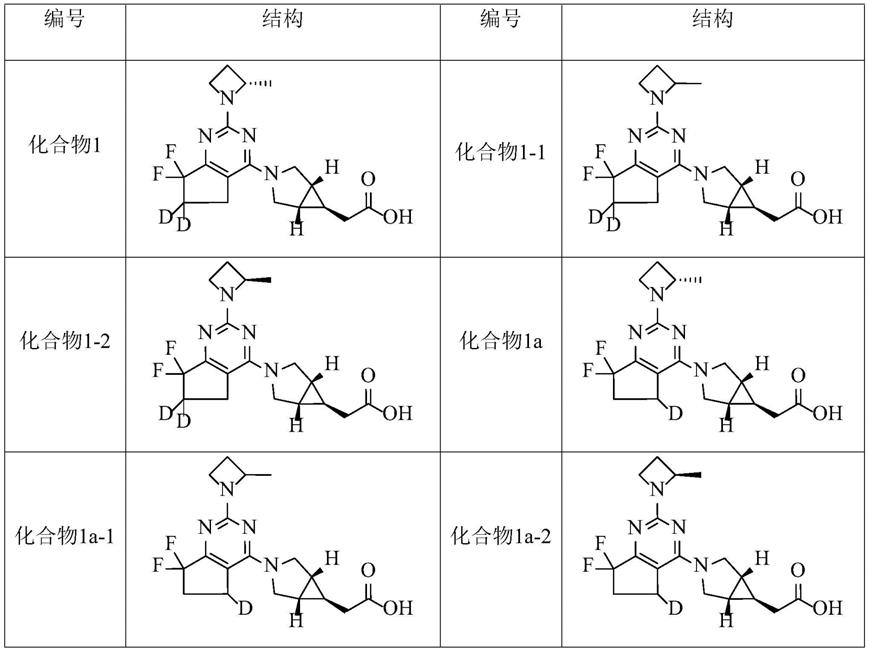
‑
(l)
m
‑
oc(o)r
a
、
‑
(l)
m
‑
oc(o)or
a
、
‑
(l)
m
‑
oc(o)nr
a
r
b
、
‑
(l)
m
‑
nr
a
c(o)r
b
、
‑
(l)
m
‑
nr
a
c(o)or
b
、
‑
(l)
m
‑
os(o)r
a
、
‑
(l)
m
‑
os(o)or
a
、
‑
(l)
m
‑
os(o)nr
a
r
b
、
‑
(l)
m
‑
s(o)nr
a
r
b
、
‑
(l)
m
‑
nr
a
s(o)r
b
、
‑
(l)
m
‑
os(o)2r
a
、
‑
(l)
m
‑
s(o)2nr
a
r
b
、
‑
(l)
m
‑
nr
a
s(o)2r
b
,任选被一个或多个q1取代的
‑
(l)
m
‑
c1‑6烷基、
‑
(l)
m
‑
c1‑6烷氧基、
‑
(l)
m
‑
c3‑
12
环烷基、
‑
(l)
m
‑
c3‑
12
杂环基、
‑
(l)
m
‑
c6‑
12
芳基和
‑
(l)
m
‑
c5‑
12
杂芳基;
[0014]
每一l分别独立地选自任选被氘代的c1‑6亚烷基和卤代c1‑6亚烷基;
[0015]
r2选自任选被一个或多个q2取代的3
‑
12元杂环基、3
‑
12元环烷基、5
‑
12元杂芳基、
6
‑
12元芳基、5
‑
12元螺环基、5
‑
12元螺杂环基、5
‑
12元桥环基、5
‑
12元桥杂环基、
‑
n(c1‑6烷基)2、
‑
n(c1‑6烷基)(c3‑8环烷基)、
‑
nh(c1‑6烷基)和
‑
nh(c3‑8环烷基);
[0016]
每一r3分别独立地选自氘,氢,卤素,硝基,氰基,氨基,羟基,羧基,任选被一个或多个q3取代的c1‑6烷基、c1‑6烷氧基、c1‑6烷基氨基、二(c1‑6烷基)氨基、卤代c1‑6烷基、羟基c1‑6烷基、氨基c1‑6烷基、卤代c1‑6烷氧基、3
‑
12元环烷基、3
‑
12元杂环基、6
‑
12元芳基和5
‑
12元杂芳基;
[0017]
每一r4分别独立地选自氘、氢、氰基,及任选被一个或多个q4取代的如下基团:c1‑6烷基、
‑
c(o)r
a
、
‑
c(o)or
a
、
‑
c(o)nr
a
r
b
、
‑
s(o)r
a
、
‑
s(o)or
a
、
‑
s(o)nr
a
r
b
、
‑
s(o)2r
a
、
‑
s(o)2or
a
、
‑
s(o)2nr
a
r
b
、3
‑
12元环烷基、3
‑
12元杂环基、6
‑
12元芳基和5
‑
12元杂芳基;
[0018]
每一r
a
、每一r
b
分别独立地选自氢、c1‑6烷基、c1‑6烷氧基、c1‑6烷基氨基、二(c1‑6烷基)氨基、卤代c1‑6烷基、羟基c1‑6烷基、氨基c1‑6烷基和卤代c1‑6烷氧基;
[0019]
每一q1、每一q2、每一q3、每一q4分别独立地选自氘、羟基、氨基、卤素、硝基、氰基、羧基、c1‑6烷基、c1‑6烷氧基、c1‑6烷基氨基、二(c1‑6烷基)氨基、卤代c1‑6烷基、羟基c1‑6烷基、氨基c1‑6烷基、卤代c1‑6烷氧基、3
‑
10元环烷基、3
‑
10元杂环基、6
‑
10元芳基和5
‑
10元杂芳基;
[0020]
每一m、n分别独立地为0
‑
8的整数;
[0021]
且r1、r2、r3、r4、l、q1、q2、q3、q4中至少有一个为氘或被氘取代。
[0022]
在某些实施方案,前述通式(i)所示的化合物、其药学上可接受的盐、其酯或其立体异构体,其中,
[0023]
x、y、z分别独立地选自
‑
cr4‑
和
‑
n
‑
;
[0024]
环a选自3
‑
12元环烷基、3
‑
12元杂环基、6
‑
10元芳基和5
‑
10元杂芳基;
[0025]
r1选自氘,氢,卤素,硝基,氰基,
‑
(l)
m
‑
c(o)or
a
、
‑
(l)
m
‑
conr
a
r
b
、
‑
(l)
m
‑
conhso2r
a
、
‑
(l)
m
‑
so2r
a
、
‑
(l)
m
‑
so2nhcor
a
、
‑
(l)
m
‑
or
a
、
‑
(l)
m
‑
sr
a
、
‑
(l)
m
‑
nr
a
r
b
、
‑
(l)
m
‑
c(o)r
a
、
‑
(l)
m
‑
oc(o)r
a
、
‑
(l)
m
‑
oc(o)or
a
、
‑
(l)
m
‑
oc(o)nr
a
r
b
、
‑
(l)
m
‑
nr
a
c(o)r
b
、
‑
(l)
m
‑
nr
a
c(o)or
b
、
‑
(l)
m
‑
os(o)r
a
、
‑
(l)
m
‑
os(o)or
a
、
‑
(l)
m
‑
os(o)nr
a
r
b
、
‑
(l)
m
‑
s(o)nr
a
r
b
、
‑
(l)
m
‑
nr
a
s(o)r
b
、
‑
(l)
m
‑
os(o)2r
a
、
‑
(l)
m
‑
s(o)2nr
a
r
b
、
‑
(l)
m
‑
nr
a
s(o)2r
b
,任选被一个或多个q1取代的
‑
(l)
m
‑
c1‑6烷基、
‑
(l)
m
‑
c1‑6烷氧基、
‑
(l)
m
‑
c3‑
10
环烷基、
‑
(l)
m
‑
c3‑
10
杂环基、
‑
(l)
m
‑
c6‑
10
芳基和
‑
(l)
m
‑
c5‑
10
杂芳基;
[0026]
每一l分别独立地选自任选被氘代的c1‑6亚烷基和卤代c1‑6亚烷基;
[0027]
r2选自任选被一个或多个q2取代的3
‑
8元杂环基、3
‑
8元环烷基、5
‑
10元杂芳基、6
‑
10元芳基、5
‑
10元螺环基、5
‑
10元螺杂环基、5
‑
10元桥环基、5
‑
10元桥杂环基、n(c1‑6烷基)2、n(c1‑6烷基)(c3‑8环烷基)、nh(c1‑6烷基)和nh(c3‑8环烷基);
[0028]
每一r3分别独立地选自氘,氢,卤素,硝基,氰基,氨基,羟基,羧基,任选被一个或多个q3取代的c1‑6烷基、c1‑6烷氧基、c1‑6烷基氨基、二(c1‑6烷基)氨基、卤代c1‑6烷基、羟基c1‑6烷基、氨基c1‑6烷基、卤代c1‑6烷氧基、3
‑
10元环烷基、3
‑
10元杂环基、6
‑
10元芳基和5
‑
10元杂芳基;
[0029]
每一r4分别独立地选自氘、氢、氰基,及任选被一个或多个q4取代的如下基团:c1‑6烷基、
‑
c(o)r
a
、
‑
c(o)or
a
、
‑
c(o)nr
a
r
b
、
‑
s(o)r
a
、
‑
s(o)or
a
、
‑
s(o)nr
a
r
b
、
‑
s(o)2r
a
、
‑
s(o)2or
a
和
‑
s(o)2nr
a
r
b
;
[0030]
每一r
a
、每一r
b
分别独立地选自氢、c1‑6烷基、c1‑6烷氧基、c1‑6烷基氨基、二(c1‑6烷
基)氨基、卤代c1‑6烷基、羟基c1‑6烷基、氨基c1‑6烷基和卤代c1‑6烷氧基;
[0031]
每一q1、每一q2、每一q3、每一q4分别独立地选自氘、羟基、氨基、卤素、硝基、氰基、羧基、c1‑6烷基、c1‑6烷氧基、c1‑6烷基氨基、二(c1‑6烷基)氨基、卤代c1‑6烷基、羟基c1‑6烷基、氨基c1‑6烷基和卤代c1‑6烷氧基;
[0032]
每一m、n分别独立地为0
‑
6的整数;
[0033]
且r1、r2、r3、r4、l、q1、q2、q3、q4中至少有一个为氘或被氘取代。
[0034]
在某些实施方案,前述通式(i)所示的化合物、其药学上可接受的盐、其酯或其立体异构体,其中,
[0035]
x、y、z分别独立地选自
‑
cr4‑
和
‑
n
‑
;
[0036]
环a选自3
‑
10元环烷基、3
‑
10元杂环基、6
‑
10元芳基和5
‑
10元杂芳基;
[0037]
r1选自氘,氢,卤素,硝基,氰基,
‑
(l)
m
‑
c(o)or
a
、
‑
(l)
m
‑
conr
a
r
b
、
‑
(l)
m
‑
conhso2r
a
、
‑
(l)
m
‑
so2r
a
、
‑
(l)
m
‑
so2nhcor
a
、
‑
(l)
m
‑
or
a
、
‑
(l)
m
‑
nr
a
r
b
、
‑
(l)
m
‑
c(o)r
a
、
‑
(l)
m
‑
oc(o)r
a
、
‑
(l)
m
‑
nr
a
c(o)r
b
、
‑
(l)
m
‑
nr
a
c(o)or
b
、
‑
(l)
m
‑
os(o)2r
a
、
‑
(l)
m
‑
s(o)2nr
a
r
b
、
‑
(l)
m
‑
nr
a
s(o)2r
b
,任选被一个或多个q1取代的
‑
(l)
m
‑
c1‑4烷基和
‑
(l)
m
‑
c1‑4烷氧基;
[0038]
每一l分别独立地选自任选被氘代的c1‑4亚烷基和卤代c1‑4亚烷基;
[0039]
r2选自任选被一个或多个q2取代的3
‑
8元杂环基、3
‑
8元环烷基、5
‑
10元杂芳基、6
‑
10元芳基、5
‑
10元螺环基、5
‑
10元螺杂环基、n(c1‑4烷基)2、n(c1‑4烷基)(c3‑6环烷基)、nh(c1‑4烷基)和nh(c3‑6环烷基);
[0040]
每一r3分别独立地选自氘,氢,卤素,硝基,氰基,氨基,羟基,羧基,任选被一个或多个q3取代的c1‑4烷基、c1‑4烷氧基、c1‑4烷基氨基、二(c1‑4烷基)氨基、卤代c1‑4烷基、羟基c1‑4烷基、氨基c1‑4烷基和卤代c1‑4烷氧基;
[0041]
每一r4分别独立地选自氘、氢、氰基,及任选被一个或多个q4取代的如下基团:c1‑4烷基、
‑
c(o)r
a
、
‑
c(o)or
a
、
‑
c(o)nr
a
r
b
、
‑
s(o)2r
a
、
‑
s(o)2or
a
和
‑
s(o)2nr
a
r
b
;
[0042]
每一r
a
、每一r
b
分别独立地选自氢、c1‑4烷基、c1‑4烷氧基、c1‑4烷基氨基、二(c1‑4烷基)氨基、卤代c1‑4烷基、羟基c1‑4烷基、氨基c1‑4烷基和卤代c1‑4烷氧基;
[0043]
每一q1、每一q2、每一q3、每一q4分别独立地选自氘、羟基、氨基、卤素、硝基、氰基、羧基、c1‑4烷基、c1‑4烷氧基、c1‑4烷基氨基、二(c1‑4烷基)氨基、卤代c1‑4烷基、羟基c1‑4烷基、氨基c1‑4烷基和卤代c1‑4烷氧基;
[0044]
每一m、n分别独立地为0
‑
6的整数;
[0045]
且r1、r2、r3、r4、l、q1、q2、q3、q4中至少有一个为氘或被氘取代。
[0046]
在某些实施方案,前述通式(i)所示的化合物、其药学上可接受的盐、其酯或其立体异构体,其中,
[0047]
x、y、z分别独立地选自
‑
cr4‑
和
‑
n
‑
;
[0048]
环a选自3
‑
10元环烷基和3
‑
10元杂环基;
[0049]
r1选自
‑
(l)
m
‑
c(o)or
a
、
‑
(l)
m
‑
conr
a
r
b
、
‑
(l)
m
‑
conhso2r
a
、
‑
(l)
m
‑
so2r
a
、
‑
(l)
m
‑
so2nhcor
a
、
‑
(l)
m
‑
or
a
、
‑
(l)
m
‑
nr
a
r
b
、
‑
(l)
m
‑
c(o)r
a
、
‑
(l)
m
‑
oc(o)r
a
、
‑
(l)
m
‑
nr
a
c(o)r
b
、
‑
(l)
m
‑
nr
a
c(o)or
b
、
‑
(l)
m
‑
os(o)2r
a
、
‑
(l)
m
‑
s(o)2nr
a
r
b
、
‑
(l)
m
‑
nr
a
s(o)2r
b
,及任选被1
‑
4个q1取代的
‑
(l)
m
‑
c1‑4烷基和
‑
(l)
m
‑
c1‑4烷氧基;
[0050]
每一l分别独立地选自任选被氘代的c1‑3亚烷基和卤代c1‑3亚烷基;
[0051]
r2选自任选被1
‑
4个q2取代的3
‑
6元杂环基、3
‑
6元环烷基、5
‑
8元杂芳基、6
‑
8元芳基、5
‑
8元螺环基、5
‑
8元螺杂环基和n(c1‑4烷基)(c3‑6环烷基);
[0052]
每一r3分别独立地选自氘,氢,卤素,硝基,氰基,氨基,羟基,羧基,任选被1
‑
4个q3取代的c1‑4烷基、c1‑4烷氧基、c1‑4烷基氨基、二(c1‑4烷基)氨基、卤代c1‑4烷基、羟基c1‑4烷基、氨基c1‑4烷基和卤代c1‑4烷氧基;
[0053]
每一r4分别独立地选自氘、氢,或任选被一个或多个q4取代的如下基团:c1‑4烷基、
‑
c(o)r
a
、
‑
c(o)or
a
、
‑
c(o)nr
a
r
b
、
‑
s(o)2r
a
和
‑
s(o)2nr
a
r
b
;
[0054]
每一r
a
、每一r
b
分别独立地选自氢、c1‑4烷基、c1‑4烷氧基、c1‑4烷基氨基、二(c1‑4烷基)氨基、卤代c1‑4烷基、羟基c1‑4烷基、氨基c1‑4烷基和卤代c1‑4烷氧基;
[0055]
每一q1、每一q2、每一q3、每一q4分别独立地选自氘、羟基、氨基、卤素、硝基、氰基、羧基、c1‑4烷基、c1‑4烷氧基、c1‑4烷基氨基、二(c1‑4烷基)氨基、卤代c1‑4烷基、羟基c1‑4烷基、氨基c1‑4烷基和卤代c1‑4烷氧基;
[0056]
每一m、n分别独立地为0
‑
6的整数;
[0057]
且r1、r2、r3、r4、l、q1、q2、q3、q4中至少有一个为氘或被氘取代。
[0058]
在某些实施方案,前述通式(i)所示的化合物、其药学上可接受的盐、其酯或其立体异构体,其中,
[0059]
x、y、z分别独立地选自
‑
cr4‑
和
‑
n
‑
;
[0060]
环a选自4
‑
8元环烷基和4
‑
8元杂环基,优选4
‑
8元环烷基;
[0061]
r1选自
‑
(l)
m
‑
c(o)or
a
、
‑
(l)
m
‑
conr
a
r
b
、
‑
(l)
m
‑
so2r
a
、
‑
(l)
m
‑
or
a
、
‑
(l)
m
‑
nr
a
r
b
、
‑
(l)
m
‑
c(o)r
a
、
‑
(l)
m
‑
oc(o)r
a
、
‑
(l)
m
‑
nr
a
c(o)r
b
、
‑
(l)
m
‑
s(o)2nr
a
r
b
、
‑
(l)
m
‑
nr
a
s(o)2r
b
,任选被1
‑
3个q1取代的
‑
(l)
m
‑
c1‑4烷基和
‑
(l)
m
‑
c1‑4烷氧基;
[0062]
l为任选被氘代的c1‑3亚烷基;
[0063]
r2选自任选被1
‑
4个q2取代的3
‑
6元杂环基、5
‑
8元螺杂环基、5
‑
6元杂芳基和n(c1‑4烷基)(c3‑6环烷基),优选3
‑
6元杂环基;
[0064]
每一r3分别独立地选自氘、氢、卤素、硝基、氰基、氨基、羟基和羧基;
[0065]
每一r4分别独立地选自氘、氢和c1‑4烷基;
[0066]
每一r
a
、每一r
b
分别独立地选自氢和c1‑4烷基;
[0067]
每一q1、每一q2分别独立地选自氘、羟基、氨基、卤素、硝基、氰基、羧基、c1‑4烷基、c1‑4烷氧基、c1‑4烷基氨基、二(c1‑4烷基)氨基、卤代c1‑4烷基、羟基c1‑4烷基、氨基c1‑4烷基和卤代c1‑4烷氧基;
[0068]
每一m、n分别独立地为0
‑
6的整数;
[0069]
且r1、r2、r3、r4、l、q1、q2中至少有一个为氘或被氘取代。
[0070]
在某些实施方案,前述通式(i)所示的化合物、其药学上可接受的盐、其酯或其立体异构体,其中,
[0071]
x、y、z分别独立地为
‑
n
‑
;
[0072]
环a为4
‑
7元环烷基,优选5
‑
6元环烷基;
[0073]
r1选自
‑
(l)
m
‑
c(o)or
a
、
‑
(l)
m
‑
conr
a
r
b
、
‑
(l)
m
‑
so2r
a
、
‑
(l)
m
‑
or
a
、
‑
(l)
m
‑
nr
a
r
b
、
‑
(l)
m
‑
c(o)r
a
,任选被1
‑
3个q1取代的
‑
(l)
m
‑
c1‑4烷基和
‑
(l)
m
‑
c1‑4烷氧基;
[0074]
l为任选被氘代的亚甲基;
[0075]
r2选自任选被1
‑
3个q2取代的氧杂环丁基、氮杂环丁基、四氢呋喃基、四氢噻吩基、吡咯烷基、咪唑烷基、噁唑烷基、噻唑烷基、哌啶基、哌嗪基、吗啉基、呋喃基、吡喃基、吡咯基、噻吩基、噻唑基、异噻唑基、噻二唑基、咪唑基、吡唑基、恶唑基、异恶唑基、噁二唑基、三唑基、四唑基、吡啶基、嘧啶基、吡嗪基、哒嗪基、三嗪基、四嗪基、唑基、四唑基、吡啶基、嘧啶基、吡嗪基、哒嗪基、三嗪基、四嗪基、
[0076]
每一r3分别独立地选自氘、氢、卤素、硝基、氰基、氨基、羟基和羧基;
[0077]
每一r
a
、每一r
b
分别独立地选自氢、甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基和叔丁基;
[0078]
每一q1、每一q2分别独立地选自氘、羟基、氨基、氟、氯、溴、碘、硝基、氰基、羧基、甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、甲氧基、乙氧基、丙氧基、甲基氨基、二甲氨基、三氟甲基和三氟甲氧基;
[0079]
每一m、n分别独立地为0、1、2、3或4;
[0080]
且r1、r2、r3、l、q1、q2中至少有一个为氘或被氘取代。
[0081]
在某些实施方案,前述通式(i)所示的化合物、其药学上可接受的盐、其酯或其立体异构体,其中,
[0082]
x、y、z分别独立地为
‑
n
‑
;
[0083]
环a为5
‑
6元环烷基;
[0084]
r1选自
‑
(l)
m
‑
c(o)or
a
;
[0085]
l为任选被氘代的亚甲基;
[0086]
r2选自任选被1
‑
3个q2取代的氮杂环丁基;
[0087]
每一r3分别独立地选自氘、氢、卤素;
[0088]
r
a
为氢、甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基和叔丁基;
[0089]
每一q2分别独立地选自氘、氟、氯、溴、甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基和叔丁基;
[0090]
m、n分别独立地为0、1、2、3或4;
[0091]
且r1、r2、r3、l、q2中至少有一个为氘或被氘取代。
[0092]
在某些实施方案,前述通式(i)所示的化合物、其药学上可接受的盐、其酯或其立体异构体,其中,
[0093]
x、y、z分别独立地为
‑
n
‑
;
[0094]
环a为5元环烷基;
[0095]
r1选自
‑
(l)
m
‑
c(o)or
a
;
[0096]
l为亚甲基;
[0097]
r2选自任选被甲基和氟取代的氮杂环丁基;
[0098]
每一r3分别独立地选自氘、氢、氟,且r3中至少有一个为氘;
[0099]
r
a
为氢;
[0100]
m为1;n为1、2、3或4。
[0101]
在某些实施方案,前述通式(i)所示的化合物、其药学上可接受的盐、其酯或其立体异构体,
[0102]
其中,每一r3分别独立地选自氘、氢、卤素,且r3中至少有一个为氘。
[0103]
在某些实施方案,前述通式(i)所示的化合物、其药学上可接受的盐、其酯或其立体异构体,所述式(i)化合物具有式(ii’)所示的结构,
[0104][0105]
其中,r5、r6、r7、r8各自独立地选自氢或氘,且r5、r6、r7、r8中至少有一个为氘;
[0106]
在某些实施方案,所述式(ii’)化合物具有式(iii’)所示的结构,
[0107][0108]
其中,r5、r6、r7、r8各自独立地选自氢或氘,且r5、r6、r7、r8中至少有一个为氘。
[0109]
在某些实施方案,前述通式(ii’)或(iii’)所示的化合物、其药学上可接受的盐、其酯或其立体异构体,
[0110]
其中,r5、r6各自独立地选自氘;r7、r8各自独立地选自氢。
[0111]
在某些实施方案,前述通式(ii’)或(iii’)所示的化合物、其药学上可接受的盐、其酯或其立体异构体,
[0112]
其中,r5、r7各自独立地选自氘,r6、r8各自独立地选自氢。
[0113]
在某些实施方案,前述通式(ii’)或(iii’)所示的化合物、其药学上可接受的盐、其酯或其立体异构体,
[0114]
其中,r5、r6各自独立地选自氢;r7、r8各自独立地选自氘。
[0115]
在某些实施方案,前述通式(ii’)或(iii’)所示的化合物、其药学上可接受的盐、其酯或其立体异构体,
[0116]
其中,r5、r6、r7各自独立地选自氢;r8为氘。
[0117]
在某些实施方案,前述通式(ii’)或(iii’)所示的化合物、其药学上可接受的盐、其酯或其立体异构体,
[0118]
其中,r6、r7、r8各自独立地选自氢;r5为氘。
[0119]
本发明所述的任一实施方式中的任一取代基的选择可以相互组合,其组合后的技术方案仍包含在本发明的保护范围之内。
[0120]
本发明的一些实施方式中,前述通式(i)所述的化合物、其药学上可接受的盐、酯
或其立体异构体的结构见表1:
[0121]
表1
[0122][0123]
[0124]
[0125]
[0126]
[0127][0128]
本发明所述的“药学上可接受的盐”是指可药用的酸和碱的加成盐。
[0129]
本发明所述的“酯”是指药学上可接受的酯,尤其指如下酯,其在活体内水解且包括容易在人体内分解留下母体化合物(通式(i)所述的化合物)或其盐的酯。本发明的一些实施方式中,其中药学上可接受的酯,包括:衍生自药学上可接受的脂族羧酸及磷酸。
[0130]
本发明通式(i)所示的化合物的“立体异构体”是指当式(i)所示的化合物存在不对称碳原子时,会产生对映异构体;当化合物存在碳碳双键或环状结构时,会产生顺反异构体;当化合物存在酮或肟时,会产生互变异构体,本发明的一些实施方式中,立体异构体包括但不限于:对映异构体、非对映异构体、消旋异构体、顺反异构体、互变异构体、几何异构体、差向异构体及其混合物。
[0131]
本发明的实施例还提供了上述化合物的制备方法,但不仅限于以下方法,制备步骤及反应方程式如下:
[0132]
步骤1中间体1的制备 自己制备中间体1。
[0133]
步骤2中间体2的制备 参考文献(us15/381,295)的制备方法进行制备。
[0134]
步骤3中间体3的制备 中间体1溶于适当溶剂(例如nmp),加入中间体2和碱性物质(例如碳酸钾),70
‑
100℃反应10
‑
40小时,加入水,适当有机溶剂(例如乙酸乙酯)萃取,有机相浓缩,经适当方法(例如硅胶柱层析)得中间体3。
[0135]
步骤4中间体4的制备中间体3溶于适当溶剂(例如二氯甲烷),加入间氯过氧苯甲酸,10
‑
30℃反应0.5
‑
5小时,适当试剂(例如饱和碳酸钠)洗涤,有机溶剂(例如二氯甲烷)萃取,干燥,浓缩,经适当方法(例如硅胶柱层析)得中间体4。
[0136]
步骤5本发明通式(i)化合物的制备
[0137]
中间体4溶于适当溶剂(例如乙腈、nmp),加入中间体5(h
‑
r2或r2的盐),碱性物质(例如碳酸铯),40
‑
100℃反应10
‑
20小时,加入水,适当有机溶剂(例如乙酸乙酯)萃取,干燥,浓缩,纯化,将产物溶于适当溶剂(例如thf/甲醇/h2o),加入碱性试剂(例如naoh、koh等),10
‑
50℃反应0.2
‑
5小时,调节ph为4.5
‑
6.5,有机溶剂(例如二氯甲烷)萃取,干燥,浓
缩,经适当方法(例如硅胶柱层析)得本发明通式(i)化合物。
[0138][0139]
上述制备工艺还可以简单地概括为以下步骤:将式(ii)所示的化合物与式(iii)所示的化合物反应,得到式(iv)所示的化合物;式(iv)所示的化合物中的硫基通过官能团转化反应,得到式(v)所示的化合物;式(v)所示的化合物通过反应得到通式(i)所示的化合物。
[0140]
所述的“官能团转化反应”可以采用已知的化学合成方法来实现,包括但不限于取代反应、加成反应、消除反应、脱水反应、水解反应、氧化反应及酯化反应等,这些反应对于化学领域的技术人员是熟知的,本发明在此不再进行限定;具体实施过程中,可以通过一步反应实现,也可以通过多步反应实现。
[0141]
以上反应方程式中的取代基g为卤素;r1、r2、r3、x、y、z、n及环a如前文所定义。
[0142]
本发明还提供了用于合成通式(i)所示化合物的中间体,其具有以下结构式:
[0143][0144]
其中,取代基g为卤素;r1、r3、x、y、z、n及环a如前文所定义。
[0145]
本发明还提供了一种药物组合物,其含有前述通式(i)所示的化合物、其药学上可接受的盐、酯或其立体异构体,及一种或多种第二治疗活性剂,任选地,所述药物组合物还包含一种或多种药用载体和/或稀释剂。
[0146]
本发明还提供了一种药物制剂,其含有前述通式(i)所示的化合物、其药学上可接受的盐、酯或其立体异构体,及一种或多种药用载体和/或稀释剂;所述药物制剂为临床上或药学上可接受的任一剂型。
[0147]
本发明的药物组合物或药物制剂中可用的药用载体和/或稀释剂可以是药物制剂领域中任何常规的载体和/或稀释剂,特定载体和/或稀释剂的选择将取决于用于治疗特定患者的给药方式或疾病类型和状态。
[0148]
本发明还提供了前述通式(i)所示的化合物、其药学上可接受的盐、酯或其立体异构体、前述的药物制剂或前述的药物组合物在制备用于治疗和/或预防khk介导的疾病及相
关疾病的药物中的用途;所述khk介导的疾病及相关疾病选自内分泌失调病、泌尿类疾病、代谢类疾病、非酒精性脂肪肝炎、肝硬化、脂肪肝、肝炎、肝脏衰竭、遗传性果糖不耐受症、非酒精性脂肪肝病、肝胆类疾病、纤维化疾病、心脑血管类疾病、免疫炎症类疾病、中枢神经类疾病、胃肠道类疾病、过度增殖性疾病诸如癌症等。
[0149]
在本技术的说明书和权利要求书中,化合物都是依据化学结构式而命名,如果表示同一化合物时化合物的命名和化学结构式不符,以化学结构式为准。
[0150]
在本技术中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员通常理解的含义,然而为了更好地理解本发明,下面提供了部分术语的定义。当本技术所提供的术语的定义和解释与本领域技术人员所通常理解的含义不符的时候,以本技术所提供的术语的定义和解释为准。
[0151]
本发明所述的“卤素”是指氟、氯、溴和碘,优选氟和氯。
[0152]
本发明所述的“卤代”是指取代基中的任一氢可被一个或多个相同或不同的卤素取代。“卤素”如前文所定义。
[0153]
本发明所述的“c1‑6烷基”表示直链或支链的含有1
‑
6个碳原子的烷基,包括例如“c1‑5烷基”、“c1‑4烷基”、“c1‑3烷基”、“c1‑2烷基”、“c2‑6烷基”、“c2‑5烷基”、“c2‑4烷基”、“c2‑3烷基”、“c3‑6烷基”、“c3‑5烷基”、“c3‑4烷基”、“c4‑6烷基”、“c4‑5烷基”、“c5‑6烷基”等,具体实例包括但不限于:甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、2
‑
甲基丁基、新戊基、1
‑
乙基丙基、正己基、异己基、3
‑
甲基戊基、2
‑
甲基戊基、1
‑
甲基戊基、3,3
‑
二甲基丁基、2,2
‑
二甲基丁基、1,1
‑
二甲基丁基、1,2
‑
二甲基丁基、1,3
‑
二甲基丁基、2,3
‑
二甲基丁基、2
‑
乙基丁基、1,2
‑
二甲基丙基等。本发明所述的“c1‑4烷基”指c1‑6烷基中的含有1
‑
4个碳原子的具体实例。
[0154]
本发明所述的“c1‑6亚烷基”指上述所述c1‑6烷基去除一个氢原子形成的基团,包括例如“c1‑5亚烷基”、“c1‑4亚烷基”、“c1‑3亚烷基”、“c1‑2亚烷基”、“c2‑6亚烷基”、“c2‑5亚烷基”、“c2‑4亚烷基”、“c2‑3亚烷基”、“c3‑6亚烷基”、“c3‑5亚烷基”、“c3‑4亚烷基”、“c4‑6亚烷基”、“c4‑5亚烷基”、“c5‑6亚烷基”等,具体实例包括但不限于:亚甲基、亚乙基、亚丙基、亚丁基、亚戊基、亚己基等。本发明所述的“c1‑4亚烷基”指c1‑6亚烷基中的含有1
‑
4个碳原子的具体实例。
[0155]
本文所述的“c1‑6烷氧基、c1‑6烷基氨基、二(c1‑6烷基)氨基”是指以c1‑6烷基
‑
o
‑
、c1‑6烷基
‑
nh
‑
、(c1‑6烷基)2‑
n
‑
方式形成的基团,其中“c1‑6烷基”的定义如前文所述。
[0156]
本文所述的“c1‑4烷氧基、c1‑4烷基氨基、二(c1‑4烷基)氨基”是指以c1‑4烷基
‑
o
‑
、c1‑4烷基
‑
nh
‑
、(c1‑4烷基)2‑
n
‑
方式形成的基团,其中“c1‑4烷基”的定义如前文所述。
[0157]
本文所述的“卤代c1‑6烷基、卤代c1‑6亚烷基、羟基c1‑6烷基、氨基c1‑6烷基、卤代c1‑6烷氧基”是指一至多个,例如1
‑
4个、1
‑
3个、1
‑
2个卤素原子、羟基、氨基分别取代c1‑6烷基、c1‑6亚烷基、c1‑6烷氧基中的氢原子所形成的基团。
[0158]
本文所述的“卤代c1‑4烷基、卤代c1‑4亚烷基、羟基c1‑4烷基、氨基c1‑4烷基、卤代c1‑4烷氧基”是指一至多个,例如1
‑
4个、1
‑
3个、1
‑
2个卤素原子、羟基、氨基分别取代c1‑4烷基、c1‑4亚烷基、c1‑4烷氧基中的氢原子所形成的基团。
[0159]
本发明所述的“3
‑
14元环烷基”是指含有3
‑
14个碳原子的饱和或部分饱和的且不具有芳香性的环状烷基,包括“单环烷基”和“稠环烷基”。
[0160]
本发明所述的“单环烷基”是指饱和或部分饱和的且不具有芳香性的单环环状烷
基,包括“3
‑
8元饱和环烷基”和“3
‑
8元部分饱和环烷基”;优选“3
‑
4元环烷基”、“3
‑
5元环烷基”、“3
‑
6元环烷基”、“3
‑
7元环烷基”、“4
‑
5元环烷基”、“4
‑
6元环烷基”、“4
‑
7元环烷基”、“4
‑
8元环烷基”、“5
‑
6元环烷基”、“5
‑
7元环烷基”、“5
‑
8元环烷基”、“6
‑
7元环烷基”、“6
‑
8元环烷基”、“7
‑
8元环烷基”、“3
‑
6元饱和环烷基”、“4
‑
7元饱和环烷基”、“4
‑
8元饱和环烷基”、“5
‑
8元饱和环烷基”、“5
‑
7元饱和环烷基”、“5
‑
6元饱和环烷基”、“3
‑
6元部分饱和环烷基”、“4
‑
7元部分饱和环烷基”、“4
‑
8元部分饱和环烷基”、“5
‑
8元部分饱和环烷基”、“5
‑
7元部分饱和环烷基”、“5
‑
6元部分饱和环烷基”等。所述的“3
‑
8元饱和环烷基”的具体实例包括但不限于:环丙烷基(环丙基)、环丁烷基(环丁基)、环戊烷基(环戊基)、环己烷基(环己基)、环庚烷基(环庚基)、环辛烷基(环辛基)等;所述的“3
‑
8元部分饱和环烷基”的具体实例包括但不限于环丙烯基、环丁烯基、环戊烯基、环戊二烯基、环己烯基、环己
‑
1,3
‑
二烯、环己
‑
1,4
‑
二烯、环庚烯基、环庚
‑
1,3
‑
二烯基、环庚
‑
1,4
‑
二烯基、环庚
‑
1,3,5
‑
三烯基,环辛烯基、环辛
‑
1,3
‑
二烯基、环辛
‑
1,4
‑
二烯基、环辛
‑
1,5
‑
二烯基、环辛
‑
1,3,5
‑
三烯基、环辛四烯基等。
[0161]
本发明所述的“稠环烷基”是指由两个或两个以上环状结构彼此共用两个相邻的碳原子所形成的饱和或部分饱和的、非芳香性环状基团,所述的稠环中的一个环可以为芳香性环,但稠环整体不具备芳香性;其稠和方式可以为:5
‑
6元环烷基并5
‑
6元环烷基、苯并5
‑
6元环烷基、苯并5
‑
6元饱和环烷基等。其实例包括但不限于:二环[3.1.0]己烷基、二环[4.1.0]庚烷基、二环[2.2.0]己烷基、二环[3.2.0]庚烷基、二环[4.2.0]辛烷基、八氢并环戊二烯基、八氢
‑
1h
‑
茚基、十氢化萘基、十四氢菲基、双环[3.1.0]己
‑2‑
烯基、双环[4.1.0]庚
‑3‑
烯基、双环[3.2.0]庚
‑3‑
烯基、双环[4.2.0]辛
‑3‑
烯基、1,2,3,3a
‑
四氢并环戊二烯基、2,3,3a,4,7,7a
‑
六氢
‑
1h
‑
茚基、1,2,3,4,4a,5,6,8a
‑
八氢化萘基、1,2,4a,5,6,8a
‑
六氢化萘基、1,2,3,4,5,6,7,8,9,10
‑
十氢菲基、苯并环戊基、苯并环己基、苯并环己烯基、苯并环戊烯基等。
[0162]
本发明所述的“3
‑
14元杂环基”是指至少含有一个杂原子(例如,含有1个、2个、3个、4个或5个)的且环原子数为3
‑
14个的饱和或部分饱和的且不具有芳香性的环状基团,所述杂原子为氮原子、氧原子和/或硫原子,任选地,环状结构中的环原子(例如碳原子、氮原子或硫原子)可以被氧代。所述的“杂环基”包括“单环杂环基”和“稠环杂环基”。
[0163]
本发明所述的“单环杂环基”是指至少含有一个杂原子(例如,含有1个、2个、3个、4个或5个)的饱和或部分饱和的且不具有芳香性的单环环状基团,所述杂原子为氮原子、氧原子和/或硫原子,任选地,环状结构中的环原子(例如碳原子、氮原子或硫原子)可以被氧代。本发明所述的“3
‑
8元杂环基”包括“3
‑
8元饱和杂环基”和“3
‑
8元部分饱和杂环基”。优选地,本发明所述的“3
‑
8元杂环基”含有1
‑
3个杂原子;优选地,本发明所述的“3
‑
8元杂环基”含有1
‑
2个杂原子,且所述的杂原子选自氮原子和/或氧原子;优选地,本发明所述的“3
‑
8元杂环基”含有1个氮原子。所述“3
‑
8元杂环基”优选“3
‑
7元杂环基”、“3
‑
6元杂环基”、“4
‑
7元杂环基”、“4
‑
6元杂环基”、“6
‑
8元杂环基”、“5
‑
7元杂环基”、“5
‑
6元杂环基”、“3
‑
6元饱和杂环基”、“4
‑
6元饱和杂环基”、“5
‑
6元饱和杂环基”、“3
‑
6元含氮杂环基”、“3
‑
6元饱和含氮杂环基”、“4
‑
6元含氮杂环基”、“4
‑
6元饱和含氮杂环基”、“5
‑
6元含氮杂环基”、“5
‑
6元饱和含氮杂环基”等。“3
‑
8元杂环基”的具体实例包括但不仅限于:氮杂环丙烷基、2h
‑
氮杂环丙烷基、二氮杂环丙烷基、3h
‑
二氮杂环丙烯基、氮杂环丁烷基、1,4
‑
二氧杂环己烷基、1,3
‑
二氧杂环己烷基、1,3
‑
二氧杂环戊烷基、1,4
‑
二氧杂环己二烯基、四氢呋喃基、二氢吡咯基、吡咯
烷基、咪唑烷基、4,5
‑
二氢咪唑基、吡唑烷基、4,5
‑
二氢吡唑基、2,5
‑
二氢噻吩基、四氢噻吩基、4,5
‑
二氢噻唑基、噻唑烷基、哌啶基、四氢吡啶基、哌啶酮基、四氢吡啶酮基、二氢哌啶酮基、哌嗪基、吗啉基、4,5
‑
二氢噁唑基、4,5
‑
二氢异噁唑基、2,3
‑
二氢异噁唑基、噁唑烷基、2h
‑
1,2
‑
噁嗪基、4h
‑
1,2
‑
噁嗪基、6h
‑
1,2
‑
噁嗪基、4h
‑
1,3
‑
噁嗪基、6h
‑
1,3
‑
噁嗪基、4h
‑
1,4
‑
噁嗪基、4h
‑
1,3
‑
噻嗪基、6h
‑
1,3
‑
噻嗪基、2h
‑
吡喃基、2h
‑
吡喃
‑2‑
酮基、3,4
‑
二氢
‑
2h
‑
吡喃基等。
[0164]
本发明所述“稠环杂环基”是指由两个或两个以上环状结构彼此共用两个相邻的原子所形成的至少一个环原子为杂原子的、饱和或部分饱和的、非芳香性环状基团,所述的稠环中其中一个环可以为芳香性环,但稠环整体不具备芳香性,所述杂原子为氮原子、氧原子和/或硫原子,任选地,环状结构中的环原子(例如碳原子、氮原子或硫原子)可以被氧代,其稠和方式可以为5
‑
6元杂环基并5
‑
6元杂环基、5
‑
6元杂环基并5
‑
6元环烷基、苯并5
‑
6元杂环基、苯并5
‑
6元饱和杂环基、5
‑
6元杂芳基并5
‑
6元杂环基、5
‑
6元杂芳基并5
‑
6元饱和杂环基;具体实例包括但不仅限于:吡咯烷基并环丙基、环戊基并氮杂环丙基、吡咯烷基并环丁基、吡咯烷基并吡咯烷基、吡咯烷基并哌啶基、吡咯烷基并哌嗪基、吡咯烷基并吗啉基、哌啶基并吗啉基、苯并吡咯烷基、苯并环戊基、苯并环己基、苯并四氢呋喃基、苯并吡咯烷基、苯并咪唑烷基、苯并噁唑烷基、苯并噻唑烷基、苯并异噁唑烷基、苯并异噻唑烷基、苯并哌啶基、苯并吗啉基、苯并哌嗪基、苯并四氢吡喃基、吡啶并环戊基、吡啶并环己基、吡啶并四氢呋喃基、吡啶并吡咯烷基、吡啶并咪唑烷基、吡啶并噁唑烷基、吡啶并噻唑烷基、吡啶并异噁唑烷基、吡啶并异噻唑烷基、吡啶并哌啶基、吡啶并吗啉基、吡啶并哌嗪基、吡啶并四氢吡喃基、嘧啶并环戊基、嘧啶并环己基、嘧啶并四氢呋喃基、嘧啶并吡咯烷基、嘧啶并咪唑烷基、嘧啶并噁唑烷基、嘧啶并噻唑烷基、嘧啶并异噁唑烷基、嘧啶并异噻唑烷基、嘧啶并哌啶基、嘧啶并吗啉基、嘧啶并哌嗪基、嘧啶并四氢吡喃基;四氢咪唑并[4,5
‑
c]吡啶基、3,4
‑
二氢喹唑啉基、1,2
‑
二氢喹喔啉基、苯并[d][1,3]二氧杂环戊烯基、2h
‑
色原烯基、2h
‑
色原烯
‑2‑
酮基、4h
‑
色烯基、4h
‑
色烯
‑4‑
酮基、4h
‑
1,3
‑
苯并噁嗪基、4,6
‑
二氢
‑
1h
‑
呋喃并[3,4
‑
d]咪唑基、3a,4,6,6a
‑
四氢
‑
1h
‑
呋喃并[3,4
‑
d]咪唑基、4,6
‑
二氢
‑
1h
‑
噻吩并[3,4
‑
d]咪唑基、4,6
‑
二氢
‑
1h
‑
吡咯并[3,4
‑
d]咪唑基、八氢
‑
苯并[d]咪唑基、十氢喹啉基、六氢噻吩并咪唑基、六氢呋喃并咪唑基、4,5,6,7
‑
四氢
‑
1h
‑
苯并[d]咪唑基、八氢环戊烯并[c]吡咯基、4h
‑
1,3
‑
苯并噁嗪基。
[0165]
本发明所述的“6
‑
12元芳基”是指含有6
‑
12个环碳原子的具有芳香性的环状基团,包括“6
‑
8元单环芳基”和“8
‑
12元稠环芳基”,优选6
‑
10元芳基。
[0166]
本发明所述的“6
‑
8元单环芳基”是指含有6
‑
8个环碳原子的单环芳基,其实例包括但不限于:苯基、环辛四烯基等;优选苯基。
[0167]
本发明所述的“8
‑
12元稠环芳基”是指由两个或两个以上环状结构彼此共用两个相邻的原子所形成的、含有8
‑
12个环碳原子的、不饱和的、具有芳香性的环状基团,优选“9
‑
10元稠环芳基”,具体实例如萘基等。
[0168]
本发明所述的“5
‑
12元杂芳基”是指含有5
‑
12个环原子(其中至少一个环原子为杂原子,例如氮原子、氧原子或硫原子)的具有芳香性的环状基团。包括“5
‑
8元单杂芳基”和“8
‑
12元稠杂芳基”,优选5
‑
10元杂芳基。
[0169]
本发明所述的“5
‑
8元单杂芳基”是指含有5
‑
8个环原子(其中至少一个环原子为杂
原子,例如氮原子、氧原子或硫原子)的具有芳香性的单环环状基团。任选地,环状结构中的环原子(例如碳原子、氮原子或硫原子)可以被氧代。“5
‑
8元单杂芳基”包括例如“5
‑
7元单杂芳基”、“5
‑
6元单杂芳基”、“5
‑
6元含氮单杂芳基”、“5元含氮单杂芳基”等。“5
‑
8元单环杂芳基”的具体实例包括但不仅限于呋喃基、噻吩基、吡咯基、噻唑基、异噻唑基、噻二唑基、噁唑基、异噁唑基、噁二唑基、咪唑基、吡唑基、1,2,3
‑
三唑基、1,2,4
‑
三唑基、1,2,3
‑
噁二唑基、1,2,4
‑
噁二唑基、1,2,5
‑
噁二唑基、1,3,4
‑
噁二唑基、吡啶基、2
‑
吡啶酮基、4
‑
吡啶酮基、嘧啶基、哒嗪基、吡嗪基、1,2,3
‑
三嗪基、1,3,5
‑
三嗪基、1,2,4,5
‑
四嗪基、氮杂环庚三烯基、1,3
‑
二氮杂环庚三烯基、氮杂环辛四烯基等。所述“5
‑
6元杂芳基”是指5
‑
8元杂芳基中含有5
‑
6个环原子的具体实例。
[0170]
本发明所述的“8
‑
12元稠杂芳基”是指由两个或两个以上环状结构彼此共用两个相邻的原子所形成的、含有8
‑
12个环原子(其中至少一个环原子为杂原子,例如氮原子、氧原子或硫原子)的、不饱和的具有芳香性的环状结构。任选地,环状结构中的环原子(例如碳原子、氮原子或硫原子)可以被氧代。包括“9
‑
10元稠杂芳基”,“8
‑
9元稠杂芳基”等,其稠和方式可以为苯并5
‑
6元杂芳基、5
‑
6元杂芳基并5
‑
6元杂芳基等;具体实例包括但不限于:吡咯并吡咯、吡咯并呋喃、吡唑并吡咯、吡唑并噻吩、呋喃并噻吩、吡唑并噁唑、苯并呋喃基、苯并异呋喃基、苯并噻吩基、吲哚基、异吲哚基、苯并噁唑基、苯并咪唑基、吲唑基、苯并三唑基、喹啉基、2
‑
喹啉酮基、4
‑
喹啉酮基、1
‑
异喹啉酮基、异喹啉基、吖啶基、菲啶基、苯并哒嗪基、酞嗪基、喹唑啉基、喹喔啉基、嘌呤基、萘啶基。
[0171]
本发明所述的“5
‑
12元桥环基”是指任意两个环共用两不直接相连的原子形成的含有5
‑
12个碳原子的结构,“5
‑
12元桥环”包括5
‑
12元饱和桥环基、5
‑
12元部分饱和桥环基。优选5
‑
10元桥环基、5
‑
8元桥环基、5
‑
10元饱和桥环基、5
‑
8元饱和桥环基、6
‑
10元饱和桥环基、7
‑
12元部分饱和桥环基,5
‑
12元桥环基包括但不仅限于双环[2.1.1]己烷基、双环[2.2.1]庚烷基、双环[2.2.2]辛烷基、双环[3.2.1]辛烷基、双环[3.3.1]壬烷基、双环[2.2.1]庚
‑5‑
烯基、双环[3.2.1]辛
‑6‑
烯基、双环戊二烯基。
[0172]
本发明所述的“5
‑
12元桥杂环基”是指上述5
‑
12元桥环基中的至少一个环碳原子被选自o、s、n的杂原子替代,优选1
‑
3个杂原子,同时包括碳原子、氮原子和硫原子可以被氧代的情况,优选5
‑
10元桥杂环基,5
‑
8元桥杂环基。
[0173]
本发明所述“5
‑
12元螺环基”是指一类至少有两个环共享一个原子形成的含有5
‑
12个碳原子的结构。包含5
‑
12元饱和螺环基和5
‑
12元部分饱和螺环基,5
‑
12元饱和螺环基的具体实例包括但不仅限于:的具体实例包括但不仅限于:等环状结构取代任意可取代的氢原子所形成的基团。5
‑
12元部分饱和螺环基,是指该螺环基中至少有一个环为不饱和的环状基团,具体实例包括但不仅限于:
等环状结构取代任意可取代的氢原子所形成的基团。优选5
‑
10元螺环基,包括“5
‑
10元饱和螺环基”及5
‑
10元不饱和螺环基”,优选5
‑
8元螺环基,包括“5
‑
8元饱和螺环基”及5
‑
8元不饱和螺环基”。
[0174]
本发明所述的“5
‑
12元螺杂环基”是指5
‑
12元螺环基中至少一个环碳原子被选自o、s、n的杂原子替代,优选1
‑
3个杂原子,同时包括碳原子、氮原子和硫原子可以被氧代的情况。优选5
‑
10元螺杂环基,5
‑
8元螺杂环基,5
‑
6元螺杂环基。
[0175]
本发明所述的“任选被
…
取代”包括“被取代”和“未被取代”两种情形。
[0176]
本发明所述的“氘代”是指被氘代的基团上的一个或多个氢原子被一个或多个氘原子取代,可以是部分氘代,也可以是全部氘代。例如,氘代化合物可以仅含有一个氘。在一些实施方案中,氘代化合物仅含有两个氘。在一些实施方案中,氘代化合物仅含有三个氘。在一些实施方案中,氘代化合物含有四个氘。
[0177]
本发明所述的“任选被氘代”包括基团被氘代和未被氘代两种情况,其中所述“氘代”如前文所定义。
[0178]
发明的有益效果
[0179]
(1)本发明化合物、其药学上可接受的盐、酯或其立体异构体具有优异的khk抑制活性,能够治疗和/或预防khk介导的疾病及相关疾病;
[0180]
(2)本发明化合物、其药学上可接受的盐、酯或其立体异构体具有良好的药代动力学性质,作用更持久,生物利用度高;
[0181]
(3)本发明化合物、其药学上可接受的盐、酯或其立体异构体具有良好的安全性;
[0182]
(4)本发明化合物制备工艺简单,药品纯度高,质量稳定,易于进行大规模工业生产。
[0183]
以下通过实验进一步阐述本发明实施例提供的化合物的有益效果,但不应将此理解为本发明实施例提供的化合物仅具有下列有益效果。
[0184]
实验例1本发明实施例提供的化合物的体外khk激酶抑制活性实验
[0185]
供试品:本发明实施例提供的化合物,其化学名称和制备方法请见各化合物的制备实施例。
[0186]
对照药:pf
‑
06835919,参考文献(us15/381,295)中的方法制备。
[0187]
实验试剂:
[0188]
[0189]
实验耗材:
[0190][0191]
实验仪器:
[0192][0193]
实验方法:
[0194]
1、化合物稀释
[0195]
1)使用dmso配制本发明化合物及对照药至10mm,作为试验储备液。
[0196]
2)将本发明化合物及对照药储备液10倍稀释至1mm,然后,3倍梯度稀释本发明化合物至11个浓度,最高浓度为1mm。
[0197]
3)使用echo550分别转移0.1μl稀释后的本发明化合物及对照药至384孔板,每个浓度设定2个复孔,1000rpm离心1min。
[0198]
2、酶反应实验
[0199]
1)加入5μl khk
‑
c激酶工作液至384孔板,1000rpm离心1min,然后,室温25℃孵育15min。
[0200]
2)加入5μl底物工作液至384孔板,启动激酶反应,1000rpm离心1min,室温25℃孵育60min。
[0201]
3)khk
‑
c激酶反应终浓度为1nm khk
‑
c,100μm atp,200μm d
‑
fructose,hepes 50mm,mgcl
2 10mm,brij35 0.01%,dmso终浓度为1%。
[0202]
4)测试化合物及对照药终浓度为10000nm、3333.33nm、1111.11nm、370.37nm、123.457nm、41.15nm、13.71nm、4.572nm、1.524nm、0.508nm、0.169nm。
[0203]
3、反应终止及检测
[0204]
1)加入10μl adp glo试剂,1000rpm离心1min,室温25℃孵育40min。
[0205]
2)加入20μl激酶检测试剂,1000rpm离心1min,室温25℃孵育40min.
[0206]
3)反应结束后,在envision上读取荧光值lum。
[0207]
4、数据分析
[0208]
使用如下公式计算抑制率inhibition(%inh):
[0209][0210]
其中,lum
hc
表示:high control(反应体系含有与待测化合物相同体积的dmso)的发光信号强度;lum
lc
表示:low control(对照药1μm)的发光信号强度;lum
cpd
表示:表示供试
品化合物的发光信号强度。
[0211]
实验结果:
[0212]
表2本发明实施例化合物对khk
‑
c抑制活性
[0213][0214]
从上述实验结果可以看出,本发明提供的化合物,能够有效抑制khk
‑
c激酶活性,是有效的khk
‑
c激酶抑制剂。
具体实施方式
[0215]
下面将结合具体实施例对本发明的技术方案进行描述,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0216]
下述实验中所用缩写代表的含义如下:
[0217]
dast:二乙胺基三氟化硫;thf:四氢呋喃;nmp:n
‑
甲基吡咯烷酮;m
‑
cpba:间氯过氧苯甲酸;
[0218]
实施例1 2
‑
((1r,5s,6r)
‑3‑
(7,7
‑
二氟
‑2‑
((s)
‑2‑
甲基氮杂环丁烷
‑1‑
基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑4‑
基
‑
6,6
‑
二氘)
‑3‑
氮杂双环[3.1.0]己基
‑6‑
基)乙酸的制备(化合物1)
[0219]
(1)1
‑
乙基2,4
‑
二甲基1
‑
氧代丁烷
‑
1,2,4
‑
三羧酸酯的制备
[0220][0221]
将乙醇钠(6.1g,90.0mmol)溶于thf(150ml),加入草酸二乙酯(13.1g,90.0mmol),至溶液澄清,再加入戊二酸二甲酯(14.4g,90.0mmol),加入完毕,15℃反应18.5h。浓缩溶剂,加水稀释,甲基叔丁基醚萃取,水相用浓盐酸调节ph=1,乙酸乙酯萃取,有机相干燥浓缩得目标化合物8.9g,甲基叔丁基醚相用盐酸洗涤,有机相干燥浓缩得10g目标化合物,一共得目标化合物18.9g,收率80.8%。
[0222]
(2)2
‑
氧代己二酸
‑
3,3
‑
二氘的制备
[0223][0224]
将1
‑
乙基
‑
2,4
‑
二甲基1
‑
氧代丁烷
‑
1,2,4
‑
三羧酸酯(7.8g,30.0mmol)溶于dcl(4m in d2o)(30ml),65℃反应19h,浓缩得固体,固体用二氯甲烷洗涤,干燥得目标化合物3.2g,收率:65.8%。
[0225]
(3)2
‑
氧代己二酸二甲酯
‑
3,3
‑
二氘的制备
[0226][0227]
将2
‑
氧代己二酸
‑
3,3
‑
二氘(3.2g,19.8mmol)溶于甲醇(30ml),0℃下滴加浓硫酸(4ml),加入完毕,0℃反应21h。反应液倒入冰水中,乙酸乙酯萃取,有机相干燥浓缩,hnmr检测有副产物生成。将得到的混合物溶于二氯甲烷(30ml),加入三氟乙酸(10ml),15℃下搅拌2h。浓缩溶剂硅胶柱纯化(石油醚:乙酸乙酯=5:1)得目标化合物1.5g,收率:39.8%。
[0228]
(4)2,2
‑
二氟己二酸二甲酯
‑
3,3
‑
二氘的制备
[0229][0230]
将2
‑
氧代己二酸二甲酯
‑
3,3
‑
二氘(1.5g,7.9mmol)滴加到dast(3.8g,23.7mmol)的二氯甲烷(15ml)溶液中,加入完毕,20℃反应5h。加水淬灭,二氯甲烷萃取,有机相干燥,浓缩,硅胶柱纯化(石油醚:乙酸乙酯=10:1)得目标化合物500mg,收率:29.9%。
[0231]
(5)3,3
‑
二氟
‑2‑
氧代环戊烷
‑1‑
羧酸甲酯
‑
4,4
‑
二氘的制备
[0232][0233]
将2,2
‑
二氟己二酸二甲酯
‑
3,3
‑
二氘(500mg,2.4mmol)溶于thf(40ml),加入甲醇钠(194.4mg,3.6mmol),加入完毕,20℃反应2h。浓缩溶剂,加水稀释,乙酸乙酯萃取,有机相干燥,浓缩得目标化合物150mg,收率:34.7%。
[0234]
(6)7,7
‑
二氟
‑2‑
(甲硫基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑
6,6
‑
二氘
‑4‑
羟基的制备
[0235][0236]
将3,3
‑
二氟
‑2‑
氧代环戊烷
‑1‑
羧酸甲酯
‑
4,4
‑
二氘(150mg,0.83mmol),s
‑
甲基异硫脲硫酸盐(235.2mg,1.2mmol)溶于水(15ml),加入碳酸钠(176.0mg,1.6mmol),加入完毕,20℃反应23h。稀盐酸调节ph=6,乙酸乙酯萃取,有机相干燥,浓缩直接用于下一步。
[0237]
(7)4
‑
氯
‑
7,7
‑
二氟
‑2‑
(甲硫基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑
6,6
‑
二氘的制备
[0238][0239]
将7,7
‑
二氟
‑2‑
(甲硫基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑
6,6
‑
二氘
‑4‑
羟基(上步粗品)溶于1,2
‑
二氯乙烷(10ml),加入三氯氧磷(5ml),加入完毕80℃反应2h。浓缩溶剂,乙酸乙酯稀释,饱和碳酸氢钠水溶液洗涤,有机相干燥,浓缩,硅胶柱纯化(石油醚:乙酸乙酯=
20:1)得目标化合物80mg,两步收率:40.5%。
[0240]
(8)甲基2
‑
((1r,5s,6s)
‑3‑
(7,7
‑
二氟
‑2‑
(甲硫基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑4‑
基
‑
6,6
‑
二氘)
‑3‑
氮杂双环[3.1.0]己基6
‑
基)乙酸酯的制备
[0241][0242]
将4
‑
氯
‑
7,7
‑
二氟
‑2‑
(甲硫基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑
6,6
‑
二氘(80mg,0.34mmol)溶于n
‑
甲基吡咯烷酮(5ml),加入2
‑
((1r,5s,6s)
‑3‑
氮杂双环[3.1.0]己
‑6‑
基)乙酸甲酯盐酸盐(70.8mg,0.37mmol),碳酸钾(138mg,1.0mmol),加入完毕90℃反应22h。加水稀释,乙酸乙酯萃取,有机相干燥浓缩直接用于下一步。
[0243]
(9)甲基2
‑
((1r,5s,6s)
‑3‑
(7,7
‑
二氟
‑2‑
(甲基磺酰基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑4‑
基
‑
6,6
‑
二氘)
‑3‑
氮杂双环[3.1.0]己基
‑6‑
基)乙酸酯的制备
[0244][0245]
将甲基2
‑
((1r,5s,6s)
‑3‑
(7,7
‑
二氟
‑2‑
(甲硫基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑4‑
基
‑
6,6
‑
二氘)
‑3‑
氮杂双环[3.1.0]己基
‑6‑
基)乙酸酯(上步粗品)溶于二氯甲烷(10ml),加入m
‑
cpba(175.7mg,1.02mmol),加入完毕15℃反应2h。饱和碳酸钠水溶液洗涤,二氯甲烷萃取,有机相干燥浓缩硅胶柱纯化(石油醚:乙酸乙酯=1:1)得目标化合物,直接用于下一步。
[0246]
(10)甲基2
‑
((1r,5s,6r)
‑3‑
(7,7
‑
二氟
‑2‑
((s)
‑2‑
甲基氮杂环丁烷
‑1‑
基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑4‑
基
‑
6,6
‑
二氘)
‑3‑
氮杂双环[3.1.0]己基
‑6‑
基)乙酸酯的制备
[0247][0248]
将甲基2
‑
((1r,5s,6s)
‑3‑
(7,7
‑
二氟
‑2‑
(甲基磺酰基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑4‑
基
‑
6,6
‑
二氘)
‑3‑
氮杂双环[3.1.0]己基
‑6‑
基)乙酸酯(上步粗品)溶于乙腈(20ml),加入(s)
‑2‑
甲基氮杂环丁烷盐酸盐(108.6mg,1.02mmol),碳酸铯(552.5mg,1.7mmol),加入完毕60℃反应16h。加水稀释,乙酸乙酯萃取,有机相干燥,浓缩,硅胶柱纯化(石油醚:乙酸乙酯=5:1)得目标化合物65mg,三步收率:50.3%。
[0249]
(11)2
‑
((1r,5s,6r)
‑3‑
(7,7
‑
二氟
‑2‑
((s)
‑2‑
甲基氮杂环丁烷
‑1‑
基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑4‑
基
‑
6,6
‑
二氘)
‑3‑
氮杂双环[3.1.0]己基
‑6‑
基)乙酸的制备
in h2o)(66ml),65℃反应19h,浓缩得固体,固体用二氯甲烷洗涤,干燥得目标化合物2.6g,两步收率:48.1%。
[0264]
(4)2
‑
氧代己二酸二甲酯
‑4‑
氘的制备
[0265][0266]
将2
‑
氧代己二酸
‑4‑
氘(2.6g,16.1mmol)溶于甲醇(20ml),0℃下滴加浓硫酸(5ml),加入完毕,0℃反应21h。反应液倒入冰水中,乙酸乙酯萃取,有机相干燥浓缩,hnmr检测有副产物生成。将得到的混合物溶于二氯甲烷(30ml),加入三氟乙酸(10ml),15℃下搅拌2h。浓缩溶剂硅胶柱纯化(石油醚:乙酸乙酯=5:1)得目标化合物1.2g,收率:39.4%。
[0267]
(5)2,2
‑
二氟己二酸二甲酯
‑4‑
氘的制备
[0268][0269]
将2
‑
氧代己二酸二甲酯
‑4‑
氘(1.1g,5.8mmol)滴加到dast(2.8g,17.4mmol)的二氯甲烷(15ml)溶液中,加入完毕20℃反应5h。加水淬灭,二氯甲烷萃取,有机相干燥,浓缩,硅胶柱纯化(石油醚:乙酸乙酯=10:1)得目标化合物550mg,收率:44.8%。
[0270]
(6)3,3
‑
二氟
‑2‑
氧代环戊烷
‑1‑
羧酸甲酯
‑5‑
氘的制备
[0271][0272]
将2,2
‑
二氟己二酸二甲酯
‑4‑
氘(550mg,2.6mmol)溶于thf(18ml),加入甲醇钠(211mg,3.9mmol),加入完毕20℃反应2h。浓缩溶剂,加水稀释,乙酸乙酯萃取,有机相干燥,浓缩得目标化合物344mg,收率:73.8%。
[0273]
(7)7,7
‑
二氟
‑2‑
(甲硫基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑5‑
氘
‑4‑
羟基的制备
[0274][0275]
将3,3
‑
二氟
‑2‑
氧代环戊烷
‑1‑
羧酸甲酯
‑5‑
氘(344mg,1.9mmol),s
‑
甲基异硫脲硫酸盐(542mg,1.9mmol)溶于水(15ml),加入碳酸钠(413mg,3.9mmol),加入完毕20℃反应23h。稀盐酸调节ph=6,乙酸乙酯萃取,有机相干燥,浓缩得目标化合物280mg,收率:66.6%。
[0276]
(8)4
‑
氯
‑
7,7
‑
二氟
‑2‑
(甲硫基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑5‑
氘的制备
[0277][0278]
将7,7
‑
二氟
‑2‑
(甲硫基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑5‑
氘
‑4‑
羟基(280mg,1.3mmol)溶于1,2
‑
二氯乙烷(12ml),加入三氯氧磷(4.4ml),加入完毕80℃反应2h。浓缩溶
剂,乙酸乙酯稀释,饱和碳酸氢钠水溶液洗涤,有机相干燥,浓缩,硅胶柱纯化(石油醚:乙酸乙酯=10:1)得目标化合物187mg,收率:61.7%。
[0279]
(9)甲基2
‑
((1r,5s,6s)
‑3‑
(7,7
‑
二氟
‑2‑
(甲硫基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑4‑
基
‑5‑
氘)
‑3‑
氮杂双环[3.1.0]己基
‑6‑
基)乙酸酯的制备
[0280][0281]
将4
‑
氯
‑
7,7
‑
二氟
‑2‑
(甲硫基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑5‑
氘(167mg,0.70mmol)溶于n
‑
甲基吡咯烷酮(5ml),加入2
‑
((1r,5s,6s)
‑3‑
氮杂双环[3.1.0]己
‑6‑
基)乙酸甲酯盐酸盐(120mg,0.62mmol),碳酸钾(291mg,2.1mmol),加入完毕90℃反应20h。加水稀释,乙酸乙酯萃取,有机相干燥,浓缩,硅胶柱纯化(石油醚:乙酸乙酯=10:1)得目标化合物171mg,收率:68.2%。
[0282]
(10)甲基2
‑
((1r,5s,6s)
‑3‑
(7,7
‑
二氟
‑2‑
(甲基磺酰基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑4‑
基
‑5‑
氘)
‑3‑
氮杂双环[3.1.0]己基
‑6‑
基)乙酸酯的制备
[0283][0284]
将甲基2
‑
((1r,5s,6s)
‑3‑
(7,7
‑
二氟
‑2‑
(甲硫基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑4‑
基
‑5‑
氘)
‑3‑
氮杂双环[3.1.0]己基
‑6‑
基)乙酸酯(171mg,0.48mmol)溶于二氯甲烷(7ml),加入m
‑
cpba(249mg,1.4mmol),加入完毕15℃反应2h。饱和碳酸钠水溶液洗涤,二氯甲烷萃取,有机相干燥浓缩硅胶柱纯化(石油醚:乙酸乙酯=1:1)得目标化合物132mg,收率:70.8%。
[0285]
(11)甲基2
‑
((1r,5s,6r)
‑3‑
(7,7
‑
二氟
‑2‑
((s)
‑2‑
甲基氮杂环丁烷
‑1‑
基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑4‑
基
‑5‑
氘)
‑3‑
氮杂双环[3.1.0]己基6
‑
基)乙酸酯的制备
[0286][0287]
将甲基2
‑
((1r,5s,6s)
‑3‑
(7,7
‑
二氟
‑2‑
(甲基磺酰基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑4‑
基
‑5‑
氘)
‑3‑
氮杂双环[3.1.0]己基
‑6‑
基)乙酸酯(132mg,0.34mmol)溶于乙腈(13ml),加入(s)
‑2‑
甲基氮杂环丁烷盐酸盐(108.6mg,1.0mmol),碳酸铯(554mg,1.7mmol),加入完毕60℃反应16h。加水稀释,乙酸乙酯萃取,有机相干燥,浓缩,硅胶柱纯化(石油醚:乙酸乙酯=5:1)得目标化合物80mg,收率:62.0%。
[0288]
(12)2
‑
((1r,5s,6r)
‑3‑
(7,7
‑
二氟
‑2‑
((s)
‑2‑
甲基氮杂环丁烷
‑1‑
基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑4‑
基
‑5‑
氘)
‑3‑
氮杂双环[3.1.0]己基
‑6‑
基)乙酸的制备
[0289][0290]
将甲基2
‑
((1r,5s,6r)
‑3‑
(7,7
‑
二氟
‑2‑
((s)
‑2‑
甲基氮杂环丁烷
‑1‑
基)
‑
6,7
‑
二氢
‑
5h
‑
环戊[d]嘧啶
‑4‑
基
‑5‑
氘)
‑3‑
氮杂双环[3.1.0]己基
‑6‑
基)乙酸酯(80mg,0.21mmol)溶于thf(4ml),甲醇(4ml),水(2ml),加入氢氧化钠(42mg,1.1mmol),加入完毕15℃反应4h。浓缩溶剂,稀盐酸调节ph=6,二氯甲烷萃取,有机相干燥,浓缩,硅胶柱纯化(二氯甲烷:甲醇=50:1)得目标化合物15.5mg,收率:20.1%。
[0291]
分子式:c
18
h
21
df2n4o2分子量:365.4lc
‑
ms(m/e):366.0(m+h
+
)
[0292]1h
‑
nmr(400mhz,meod)δ:4.38
‑
4.44(m,1h),3.94
‑
4.04(m,3h),3.85
‑
3.91(m,1h),3.65
‑
3.68(m,2h),3.04(m,1h),2.35
‑
2.39(m,3h),2.30(d,j=7.2hz,2h),1.89
‑
1.95(m,1h),1.53
‑
1.58(m,2h),1.47(d,j=6hz,3h),0.86
‑
0.88(m,1h)。
[0293]
以上对本发明所提供的氘代的khk抑制剂及其应用进行了详细介绍。本文中应用了具体实施例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其中心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护。
[0294]
本技术氘代khk抑制剂化合物1
‑
18所对应的部分非氘代khk抑制剂化合物,其具体制备方法参见pct/cn2020/073813,其酶学活性测定方法如本技术实验例1所述,其结构、核磁氢谱、酶学数据如下所示。
[0295]
可以采用与本技术实施例1、2或者与非氘代khk抑制剂化合物的制备方法(pct/cn2020/073813)类似的方法,制备得到本技术的其他氘代khk抑制剂化合物。
[0296]
[0297]
[0298]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1