吡嗪并吡啶酮类蛋氨酸腺苷转移酶2A抑制剂的制作方法
吡嗪并吡啶酮类蛋氨酸腺苷转移酶2a抑制剂
技术领域
1.本发明涉及吡嗪并吡啶酮类蛋氨酸腺苷转移酶2a抑制剂,其可用于治疗某些癌症。
背景技术:
2.蛋氨酸腺苷转移酶(mat)(也称为s-腺苷蛋氨酸合成酶)是催化由蛋氨酸和atp合成s-腺 苷蛋氨酸(sam或adomet)的细胞酶,并被认为是蛋氨酸循环的限速步骤。sam是多胺生物 合成中的丙氨基供体,并且是用于dna甲基化的主要甲基供体,并且其参与基因转录和细 胞增殖以及次级代谢产物的生成。
3.蛋氨酸腺苷转移酶2a(mat2a)是利用蛋氨酸(met)和三磷酸腺苷(atp)生成s-腺 苷蛋氨酸(sam)的酶。sam是细胞中主要的甲基供体,用于包括dna,rna和蛋白质在 内的多种底物的甲基化。mtap(甲硫腺苷磷酸化酶)是一种在正常组织中广泛表达的酶, 其催化甲硫腺苷(mta)转化为腺嘌呤和5-甲硫核糖-1-磷酸,腺嘌呤转化为腺苷单磷酸,5-甲 硫基核糖-1-磷酸转化为蛋氨酸和甲酸盐。当嘌呤合成被阻断时,例如被抗代谢物阻断时,mta 可用作替代的嘌呤源。
4.编码mtap的基因位于9号染色体上的一个部位,在癌症患者中经常从中枢神经系统, 胰腺,食管膀胱和肺的细胞中缺失。与表达mtap的细胞相比,mtap的丧失导致mta的 积累,使得mtap缺失的细胞更依赖于sam的产生,因此更依赖于mat2a活性。在约400 个癌细胞系筛选中,与正常表达mtap的细胞相比,mat2a敲低导致mtap缺失的细胞有 更大百分比的活力丧失。此外,mat2a蛋白的诱导性敲低降低了体内肿瘤的生长。这些结果 表明,mat2a抑制剂可能为包括mtap缺失肿瘤患者提供一种新颖的治疗方法。
5.目前中国专利申请cn109890822a中公开了一种吡唑并嘧啶酮类mat2a抑制剂, wo2020123395a1中公开了一种2-氧代喹唑啉衍生物作为mat2a抑制剂,本发明提供了一 种新的吡嗪并吡啶酮类蛋氨酸腺苷转移酶2a抑制剂。
技术实现要素:
6.本发明提供如式i所示的化合物或其药学上可接受的盐:
[0007][0008]
其中,x和y各自独立地选自c或n;且x和y选自不同的原子;
[0009]
m或n独立地选自0或1;
[0010]
r1选自氢、氰基、c2-c6炔基、卤素、羟基、nh2、(c1-c6烷基)-nr
6-、(c1-c6烷基)-o-、 (c1-c6烷基)-s-、c1-c6烷基、c3-c6环烷基、6-10元芳基、c2-c6烯基或c3-c6环烯基, 其中所述c1-c6烷基、c2-c6烯基、c3-c6环烷基或c3-c6环烯基任选地被卤素、氰基、羟 基、-nr7r8、c1-c3烷基、c1-c3烷基氧基、c2-c6烯基或c2-c6炔基取代,所述6-10元芳 基任选被卤素、羟基、氰基、-nr7r8、no2、c1-c3烷基、c1-c3烷氧基、c2-c6烯基或c2-c6 炔基取代,或任选被卤素、羟基、氰基、-nr7r8、no2取代的c1-c3烷基、c1-c3烷氧基c2-c6 烯基或c2-c6炔基取代;
[0011]
r2选自6-10元芳基或9-12元苯并杂环基,所述6-10元芳基或9-12元苯并杂环基任选地 被卤素、羟基、氰基、-nr7r8、no2、-nr9c(o)r
10
、c1-c6烷基、(c1-c6烷基)-o-、-c(o)n r
9 r
10
或5-7元杂芳基取代,所述的c1-c6烷基或5-7元杂芳基任选被卤素、氰基、羟基、 c1-c3烷基、(c1-c3烷基)-o-或-nr7r8取代;
[0012]r3a
和r
3b
各自独立地选自氢或c1-c6烷基,或r
3a
和r
3b
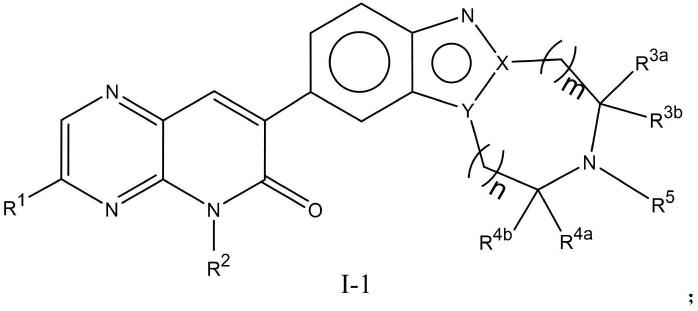
以及与它们相连的碳原子一起 形成-c(o)-或3-6元饱和碳环;
[0013]r4a
和r
4b
各自独立地选自氢或c1-c6烷基,或r
4a
和r
4b
以及与它们相连的碳原子一起 形成-c(o)-或3-6元饱和碳环;
[0014]
r5选自氢、c1-c6烷基、c3-c6环烷基、c4-c6杂环烷基或c1-c3烷基磺酰基,所述c1-c6 烷基、c3-c6环烷基或c4-c6杂环烷基可被卤素、氰基或羟基取代;
[0015]
r6、r7、r8、r9和r
10
各自独立地选自h或c1-c6烷基。
[0016]
在一些实施方案中,x选自c,且y选自n。
[0017]
在一些实施方案中,x选自n,且y选自c。
[0018]
在一些实施方案中,r1为(c1-c6烷基)-nr
6-,其中c1-c6烷基可被卤素取代。
[0019]
在一些实施方案中,r1为(c1-c6烷基)-nr
6-,其中c1-c6烷基可被氟取代。
[0020]
在一些实施方案中,r6选自氢。
[0021]
在一些典型的实施方案中,r1为(c1-c2烷基)-nh-,其中c1-c2烷基可被氟取代;在一 些更为典型的实施方案中,r1为cf3ch2nh-。
[0022]
在一些实施方案中,r2选自6-10元芳基,所述的芳基任选被(c1-c6烷基)-o-取代,其中 的c1-c6烷基可被卤素取代。
[0023]
在一些实施方案中,r2选自6-10元芳基,所述的芳基任选被(c1-c6烷基)-o-取代,其中 的c1-c6烷基可被氟取代。
[0024]
在一些典型的实施方案中,r2选自苯基,所述的苯基任选被(c1-c6烷基)-o-取代,其中 的c1-c6烷基可被氟取代。
[0025]
在一些典型的实施方案中,r2选自苯基,所述的苯基被(c1-c2烷基)-o-取代,其中的 c1-c2烷基可被氟取代;在一些更为典型的实施方案中,r2选自4-二氟甲氧基苯基。
[0026]
在一些实施方案中,r
3a
和r
3b
独立地选自氢,或r
3a
和r
3b
以及与它们相连的碳原子一起 形成-c(o)-或3-6元饱和碳环。
[0027]
在一些典型的实施方案中,r
3a
和r
3b
选自氢、或r
3a
和r
3b
以及与它们相连的碳原子一起 形成-c(o)-或3元饱和碳环;优选地,r
3a
和r
3b
选自氢,或r
3a
和r
3b
以及与它们相连的碳原 子一起形成-c(o)-;更优选地,r
3a
和r
3b
与它们相连的碳原子一起形成-c(o)-。
[0028]
在一些实施方案中,r
4a
和r
4b
独立地选自氢,或r
4a
和r
4b
以及与它们相连的碳原子一起 形成-c(o)-或3-6元饱和碳环。
[0029]
在一些典型的实施方案中,r
4a
和r
4b
独立地选自氢,或r
4a
和r
4b
以及与它们相连的碳原 子一起形成-c(o)-或3元饱和碳环;优选地,r
4a
和r
4b
以及与它们相连的碳原子一起形成-c(o)
‑ꢀ
或3元饱和碳环。
[0030]
在一些实施方案中,r5选自氢、c1-c3烷基、c3-c6环烷基、c4-c6杂环烷基或c1-c3 烷基磺酰基,其中c1-c3烷基可被氰基或羟基取代;
[0031]
在一些典型的实施方案中,r5选自氢、甲基、3-氧杂环丁烷基、氰甲基、2-羟基乙基、 环丙基或甲磺酰基;优选地,r5选自3-氧杂环丁烷基、氰甲基、环丙基或甲磺酰基;更优选 地,r5选自3-氧杂环丁烷基。
[0032]
在一些实施方案中,前述式i化合物具有如式i-1所示的结构,
[0033][0034]
其中,x、y、m、n、r1、r2、r
3a
、r
3b
、r
4a
、r
4b
和r5的定义如式i化合物中所定义的。
[0035]
在一些实施方案中,前述式i化合物具有如式ii所示的结构,
[0036][0037]
其中,m、n、r1、r2、r
3a
、r
3b
、r
4a
、r
4b
和r5的定义如式i化合物中所定义的。
[0038]
在一些实施方案中,前述式i化合物具有如式iii所示的结构,
[0039][0040]
其中,m、n、r1、r2、r
3a
、r
3b
、r
4a
、r
4b
和r5的定义如式i化合物中所定义的。
[0041]
另一方面,本发明提供下列化合物或其药学上可接受的盐:
[0042]
[0043][0044]
在一些实施方案中,本发明提供了一种药物组合物,其包含治疗有效量的式i、i-1、ii 或iii化合物或其药学上可接受的盐和药学上可接受的载体。
[0045]
在一些实施方案中,本发明提供了在需要的哺乳动物中治疗mat2a的过表达介导的疾 病或病症的方法,包括向哺乳动物给予有效量的式i、i-1、ii或iii化合物或其药学上可接受 的盐。
[0046]
在一些实施方案中,本发明提供了在受试者中治疗mtap缺失的(null)癌症的方法,包括 向受试者给药有效量的式i、i-1、ii或iii的化合物或其药学上可接受的盐。
[0047]
在一些实施方案中,本发明提供在细胞中通过mat2a抑制从蛋氨酸和atp合成s-腺苷 蛋氨酸(sam)的方法,包括将细胞与有效量的式i、i-1、ii或iii的化合物或其药学上可接受 的盐接触。
[0048]
在一些实施方案中,本发明提供了在患有癌症的受试者中治疗癌症的方法,其中所述癌 症的特征为甲硫腺苷磷酸化酶(mtap)基因表达的减少或缺失、mtap基因的缺失、或mtap 蛋白功能的减少,包括向受试者给药治疗有效量的式i、i-1、ii或iii的化合物或其药学上可 接受的盐。
[0049]
在一些实施方案中,本发明提供了式i、i-1、ii或iii的化合物或其药学上可接受的盐, 其用于在细胞中通过mat2a抑制从蛋氨酸和atp合成s-腺苷蛋氨酸(sam)。
[0050]
在一些实施方案中,本发明提供了式i、i-1、ii或iii的化合物或其药学上可接受的盐, 其用于在患有疾病或病症的受试者中治疗疾病或病症,其中所述疾病或病症通过mat2a的 过表达介导。
[0051]
在一些实施方案中,本发明提供了式i、i-1、ii或iii的化合物或其药学上可接受的盐, 其用于在患有癌症的受试者中治疗癌症,其中所述癌症的特征为甲硫腺苷磷酸化酶(mtap) 基因表达的减少或缺失、mtap基因的缺失、或mtap蛋白功能的减少。
[0052]
另一方面,本发明提供一种制备式i、i-1、ii或iii化合物的方法,包括但不限于以下合 成方案:
[0053]
合成方案1:
[0054][0055]
其中w选自ona或nh,x选自氯、溴或碘,r1、r2如式i所定义。
[0056]
式1-1化合物在碱性条件下与式1-2a、1-2b或1-2c反应得式1-3化合物,式1-3化合物 在卤代剂的作用下进行卤代得式1-4化合物,式1-4化合物在还原体系下发生还原反应得式 1-5化合物,式1-5化合物在碱性条件下与式1-6a化合物或1-6b化合物反应制得式1-7化合 物。
[0057]
合成方案2:
[0058][0059]
其中m、n、r1、r2、r
3a
、r
3b
、r
4a
、r
4b
和r5的定义如式i化合物中所定义的,x选自氯、 溴或碘。
[0060]
式1-7化合物与式2-1化合物在碱性条件下反应制得式2-2化合物,式2-2化合物与式2-3 化合物在碱性条件下缩合得式2-4化合物。
[0061]
相关定义
[0062]
除非有特定说明,下列用在说明书和权利要求书中的术语具有下述含义:
[0063]
本发明“化合物”可以是不对称的,例如,具有一个或多个手性中心。除非另有说 明,本发明的“化合物”指的是任意一种立体异构体或两种以上的立体异构体的混合物。 立体异构体包括但不限于对映异构体和非对映异构体。本发明的含有不对称碳原子的化 合物可以以光学活性纯的形式或两种以上的立体异体的混合物的形式被分离得到。光学 活性纯的形式可以从两种以上的立体异构体的混合物中进行拆分,或通过使用手性原料 或手性试剂合成。
[0064]
本发明“化合物”还包括互变异构体形式。互变异构体形式来源于一个单键与相邻 的双键交换并一起伴随一个质子的迁移。例如:酮-烯醇互变异构,两者在一定条件下可 发生转变。
[0065]
术语“任选”或“任选地”是指随后描述的事件或情况可能发生或可能不发生,该描述包括 发生所述事件或情况和不发生所述事件或情况。
[0066]
本文中的数字范围,是指给定范围中的各个整数。例如,“c1-c6”是指该基团可具有1 个碳原子、2个碳原子、3个碳原子、4个碳原子、5个碳原子或6个碳原子;“c3-c6”是指该 基团可具有3个碳原子、4个碳原子、5个碳原子或6个碳原子。
[0067]
术语“元”是指组成环的骨架原子或原子团的数目。例如,“5-7元”是指组成环的 骨架原子或原子团的数目为5个、6个或7个。因此,举例而言,吡啶、哌啶、哌嗪和苯为 六元环,而噻吩、吡咯为五元环。
[0068]
术语“被取代”是指特定基团上的任意一个或多个氢原子被取代基取代,只要特定基团的 价态是正常的并且取代后的化合物是稳定的。例如,“被卤素取代”是指特定基团上的任意一 个或多个氢原子被卤素取代,只要特定基团的价态是正常的并且取代后的化合物是稳定的。
[0069]
术语“烷基”指饱和的脂族烃基团,包括直链的或支链的饱和烃基,所述烃基具有所示出 的碳原子数。如术语“c1-c6烷基”包括c1烷基、c2烷基、c3烷基、c4烷基、c5烷基、c6 烷基,实例包括,但不限于,甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正 戊基、2-戊基、3-戊基、正己基、2-己基、3-己基等。
[0070]
术语“烷氧基”指具有烷基-o-结构的基团,烷基为包括直链的或支链的饱和一价烃基。如
ꢀ“
c1-c3烷氧基”包括甲氧基、乙氧基、正丙氧基、异丙氧基。
[0071]
术语“环烷基”指单环饱和烃体系,无杂原子,无双键。术语“3-6元环烷基”的实 例包括,但不限于,环丙基、环丁基、环戊基、环己基。
[0072]
术语“卤素”指氟、氯、溴和碘。
[0073]
术语“芳基”是指具有共轭的π电子体系的全碳单环或稠合双环的芳香环基团,其通过从母 体芳香环体系的单一碳原子上除去一个氢原子而得到。包括与饱和环、部分不饱和环或芳香 碳环稠合的双环基团;实例包括,但不限于,苯基、萘基、蒽基、茚、茚满、1,2-二氢萘、1,2,3,4
‑ꢀ
四氢萘。
[0074]
术语“杂芳基”指包含至少一个独立地选自氮、氧和硫杂原子的一价芳基。例如“5-7 元杂芳基”实例包括,但不限于,吡啶基、噻吩基、咪唑基、嘧啶基、吡啶基、呋喃基、 吡嗪基、噻唑基。
[0075]
术语“9-12元苯并杂环基”是指苯环与杂环稠和形成的具有9-12个环原子或环原
子团的环 体系,苯环与杂环共享一对相邻环原子,且与母核结构的连接位点位于苯环部分。其中杂 环部分为具有环碳原子和1至4个环杂原子或杂原子团的5-8元饱和、部分不饱和或完全不 饱和的环体系,杂原子或杂原子团独立地选自氮、硫、氧,杂环为单环。实例包括,但不限 于苯并四氢呋喃呋喃基。
[0076]
术语“药学上可接受的盐”是指保留了特定化合物的游离酸和碱的生物学效力而没 有生物学不良作用的盐。例如酸(包括有机酸和无机酸)加成盐或碱加成盐(包括有机 碱和无机碱)。
[0077]
本发明的药学上可接受的盐可由含有酸根或碱基的母体化合物通过常规化学方法合 成。一般情况下,这样的盐的制备方法是:在水或有机溶剂或两者的混合物中,经由游 离酸或碱形式的这些化合物与化学计量的适当的碱或酸反应来制备。
[0078]
术语“有效量”或“治疗有效量”是指无毒的但能达到预期效果的药物或药剂的足 够用量。
[0079]
术语“药学上可接受的载体”是指对机体无明显刺激作用,而且不会损害该活性化 合物的生物活性及性能的那些载体。包括但不限于国家食品药品监督管理局许可的可用 于人或动物的任何稀释剂、崩解剂、粘合剂、助流剂、润湿剂。
[0080]
权利要求书和说明书中所使用的简称其含义如下:
[0081]
m:mol/l;
[0082]
mm:mmol/l;
[0083]
μm:μmol/l;
[0084]
nm:nmol/l;
[0085]
tbaf:四丁基氟化铵
[0086]
pmb:对甲氧基苄基
[0087]
sem:(三甲基硅)乙氧基甲基
[0088]
brij35:月桂醇聚氧乙烯醚
[0089]
bsa:牛血清白蛋白
[0090]
dmso:二甲基亚砜
[0091]
rpm:转/分
[0092]
tris-hcl:三羟甲基氨基甲烷盐酸盐
具体实施方式
[0093]
下面更具体地描述本发明的化合物的制备方法,但这些具体的制备方法不对本发明 的范围构成任何限制。此外,反应条件如反应物、溶剂、碱、所用化合物的量、反应温 度、反应时间等不限于下面的实例。
[0094]
本发明的化合物还可以任选地将在本说明书中描述的或本领域已知的各种合成方法 组合起来而方便制得,这样的组合可由本领域的技术人员容易地进行。
[0095]
实施例中间体的合成:7-溴-5-(4-(二氟甲氧基)苯基)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡 嗪-6(5h)-酮
[0096][0097]
a)3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮的制备
[0098]
将3-溴吡啶并[2,3-b]吡嗪-6(5h)-酮(11.3g),三氟乙胺(24.75g)和二甲基亚砜(60ml) 加入到聚四氟乙烯高压罐中,加热到100℃,反应两天。反应结束后将反应液倒入到水(800ml) 中,然后过滤,滤饼用二氯甲烷/甲醇=20/1(v/v)(50ml)打浆,过滤后得到标题化合物11.8g。
[0099]
b)2,7-二溴-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮的制备
[0100]
将3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮(11.8g),n-溴代丁二酰亚胺 (17.2g),和n,n-二甲基甲酰胺(100ml)加入到烧瓶中,常温搅拌过夜。反应结束后将反 应液倒入到水(1.5l)中,过滤得到标题化合物12.5g。
[0101]
c)7-溴-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮的制备
[0102]
将2,7-二溴-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮(12.5g),三乙基硅烷 (3.62g),醋酸钯(279mg),三苯基膦(653mg)和碳酸钠(106mg)加入到烧瓶中,氮气保 护后再加入n,n-二甲基乙酰胺(40ml),乙醇(15ml)和水(8ml),将烧瓶至于80℃下反 应1小时,然后再补加三乙基硅烷(724mg),继续反应1小时。反应结束后将反应液倒入水 (1l)中,过滤,将滤饼用二氯甲烷/甲醇=20/1(v/v)(40ml)打浆,过滤得到标题化合物 8.2g。
[0103]
d)7-溴-5-(4-(二氟甲氧基)苯基)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮的制 备
[0104]
将7-溴-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮(6.4g),对二氟甲氧基苯硼 酸(7.5g),三氟甲磺酸铜(21.7g),4,4'-二叔丁基-2,2'-二吡啶(25mg),吡啶(15.8g)和4a 分子筛(15g)加入到烧瓶中,氮气保护后加入n,n-二甲基甲酰胺(200ml),在常温下搅拌 过夜。反应结束后过滤除去固体残渣,将有机相倒入水(2l)中,过滤,滤饼用二氯甲烷/ 甲醇=20/1(v/v)(50ml)打浆,得到标题化合物7.1g。
[0105]
实施例1:5-(4-(二氟甲氧基)苯基)-7-(2-(氧杂环丁-3-基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡 嗪-7-yl)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮
[0106][0107]
a)4-(5-溴-2-硝基苯基)-3-氧哌嗪-1-羧酸叔丁酯的制备
[0108]
将3-氧杂哌嗪-1-羧酸叔丁酯(1.76g)加入烧瓶中,氮气保护后加入n,n-二甲基甲酰胺 (40ml),常温搅拌10分钟后加入氢化钠(480mg,60%分散在矿物油中),继续搅拌10分 钟,最后加入4-溴-2-氟-1-硝基苯(1.76g),常温搅拌过夜。反应结束后加入乙酸乙酯(400ml) 和氯化铵饱和水溶液(50ml),然后依次用水和饱和氯化钠水溶液洗涤有机相,将有机相浓 缩至干,粗品柱层析纯化(流动相:二氯甲烷/甲醇=50/1(v/v))得到标题化合物1g。
[0109]
b)1-(7-溴-3,4-二氢苯并[4,5]咪唑并[1,2-a]吡嗪-2(1h)-基)乙-1-酮和7-溴-3,4-二氢苯并[4,5] 咪唑并[1,2-a]吡嗪-2(1h)-羧酸叔丁酯的制备
[0110]
将4-(5-溴-2-硝基苯基)-3-氧哌嗪-1-羧酸叔丁酯(1g),还原铁粉(700mg),和醋酸(20ml) 加入到烧瓶中,回流反应1小时。反应结束后将有机相浓缩至干,粗品柱层析纯化(流动相: 二氯甲烷/甲醇=50/1(v/v))得到标题化合物的混合物650mg。
[0111]
c)7-溴-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪的制备
[0112]
将1-(7-溴-3,4-二氢苯并[4,5]咪唑并[1,2-a]吡嗪-2(1h)-基)乙-1-酮和7-溴-3,4-二氢苯并[4,5] 咪唑并[1,2-a]吡嗪-2(1h)-羧酸叔丁酯的混合物(650mg),和稀盐酸(4n,6ml)加入到烧瓶 中,回流反应3小时。反应结束后用饱和碳酸氢钠水溶液调节ph至弱碱性,然后用二氯甲 烷萃取,合并有机相,干燥后浓缩,粗品柱层析纯化(流动相:二氯甲烷/甲醇=20/1(v/v)) 得到标题化合物380mg。
[0113]
d)7-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪的制 备
[0114]
将7-溴-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪(360mg),联硼酸频那醇酯(544mg),[1,1'
‑ꢀ
双(二苯基膦基)二茂铁]二氯化钯(102mg)和醋酸钾(420mg)加入到烧瓶中,氮气保护后加 入1,4-二氧六环(15ml),在90℃下反应3小时。反应结束后滤出固体残渣,将有机相浓缩 至干,粗品柱层析纯化(流动相:二氯甲烷/甲醇=20/1(v/v))得到标题
化合物280mg。
[0115]
e)5-(4-(二氟甲氧基)苯基)-7-(1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪-7-基)-3-((2,2,2-三氟 乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮的制备
[0116]
将7-溴-5-(4-(二氟甲氧基)苯基)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮 (336mg),7-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪 (260mg),[1,1'-双(二苯基膦基)二茂铁]二氯化钯(51mg)和磷酸钾(459mg)加入到烧瓶中, 氮气保护后加入1,4-二氧六环(10ml)和水(2.5ml),在80℃下反应2小时。反应结束后滤 出固体残渣,将有机相浓缩至干,粗品柱层析纯化(流动相:二氯甲烷/甲醇=10/1(v/v)) 得到标题化合物440mg。
[0117]
f)5-(4-(二氟甲氧基)苯基)-7-(2-(氧杂环丁-3-基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪
ꢀ‑
7-基)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮的制备
[0118]
将5-(4-(二氟甲氧基)苯基)-7-(1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪-7-基)-3-((2,2,2-三氟 乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮(28mg),3-氧杂环丁酮(18mg),三乙酰氧基硼氢化 钠(53mg),醋酸(9mg)和1,2-二氯乙烷(2ml)加入到反应瓶中,常温搅拌过夜。反应结 束后将有机相浓缩至干,粗品柱层析纯化(流动相:二氯甲烷/甲醇=25/1(v/v))得到标题 化合物15mg。
[0119]1h nmr(400mhz,dmso-d6)δ8.41(s,1h),8.12(s,1h),8.04(s,1h),7.95(s,1h),7.59(t, j=1.4hz,2h),7.44
–
7.38(m,2h),7.37
–
7.28(m,3h),4.65(t,j=6.6hz,2h),4.57(t,j=6.1 hz,2h),4.17(t,j=5.5hz,2h),3.81(d,j=19.6hz,5h),2.94(t,j=5.6hz,2h).
[0120]
lcms m/z=614.2[m+1]
+
[0121]
实施例2:5-(4-(二氟甲氧基)苯基)-7-(2-甲基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪-7
‑ꢀ
基)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮
[0122][0123]
将5-(4-(二氟甲氧基)苯基)-7-(1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪-7-基)-3-((2,2,2-三氟 乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮(38mg),甲醛水溶液(36%,31mg),三乙酰氧基硼 氢化钠(74mg),醋酸(13mg)和1,2-二氯乙烷(2ml)加入到反应瓶中,常温搅拌过夜。 反应结束后将有机相浓缩至干,粗品柱层析纯化(流动相:二氯甲烷/甲醇=25/1(v/v))得 到标题化合物10mg。
[0124]1h nmr(400mhz,dmso-d6)δ8.11(s,1h),8.04(s,1h),7.93(s,1h),7.60(d,j=8.6hz, 2h),7.41(d,j=8.4hz,2h),7.34(m,3h),4.15(t,j=4.6hz,2h),3.92
–
3.71(m,4h),3.03
–ꢀ
2.88(m,2h),2.46(s,3h).
[0125]
lcms m/z=572.2[m+1]
+
[0126]
实施例3:2-(7-(5-(4-(二氟甲氧基)苯基)-6-氧代-3-((2,2,2-三氟乙基)氨基)-5,6-二氢吡啶并[2,3-b] 吡嗪-7-基)-3,4-二氢苯并[4,5]咪唑并[1,2-a]吡嗪-2(1h)-基)乙腈
[0127][0128]
将5-(4-(二氟甲氧基)苯基)-7-(1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪-7-基)-3-((2,2,2-三氟 乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮(28mg),溴乙腈(9mg),碳酸钾(35mg)和乙腈(2ml) 加入到烧瓶中,常温搅拌过夜。反应结束后将有机相浓缩至干,粗品柱层析纯化(流动相: 二氯甲烷/甲醇=25/1(v/v))得到标题化合物9.6mg。
[0129]1h nmr(400mhz,dmso-d6)δ8.43(s,1h),8.12(s,1h),8.04(s,1h),7.95(d,j=1.2hz, 1h),7.60(d,j=1.2hz,2h),7.44
–
7.39(m,2h),7.37
–
7.26(m,3h),4.21(t,j=5.5hz,2h), 4.07(s,2h),3.97(s,2h),3.84(dd,j=9.8,6.7hz,2h),3.13(t,j=5.6hz,2h).
[0130]
lcms m/z=597.2[m+1]
+
[0131]
实施例4:7-(2-环丙基-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪-7-基)-5-(4-(二氟甲氧基)苯 基)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮
[0132][0133]
将5-(4-(二氟甲氧基)苯基)-7-(1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪-7-基)-3-((2,2,2-三氟 乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮(112mg),(1-乙氧基环丙氧基)三甲基硅烷(139mg), 氰基硼氢化钠(50mg)和醋酸(60mg)加入到反应瓶中,氮气保护后加入甲醇(10ml),在 65℃下反应4小时。反应结束后将有机相浓缩至干,粗品柱层析纯化(流动相:二氯甲烷/ 甲醇=25/1(v/v))得到标题化合物27mg。
[0134]1h nmr(400mhz,dmso-d6)δ8.49(s,1h),8.10(s,1h),8.04(s,1h),7.91(s,1h),7.58(d, j=1.7hz,2h),7.44
–
7.38(m,2h),7.36
–
7.28(m,3h),4.12(t,j=5.6hz,2h),3.98(s,2h), 3.84(q,j=9.6,9.0hz,2h),3.16(m,2h),1.99(tt,j=6.6,3.5hz,1h),0.55(dt,j=6.0,2.6hz, 2h),0.49(p,j=4.6,4.0hz,2h).
[0135]
lcms m/z=598.2[m+1]
+
[0136]
实施例5:5-(4-(二氟甲氧基)苯基)-7-(2-(2-羟乙基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪-7
‑ꢀ
基)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮
[0137][0138]
将5-(4-(二氟甲氧基)苯基)-7-(1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪-7-基)-3-((2,2,2-三 氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮(56mg),2-溴乙醇(19mg),n,n-二异丙基乙基胺 (26mg)和n,n-二甲基甲酰胺(2ml)加入到烧瓶中,在120℃下反应3小时。反应结束后 将有机相浓缩至干,粗品柱层析纯化(流动相:二氯甲烷/甲醇=25/1(v/v))得到标题化合 物20.5mg。
[0139]1h nmr(400mhz,dmso-d6)δ8.43(s,1h),8.11(s,1h),8.04(s,1h),7.93(s,1h),7.58(d, j=1.6hz,2h),7.44
–
7.38(m,2h),7.37
–
7.29(m,3h),4.61(s,1h),4.14(t,j=5.5hz,2h), 3.90(s,2h),3.87
–
3.77(m,2h),3.63(t,j=5.8hz,2h),3.07(t,j=5.5hz,2h),2.69(t,j=5.9 hz,2h).
[0140]
lcms m/z=602.3[m+1]
+
[0141]
实施例6:5-(4-(二氟甲氧基)苯基)-7-(2-(甲基磺酰基)-1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪
ꢀ‑
7-基)-3
–
((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮
[0142][0143]
将5-(4-(二氟甲氧基)苯基)-7-(1,2,3,4-四氢苯并[4,5]咪唑并[1,2-a]吡嗪-7-基)-3-((2,2,2-三 氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮(53mg),三乙胺(101mg)和四氢呋喃(50ml)加 入到烧瓶中,然后再加入甲磺酰氯(23mg),在常温下反应1小时后薄层色谱板监测,如果 原料没有反应完则补加甲磺酰氯(5mg),继续反应1小时,直至原料全部反应完。反应结束 后将有机相浓缩至干,粗品柱层析纯化(流动相:二氯甲烷/甲醇=20/1(v/v))得到标题化 合物43mg。
[0144]1h nmr(400mhz,dmso-d6)δ8.44(s,1h),8.13(s,1h),8.04(s,1h),7.98(s,1h),7.64(s, 2h),7.41(d,j=8.5hz,2h),7.34(m,3h),4.68(s,2h),4.30(t,j=5.4hz,2h),3.83(q,j=7.6, 5.6hz,4h),3.11(s,3h).
[0145]
lcms m/z=636.2[m+1]
+
[0146]
实施例7:5-(4-(二氟甲氧基)苯基)-7-(3-甲基-2,3,4,5-四氢-1h-苯并[4,5]咪唑[1,2-d][1,4]二氮杂
ꢀ‑
9-基)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮
[0147][0148]
a)4-(5-溴-2-硝基苯基)-5-氧代-1,4-二氮杂-1-羧酸叔丁酯的制备
[0149]
将5-氧代-1,4-二氮杂-1-羧酸叔丁酯(1.9g)加入烧瓶中,氮气保护后加入n,n-二甲基甲 酰胺(40ml),常温搅拌10分钟后加入氢化钠(480mg,60%分散在矿物油中),继续搅拌 10分钟,最后加入4-溴-2-氟-1-硝基苯(1.76g),常温搅拌过夜。反应结束后加入乙酸乙酯 (400ml)和氯化铵饱和水溶液(50ml),然后依次用水和饱和氯化钠水溶液洗涤有机相, 将有机相浓缩至干,粗品柱层析纯化(流动相:二氯甲烷/甲醇=50/1(v/v))得到标题化合 物2.6g。
[0150]
b)1-(9-溴-1,2,4,5-四氢-3h-苯并[4,5]咪唑[1,2-d][1,4]二氮杂-3-基)乙-1-酮和9-溴-1,2,4,5
‑ꢀ
四氢-3h-苯并[4,5]咪唑并[1,2-d][1,4]二氮杂-3-羧酸叔丁酯的制备
[0151]
将4-(5-溴-2-硝基苯基)-5-氧代-1,4-二氮杂-1-羧酸叔丁酯(1.5g),还原铁粉(1g),和醋 酸(30ml)加入到烧瓶中,回流反应1小时。反应结束后将有机相浓缩至干得粗品直接投入 下一步反应。
[0152]
c)9-溴-2,3,4,5-四氢-1h-苯并[4,5]咪唑[1,2-d][1,4]二氮杂的制备
[0153]
将上一步粗品,和稀盐酸(4n,10ml)加入到烧瓶中,回流反应3小时。反应结束后用 饱和碳酸氢钠水溶液调节ph至弱碱性,然后用二氯甲烷萃取,合并有机相,干燥后浓缩, 粗品柱层析纯化(流动相:二氯甲烷/甲醇=20/1(v/v))得到标题化合物630mg。
[0154]
d)9-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-2,3,4,5-四氢-1h-苯并[4,5]咪唑[1,2-d][1,4]二 氮杂的制备
[0155]
将9-溴-2,3,4,5-四氢-1h-苯并[4,5]咪唑[1,2-d][1,4]二氮杂(600mg),联硼酸频那醇酯 (859mg),[1,1'-双(二苯基膦基)二茂铁]二氯化钯(165mg)和醋酸钾(664mg)加入到烧瓶 中,氮气保护后加入1,4-二氧六环(15ml),在90℃下反应3小时。反应结束后滤出固体残 渣,将有机相浓缩至干,粗品柱层析纯化(流动相:二氯甲烷/甲醇=20/1(v/v))得到标题 化合物230mg。
[0156]
e)5-(4-(二氟甲氧基)苯基)-7-(2,3,4,5-四氢-1h-苯并[4,5]咪唑并[1,2-d][1,4]二氮杂-9
‑ꢀ
基)-3-(2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮的制备
[0157]
将7-溴-5-(4-(二氟甲氧基)苯基)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮 (298mg),9-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-2,3,4,5-四氢-1h-苯并[4,5]咪唑[1,2-d] [1,4]二氮杂(200mg),[1,1'-双(二苯基膦基)二茂铁]二氯化钯
(47mg)和磷酸钾(408mg)加 入到烧瓶中,氮气保护后加入1,4-二氧六环(10ml)和水(2.5ml),在80℃下反应2小时。 反应结束后滤出固体残渣,将有机相浓缩至干,粗品柱层析纯化(流动相:二氯甲烷/甲醇=10/1 (v/v))得到标题化合物220mg。
[0158]
f)5-(4-(二氟甲氧基)苯基)-7-(3-甲基-2,3,4,5-四氢-1h-苯并[4,5]咪唑[1,2-d][1,4]二氮杂-9
‑ꢀ
基)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮的制备
[0159]
将5-(4-(二氟甲氧基)苯基)-7-(2,3,4,5-四氢-1h-苯并[4,5]咪唑并[1,2-d][1,4]二氮杂-9
‑ꢀ
基)-3-(2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮(40mg),甲醛水溶液(36%,31mg), 三乙酰氧基硼氢化钠(74mg),醋酸(13mg)和1,2-二氯乙烷(2ml)加入到反应瓶中,常 温搅拌过夜。反应结束后将有机相浓缩至干,粗品柱层析纯化(流动相:二氯甲烷/甲醇=25/1 (v/v))得到标题化合物15mg。
[0160]1h nmr(400mhz,dmso-d6)δ8.40(s,1h),8.11(s,1h),8.04(s,1h),7.94(d,j=1.2hz, 1h),7.54(d,j=1.1hz,2h),7.43
–
7.37(m,2h),7.37
–
7.30(m,3h),4.34(d,j=7.3hz,2h), 3.84(t,j=8.3hz,2h),3.19
–
3.10(m,2h),2.71
–
2.65(m,2h),2.64(s,2h),2.38(s,3h).
[0161]
lcms m/z=586.1[m+1]
+
[0162]
实施例8:5-(4-(二氟甲氧基)苯基)-7-(3-(氧杂环丁-3-基)-2,3,4,5-四氢-1h-苯并[4,5]咪唑并[1,2-d] [1,4]二氮杂-9-基)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮
[0163][0164]
将5-(4-(二氟甲氧基)苯基)-7-(2,3,4,5-四氢-1h-苯并[4,5]咪唑并[1,2-d][1,4]二氮杂-9
‑ꢀ
基)-3-(2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮(40mg),3-氧杂环丁酮(25mg),三 乙酰氧基硼氢化钠(74mg),醋酸(13mg)和1,2-二氯乙烷(2ml)加入到反应瓶中,常温 搅拌过夜。反应结束后将有机相浓缩至干,粗品柱层析纯化(流动相:二氯甲烷/甲醇=25/1 (v/v))得到标题化合物23mg。
[0165]1h nmr(400mhz,dmso-d6)δ8.41(s,1h),8.10(s,1h),8.04(s,1h),7.93(s,1h),7.58
–ꢀ
7.53(m,2h),7.44
–
7.38(m,2h),7.38
–
7.28(m,3h),4.59(t,j=6.4hz,2h),4.50(t,j=6.1hz, 2h),4.38
–
4.31(m,2h),3.91
–
3.77(m,2h),3.70(p,j=6.4hz,1h),3.22
–
3.12(m,2h),2.60
–ꢀ
2.52(m,4h).
[0166]
lcms m/z=628.1[m+1]
+
[0167]
实施例9:5-(4-(二氟甲氧基)苯基)-7-(3-(2-羟乙基)-2,3,4,5-四氢-1h-苯并[4,5]咪唑并[1,2-d] [1,4]二氮杂-9-基)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮
[0168][0169]
将5-(4-(二氟甲氧基)苯基)-7-(2,3,4,5-四氢-1h-苯并[4,5]咪唑并[1,2-d][1,4]二氮杂-9
‑ꢀ
基)-3-(2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮(57mg),2-溴乙醇(19mg),n,n-二 异丙基乙基胺(26mg)和n,n-二甲基甲酰胺(2ml)加入到烧瓶中,在120℃下反应3小时。 反应结束后将有机相浓缩至干,粗品柱层析纯化(流动相:二氯甲烷/甲醇=25/1(v/v))得 到标题化合物20mg。
[0170]1h nmr(400mhz,dmso-d6)δ8.41(t,j=6.4hz,1h),8.11(s,1h),8.04(s,1h),7.99(s, 1h),7.55(s,1h),7.40(d,j=8.9hz,2h),7.34(m,3h),4.49(s,1h),4.34(m,2h),3.83(dt,j= 16.1,7.9hz,2h),3.57(t,j=5.8hz,2h),3.16(m,2h),2.84(m,4h),2.68(m,2h).
[0171]
lcms m/z=616.1[m+1]
+
[0172]
实施例10:9'-(5-(4-(二氟甲氧基)苯基)-6-氧代-3-((2,2,2-三氟乙基)氨基)-5,6-二氢吡啶并[2,3-b] 吡嗪-7-基)-4'h-螺[环丙烷-1,3'-吡嗪并[1,2-b]吲唑]-1'(2'h)-酮
[0173][0174]
a)5-溴-n-(1-(羟甲基)环丙基)-2h-吲唑-3-甲酰胺的制备
[0175]
将5-溴-2h-吲唑-3-羧酸(6g),(1-氨基环丙基)甲醇盐酸盐(3.69g),1-羟基苯并三唑 (4.04g),三乙胺(5.04g),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(5.73g)与n,n-二甲 基甲酰胺(60ml)混合,室温下反应2小时。反应完毕加水淬灭,反应液用100ml二氯甲 烷萃取3次。合并有机相,用100ml饱和食盐水洗涤3次。有机相浓缩至干,加入100ml 乙醚,抽滤,滤饼用100ml乙醚洗涤两次,得标题化合物2.8g。
[0176]
ms(esi+):311.75(m+h).
[0177]
b)9'-溴-4'h-螺[环丙烷-1,3'-吡嗪并[1,2-b]吲唑]-1'(2'h)-酮的制备
[0178]
氮气保护下,将5-溴-n-(1-(羟甲基)环丙基)-2h-吲唑-3-甲酰胺(400mg),(1-氨基环丙基) 甲醇盐酸盐(3.69g),三苯基膦(575.06mg)与四氢呋喃(40ml)混合,0℃下滴加
偶氮二 甲酸二叔丁酯(504.84mg),室温下反应2小时。反应完毕加水淬灭,反应液用100ml乙酸 乙酯萃取3次。合并有机相,用100ml饱和食盐水洗涤3次。有机相浓缩至干,粗品柱层析 纯化(流动相:甲醇/二氯甲烷=0-1/10(v/v))得标题化合物300mg。
[0179]
c)9'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-4'h-螺[环丙烷-1,3'-吡嗪并[1,2-b]吲 唑]-1'(2'h)-酮的制备
[0180]
氮气保护下,将9'-溴-4'h-螺[环丙烷-1,3'-吡嗪并[1,2-b]吲唑]-1'(2'h)-酮(100mg),联硼酸 频那醇酯(104.31mg),乙酸钾(100.78mg)与1,4-二氧六环(10ml)混合,加入[1,1'-双(二 苯基膦)二茂铁]二氯化钯二氯甲烷络合物(13.94mg),加热至80℃搅拌2小时。反应完毕抽 滤,滤饼用50ml二氯甲烷洗涤3次。合并有机相浓缩至干,粗品柱层析纯化(流动相:甲 醇/二氯甲烷=0-1/10(v/v))得标题化合物100mg。
[0181]
ms(esi+):339.90(m+h).
[0182]
d)9'-(5-(4-(二氟甲氧基)苯基)-6-氧代-3-((2,2,2-三氟乙基)氨基)-5,6-二氢吡啶并[2,3-b]吡嗪
ꢀ‑
7-基)-4'h-螺[环丙烷-1,3'-吡嗪并[1,2-b]吲唑]-1'(2'h)-酮的制备
[0183]
氮气保护下,将7-溴-5-(4-(二氟甲氧基)苯基)-3-((2,2,2-三氟乙基)氨基)-5,6-二氢吡啶并 [2,3-b]吡嗪-6-酮(98.74mg),9'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-4'h-螺[环丙烷-1,3'-吡 嗪并[1,2-b]吲唑]-1'(2'h)-酮(60mg),[1,1'-双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物 (7.2mg),磷酸钾(112.64mg)与1,4-二氧六环(6ml)和水(1ml)混合,加热至80℃搅 拌2小时。反应完毕将反应液浓缩至干,粗品制备色谱纯化(色谱柱:ymc-actus triart c18, 30*150mm,5μm;流动相a:水(10mmol/l甲酸铵),流动相b:乙腈;流速:60ml/min;梯 度:30%b到61%b(0~8min),61%b;检测波长:220nm;保留时间(min):8.13;柱温: 25℃)得标题化合物11.1mg。
[0184]1h nmr(400mhz,dmso-d6):δ8.55(s,1h),8.45(d,j=1.4hz,2h),8.12(s,1h),8.06(s, 1h),7.81(dd,j=9.1,0.9hz,1h),7.74(d,j=1.7hz,1h),7.54
–
7.13(m,5h),4.64(s,2h),3.86 (d,j=10.2hz,2h),1.04
–
0.92(m,4h).
[0185]
ms(esi+):598(m+h).
[0186]
实施例11:9-(5-(4-(二氟甲氧基)苯基)-6-氧代-3-((2,2,2-三氟乙基)氨基)-5,6-二氢吡啶并[2,3-b] 吡嗪-7-基)-3,4-二氢吡嗪并[1,2-b]吲唑-1(2h)-酮
[0187][0188]
a)5-溴-n-(2-羟乙基)-n-(4-甲氧基苄基)-2h-吲唑-3-甲酰胺的制备
[0189]
将5-溴-2h-吲唑-3-羧酸(2g),2-((4-甲氧基苄基)氨基)乙醇(1.8g),1-羟基苯并三唑 (1.35g),三乙胺(1.68g),1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(1.91g)与n,n-二甲 基甲酰胺(40ml)混合,室温下反应2小时。反应完毕加水淬灭,反应液用100ml二氯甲 烷萃取3次。合并有机相,用100ml饱和食盐水洗涤3次。有机相浓缩至干,粗品柱层析纯 化(流动相:石油醚/乙酸乙酯=4/1(v/v))得标题化合物920mg。
[0190]
ms(esi+):405.95(m+h).
[0191]
b)9-溴-2-(4-甲氧基苄基)-3,4-二氢吡嗪并[1,2-b]吲唑-1(2h)-酮的制备
[0192]
氮气保护下,将5-溴-n-(2-羟乙基)-n-(4-甲氧基苄基)-2h-吲唑-3-甲酰胺(820mg),三苯 基膦(904.4mg)与四氢呋喃(54ml)混合,0℃下滴加偶氮二甲酸二叔丁酯(794mg),30℃ 下反应2小时。反应完毕将反应液浓缩至干,粗品柱层析纯化(流动相:石油醚/乙酸乙酯=4/1 (v/v))得标题化合物510mg。
[0193]
ms(esi+):387.95(m+h).
[0194]
c)9-溴-3,4-二氢吡嗪并[1,2-b]吲唑-1(2h)-酮的制备
[0195]
将9-溴-2-(4-甲氧基苄基)-3,4-二氢吡嗪并[1,2-b]吲唑-1(2h)-酮(510mg),硝酸铈铵(2.18g) 与乙腈(5ml)和水(1ml)混合,30℃下反应2小时。反应完毕加入饱和碳酸氢钠水溶液 淬灭,反应液用20ml乙酸乙酯萃取3次。合并有机相,用20ml饱和食盐水洗涤3次。有 机相浓缩至干,粗品柱层析纯化(流动相:石油醚/乙酸乙酯=4/1(v/v))得标题化合物100mg。
[0196]
ms(esi+):265.90(m+h).
[0197]
d)9-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-3,4-二氢吡嗪并[1,2-b]吲唑-1(2h)-酮的制备 氮气保护下,将9-溴-3,4-二氢吡嗪并[1,2-b]吲唑-1(2h)-酮(40mg),联硼酸频那醇酯 (45.81mg),乙酸钾(44.26mg)与1,4-二氧六环(4ml)混合,加入[1,1'-双(二苯基膦)二茂 铁]二氯化钯二氯甲烷络合物(6.12mg),加热至80℃搅拌2小时。反应完毕将反应液浓缩至 干,粗品柱层析纯化(流动相:石油醚/乙酸乙酯=1/1(v/v))得标题化合物40mg。
[0198]
ms(esi+):313.85(m+h).
[0199]
e)9-(5-(4-(二氟甲氧基)苯基)-6-氧代-3-((2,2,2-三氟乙基)氨基)-5,6-二氢吡啶并[2,3-b]吡嗪
ꢀ‑
7-基)-3,4-二氢吡嗪并[1,2-b]吲唑-1(2h)-酮的制备
[0200]
氮气保护下,将7-溴-5-(4-(二氟甲氧基)苯基)-3-((2,2,2-三氟乙基)氨基)-5,6-二氢吡啶并 [2,3-b]吡嗪-6-酮(71.3mg),9-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-3,4-二氢吡嗪并[1,2-b] 吲唑-1(2h)-酮(40mg),[1,1'-双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物(5.2mg),磷酸 钾(37.61mg)与1,4-二氧六环(4ml)和水(0.8ml)混合,加热至80℃搅拌2小时。反应 完毕将反应液浓缩至干,粗品制备色谱纯化(色谱柱:ymc-actus triart c18,30*150mm,5μm; 流动相a:水(10mmol/l甲酸铵),流动相b:乙腈;流速:60ml/min;梯度:等度洗脱;检 测波长:220nm;柱温:25℃)得标题化合物39.5mg。
[0201]1h nmr(400mhz,dmso-d6):δ8.47
–
8.43(m,2h),8.31(d,j=2.8hz,1h),8.10(s,1h), 8.05(s,1h),7.78(s,1h),7.72(d,j=1.7hz,1h),7.54
–
7.12(m,5h),4.70
–
4.62(m,2h),3.85 (dd,j=9.7,6.6hz,2h),3.75(td,j=6.2,5.1,2.7hz,2h).
[0202]
ms(esi+):572(m+h).
[0203]
实施例12:5-(4-(二氟甲氧基)苯基)-7-(1',2'-二氢-4'h-螺[环丙烷-1,3'-吡嗪并[1,2-b]吲唑]-9'
‑ꢀ
基)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮
[0204][0205]
a)9'-溴-1',2'-二氢-4'h-螺[环丙烷-1,3'-吡嗪并[1,2-b]吲唑]的制备
[0206]
将9'-溴-4'h-螺[环丙烷-1,3'-吡嗪并[1,2-b]吲唑]-1'(2'h)-酮(100mg)与四氢呋喃(2ml) 混合,加入硼烷四氢呋喃溶液(1m,1.7ml),加热至70℃搅拌2小时。反应完毕将反应液 浓缩至干,加入20ml乙醚,抽滤,滤饼用20ml乙醚洗涤两次,得标题化合物25mg。
[0207]
ms(esi+):279.65(m+h).
[0208]
b)9'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-1',2'-二氢-4'h-螺[环丙烷-1,3'-吡嗪并[1,2-b] 吲唑]的制备
[0209]
氮气保护下,将9'-溴-1',2'-二氢-4'h-螺[环丙烷-1,3'-吡嗪并[1,2-b]吲唑](20mg),联硼酸 频那醇酯(21.91mg),乙酸钾(21.17mg)与1,4-二氧六环(2ml)混合,加入[1,1'-双(二苯 基膦)二茂铁]二氯化钯二氯甲烷络合物(2.93mg),加热至80℃搅拌2小时。反应完毕将反 应液浓缩至干,粗品柱层析纯化(流动相:甲醇/二氯甲烷=0-1/10(v/v))得标题化合物26mg。
[0210]
ms(esi+):326.10(m+h).
[0211]
c)5-(4-(二氟甲氧基)苯基)-7-(1',2'-二氢-4'h-螺[环丙烷-1,3'-吡嗪并[1,2-b]吲唑]-9'
‑ꢀ
基)-3-((2,2,2-三氟乙基)氨基)吡啶并[2,3-b]吡嗪-6(5h)-酮的制备
[0212]
氮气保护下,将7-溴-5-(4-(二氟甲氧基)苯基)-3-((2,2,2-三氟乙基)氨基)-5,6-二氢吡啶并 [2,3-b]吡嗪-6-酮(34.33mg),9'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-1',2'-二氢-4'h-螺[环丙 烷-1,3'-吡嗪并[1,2-b]吲唑](20mg),[1,1'-双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物 (2.5mg),磷酸钾(39.16mg)与1,4-二氧六环(2ml)和水(0.4ml)混合,加热至80℃搅 拌2小时。反应完毕将反应液浓缩至干,粗品制备色谱纯化(色谱柱:ymc-actus triart c18, 30*150mm,5μm;流动相a:水(10mmol/l甲酸铵),流动相b:乙腈;流速:60ml/min;梯 度:30%b到60%b(0~8min),60%b;检测波长:220nm;保留时间(min):7.62;柱 温:25℃)得标题化合物7.1mg。
[0213]1h nmr(400mhz,dmso-d6):δ8.40(s,1h),8.13(s,1h),8.09(s,1h),8.04(s,1h),7.62 (dd,j=9.1,1.7hz,1h),7.55(d,j=9.1hz,1h),7.41(d,j=8.9hz,2h),7.38
–
7.32
(m,3h), 4.27(d,j=8.8hz,4h),3.85(d,j=9.9hz,2h),3.20(t,j=7.1hz,1h),δ0.76(d,j=4.0hz, 2h),0.70(d,j=4.4hz,2h).
[0214]
ms(esi+):584(m+h).
[0215]
实施例13:9'-(5-(4-(二氟甲氧基)苯基)-6-氧代-3-((2,2,2-三氟乙基)氨基)-5,6-二氢吡啶并[2,3-b] 吡嗪-7-基)-2'h-螺[环丙烷-1,1'-吡嗪并[1,2-b]吲唑]-3'(4'h)-酮
[0216][0217]
a)5-溴-1-((2-(三甲基硅基)乙氧基)甲基)-1h-吲唑-3-腈的制备
[0218]
氮气保护下,将氢化钠(2.81g)与四氢呋喃(110ml)混合,-20℃下分批滴加5-溴-1h
‑ꢀ
吲唑-3-腈(13g)的四氢呋喃(85ml)溶液,保持-20℃搅拌45分钟后,加入[2-(氯甲氧基) 乙基]三甲基硅烷(19.52g)。继续保持-20℃搅拌45分钟后,在室温下搅拌30分钟。反应完 毕加水淬灭。水相用70ml乙酸乙酯萃取3次。合并有机相浓缩至干,粗品柱层析纯化(流 动相:石油醚/乙酸乙酯=5/1(v/v))得标题化合物20.73g。
[0219]
b)1-(5-溴-1-((2-(三甲基硅基)乙氧基)甲基)-1h-吲唑-3-基)环丙基-1-胺的制备
[0220]
氮气保护下,将钛酸四异丙酯(1.56g)与乙醚(50ml)混合,-70℃下分批滴加乙基溴 化镁(1.46g)溶液,保持-70℃搅拌1小时后,加入5-溴-1-((2-(三甲基硅基)乙氧基)甲基)-1h
‑ꢀ
吲唑-3-腈(1.76g),在室温下搅拌1小时。反应完毕先后加入1n盐酸(15ml)和10%氢氧 化钠溶液(50ml)淬灭。水相用70ml乙酸乙酯萃取3次。合并有机相浓缩至干,粗品柱层 析纯化(流动相:石油醚/乙酸乙酯=3/1(v/v))得标题化合物1.22g。
[0221]
ms(esi+):383.90(m+h).
[0222]
c)1-(5-溴-1h-吲唑-3-基)环丙基-1-胺的制备
[0223]
氮气保护下,将1-(5-溴-1-((2-(三甲基硅基)乙氧基)甲基)-1h-吲唑-3-基)环丙基-1-胺(10g) 与n,n-二甲基甲酰胺(200ml)混合,加入四丁基溴化铵(1m四氢呋喃溶液,130ml)和 乙二胺(15.72g),加热至70℃搅拌5小时后冷却至室温。向反应液加入500ml乙酸乙酯稀 释,用200ml水洗涤两次。水相用100ml乙酸乙酯萃取3次。合并有机相,用100ml饱和 食盐水洗涤3次。有机相浓缩至干,粗品柱层析纯化(流动相:甲醇/二氯甲烷=0-1/10(v/v)) 得标题化合物5g。
[0224]
ms(esi+):253.95(m+h).
[0225]
d)n-(1-(5-溴-1h-吲唑-3-基)环丙基)-2-氯乙酰胺的制备
[0226]
氮气保护下,将1-(5-溴-1h-吲唑-3-基)环丙基-1-胺(4g),三乙胺(3.21g)与二氯甲烷 (120ml)混合,-10℃下滴加氯乙酰氯(2.33g),保持-10℃搅拌4小时。反应完毕在0℃ 下加水淬灭。反应液用100ml甲醇/二氯甲烷=1/10(v/v)的混合溶液萃取3次。合并有机 相,用100ml饱和食盐水洗涤。有机相浓缩至干,粗品柱层析纯化(流动相:甲醇/二氯甲 烷=0-1/10(v/v))得标题化合物2.5g。
[0227]
ms(esi+):329.90(m+h).
[0228]
e)9'-溴-2'h-螺[环丙烷-1,1'-吡嗪并[1,2-b]吲唑]-3'(4'h)-酮的制备
[0229]
氮气保护下,将n-(1-(5-溴-1h-吲唑-3-基)环丙基)-2-氯乙酰胺(2g)与n-甲基吡咯烷酮 (200ml)混合,加入碳酸钾(1.68g),加热至80℃搅拌5小时后冷却至室温。向反应液加 入300ml乙酸乙酯和300ml水稀释,混合溶液用300ml乙酸乙酯萃取3次。合并有机相, 用200ml饱和食盐水洗涤两次。有机相浓缩至20ml,抽滤,滤饼用5ml乙酸乙酯洗涤3次, 得标题化合物。
[0230]
ms(esi+):293.90(m+h).
[0231]
f)9'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-2'h-螺[环丙烷-1,1'-吡嗪并[1,2-b]吲 唑]-3'(4'h)-酮的制备
[0232]
氮气保护下,将9'-溴-2'h-螺[环丙烷-1,1'-吡嗪并[1,2-b]吲唑]-3'(4'h)-酮(160mg),联硼酸 频那醇酯(167mg),乙酸钾(134.48mg)与1,4-二氧六环(3ml)混合,加入[1,1'-双(二苯基 膦)二茂铁]二氯化钯二氯甲烷络合物(44.62mg),加热至80℃搅拌2小时。反应完毕抽滤, 滤饼用30ml二氯甲烷洗涤3次。合并有机相浓缩至干,粗品柱层析纯化(流动相:甲醇/二 氯甲烷=0-1/10(v/v))得标题化合物130mg。
[0233]
ms(esi+):340.05(m+h).
[0234]
g)9'-(5-(4-(二氟甲氧基)苯基)-6-氧代-3-((2,2,2-三氟乙基)氨基)-5,6-二氢吡啶并[2,3-b]吡嗪
ꢀ‑
7-基)-2'h-螺[环丙烷-1,1'-吡嗪并[1,2-b]吲唑]-3'(4'h)-酮的制备
[0235]
氮气保护下,将7-溴-5-(4-(二氟甲氧基)苯基)-3-((2,2,2-三氟乙基)氨基)-5,6-二氢吡啶并 [2,3-b]吡嗪-6-酮(20mg),9'-(4,4,5,5-四甲基-1,3,2-二氧杂硼烷-2-基)-2'h-螺[环丙烷-1,1'-吡嗪 并[1,2-b]吲唑]-3'(4'h)-酮(21.88mg),[1,1'-双(二苯基膦)二茂铁]二氯化钯二氯甲烷络合物 (3.5mg),磷酸钾(27.32mg)与1,4-二氧六环(0.8ml)和水(0.2ml)混合,加热至80℃ 搅拌4小时。反应完毕将反应液浓缩至干,粗品制备色谱纯化(色谱柱:xbridge prep obd c18 column,30*150mm,5μm;流动相a:水(10mmol/l甲酸铵),流动相b:乙腈;流速:60ml/min; 梯度:20%b到55%b(0~8min),55%b;检测波长:220nm;保留时间(min):7.90;柱 温:25℃)得标题化合物11mg。
[0236]1h nmr(400mhz,dmso-d6):δ8.88(s,1h),8.41(s,1h),8.18(s,1h),8.04(s,1h),7.87(s, 1h),7.68
–
7.56(m,2h),7.46
–
7.25(m,5h),5.16(s,2h),3.85(d,j=9.8hz,2h),1.82
–
1.73(m, 2h),1.59
–
1.42(m,2h).
[0237]
ms(esi+):598.05(m+h).
[0238]
生物活性测试
[0239]
一、mat2a酶学测试方法
[0240]
1.实验步骤
[0241]
a)首先配制5
×
mat2a测试缓冲液(250mm tris-hcl,ph8.0;250mm kcl;75mm mgcl2; 0.025%bsa;0.05%brij35;1.5mm edta),部分稀释至1
×
备用;
[0242]
b)mat2a酶(bps,71401)配制及加入:用1
×
mat2a测试缓冲液将mat2a酶配制 成3.674ng/μl(1.67
×
,终浓度2.20ng/μl),使用biotek(multiflo fx)自动分液仪,化合 物测试孔和阴性对照孔分别加入15μl 1.67
×
mat2a酶溶液,同时在空白对照孔中加入15μl 的1
×
mat2a测试缓冲液;
[0243]
c)化合物配制及加入:使用dmso将待测化合物从10mm储备液稀释至100μm,阳性药 agi-24512同样条件稀释,使用tecan化合物滴定仪(d300e)按照预设浓度梯度,自动喷入 每孔,喷入体积极微量可忽略不计。浓度梯度起始为1μm,1/2log稀释,共设8个梯度。2500rpm 离心30s,25℃孵育30min;
[0244]
d)atp配制:使用1
×
mat2a测试缓冲液将10mm atp(sigma,a7699)稀释至700μm 备用;
[0245]
e)底物和atp混合液的配制及加入:5
×
mat2a测试缓冲液,3μl/孔;750μm l-蛋氨 酸(adamas,01100469),2.5μl/孔;700μm atp,2.5μl/孔;双蒸水,2μl/孔。根据检测孔 数配制所需混合液的总量,使用biotek(multiflo fx)自动分液仪每孔加入10μl;2500rpm 离心30s,25℃反应150min;
[0246]
f)biomol green检测试剂加入:使用biotek(multiflo fx)自动分液仪每孔加入50μl biomol green(enzo,bml-ak111),2500rpm离心30s,25℃孵育20min;
[0247]
g)反应结束后,使用perkin elmer(envision 2105)多功能读板仪读取od
620
值。
[0248]
2.数据分析
[0249]
抑制率计算公式如下:
[0250][0251]
其中,
[0252]
%inhibition:抑制率%
[0253]
odsample:样品孔的od620值;
[0254]
odmin:代表无酶无待测化合物的空白对照孔od620均值;
[0255]
odmax:代表有酶、无化合物的阴性对照孔od620均值。
[0256]
再使用graphpad prism 5软件log(inhibitor)vs.response-variable slope拟合量效曲线,得 到化合物对mat2a酶抑制的ic
50
值。
[0257]
二、细胞测试方法
[0258]
1.实验步骤
[0259]
hct116 mtap-/-细胞(购自horizon discovery):mtap基因缺失的人结直肠癌细胞株, 使用培养基rpmi 1640+10%fbs(fetal bovine serum,胎牛血清)培养。实验第0天,将对 数生长期的上述细胞的活细胞密度调整为5000个/ml,以100μl/孔的量接种至96孔板中,平 行设置空白组;将接种好的细胞板置于37℃,5%co2的培养箱中培养过夜。
[0260]
实验第1天,取出过夜培养的细胞板,弃去上清,每孔加入80μl无血清的rpmi 1640培 养基,置于培养箱中饥饿培养4h。将待测化合物溶解在dmso(dimethyl sulfoxide,二甲基 亚砜)中,制备得到10mm的化合物母液。饥饿结束后,取出细胞板,每孔补加80μl rpmi1640+20%fbs培养基;将细胞板放置在自动加液仪d300e(tecan)上,加药程序设置为: 化合物测试的最高浓度为30μm,使用dmso进行3倍浓度梯度稀释,共10个浓度,每个 浓度设置两个复孔,96孔板每孔的dmso终浓度为0.3%,v/v。取出预先配制好的10mm待 测化合物母液,运行上述加药程序进行加药。加药结束后,将细胞板置于培养箱中培养120h。
[0261]
实验第6天,取出细胞板,每孔加入50μl(购自promega),按照说明书 的操作流程在envision(perkinelmer)上测定荧光信号。
[0262]
2.数据分析
[0263]
使用graphpad prism 5软件拟合量效曲线:log(inhibitor)vs.response-variable slope,得到 化合物对细胞增殖抑制的ic50值。抑制率计算公式:
[0264][0265]
其中:
[0266]
受试物信号值:细胞+培养基+化合物组荧光信号均值;
[0267]
空白组信号值:培养基组荧光信号均值;
[0268]
阴性对照组信号值:细胞+培养基组荧光信号均值。
[0269]
三、实验结果:
[0270]
根据上述实验方法测得agi-24512抑制mat2a的ic
50
为23.2nm,对hct116 mtap-/
‑ꢀ
细胞抑制的ic
50
为153.6nm。
[0271]
根据被测化合物抑制mat2a的ic
50
大小给予以下评分等级:(a)ic
50
小于50nm,(b)ic
50
在50nm和200nm之间,(c)ic
50
在200nm和1000nm之间,(d)ic
50
大于1000nm。
[0272]
根据被测化合物抑制hct116 mtap-/-细胞的ic
50
大小给予以下评分等级:(a)ic
50
小于 150nm,(b)ic
50
在150nm和400nm之间,(c)ic
50
在400nm和1000nm之间,(d)ic
50
大于 1000nm。
[0273]
本发明化合物的实验结果如下表所示:
[0274][0275]
注:
‑‑‑
是代表未测试
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1