结合CS1蛋白兔重组单克隆抗体及应用的制作方法
结合cs1蛋白兔重组单克隆抗体及应用
技术领域
1.本发明属于生物技术领域,特别是涉及能特异结合cs1蛋白的兔重组单克隆抗体及应用。
背景技术:
2.表面抗原cd319,是靶向信号淋巴细胞激活分子家族成员7(signaling lymphocytic activation molecule f7 ,slamf7),又称为cs1,它是一种表达于骨髓瘤细胞表面的糖蛋白,同时也表达于自然杀伤细胞和浆细胞表面,在造血谱系分化细胞的特定免疫细胞亚群种也有低量表达。 cs1是多发性骨髓瘤中正常浆细胞和恶性浆细胞的强标记物。目前,cs1是免疫治疗多发性骨髓瘤的热门靶点之一。另外,有研究发现cs1是否存在于病人的癌症中可能有助于一开始确定cd47抑制剂是否是一种好的治疗选择。因此,开发cs1的单克隆抗体对于多发性骨髓瘤的诊断和治疗具有重要的价值。
3.目前现有技术中,已经开发了靶向cs1的抗体。例如中国专利申请cn 2004800164542公开了抗cs1抗体的治疗用途,cn2009801458197公开了抗cs1抗体用于治疗罕见淋巴瘤的用途。虽然上述抗体也具有一定的应用前景,但是仍然需要开发亲和力更强、表位更多的单克隆抗体。
4.
技术实现要素:
5.本发明目的在于提供能特异结合cs1蛋白的兔重组单克隆抗体,选自以下兔重组单克隆抗体的一种或多种:命名为1d12的兔重组单克隆抗体:其重链互补决定区cdr1、cdr2、cdr3的氨基酸序列分别为seq id no:1、seq id no:2、seq id no:3所示的氨基酸序列;且轻链互补决定区cdr1、cdr2、cdr3的氨基酸序列分别为seq id no:4,seq id no:5、seq id no:6所示的氨基酸序列;命名为1h2的兔重组单克隆抗体:其重链互补决定区cdr1、cdr2、cdr3的氨基酸序列分别为seq id no:10、seq id no:11、seq id no:12所示的氨基酸序列,且轻链互补决定区cdr1、cdr2、cdr3的氨基酸序列分别为seq id no:13、seq id no:14、seq id no:15所示的氨基酸序列;命名为2b3的兔重组单克隆抗体,其重链互补决定区cdr1、cdr2、cdr3的氨基酸序列分别为seq idno:19、seq id no:20、seq id no:21所示的氨基酸序列,且轻链互补决定区cdr1、cdr2、cdr3的氨基酸序列分别为seq id no:22、seq id no:23、seq id no:24所示的氨基酸序列;在上述技术方案的基础上,命名为1d12的兔重组单克隆抗体,其重链可变区序列为seq id no:7所示的氨基酸序列,且轻链可变区序列为seq id no:8所示的氨基酸序列;命名为1h2的兔重组单克隆抗体,其重链可变区序列为seq id no:16所示的氨基
酸序列,且轻链可变区序列为seq id no:17所示的氨基酸序列;命名为2b3的兔重组单克隆抗体,其重链可变区序列为seq id no:25所示的氨基酸序列,且轻链可变区序列为seq id no:26所示的氨基酸序列;在上述技术方案的基础上,命名为1d12的兔重组单克隆抗体,其scfv序列为seq id no:9所示的氨基酸序列;命名为1h2的兔重组单克隆抗体,其scfv序列为seq id no:18所示的氨基酸序列;命名为2b3的兔重组单克隆抗体,其scfv序列为seq id no:27所示的氨基酸序列;在上述技术方案的基础上,兔重组单克隆抗体的轻链恒定区为κ链,重链恒定区为igg型。
6.本发明还提供一种核酸分子,其包含能够编码结合cs1蛋白的兔重组单克隆抗体的重链互补决定区或轻链互补决定区的核酸序列。
7.本发明还提供一种载体,其含有上述核酸分子。
8.本发明还提供一种宿主细胞,该宿主细胞含有上述结合cs1蛋白的兔重组单克隆抗体、上述核酸分子或上述载体。
9.本发明还提供一种偶联物,含有上述抗体。
10.本发明还提供一种药物组合物,含有主成分和辅成分,其中:主成分上述结合cs1蛋白的兔重组单克隆抗体、上述核酸分子、上述载体、上述宿主细胞、上述偶联物中的一种或多种,辅成分选自药学上可接受的载体或赋形剂,以及任选的其它生物活性物质。
11.本发明还提供上述结合cs1蛋白的兔重组单克隆抗体、上述核酸分子、上述载体、上述宿主细胞、上述偶联物在制备治疗疾病的药物或检测试剂中的应用。
12.本发明还提供一种试剂盒,该试剂盒包含上述结合cs1蛋白的兔重组单克隆抗体。
13.与现有技术相比,本发明具有以下优点和有益效果:目前针对cs1单克隆抗体的还没有兔源的,由于兔源抗体的亲和力较鼠源的要高,而且兔子的免疫过程相较于鼠更复杂,可以得到更多表位的抗体,因此,本发明利用b细胞克隆技术提供结合cs1蛋白的兔重组单克隆抗体,重要的是结合cs1蛋白的兔重组单克隆抗体亲和力高,具有良好的特异性,特别是该抗体可以通过流式方式识别天然细胞膜上的cs1蛋白,因此,一方面可以弥补市场上结合cs1蛋白的兔重组单克隆抗体的诊断应用,同时,后期可进行人源化后开发针对cs1靶点的嵌合抗原受体(car-t)或双特异性抗体或抗体偶联药物等进行相关疾病的治疗。
附图说明
14.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
15.图1显示了cs1蛋白的sds电泳图。
16.图2 显示了表达纯化的cs1兔重组单克隆抗体的sds电泳图。
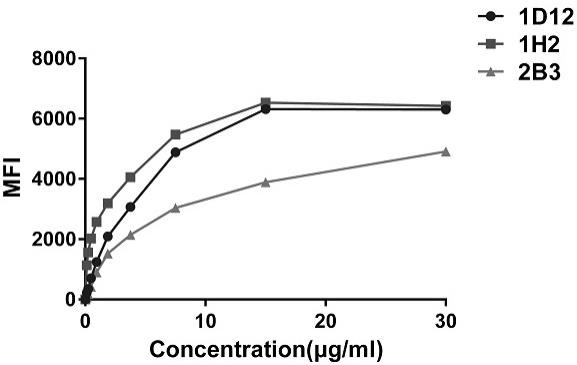
17.图3显示了facs检测cs1兔重组单克隆抗体的结合力。
18.图4-6显示了facs检测cs1兔重组单克隆抗体的的特异性性。
具体实施方式
19.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
20.以下对本发明做进一步描述:在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的蛋白质和核酸化学、分子生物学、细胞和组织培养、微生物学、免疫学相关术语和实验室操作步骤均为相应领域内广泛使用的术语和常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
21.这里提到的术语“抗体”包括完整抗体及其任何抗原结合片段 (即“抗原结合部分”)或单链。“抗体”是指包含通过二硫键互相连接在一起的至少两条重(h)链和两条轻(l)链的糖蛋白,或其抗原结合部分。每条重链由重链可变区和重链恒定区组成。本发明中涉及的蛋白或其片段可以是天然纯化的产物,或是化学合成的产物,或使用重组技术从真核宿主(例如哺乳动物细胞)中产生。本发明所用原料及试剂均可由市场购得。
22.下面结合实施例,进一步阐述本发明的技术方案。
23.实施例:(1)cs1蛋白的制备:本发明构建了cs1 fc融合标签蛋白真核表达质粒,转染293f细胞5天后,收集细胞培养基上清,利用proteina树脂进行纯化,并对蛋白的浓度进行鉴定,蛋白表达纯化鉴定结果见图1。
24.(2)免疫动物外周血单个核细胞(即pbmc细胞)的获取:选择新西兰大白兔作为免疫动物。第一次免疫时将250μg cs1蛋白与等体积的完全弗氏佐剂进行乳化,对新西兰大白兔皮下背部多点进行注射,21天后进行第二次免疫,将120μg的蛋白与等体积的不完全弗氏佐剂进行乳化,对新西兰大白兔背部皮下注射,21天后进行第三次免疫,将120μg的蛋白与等体积的不完全弗氏佐剂进行乳化,对新西兰大白兔背部皮下注射。第三次免疫后间隔一周,无菌采集外周血。
25.(3)cs1特异性b淋巴细胞的获取:用淋巴细胞分离液将所采集的外周血中的pbmc细胞分离出来;按照免疫磁珠操作说明,将cs1蛋白偶联到磁珠上;将cs1蛋白偶联的磁珠与分离出的pbmc细胞共同室温孵育50min后的混合物放入磁力架中,5min后磁珠全部沉入底部,弃掉上清,加入无菌的pbs洗涤细胞,重复洗细胞3次,最后分离得到的细胞即为cs1特异性的b淋巴细胞。
26.(4)b淋巴细胞的鉴定:将分离获得的b淋巴细胞进行一定倍数的稀释后置入96孔细胞培养板,加入含10%胎牛血清(fbs)和2μg/ml的人il2的1640培养基,37℃ 5% co2条件下培养6天。收集培养基上清进行抗体的鉴定。
27.间接elisa鉴定:包被浓度为1μg/ml的cs1蛋白,100μl/孔,4℃孵育16h;次日弃掉包被液后用含1%牛血清白蛋白(bsa)的pbs进行封闭,150μl/孔,37℃孵育1h。弃掉封闭液,加入b细胞上清,50μl/孔,37℃孵育1h。弃掉b细胞上清,用含0.5wt.%的tween-20的pbs洗板5次,2min/次,最后加入稀释5000倍的羊抗兔igg-hrp二抗,37℃孵育1h。弃掉二抗,用磷酸盐吐温缓冲液
(pbst)洗板5次,2min/次。弃掉洗涤液,拍干,加入底物进行显色。标记为1d12、1h2、2b3的b细胞克隆elisa鉴定为阳性,检测结果见表1。
28.表1. elisa检测结果克隆号od450值1d122.131h21.522b32.03(5)抗体基因的克隆对经鉴定为阳性的b细胞进行收集,利用常规的rna提取方法提取rna后,反转录为cdna,利用抗体重链的基因引物即:上游引物5
’‑
cagtcgctggaggagtccgg-3’和下游引物5
’‑
ccattggtgagggtgcccgag-3’,抗体轻链基因的引物即:上游引物5
’‑
gacattgtgatgacccagac-3’和下游引物5
’‑
ccacctcggtcccttcgccg-3’,对抗体重轻链基因进行扩增,其扩增条件为:94℃ 3min进行变性,(95℃ 1min,56℃ 30s,72℃1min)进行30个循环反应,最后72℃延伸10min(pcr扩增结果见图2)。利用dna胶纯化回收试剂盒将pcr产物进行回收。将兔重组单克隆抗体的重轻链基因克隆至表达载体后进行转化,利用菌落pcr验证单菌落,将阳性菌落进行基因测序,即可获得特异性抗体的基因序列。对特异性抗体的基因序列按照密码子翻译即可得到特异性抗体各区域的氨基酸序列。通过标记为1d12,1h2,2b3的b淋巴细胞最终所获得的特异性抗体的氨基酸序列见表2所示。
29.表2. 特异性抗体的氨基酸序列
seqidno.命名形式/来源类型序列11d12vhcdr1aagfslssyg21d12vhcdr2aaintdgst31d12vhcdr3aaargypgyitdsyyyfni41d12vlcdr1aaqsissy51d12vlcdr2aaras61d12vlcdr3aaqctygtfhssgyg71d12vhaaqsveesggrlvtpgtpltltctvsgfslssygmiwvrqapgkglewigsintdgstyyatwakgrftisrtsttvdlkitspttedtatyfcargypgyitdsyyyfniwgpgtlvtvs81d12vlaadvvltqtpasveaavrgtvtikcqasqsissylswyqqkpgqppklliyrastlesgvpsrfkgsgsgteftltitdlecadaatyycqctygtfhssgygfgggtgvvvk91d12scfvaaqsveesggrlvtpgtpltltctvsgfslssygmiwvrqapgkglewigsintdgstyyatwakgrftisrtsttvdlkitspttedtatyfcargypgyitdsyyyfniwgpgtlvtvsdvvltqtpasveaavrgtvtikcqasqsissylswyqqkpgqppklliyrastlesgvpsrfkgsgsgteftltitdlecadaatyycqctygtfhssgygfgggtgvvvk101h2vhcdr1aagfslsnyg11 vhcdr2aaigtigat12 vhcdr3aaargiygdiyvyafdi13 vlcdr1aaqsvrdngd14 vlcdr2aadvs15 vlcdr3aaaggyiagsdrwv
16 vhaaqsveesrgglikptdtltltctvsgfslsnygvswvrqapgngleyigfigtigatlyanwaksrstitrntnlntvtlkmtsltaadtatyfcargiygdiyvyafdiwgpgtlvtvss17 vlaaaavltqtpspvsaavggtvtiscqasqsvrdngdlawyqqkpgqppklliydvsalasgvpsrfkgrgsgtqftltisdlecddaatyscaggyiagsdrwvfgggtevvvk18 scfvaaqsveesrgglikptdtltltctvsgfslsnygvswvrqapgngleyigfigtigatlyanwaksrstitrntnlntvtlkmtsltaadtatyfcargiygdiyvyafdiwgpgtlvtvssaavltqtpspvsaavggtvtiscqasqsvrdngdlawyqqkpgqppklliydvsalasgvpsrfkgrgsgtqftltisdlecddaatyscaggyiagsdrwvfgggtevvvk192b3vhcdr1aagfslsaya20 vhcdr2aaisdsast21 vhcdr3aaarayyvvdndspfnm22 vlcdr1aaeniyss23 vlcdr2aaaas24 vlcdr3aaqsyydtgrasfa25 vhaaqsveesggrlvtpgtpltltctvsgfslsayamgwfrqapgkgleyigiisdsastfyatwakgrftisrtsstmvdlkmtspttedtatyfcarayyvvdndspfnmwgpgtvvtvs26 vlaavmtqtpssvsaavggtvtincqaseniysslawyqqkpgqppklliyaasklesgvpsrfkgsrsetdftltisdlecddaatyycqsyydtgrasfafgggtevvvk27 scfvaaqsveesggrlvtpgtpltltctvsgfslsayamgwfrqapgkgleyigiisdsastfyatwakgrftisrtsstmvdlkmtspttedtatyfcarayyvvdndspfnmwgpgtvvtvsvmtqtpssvsaavggtvtincqaseniysslawyqqkpgqppklliyaasklesgvpsrfkgsrsetdftltisdlecddaatyycqsyydtgrasfafgggtevvvk
(6)cs1兔重组单克隆抗体的生产和鉴定将抗体的重轻链基因的表达质粒共转染入293细胞,37℃ 5% co2培养条件下培养72h,收集细胞上清,利用proteina树脂进行抗体的纯化,纯化后的抗体进行sds电泳鉴定,结果见图3。
30.纯化后的抗体进行功能鉴定,具体如下:a) elisa反应包被浓度为1μg/ml的cs1蛋白,100μl/孔,4℃孵育16h;次日弃掉包被液后用含1%bsa的pbs进行封闭,150μl/孔,37℃孵育1h。弃掉封闭液,加入不同倍比稀释的抗体,50μl/孔,37℃孵育1h。弃掉抗体,用含0.5%的tween-20的pbs洗板5次,2min/次,最后加入稀释5000倍的羊抗兔igg-hrp二抗,37℃孵育1h。弃掉二抗,用pbst洗板5次,2min/次。弃掉洗涤液,拍干,加入底物进行显色。elisa检测结果见表2。
31.表2. elisa测试结果稀释倍数2b31d121h21koverflowoverflow3.95425k3.9519overflow3.82725k2.90853.44632.3875125k0.97952.02471.1844
625k0.2760.52210.32023125k0.16110.20940.152715625k0.10850.12450.1101blank0.10320.09110.0978b) 基于流式结合力测定方法用raji细胞进行测试。即收集细胞于离心管中,采用无菌的pbs洗细胞两次,采用fc受体封闭液进行细胞表面fc受体的封闭,4℃孵育30min。离心收集细胞,用含0.5wt.%bsa的pbs洗细胞两次,加入不同浓度的抗体,4℃孵育30min。再用含0.5wt.%bsa的pbs洗细胞两次,最后加入羊抗兔igg-488荧光二抗于4℃孵育30min。用含0.5wt.%bsa的pbs洗细胞两次后,加入200μl含0.5wt.%bsa的pbs重悬细胞,流式机器上机测试。流式测定结合力结果见图4。流式结合力分析显示所筛选的抗体具有不同的结合力。
32.c) 基于流式特异性测定方法用293细胞转染cs1全长蛋白质粒进行测试。即收集转染细胞于离心管中,采用无菌的pbs洗细胞两次,采用fc受体封闭液进行细胞表面fc受体的封闭,4℃孵育30min。离心收集细胞,用含0.5wt.%bsa的pbs洗细胞两次,加入不同浓度的抗体,4℃孵育30min。再用含0.5wt.%bsa的pbs洗细胞两次,最后加入羊抗兔igg-488荧光二抗于4℃孵育30min。用含0.5wt.%bsa的pbs洗细胞两次后,加入200μl含0.5wt.%bsa的pbs重悬细胞,流式机器上机测试。流式测试特异性结果见图5-图7。通过分析结果可见所筛选的抗体可以特异性识别细胞膜上cs1。
33.以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1