一种丙二腈类化合物及其应用
1.本发明属农用杀菌剂领域。具体地涉及一种丙二腈类化合物及其应用。
背景技术:
2.专利us3309396a及de2758115a1分别公开了如下通式化合物,但没有报道任何具体活性数据。
3.现有技术中,如本发明所示的丙二腈类化合物及其杀菌活性未见报道。
技术实现要素:
4.本发明的目的是提供一种结构新颖的丙二腈类化合物。它可用于制备农业和其它领域中防治病菌的药物。
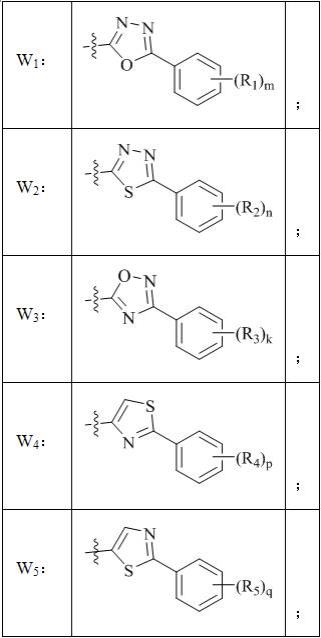
5.本发明的技术方案如下:一种丙二腈类化合物,如通式i所示:通式i通式i中:w选自w
1-w5所示基团之一:
r1、r2、r3、r4、r5各自独立地选自氢、卤素、氰基、硝基、c
1-c6烷基、卤代c
1-c6烷基、c
3-c6环烷基、c
1-c6烷氧基、卤代c
1-c6烷氧基、c
1-c6烷硫基或卤代c
1-c6烷硫基;m、n、k、p、q各自独立地选自0、1、2、3、4或5。
6.本发明中较优选的化合物为:通式i中,w选自w
1-w5所示基团之一;r1、r2、r3、r4、r5各自独立地选自氢、卤素、氰基、硝基、c
1-c4烷基、卤代c
1-c4烷基、c
3-c6环烷基、c
1-c4烷氧基、卤代c
1-c4烷氧基、c
1-c4烷硫基或卤代c
1-c4烷硫基;m、n、k、p、q各自独立地选自0、1、2、3、4或5。
7.本发明中进一步优选的化合物为:通式i中,w选自w
1-w5所示基团之一;r1、r2、r3、r4、r5各自独立地选自氢、氟、氯、溴、氰基、硝基、甲基、乙基、正丙基、异丙基、环丙基、正丁基、异丁基、仲丁基、叔丁基、一氯甲基、二氯甲基、三氯甲基、一溴甲基、二溴甲基、三溴甲基、一氟甲基、二氟甲基、三氟甲基、2, 2, 2-三氟乙基、七氟异丙基、甲氧
基、乙氧基、正丙氧基、异丙氧基、二氟甲氧基、三氟甲氧基、甲硫基、乙硫基、三氟甲硫基或2, 2, 2-三氟乙硫基;m、n、k、p、q各自独立地选自0、1、2、3、4或5。
8.或者,本发明中较优选的化合物为:通式i中,w选自w
1-w5所示基团之一;(r1)m、(r2)n、(r3)k、(r4)
p
、(r5)q各自独立地选自如下表1中所示的取代基:表1表1
。
9.上面给出的通式化合物的定义中,汇集所用术语一般代表如下取代基:卤素:指氟、氯、溴或碘。
10.烷基:直链或支链烷基,例如甲基、乙基、正丙基、异丙基或不同的丁基、戊基或己基异构体。
11.卤代烷基:直链或支链烷基,在这些烷基上的氢原子可部分或全部被卤素所取代,例如氯甲基、二氯甲基、三氯甲基、氟甲基、二氟甲基、三氟甲基、七氟异丙基等。
12.环烷基:取代或未取代的环状烷基,例如环丙基、环戊基或环己基;取代基如甲基、卤素等。
13.烷氧基:直链或支链烷基,经氧原子键连接到结构上,例如甲氧基、乙氧基、叔丁氧基等。
14.卤代烷氧基:直链或支链烷氧基,在这些烷氧基上的氢原子可部分或全部被卤素所取代,例如氯甲氧基、二氯甲氧基、三氯甲氧基、氟甲氧基、二氟甲氧基、三氟甲氧基、氯氟甲氧基、三氟乙氧基等。
15.烷硫基:直链或支链烷基,经硫原子键连接到结构上,例如甲硫基、乙硫基等。
16.卤代烷硫基:直链或支链烷硫基,在这些烷硫基上的氢原子可部分或全部被卤素所取代,例如二氟甲硫基、三氟乙硫基等。
17.上述通式i的w
1-w5部分中所示的阿拉伯数字1、2、3、4、5、6表示取代基在苯环上的具体取代位置。
18.本发明部分通式i化合物如表2~表6所示,但本发明绝非仅限于这些化合物。
19.通式i中,当w=w1时,通式i可以通式i-w1表示:表2:通式i-w1中,(r1)m为不同的取代基见表2,代表化合物编号为1.1-1.321。
20.表2
通式i中,当w=w2时,通式i可以通式i-w2表示:表3:通式i-w2中,(r2)n为不同的取代基见表3,代表化合物编号为2.1-2.321。
21.表3表3
通式i中,当w=w3时,通式i可以通式i-w3表示:表4:通式i-w3中,(r3)k为不同的取代基见表4,代表化合物编号为3.1-3.321。
22.表4
通式i中,当w=w4时,通式i可以通式i-w4表示:
表5:通式i-w4中,(r4)
p
为不同的取代基见表5,代表化合物编号为4.1-4.321。
23.表5表5
通式i中,当w=w5时,通式i可以通式i-w5表示:表6:通式i-w5中,(r5)q为不同的取代基见表6,代表化合物编号为5.1-5.321。
24.表6表6
本发明的通式i化合物可按照以下方法制备(式中各基团除另有说明外定义同前):
通式ii化合物与邻苯二甲酰亚胺钾在适宜的溶剂中,在温度从-10
°
c到溶剂沸点下反应0.5-48小时可制得通式iii化合物。适宜的溶剂可为二氯甲烷、乙酸乙酯、乙腈、二氧六环、thf、dmf或dmso等。
25.通式iii化合物通过水合肼经常规还原可制得通式iv化合物。
26.通式iv化合物与乙氧基亚甲基丙二腈,在温度从-10
°
c到溶剂沸点下反应0.5-48小时制得通式i化合物。适宜的溶剂可为二氯甲烷、氯仿、四氯化碳、己烷、苯、甲苯、甲醇、乙醇、乙酸乙酯、乙腈、二氧六环、thf、dmf或dmso等。
27.原料通式ii化合物可以按公知方法制备:(1)当w=w1时,可参照wo2001047926、cn109810071、european journal of medicinal chemistry, 46(4), 1367-1373; 2011或huaxue shiji, 26(2), 99-100, 102; 2004等所描述的方法制备;(2)当w=w2时,可参照wo2019104011、cn104844532、cn105017242、journal of agricultural and food chemistry, 53(8), 3120-3125; 2005或european journal of medicinal chemistry, 113, 246-257; 2016等所描述的方法制备;(3)当w=w3时,可参照wo2012129564、cn101817799、cn108912114、new journal of chemistry, 41(13), 5875-5883; 2017、pharmaceutical chemistry journal, 50(4), 234-238; 2016、journal of medicinal chemistry, 56(10), 3783-3805; 2013、european journal of medicinal chemistry, 96, 1-13; 2015或european journal of medicinal chemistry, 48, 296-304; 2012等所描述的方法制备;(4)当w=w4时,可参照wo2006002099、wo2005040158、journal of heterocyclic chemistry, 54(6), 3395-3402; 2017、heterocyclic communications, 23(6), 455-460; 2017或journal of medicinal chemistry, 57(8), 3213-3222; 2014等所描述的方法制备;(5)当w=w5时,可参照wo2020039027、wo2017152032、wo2009000533或wo2004020420等所描述的方法制备。
28.本发明的化合物用于控制植物细菌病害的用途,可用于防治多种植物细菌性病害,例如青枯病、细菌性疫病、溃疡病、软腐病、细菌性角斑病、细菌性条斑病、叶枯病、野火病和细菌性疮痂病等。
29.本发明的化合物也可用于防治在多种作物上由卵菌纲、担子菌纲、子囊菌和半知菌类等多种真菌引起的病害,例如在较低剂量下对黄瓜霜霉病、黄瓜灰霉病、黄瓜炭疽病、黄瓜白粉病、番茄早疫病、番茄晚疫病、辣椒疫病、葡萄霜霉病、葡萄白腐病、苹果轮纹病、苹果斑点落叶病、水稻纹枯病、水稻稻瘟病、小麦锈病、小麦叶斑病、小麦白粉病、油菜菌核病、玉米小斑病等病害都有着很好的防效。
30.本发明还提供了一种杀菌组合物,该组合物中还有通式i的化合物和农业上可接受的载体,组合物中活性组分的重量百分含量为0.1-99%。
31.本发明还提供了如上所定义的组合物的制备方法:将通式i的化合物与载体混合。这种组合物可以为含本发明的单一化合物或几种化合物的混合物。
32.本发明组合物中的载体系满足下述条件的物质:它与活性成分配置后便与施用于
待处理的位点,例如可以是植物、种子或土壤;或者有利于贮存、运输或操作。载体可以是固体或液体,包括通常为气体但已压缩成液体的物质,通常在配制杀虫、杀菌组合物中所用的载体均可使用。
33.合适的固体载体包括天然或合成的粘土或硅酸盐,例如硅藻土、滑石、硅镁土、硅酸铝(高岭土)、蒙脱石、云母;碳酸钙;硫酸钙;硫酸铵;合成氧化硅、合成硅酸钙或硅酸铝;元素如碳、硫;天然的或合成的树脂如苯并呋喃树脂、聚氯乙烯、苯乙烯聚合物或共聚物;固体多氯苯酚;沥青;蜡如蜂蜡、石蜡。
34.合适的液体载体包括水;醇如异丙醇、乙醇;酮如丙酮、甲基乙基酮、甲基异丙基酮、环己基酮;醚;芳烃如苯、甲苯、二甲苯;石油馏分如煤油、矿物油;氯代烃如四氯化碳、全氯乙烯、三氯乙烯。通常,这些液体的混合物也是合适的。
具体实施方式
35.合成实施例按照上述记载的合成路线,采用不同的原料化合物,即可分别制备获得本发明通式i所示化合物,进一步具体描述如下:实施例1:化合物1.25的制备合物1.25的制备(1)2-((5-(4-甲基苯基)-1, 3, 4-噁二唑-2-基)甲基)异吲哚啉-1, 3-二酮(中间体iii-1)的合成称取2-(氯甲基)-5-(4-甲基苯基)-1,3,4-噁二唑(中间体ii-1)4.00 g (19.23 mmol)、邻苯二甲酰亚胺钾4.27 g (23.08 mmol),加入30 ml n,n-二甲基甲酰胺,室温下搅拌反应。tlc监测反应完毕后,将反应液滴入100 ml冰水混合物中,并不断搅拌,直至有固体析出,然后经抽滤、烘干,得到产物2-((5-(4-甲基苯基)-1, 3, 4-噁二唑-2-基)甲基)异吲哚啉-1, 3-二酮5.78 g,收率94.22%。
36.(2)(5-(4-甲基苯基)-1, 3, 4-噁二唑-2-基)甲胺(中间体iv-1)的合成称取2-((5-(4-甲基苯基)-1, 3, 4-噁二唑-2-基)甲基)异吲哚啉-1, 3-二酮(中间体iii-1)5.00 g (15.67 mmol),加入40 ml乙醇,再加入质量分数为80%的水合肼7.85 g (125.45mmol),室温下搅拌反应。tlc监测反应完毕后,将反应液抽滤,滤液静置待有固体析出后再抽滤,重复此操作直至滤液无固体析出。将滤液减压脱溶后得白色固体2.89 g,即产物(5-(4-甲基苯基)-1, 3, 4-噁二唑-2-基)甲胺;收率97.56%。
328.11(m-h)-.化合物1.16:黄色固体。1h nmr (600 mhz, chloroform-d) δ 7.93
ꢀ–ꢀ
7.89 (m, 2h), 7.79
ꢀ–ꢀ
7.74 (m, 2h), 7.52 (d, 1h), 6.65 (br s, 1h), 4.81 (d, 2h). lc-ms(m/z, esi): 378.1(m+h)
+
.化合物1.19:黄色固体。1h nmr (600 mhz, chloroform-d) δ 7.89 (d, 1h), 7.56 (d, 1h), 7.47 (t, 1h), 7.40
ꢀ–ꢀ
7.32 (m, 2h), 7.07(br s, 1h), 4.83 (d, 2h), 2.70 (s, 3h). lc-ms(m/z, esi): 266.11(m+h)
+
.化合物1.22:黄色固体。1h nmr (600 mhz, chloroform-d) δ 7.87 (s, 1h), 7.85
ꢀ–ꢀ
7.82 (m, 1h), 7.56-7.50 (m, 1h), 7.45
ꢀ–ꢀ
7.38 (m, 2h), 6.71 (br s, 1h), 4.82 (d, 2h), 2.45 (s, 3h). lc-ms(m/z, esi): 266.13(m+h)
+
.化合物1.39:黄色固体。1h nmr (600 mhz, chloroform-d) δ 7.94 (dd, 1h), 7.59
ꢀ–ꢀ
7.52 (m, 2h), 7.13
ꢀ–ꢀ
7.07 (m, 2h), 6.57 (br s, 1h), 4.82 (d, 2h), 3.97 (s, 3h).化合物1.40:黄色固体。1h nmr (600 mhz, chloroform-d) δ 8.32 (s, 1h), 8.27 (d, 1h), 7.87 (d, 1h), 7.72 (t, 1h), 7.54 (d, 1h), 6.58 (br s, 1h), 4.85 (d,2h). lc-ms(m/z, esi): 318.15(m-h)-.化合物1.45:黄色固体。1h nmr (600 mhz, chloroform-d) δ 8.00
ꢀ–ꢀ
7.91 (m, 2h), 7.55 (d, 1h), 7.14-7.06(br s, 1h), 7.05
ꢀ–ꢀ
6.99 (m, 2h), 4.80 (d, 2h), 3.89 (s, 3h). lc-ms(m/z, esi): 280.05(m-h)-.化合物1.68:黄色固体。1h nmr (600 mhz, chloroform-d) δ 7.97 (d, 1h), 7.62 (d, 1h), 7.53(d, 1h), 7.45 (dd, 1h), 6.48(br s, 1h), 4.84 (d, 2h). lc-ms(m/z, esi): 320.66(m+h)
+
.化合物1.71:黄色固体。1h nmr (600 mhz, chloroform-d) δ 8.01 (d, 1h), 7.56
ꢀ–ꢀ
7.48 (m, 3h), 6.54 (br s, 1h), 4.85 (d, 2h).化合物1.321:黄色固体。1h nmr (600 mhz, dmso-d6) δ 9.69 (dt, 1h), 8.16 (d, 1h), 8.03
ꢀ–ꢀ
7.98 (m, 2h), 7.68
ꢀ–ꢀ
7.60 (m, 3h),4.87 (d, 2h). lc-ms(m/z, esi): 252.3(m+h)
+
.实施例2:化合物2.7的制备实施例2:化合物2.7的制备
(1)2-((5-(4-氟苯基)-1, 3, 4-噻二唑-2-基)甲基)异吲哚啉-1, 3-二酮(中间体iii-2)的合成称取2-(氯甲基)-5-(4-氟苯基)-1, 3, 4-噻二唑(中间体ii-2)1.40 g (6.14 mmol)、邻苯二甲酰亚胺钾1.36 g (7.37 mmol),加入15.00 ml n, n-二甲基甲酰胺,室温下搅拌反应。tlc监测反应完毕后,将反应液滴入35.00 ml冰水混合物中,并不断搅拌,直至有固体析出,然后经抽滤、烘干,得到产物2-((5-(4-氟苯基)-1, 3, 4-噻二唑-2-基)甲基)异吲哚啉-1, 3-二酮1.74 g,收率83.65%。
40.(2)(5-(4-氟苯基)-1, 3, 4-噻二唑-2-基)甲胺(中间体iv-2)的合成2-((5-(4-氟苯基)-1, 3, 4-噻二唑-2-基)甲基)异吲哚啉-1, 3-二酮(中间体iii-2)1.74 g (5.13 mmol),加入20 ml乙醇,再加入质量分数为80%的水合肼3.23 g (51.62 mmol),室温下搅拌反应。tlc监测反应完毕后,将反应液抽滤,滤液静置待有固体析出后再抽滤,重复此操作直至滤液无固体析出。将滤液减压脱溶后得黄色固体1.02 g,即产物(5-(4-氟苯基)-1, 3, 4-噻二唑-2-基)甲胺;收率95.07%。
41.(3)目标化合物2.7的合成称取(5-(4-氟苯基)-1, 3, 4-噻二唑-2-基)甲胺(中间体iv-2)1.02 g (4.88 mmol)、乙氧基亚甲基丙二腈0.54 g (4.39 mmol),加入20 ml乙腈,室温下搅拌反应。tlc监测反应完毕后,经减压脱溶、柱层析纯化后得到淡黄色固体0.91 g,即目标化合物2.7;收率72.88%。
42.化合物2.7的核磁及质谱数据如下:1h nmr (600 mhz, chloroform-d) δ 7.99
ꢀ–ꢀ
7.93 (m, 2h), 7.56 (d, 1h), 7.21 (td, 2h), 6.92 (br s, 1h), 4.96 (d, 2h). lc-ms(m/z, esi): 285..97(m+h)
+
.参照实施例2化合物2.7的制备方法,同样可制得目标化合物2.8、2.25、2.43、2.321。
43.化合物2.8、2.25、2.43、2.321的物化性状、核磁及质谱数据如下:化合物2.8:白色固体。1h nmr (600 mhz, chloroform-d) δ 7.93
ꢀ–ꢀ
7.88 (m, 2h), 7.54 (d, 1h), 7.52
ꢀ–ꢀ
7.48 (m, 2h), 6.65 (br s, 1h), 4.97 (d, 2h). lc-ms(m/z, esi): 301.79(m+h)
+
.化合物2.25:淡黄色固体。1h nmr (600 mhz, chloroform-d) δ 7.84 (d, 2h), 7.55 (d, 1h), 7.31 (d, 2h), 6.85 (br s, 1h), 4.95 (d, 2h), 2.43 (s, 3h). lc-ms(m/z, esi): 282.12(m+h)
+
.化合物2.43:白色固体。1h nmr (600 mhz, chloroform-d) δ 8.10 (d, 2h), 7.79 (d, 2h), 7.56 (d, 1h), 6.70 (br s, 1h), 4.99 (d, 2h). lc-ms(m/z, esi): 334.19(m-h)-.化合物2.321:黄色固体。1h nmr (600 mhz, chloroform-d) δ 7.98
ꢀ–ꢀ
7.94 (m, 2h), 7.59
ꢀ–ꢀ
7.49 (m, 4h), 6.78 (br s, 1h), 4.97 (d, 2h). lc-ms(m/z, esi): 268.07(m+h)
+
.实施例3:化合物3.8的制备
lc-ms(m/z, esi): 264.21(m-h)-.化合物3.43:白色固体。1h nmr (600 mhz, chloroform-d) δ 8.22 (d, 2h), 7.79 (d, 2h), 7.54 (d, 1h), 6.56 (br s, 1h), 4.83 (d, 2h).化合物3.45:白色固体。1h nmr (600 mhz, chloroform-d) δ 8.01 (d, 2h), 7.53 (d, 1h), 7.01 (d, 2h), 6.45 (br s, 1h), 4.86-4.71(m, 2h), 3.89 (s, 3h). lc-ms(m/z, esi): 282.02(m+h)
+
.化合物3.321:浅褐色固体。1h nmr (600 mhz, chloroform-d) δ 8.10
ꢀ–ꢀ
8.06 (m, 2h), 7.61
ꢀ–ꢀ
7.47 (m, 4h), 6.83 (br s, 1h), 4.79 (d, 2h). lc-ms(m/z, esi): 250.20(m-h)-.实施例4:化合物4.321的制备合物4.321的制备(1)2-((2-苯基噻唑-4-基)甲基)异吲哚-1, 3-二酮(中间体iii-4的合成)称取4-氯甲基-2-苯基噻唑(中间体ii-4)5.00 g (23.92 mmol)、邻苯二甲酰亚胺钾5.31 g (28.70 mmol),加入35.00 ml n, n-二甲基甲酰胺,室温下搅拌反应。tlc监测反应完毕后,将反应液滴入125.00 ml冰水混合物中,并不断搅拌,直至有固体析出,然后经抽滤、烘干,得到产物2-((2-苯基噻唑-4-基)甲基)异吲哚-1, 3-二酮6.20 g,收率80.94%。
48.(2)(2-苯基噻唑-4-基)甲胺(中间体iv-4)的合成称取2-((2-苯基噻唑-4-基)甲基)异吲哚-1, 3-二酮(中间体iii-4)6.20 g (19.37 mmol),加入43.00 ml乙醇,再加入质量分数为80%的水合肼9.70 g (153.36 mmol),室温下搅拌反应。tlc监测反应完毕后,将反应液抽滤,滤液静置待有固体析出后再抽滤,重复此操作直至滤液无固体析出。将滤液减压脱溶后得白色固体3.04 g,即产物(2-苯基噻唑
ꢀ‑
4-基)甲胺;收率82.61%。
49.(3)目标化合物4.321的合成称取(2-苯基噻唑-4-基)甲胺(中间体iv-4)3.00 g(15.78 mmol)、乙氧基亚甲基丙二腈1.73 g (14.21 mmol),加入21.00 ml乙腈,室温下搅拌反应。tlc监测反应完毕后,经减压脱溶、柱层析纯化后得到淡黄色固体2.58 g,即目标化合物4.321;收率68.25%。
50.化合物4.321的核磁及质谱数据如下:1h nmr (600 mhz, chloroform-d) δ 7.95
ꢀ–ꢀ
7.91 (m, 2h), 7.58 (d, 1h), 7.49
ꢀ–ꢀ
7.45 (m, 3h), 7.19 (s, 1h), 6.66 (br s, 1h), 4.62 (d, 2h). lc-ms(m/z, esi): 267.02(m+h)
+
.
参照实施例4化合物4.321的制备方法,同样可制得目标化合物4.8。
51.化合物4.8的物化性状、核磁及质谱数据如下:化合物4.8:白色固体。1h nmr (600 mhz, chloroform-d) δ 7.87 (d, 2h), 7.57 (d, 1h), 7.45 (d, 2h), 7.21 (s, 1h), 6.69 (br s, 1h), 4.61 (d , 2h). lc-ms(m/z, esi): 301.04(m+h)
+
.实施例5:化合物5.321的制备实施例5:化合物5.321的制备(1)2-((2-苯基噻唑-5-基)甲基)异吲哚-1, 3-二酮(中间体iii-5)的合成称取5-氯甲基-2-苯基噻唑(中间体ii-5)4.00 g (19.14 mmol)、邻苯二甲酰亚胺钾4.25 g (22.97 mmol),加入28.00 ml n, n-二甲基甲酰胺,室温下搅拌反应。tlc监测反应完毕后,将反应液滴入100 ml冰水混合物中,并不断搅拌,直至有固体析出,然后经抽滤、烘干,得到产物2-((2-苯基噻唑-5-基)甲基)异吲哚-1, 3-二酮4.92 g,收率80.26%。
52.(2)(2-苯基噻唑-5-基)甲胺(中间体iv-5)的合成称取2-((2-苯基噻唑-5-基)甲基)异吲哚-1, 3-二酮(中间体iii-5)4.50 g (14.06 mmol),加入31.50 ml乙醇,再加入质量分数为80%的水合肼7.04 g (112.50 mmol),室温下搅拌反应。tlc监测反应完毕后,将反应液抽滤,滤液静置待有固体析出后再抽滤,重复此操作直至滤液无固体析出。将滤液减压脱溶后得白色固体2.32 g,即产物(2-苯基噻唑-5-基)甲胺;收率86.89%。
53.(3)目标化合物5.321的合成称取(2-苯基噻唑-5-基)甲胺(中间体iv-5)2.30 g (12.10 mmol)、乙氧基亚甲基丙二腈1.33 g (10.89 mmol),加入16.10 ml乙腈,室温下搅拌反应。tlc监测反应完毕后,经减压脱溶、柱层析纯化后得到淡黄色固体2.09 g,即目标化合物5.321;收率72.07%。
54.化合物5.321的核磁及质谱数据如下:1h nmr (600 mhz, chloroform-d) δ 7.95
–ꢀ
7.91 (m, 2h), 7.75 (s, 1h), 7.50-7.46 (m, 1.8 hz, 3h), 7.44 (d, 1h), 6.45 (br s, 1h), 4.75 (d, 2h). lc-ms(m/z, esi): 267.1(m+h)
+
.参照以上实施例可以制备本发明通式i中其它化合物。
55.生物活性测定实施例6:稻瘟病和灰霉病筛选离体杀菌活性测定:采用高通量筛选方法,即将待测化合物样品用适合的溶剂(溶
剂的种类如丙酮、甲醇、dmf等,并且依据其对样品的溶解能力而选择)溶解,配制成所需浓度待测液。在超净工作环境下,将待测液加入到96孔培养板的微孔中,再将病原菌繁殖体悬浮液加入其中,处理后的培养板放置在恒温培养箱中培养。24小时后进行调查,调查时目测病原菌繁殖体萌发或生长情况,并根据对照处理的萌发或生长情况,评价化合物抑菌活性。
56.测试结果如下:25 mg/l时,化合物1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、1.16、1.19、1.22、1.25、1.39、1.40、1.45、1.68、1.71、1.321、2.7、2.8、2.25、2.43、2.321、3.7、3.8、3.25、3.43、3.45、3.321、4.7、4.8、4.321、5.321对稻瘟病菌孢子萌发抑制率为100%。
57.25 mg/l时,化合物1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、1.16、1.19、1.22、1.25、1.39、1.40、1.45、1.68、1.71、1.321、2.7、2.8、2.25、2.43、2.321、3.7、3.8、3.25、3.43、3.45、3.321、4.7、4.8、4.321、5.321对蔬菜灰霉病孢子萌发抑制率为100%。
58.实施例7:对植物细菌病害防治效果的测定用本发明的化合物对多种植物细菌性病害进行了防效测定,针对不同的细菌性病害,试验程序如下:甜瓜果斑病,将待测化合物用少量n,n二甲基甲酰胺溶解,用水稀释至所需要的浓度。将培养至稳定生长期的病原细菌与定量化合物溶液混合均匀,将经过催芽的甜瓜种子放入菌液与化合物的混合液中浸泡半小时,再将种子播种于蚯蚓土培养杯中,放入温室中保湿培养,一般培养两周时间,待对照充分发病后进行防效调查。
59.大白菜软腐病,切取2厘米见方的白菜叶片,放入垫有双层滤纸的玻璃培养皿中。将用n,n二甲基甲酰胺溶解,并用水稀释至所需浓度的化合物喷雾于白菜叶片表面,于通风橱内晾干白菜叶片表面药液后,使用接种针在白菜叶片表面针刺造成伤口,将培养至稳定生长期的大白菜软腐病菌取5微升加入伤口内,进行接种。最后将试材放入培养箱中避光培养48小时,待对照充分发病后进行防效调查。
60.黄瓜细菌性角斑病、番茄细菌性叶斑病、水稻细菌性条斑病、水稻白叶枯病,将待测化合物用少量n,n二甲基甲酰胺溶解,用水稀释至所需要的浓度。将化合物其喷雾于植物试材表面,于阴凉处风干表面药液后,将培养至稳定生长期的病原细菌菌液喷雾接种于植物试材表面,然后将植物试材放入温室中保湿培养。通常培养十天左右,待对照充分发病后,进行防效调查。
61.柑桔溃疡病:试验设处理和对照,每个处理10次重复,每个重复1张叶片,使用接种针在柑橘离体叶片上造成8-10个针刺点;用无菌水将药剂原液(即将待测化合物用少量n, n二甲基甲酰胺溶解)稀释至所需浓度后对柑橘离体叶片进行叶面喷施,再接种病原菌,处理完成后置于90mm培养皿中(用适量无菌水润湿吸水纸,置于培养皿底部进行保湿),于28℃恒温箱内培养,7天后观察并记录柑橘溃疡病的离体发病情况,进行防效调查。防治效果(%)=(对照针刺发病点数-处理针刺发病点数)/对照针刺发病点数
×
100%。
62.测试结果如下:600 mg/l时,化合物1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、1.16、1.19、1.22、1.25、1.39、1.40、1.45、1.68、1.71、1.321、2.7、2.8、2.25、2.43、2.321、3.7、3.8、3.25、3.43、3.45、3.321、4.7、4.8、4.321、5.321对甜瓜果斑病的防效为100%。
63.400 mg/l时,化合物1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、1.16、1.19、1.22、
1.25、1.39、1.40、1.45、1.68、1.71、1.321、2.7、2.8、2.25、2.43、2.321、3.7、3.8、3.25、3.43、3.45、3.321、4.7、4.8、4.321、5.321对黄瓜细菌性角斑病、水稻细菌性条斑病、水稻白叶枯病、大白菜软腐病和番茄细菌性叶斑病的防效为100%。
64.100 mg/l时,化合物1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、1.16、1.19、1.22、1.25、1.39、1.40、1.45、1.68、1.71、1.321、2.7、2.8、2.25、2.43、2.321、3.7、3.8、3.25、3.43、3.45、3.321、4.7、4.8、4.321、5.321对柑橘溃疡病的防效为100%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1