一种分泌鸭新型呼肠孤病毒σC蛋白单抗的杂交瘤细胞、单抗及应用
一种分泌鸭新型呼肠孤病毒
σ
c蛋白单抗的杂交瘤细胞、单抗及应用
技术领域
1.本发明涉及生物技术领域,特别是涉及一种分泌鸭新型呼肠孤病毒σc蛋白单抗的杂交瘤细胞、单抗及应用。
背景技术:
2.鸭呼肠孤病毒(duck reovirus,drv)分为两种基因型,即ⅰ型和ⅱ型。基因ⅰ型为经典鸭呼肠孤病毒(classical drv,cdrv),亦称番鸭呼肠孤病毒(muscovey duck reovirus,mdrv),该病毒主要感染番鸭和半番鸭,引起番鸭坏死性肝炎(俗称番鸭“白点病”或“花肝病”),以肝脾等脏器出现大量粟粒状坏死灶为病理特征,该病在我国始发于1997,在我国南方广东、福建、浙江和江西等地广泛流行;基因ⅱ型为鸭新型呼肠孤病毒(novel drv,ndrv),该病毒可引起不同品种鸭(包括番鸭、半番鸭、北京鸭、樱桃谷鸭、麻鸭)及鹅等水禽发病,其特征性病变为肝脾出现严重的坏死和出血(俗称“出血性坏死性肝炎”或“脾出血坏死症”),该病最早发生于2000年,此后开始在我国广东、福建、浙江、江苏、河北、山东等省相继暴发与流行。流行病学调查研究发现,基因ⅱ型(ndrv)已成为我国流行的优势基因型。
3.ndrv基因组由10个节段的双链rna构成,病毒粒子由二十面体对称的双层衣壳组成,直径70nm、无囊膜。依据sds
‑
page电泳结果均可将基因组分为3个大片段(命名为l1
‑
3),3个中片段(命名为m1
‑
3)和4个小片段(命名为s1
‑
4),其基因组至少可编码10种结构蛋白和4种非结构蛋白。σc蛋白由s1基因节段第3个orf编码,是构成病毒外衣壳的次要成分。研究表明,σc蛋白与病毒型特异性中和反应的表面抗原有关,能够刺激机体产生保护性中和抗体;且该蛋白位于外衣壳的表面,可通过受体介导识别和附着靶细胞,因此具有受体功能(1、mart
í
nez
‑
costas j,grande a,varela r,et al.1997.protein architecture of avian reovirus s1133 and identification of the cell attachment protein[j].journal of virology,71(1):59
‑
64.;2、shapouri m r s,mari
è
me kane,letarte m,et al.1995,cloning,sequencing and expression of the s1 gene of avian reovirus[j].journal of general virology,76(6):1515
‑
1520.)。此外,σc蛋白可通过p53依赖性通路诱导宿主细胞凋亡(shih w l,hsu h w,liao m h,et al.2004,avian reovirus sigmac protein induces apoptosis in cultured cells[j].virology,321(1):65
‑
74.)。σc在禽呼肠孤病毒(arv)编码的蛋白中是最易变异的蛋白(1、liu h j,giambrone j j.1997.amplification,cloning and sequencing of theσc
‑
encoded gene of avian reovirus[j].journal of virological methods,65(2):318
‑
318.;2、liu h j,lee l h,hsu h w,et al.2003.molecular evolution of avian reovirus::evidence for genetic diversity and reassortment of the s
‑
class genome segments and multiple cocirculating lineages[j].virology,314(1):336
‑
349.)。ndrv、cdrv与arv均属于禽正呼肠孤病毒种群成员,但ndrvσc蛋白与cdrv及arv的σc蛋白氨基酸同源性仅分别约40%和30%。目前对ndrvσc蛋白的表位抗原性信息以及是否存在型特异性抗原表位还不
清楚。
技术实现要素:
[0004]
本发明利用原核表达的重组ndrvσc蛋白作为免疫原,制备了针对该蛋白的特异性单克隆抗体(mcabs),并对其识别的抗原表位进行了鉴定,为进一步研究ndrvσc蛋白的结构和功能及ndrv型特异性检测方法的建立奠定基础。
[0005]
本发明首先提供了一种分泌鸭新型呼肠孤病毒(novel duck reovirus,ndrv)σc蛋白单抗的杂交瘤细胞,分类命名为杂交瘤细胞株ndrv yt a5
‑
b6(以下简称a5
‑
b6),保藏号为cctcc no:c2021124。保藏日为2021年5月27日,保藏于位于中国武汉武汉大学的中国典型培养物保藏中心。
[0006]
本发明又提供了一种鸭新型呼肠孤病毒σc蛋白单抗,由所述杂交瘤细胞分泌。
[0007]
本发明还提供了所述鸭新型呼肠孤病毒σc蛋白单抗在鉴别鸭新型呼肠孤病毒中的应用。
[0008]
本发明还提供了所述鸭新型呼肠孤病毒σc蛋白单抗在制备检测鸭新型呼肠孤病毒或该病毒σc蛋白抗体的试剂盒中的应用。
[0009]
本发明还提供了一种用于鸭新型呼肠孤病毒或该病毒σc蛋白抗体检测的试剂盒,包括:
[0010]
(1)经过标记物标记的所述鸭新型呼肠孤病毒σc蛋白单抗;
[0011]
(2)阳性对照。
[0012]
本发明还提供了一种用于鸭新型呼肠孤病毒或该病毒σc蛋白抗体检测的试剂盒,包括:
[0013]
(1)作为一抗的所述鸭新型呼肠孤病毒σc蛋白单抗;
[0014]
(2)经过标记物标记的二抗,所述二抗能够在一抗与鸭新型呼肠孤病毒σc蛋白结合时结合一抗;
[0015]
(3)阳性对照。
[0016]
当用于检测鸭新型呼肠孤病毒时,可以使用的方法有western blot检测、elisa检测、ifa检测。当检测的是鸭新型呼肠孤病毒σc蛋白抗体时,可以使用竞争性elisa方法,通过待检测对象(一般为血清样本)中抗体与试剂盒中单抗的竞争性结合,从而检测待检测对象中是否存在鸭新型呼肠孤病毒抗体,以及抗体水平。
[0017]
优选的,阳性对照为鸭新型呼肠孤病毒σc蛋白或抗ndrvσc蛋白的小鼠阳性血清。根据检测方法的不同需要选择阳性对照,如果是western blot检测,阳性对照可以是使用鸭新型呼肠孤病毒σc蛋白,如果需要定量或半定量检测,则需要使用浓度已知的鸭新型呼肠孤病毒σc蛋白;如果是elisa检测或者ifa检测,则可以使用抗ndrvσc蛋白的小鼠阳性血清。
[0018]
优选的,标记抗体上带有的标记物为过氧化物酶、碱性磷酸酶(ap)或异硫氰酸荧光素。所述过氧化物酶可以为辣根过氧化物酶(hrp)。本发明制备获得了一种分泌鸭新型呼肠孤病毒(novel duck reovirus,ndrv)σc蛋白单抗的杂交瘤细胞,制备获得了鸭新型呼肠孤病毒σc蛋白单抗,具有较高的效价,且具有较强的特异性。
[0019]
a5
‑
b6单抗识别的核心抗原表位由9个氨基酸组成,序列为
177
pilsgpada
185
。通过间
接免疫荧光(ifa)和抗原表位的保守性分析表明,a5
‑
b6 mcab仅与ndrv发生特异性反应,不与cdrv和arv发生反应;其抗原表位在不同地域和不同宿主来源的ndrv分离株中具有很高的保守性。本研究结果为进一步研究σc蛋白的结构和功能,以及ndrv临床检测方法的建立奠定基础。
附图说明
[0020]
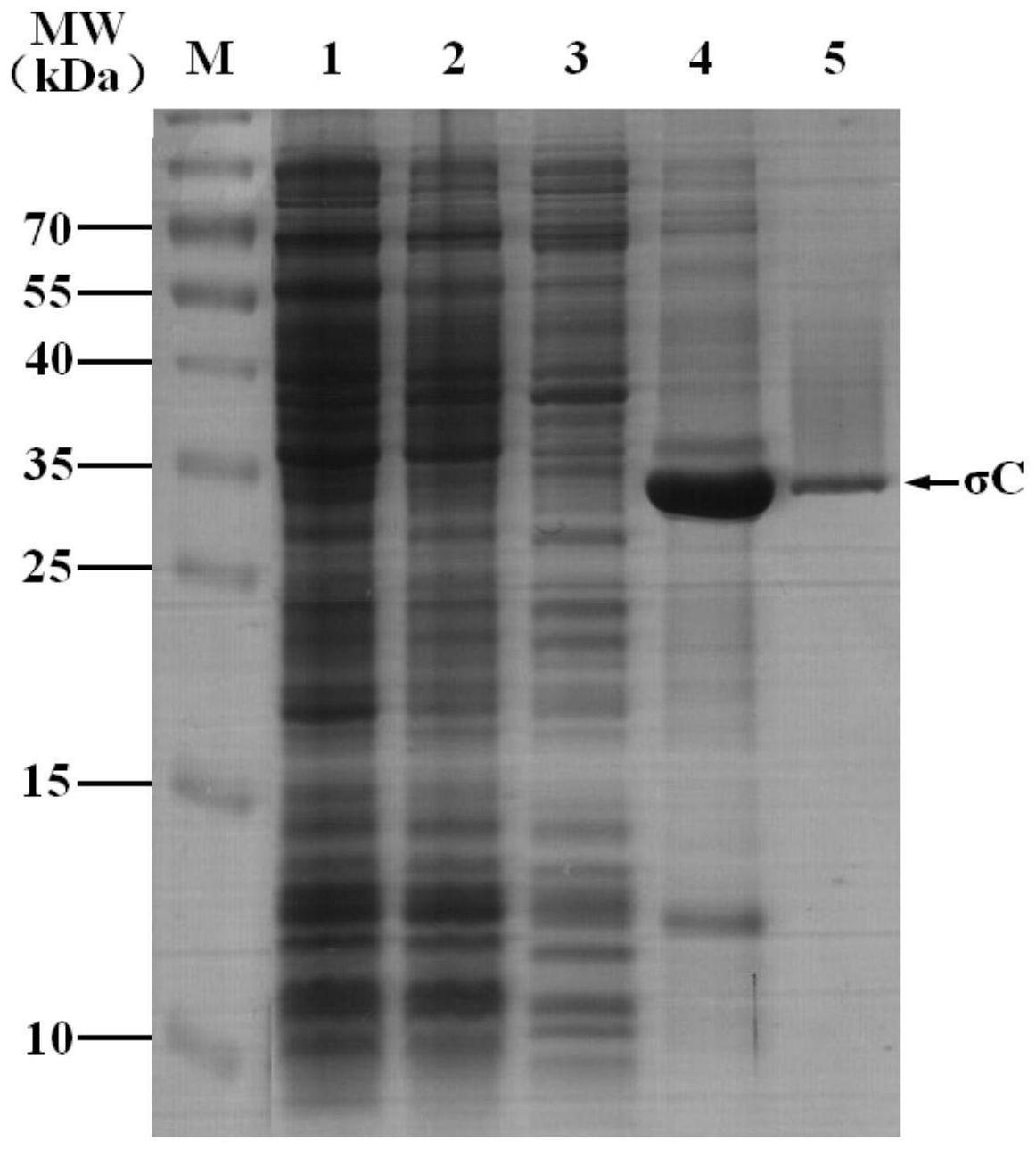
图1为重组σc蛋白的表达与纯化结果图,其中,泳道m:蛋白分子marker;泳道1:未诱导的重组菌体;泳道2:诱导的pet
‑
σc菌液;泳道3:诱导后的全菌裂解上清;泳道4:裂解后的菌体沉淀;泳道5:纯化后的重组蛋白σc。
[0021]
图2为纯化的σc蛋白western blot分析结果图,其中,泳道m:预染蛋白分子marker(prestained protein ladder);泳道1:纯化后的重组蛋白σc;泳道2:pet
‑
28a对照。
[0022]
图3为mcab的western blot分析结果图,其中,泳道m:预染蛋白分子marker(prestained protein ladder);泳道1:ndrv zj00m感染的df
‑
1细胞裂解上清液;泳道2:未感染ndrv zj00m的df
‑
1细胞裂解上清液。
[0023]
图4为mcab的ifa鉴定结果图,其中,a:ndrv zj00m感染的df
‑
1细胞;b:cdrv zj2000m感染的df
‑
1细胞;c:arv s1133感染的df
‑
1细胞;d:阳性血清作为阳性对照;e:阴性血清作为阴性对照。
[0024]
图5为肽段elisa扫描鉴定mcab识别的抗原表位结果图,其中a:sigc
‑
1~sigc
‑
32筛选;b:sigc
‑
18
‑
1~sigc
‑
18
‑
8筛选。
[0025]
图6为ndrv、cdrv、arv和tarvσc蛋白抗原表位序列比对结果图。
具体实施方式
[0026]
细胞、病毒株及实验动物:骨髓瘤细胞(sp2/0)和df
‑
1细胞由浙江省农科院畜牧兽医研究所禽病研究室保存;ndrv zj00m(yun t,yu b,ni z,et al.2014.genomic characteristics of a novel reovirus from muscovy duckling in china[j].veterinary microbiology,168:261
‑
271.)和cdrv zj2000m(yun t,yu b,ni z,et al.2013.isolation and genomic characterization of a classical muscovy duck reovirus isolated in zhejiang,china[j].infection genetics and evolution,20:444
‑
453.)毒株由浙江省农科院畜牧兽医研究所禽病研究室分离鉴定与保存,arv s1133毒株浙江省农科院畜牧兽医研究所禽病研究室保存;大肠杆菌dh5α和bl21(de3)感受态细胞购自北京式金生物技术有限公司;6~8周龄balb/c小鼠购自上海斯莱克实验动物有限责任公司。
[0027]
主要试剂及材料:pet
‑
28a载体(带有his标签)由浙江省农科院畜牧兽医研究所禽病研究室保存;hrp标记的山羊抗鼠igg抗体(hrp
‑
igg)、弗氏完全佐剂、弗氏不完全佐剂、peg4000、hat、ht均购自sigma公司;mcab亚型检测试剂盒和ecl化学发光检测试剂盒购自thermo fisher scientific公司;蛋白纯化用材料购自ge healthcare。
[0028]
实施例1:重组质粒pet
‑
28a
‑
σc的构建、蛋白表达及纯化
[0029]
根据ndrv zj00m株的s1基因序列(kf154116),利用oligo6.0软件,以s1基因的σc orf为目标区设计了一对引物,引物由invitrogen公司合成。其序列如下sigc
‑
f:5
’‑
acaccatggcgcaacgaggtgatacgcctg
‑3’
(下划线处为nco i酶切位点),sigc
‑
r:5
‘‑
atactcgaggcccgtggcgacggtgaagcgtaac
‑3’
(下划线处为xho i酶切位点)。经rt
‑
pcr扩增获得σc目的片段,用nco i/xhoⅰ分别双酶切目的片段σc和载体pet
‑
28a,以t4 dna连接酶进行连接,构建重组质粒pet
‑
28a
‑
σc,转入宿主菌bl21中,经iptg诱导表达,离心,超声破碎,分离上清液和沉淀。通过sds
‑
page分析重组蛋白的表达。利用ni
‑
nta试剂盒对重组蛋白σc
‑
his进行纯化,通过sds
‑
page分析其纯度,利用核酸蛋白仪测定蛋白浓度。
[0030]
重组质粒pet
‑
28a
‑
σc经ncoⅰ和xhoⅰ双酶切鉴定得到两个片段,与预期大小5236bp和966bp,经测序结果正确。将pet
‑
28a
‑
σc转化入bl21(de3)中,经37℃iptg(1m)诱导5h,超声裂解细菌收集上清及沉淀后分别进行sds
‑
page检测,结果表明,表达的重组σc蛋白主要以包涵体的形式存在于细胞沉淀中,大小约为35kda,大小与预期相符(图1)。纯化的重组σc蛋白western blot结果显示,在35kda处有一特异的反应条带,表明表达产物具有良好的反应性(图2)。
[0031]
实施例2:动物免疫、细胞融合及mcab的制备
[0032]
将纯化的重组σc蛋白对6~8周龄的balb/c小鼠进行颈背部皮下多点注射免疫(100μg/只)。间隔两周加强免疫一次。首免以等体积的弗氏完全佐剂乳化,二免和三免以等体积的弗氏不完全佐剂乳化。三免7d后尾部采血,分离血清,将其倍比稀释,利用免疫原σc蛋白包被的elisa板检测小鼠血清抗体效价。对血清效价最高的小鼠于细胞融合前3d,用σc蛋白(不加佐剂)(100μg/只)再进行加强免疫。第3d时,取小鼠脾脏细胞与sp2/0细胞进行细胞融合。
[0033]
按常规方法进行融合(heddy zola.单克隆抗体技术手册[m].周宗安,译.南京:南京大学出版社,1991,48
‑
63。),以纯化的重组σc蛋白为包被抗原,建立间接elisa方法。取细胞培养上清液进行检测,以抗ndrvσc蛋白的小鼠阳性血清为阳性对照,而以未融合的sp2/0细胞上清液为阴性对照。采用有限稀释法对阳性杂交瘤细胞进行3次克隆纯化,直至筛选结果100%为阳性。对筛选出能够稳定分泌抗体的阳性杂交瘤细胞按常规方法进行制备腹水(heddy zola.单克隆抗体技术手册[m].周宗安,译.南京:南京大学出版社,1991,48
‑
63。),腹水效价通过间接elisa方法检测。
[0034]
细胞融合后,通过间接elisa方法对获得的杂交瘤细胞进行筛选,将筛选获得的的杂交瘤细胞经过3次亚克隆纯化后,获得1株能稳定分泌抗ndrvσc蛋白mcab的杂交瘤细胞株,分类命名为杂交瘤细胞株ndrv yt a5
‑
b6,保藏号为cctcc no:c2021124。保藏日为2021年5月27日,保藏于位于中国武汉武汉大学的中国典型培养物保藏中心。
[0035]
间接elisa检测杂交瘤细胞上清液抗体效价为1∶1200,腹水中的mcab(单抗以下称为a5
‑
b6单抗)经纯化后效价均为1∶240000。
[0036]
实施例3:mcab生物学特性的鉴定
[0037]
(1)mcab亚类鉴定
[0038]
利用mcab亚类鉴定试剂盒对获得的mabs进行亚型鉴定,具体步骤参见说明书。
[0039]
抗体亚类鉴定结果显示,a5
‑
b6细胞株分泌的抗体亚型为igg1,分泌的抗体轻链均为κ(表1)。
[0040]
表1杂交瘤细胞株的亚型鉴定
[0041][0042]
κ、λ:抗体轻链类别。
[0043]
(2)mcab的western blot分析
[0044]
将感染ndrv的df
‑
1细胞离心,弃上清,沉淀加上样buffer,煮沸处理后进行sds
‑
page电泳,完毕后将page胶转印硝酸纤维素(nc)膜,然后用5%脱脂乳封闭。以制备的a5
‑
b6单抗为一抗,羊抗鼠igg
‑
hrp为二抗,同时以未感染ndrv的df
‑
1细胞作为阴性对照,dab试剂盒显色,进行western blot分析。
[0045]
以ndrv全病毒为抗原,western blot检测结果显示,获得的a5
‑
b6单抗能够与ndrv全病毒发生反应,在约35kda处出现特异性条带(图3),而与未接ndrv的df
‑
1细胞蛋白不发生反应。结果表明a5
‑
b6单抗能够与ndrv全病毒结合。
[0046]
(3)间接免疫荧光(ifa)鉴定
[0047]
将ndrv zj00m按0.01moi(感染指数)的感染剂量接种df
‑
1细胞,以未接种病毒的细胞为阴性对照,于37℃5%co2培养48h弃去培养基,用4%的多聚甲醛固定细胞,以制备的a5
‑
b6单抗作为一抗,羊抗鼠igg
‑
fitc为二抗,进行ifa鉴定,以确定a5
‑
b6单抗与ndrv的结合活性。同时以小鼠阳性血清和阴性血清(实施例2制备)做对照。
[0048]
用0.01moi的cdrv zj2000m和arv s1133分别感染df
‑
1细胞,以未接种病毒的细胞为阴性对照,培养48h后弃去培养基,进行ifa鉴定,方法如上。通过ifa以评价a5
‑
b6单抗对cdrv、arv的鉴别活性。
[0049]
将a5
‑
b6单抗作用于接种ndrv、cdrv和arv的df
‑
1细胞,经ifa检测结果显示,a5
‑
b6单抗及小鼠阳性血清(实施例2制备)与ndrv发生反应,细胞内产生绿色荧光;而a5
‑
b6单抗及小鼠阴性血清(实施例2制备)与cdrv和arv不发生反应,细胞内未产生荧光(图4),表明a5
‑
b6单抗仅能与ndrv发生特异性反应,具有型特异性。
[0050]
实施例4:肽扫描法对抗原表位定位
[0051]
人工合成σc蛋白截短长度为15个氨基酸、相互重叠5个氨基酸的多肽库,共32条(表2)。用dmso将各条多肽进行溶解,然后分别以1μg/孔包被elisa反应板,以制备的a5
‑
b6单抗为一抗,羊抗鼠igg
‑
hrp为二抗进行elisa筛选,同实施例2中制备的抗σc蛋白高免小鼠血清作为阳性对照,以非免小鼠血清作为阴性对照,利用间接elisa方法进行抗原表位初步鉴定。
[0052]
将32条sigc多肽库中与a5
‑
b6单抗经elisa结果检测呈强阳性的多肽,继续截短合成,分别从n端和c端分别逐步截短,且每次减少2个氨基酸为单位顺移,共合成8条(表2)。再分别将合成截短的8条多肽分别包被elisa反应板,采用上述相同的方法进行elisa筛选。
[0053]
表2根据σc蛋白氨基酸序列合成的重叠多肽序列
[0054][0055][0056]
将人工合成的32条多肽包被elisa平板,以a5
‑
b6 mcab为一抗,elisa检测结果显示,a5
‑
b6单抗与sigc
‑
18多肽呈强阳性反应,与sigc
‑
19多肽呈弱阳性反应,而与其它肽段无反应(图5a),a5
‑
b6单抗对应的初步抗原表位应为
171
sfcslspilsgpada
185
。继续将sigc
‑
18多肽从n端和c端分别以2个氨基逐步截短合成的8条sigc
‑
18短多肽包被elisa平板,以a5
‑
b6 mcab为一抗,elisa检测结果显示,sigc
‑
18多肽从n端截短6个氨基后(分别对应sigc
‑
18
‑
5、sigc
‑
18
‑
6和sigc
‑
18
‑
7多肽),仍与a5
‑
b6单抗呈强阳性反应(图5b)。因此,确定a5
‑
b6单抗对应的最小抗原表位应为
177
pilsgpada
185
,由9个氨基酸组成。
[0057]
实施例5:抗原表位的保守性分析
[0058]
选取不同年代、不同地域,且具有代表性的ndrv分离株及cdrv,鸡呼肠孤病毒(avian reovirus,arv),火鸡呼肠孤病毒(turkey reovirus,tarv)等禽正呼肠孤病毒(avian orthoreovirus,arvs)毒株各sigc蛋白氨基酸序列进行比对分析,以确定抗原表位序列(
177
pilsgpada
185
)的保守性。
[0059]
结果表明该抗原表位序列(
177
pilsgpada
185
)在不同地域来源的ndrv分离株中具有很高的保守性,均为100%(图6),可作为ndrv的型特异性表位;在cdrv、arv和tarv中差异较大(图6),可用于区别诊断ndrv与cdrv及arv感染的候选抗体。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1