3R-氨基取代丁酰胺衍生物的制备方法与流程
3r
‑
氨基取代丁酰胺衍生物的制备方法
技术领域
1.本公开涉及药物化学领域,具体涉及一类3r
‑
氨基取代丁酰胺衍生物的制备方法。
背景技术:
2.3r
‑
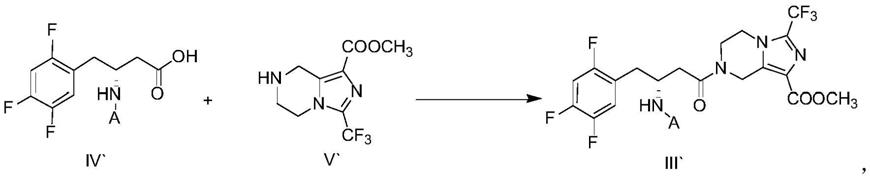
氨基取代丁酰胺衍生物是一类具有重要生理活性和药用价值的化合物,如西他列汀磷酸盐(sitagliptin phosphate)和瑞格列汀磷酸盐(retagliptin phosphate),西他列汀磷酸盐是默沙东公司研发的二肽基肽酶
‑
iv(dpp
‑
iv)抑制剂,于2006年10月获美国fda批准上市,用于治疗2型糖尿病。瑞格列汀磷酸盐现处于三期临床研究,有结果显示其具有优良的二肽基肽酶
‑
iv(dpp
‑
iv)抑制效果。
[0003][0004]
关于3r
‑
氨基取代丁酰胺衍生物的合成方法,现有技术中有很多报道:
[0005]
wo2009082881a公开了瑞格列汀化合物、其盐酸盐及制备方法,
[0006][0007]
其中,第十步的反应条件为化合物1k与化合物1f在三乙胺、双(2
‑
氧代
‑3‑
噁唑烷基)次磷酰氯条件下的二氯甲烷中,室温搅拌反应;第十二步的反应使用到了八羰基二钴,该催化剂价格昂贵,且反应条件难以放大生产。
[0008]
cn106892926b公开了如下的瑞格列汀合成路线:
[0009][0010]
其中,第三步反应是将第二步的反应产物的二氯甲烷溶液降温至
‑
15℃,加入二乙基氯化铝的甲苯溶液,所得的混合液在
‑
10℃下搅拌,然后滴加化合物的二氯甲烷溶液,所得的混合液升温至10℃并搅拌40小时,滴加盐酸溶液淬灭反应,分出有机相,洗涤,浓缩、干燥得到第三步反应的产物。或者在15
‑
25℃下,将三乙胺滴加至三氯化铝和二氯甲烷的悬浊液中,搅拌直至澄清,滴加第二步反应的产物和的二氯甲烷溶液,在15
‑
25℃下搅拌2小时,降温至0
‑
5℃,滴加盐酸溶液淬灭反应,分出有机相,洗涤,浓缩、干燥得到第三步反应的产物。将10%的湿钯碳和浓硫酸加入到第三步反应的产物的甲醇溶液中,加氢,在40
‑
50℃下搅拌,过滤除去催化剂,滤液用饱和碳酸氢钠中和,浓缩后二氯甲烷萃取,有机相浓缩、干燥得到瑞格列汀。该工艺需要使用钯碳加氢脱氨基保护基,反应条件相对危险,成本较高。
技术实现要素:
[0011]
本公开提供一种3r
‑
氨基取代丁酰胺衍生物的制备方法,包括如下步骤:
[0012][0013]
该反应是在n,n'
‑
羰基二咪唑和咪唑盐酸盐存在下,式(iv)化合物与式(v)化合物反应得到式(iii)化合物;
[0014]
其中,ar是取代或未取代的芳基,所述芳基选自苯基或萘基,其任选被选自卤素、三氟甲基、甲氧基、氨基、氰基、硝基、苯基或c1
‑
6烷基的取代基取代;或者,ar是取代或未取代的杂芳基,所述芳杂基选自呋喃、吡咯、噻吩、吲哚或喹啉基团,其任选被选自卤素、三氟甲基、甲氧基、氨基、氰基、硝基、苯基或c1
‑
6烷基的取代基取代;
[0015]
式(v)化合物是含氮杂环,所述的含氮杂环选自被c1
‑
4烷基、c1
‑
4卤代烷基或羧酸酯基取代的饱和或部分不饱和单环或并环化合物,其包含3至20个环原子,其中一个或多个
环原子为氮、氧或s(o)m(其中m是整数0至2)的杂原子,且至少一个环原子为氮,但不包括
‑
o
‑
o
‑
、
‑
o
‑
s
‑
或
‑
s
‑
s
‑
的环部分,其余环原子为碳,优选包含3至12个环原子,其中1~4个是杂原子;更优选包含8至10个环原子,其中1~4个是氮原子;更优选自原子;更优选包含8至10个环原子,其中1~4个是氮原子;更优选自
[0016]
a是氨基保护基。
[0017]
本公开所述氨基保护基可选自烷氧羰基类氨基保护基、酰基类氨基保护基、磺酰基类氨基保护基或烷基类氨基保护基:所述烷氧羰基类氨基保护基选自苄氧羰基(cbz)、叔丁氧羰基(t
‑
boc)、笏甲氧羰基(fmoc)、烯丙氧羰基(alloc)、三甲基硅乙氧羰基(teoc)、甲氧羰基或乙氧羰基;所述酰基类氨基保护基选自邻苯二甲酰基(pht)、三氟乙酰基(tfa)、特戊酰基、苯甲酰基、甲酰基或乙酰基;所述磺酰基类氨基保护基选自对甲苯磺酰基(tos或ts)、邻硝基苯磺酰基(o
‑
ns)或对硝基苯磺酰基(p
‑
ns);所述烷基类氨基保护基选自三苯甲基(trt)、2,4
‑
二甲氧基苄基(dmb)、对甲氧基苄基(pmb)或苄基(bn)。
[0018]
在一些实施方案中,氨基保护基为烷氧羰基类氨基保护基,所述烷氧羰基类氨基保护基优选苄氧羰基(cbz)、叔丁氧羰基(t
‑
boc)、笏甲氧羰基(fmoc)或烯丙氧羰基(alloc),更优选叔丁氧羰基(t
‑
boc)。
[0019]
所述的3r
‑
氨基取代丁酰胺衍生物的制备方法,还进一步包括脱除氨基保护基的步骤。当氨基保护基为叔丁氧羰基时,在有机溶剂中加酸的条件下发生脱保护反应。所述的有机溶剂选自卤代烃类溶剂、醚类溶剂、酯类溶剂、酰胺类溶剂、腈类溶剂或醇类溶剂,卤代烃类溶剂优选二氯甲烷或氯仿,醚类溶剂优选四氢呋喃或乙醚,酯类溶剂优选乙酸乙酯、乙酸甲酯或醋酸丁酯,酰胺类溶剂优选n,n
‑
二甲基甲酰胺,腈类溶剂优选乙腈,醇类溶剂优选甲醇或乙醇。所述的酸选自三氟乙酸、盐酸、氢溴酸、氢氟酸、稀硫酸、乙酸,优选三氟乙酸或盐酸。在一些实施方案中,氨基保护基为叔丁氧羰基时,在二氯甲烷/三氟乙酸的条件下发生脱保护反应。在一些实施方案中,氨基保护基为叔丁氧羰基时,在乙酸乙酯/盐酸的条件下发生脱保护反应。
[0020]
在一些实施方案中,所述的3r
‑
氨基取代丁酰胺衍生物是西他列汀或其可药用盐。
[0021]
在一些实施方案中,所述的3r
‑
氨基取代丁酰胺衍生物是瑞格列汀或其可药用盐,优选瑞格列汀磷酸盐。
[0022]
本公开提供一种瑞格列汀或其可药用盐的制备方法,包括如下步骤:
[0023][0024]
其中,a为氨基保护基,该反应是在有机溶剂中,n,n'
‑
羰基二咪唑和咪唑盐酸盐共
同存在下发生。所述有机溶剂选自醚类有机溶剂,醚类溶剂优选四氢呋喃。
[0025]
在一些实施方案中,瑞格列汀或其可药用盐的制备方法,优选瑞格列汀磷酸盐的制备方法,包括如下步骤:
[0026][0027]
其中,该反应是在有机溶剂中,n,n'
‑
羰基二咪唑和咪唑盐酸盐共同存在下发生。所述有机溶剂选自醚类有机溶剂,醚类溶剂优选四氢呋喃。在一些实施方案中,式(iv``)化合物溶于四氢呋喃后,加n,n'
‑
羰基二咪唑、咪唑盐酸盐,加热反应一段时间,加入式(v`)化合物,继续反应,反应结束,进行后处理,得式(iii``)化合物。在一些实施方案中,式(iv``)化合物溶于四氢呋喃后,加n,n'
‑
羰基二咪唑、咪唑盐酸盐,加热反应一段时间,加入式(v`)化合物,继续反应,hplc取样监控反应至中间态小于2%,反应结束,除去大部分溶剂(优选减压浓缩),剩余物缓慢滴加至2~8℃的水中,搅拌析出固体,甩滤,固体加入异丙醇中加热回流搅拌,冷却析晶,析出固体,甩滤,干燥,得式(iii``)化合物。
[0028]
在一些实施方案中,所述的瑞格列汀磷酸盐的制备方法还进一步包括如下步骤:
[0029][0030]
式(iii``)化合物在有机溶剂/hci条件下发生反应,得到式(ii)化合物,式(ii)化合物经游离后在有机溶剂/h3po4条件下发生反应,得到式(i)化合物。所述有机溶剂选自卤代烃类溶剂、醚类溶剂、酯类溶剂、酰胺类溶剂、腈类溶剂或醇类溶剂,卤代烃类溶剂优选二氯甲烷或氯仿,醚类溶剂优选四氢呋喃或乙醚,酯类溶剂优选乙酸乙酯、乙酸甲酯或醋酸丁酯,酰胺类溶剂优选n,n
‑
二甲基甲酰胺,腈类溶剂优选乙腈,醇类溶剂优选甲醇或乙醇。在一些实施方案中,第一步反应中的有机溶剂是乙酸乙酯,第二步反应中的有机溶剂是异丙醇。在一些实施方案中,将式(iii``)化合物加入溶有盐酸的乙酸乙酯中,室温反应,减压浓缩,至干,得到式(ii)化合物,加入二氯甲烷溶解,加碳酸氢钠溶液洗涤,水层用二氯甲烷提取,合并有机层,用纯化水洗涤有机层,无水硫酸钠干燥,过滤,减压浓缩,用异丙醇搅拌,加入配置好的磷酸异丙醇溶液,搅拌,反应,甩滤,滤饼用异丙醇打浆,甩滤,干燥,得式(i)化合物。
[0031]
本公开提供一种瑞格列汀磷酸盐的制备方法,包括如下步骤:
[0032][0033]
在一些实施方案中,步骤1为在有机溶剂中,n,n'
‑
羰基二咪唑和咪唑盐酸盐存在下,式(iv``)化合物与式(v`)化合物反应得到式(iii``)化合物,所述的有机溶剂选自醚类溶剂,醚类溶剂优选四氢呋喃。
[0034]
在一些实施方案中,瑞格列汀磷酸盐的制备方法各步骤具体的反应条件如下:
[0035]
步骤1:n,n'
‑
羰基二咪唑,咪唑盐酸盐,四氢呋喃,40
‑
60℃,优选48~56℃;
[0036]
步骤2:盐酸,乙酸乙酯,20~30℃;
[0037]
步骤2’:异丙醇,磷酸,15~30℃。
[0038]
在一些实施方案中,n,n'
‑
羰基二咪唑的加入量与式(iv``)化合物加入量摩尔比为0.8~1.5:1,优选0.8~1.2:1,更优选0.9~1.1:1,最优选0.9:1、1:1或1.1:1;n,n'
‑
羰基二咪唑的加入量与咪唑盐酸盐的加入量摩尔比为1~5:1,优选3~4:1。
[0039]
一种包含瑞格列汀磷酸盐的药物组合物的制备方法,包括瑞格列汀磷酸盐和赋形剂混合的步骤,其中瑞格列汀磷酸盐是根据本公开所述的方法制备得到的。
[0040]
本公开中式(v`)化合物可以采用cn106892926b中实施例1
‑
3的方法进行制备,具体如下:
[0041][0042]
步骤a:将2
‑
氨
‑2‑
吡嗪
‑
乙酸甲酯盐酸盐(13.6g,按文献方法制备j.med.chem.1994,37,4567)的二氯甲烷(180ml)溶液降温至0
‑
10℃,在上述溶液中滴加三乙胺(8.0g),所得的混合液的温度控制在0
‑
10℃,滴加三氟醋酸酐(14.6g),在5
‑
15℃搅拌1
‑
2小时,加碳酸氢钠饱和溶液(135ml),搅拌分层,分出有机相,加入硫酸镁干燥,过滤,浓缩得到产物(16.2g),收率92.2%。
[0043]
步骤b:在步骤a产物(16.2g)和pocl3(162g)的混合液中,快速加入五氧化二磷(18.0g),加热升温至105
‑
110℃,搅拌4
‑
6小时,浓缩,加人乙酸乙酯,浓缩,降温至0℃,滴加水淬灭三氯氧磷,滴加25%氨水调节ph=7
‑
9,加乙酸乙酯萃取,合并有机相,浓缩得13.2g粗品,加入乙酸乙酯和石油醚的溶液,搅拌0.5小时,过滤,干燥得产物(11.2g),收率74.2%。
[0044]
步骤c:在步骤b产物(7.3g)的乙酸乙酯(40ml)溶液中加入0.8g 10%钯碳(含水
60%),加氢(30psi),在20
‑
30℃下搅拌4
‑
6小时,过滤,浓缩,加入石油醚,搅拌1.0小时,过滤,干燥得到产物(6.1g),收率82.2%。
[0045]
发明详述
[0046]
在本技术的说明书和权利要求书中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。然而,为了更好地理解本公开,下面提供了部分相关术语的定义和解释。另外,当本公开所提供的术语的定义和解释与本领域技术人员所通常理解的含义不一致时,以本公开所提供的术语的定义和解释为准。
[0047]
本公开所述的“卤素”指氟、氯、溴或碘。
[0048]
本公开所述的“氨基保护基”是指能够保护氨基、避免发生反应的基团,常见的氨基保护基包括但不限于:甲酸酯类(氨基与氯代甲酸酯、重氮甲酸酯或各类碳酸酯等反应制备)、亚胺类(伯胺与芳香醛、芳香酮或脂肪酮等反应制备)、烷氧羰基类(苄氧羰基(cbz)、叔丁氧羰基(boc)、笏甲氧羰基(fmoc)、烯丙氧羰基(alloc)、三甲基硅乙氧羰基(teoc)、甲氧羰基或乙氧羰基)、酰基类(氨基与酰氯或酸酐等反应制备,如邻苯二甲酰基(pht)、三氟乙酰基(tfa)、特戊酰基、苯甲酰基、甲酰基或乙酰基)、磺酰基类(芳香磺酰胺类如对甲苯磺酰基(tos或ts)、邻硝基苯磺酰基(o
‑
ns)或对硝基苯磺酰基(p
‑
ns))或烷基类(三苯甲基(trt)、2,4
‑
二甲氧基苄基(dmb)、对甲氧基苄基(pmb)或苄基(bn))等,其中“烷氧羰基类、酰基类、磺酰基类”分别是指r
‑
o
‑
c(o)
‑
、r
‑
c(o)
‑
、r
‑
s(o)2
‑
,其中r可以是氢原子、烷基或芳基等基团。
[0049]
本公开所述的“醚类溶剂”是指含有醚键
‑
o
‑
且碳原子数为1至10个的链状化合物或环状化合物,具体实例包括但不限于:丙二醇甲醚、四氢呋喃或1,4
‑
二氧六环。
[0050]
本公开所述的“酯类溶剂”是指含碳原子数为1至4个的低级有机酸与含碳原子数为1至6个的低级醇的结合物,具体实例包括但不限于:乙酸乙酯、乙酸异丙酯或乙酸丁酯。
[0051]
本公开所述的“醇类溶剂”是指一个或多个“羟基”取代“烷基”上的一个或多个氢原子所衍生的基团,具体实例包括但不限于:甲醇、乙醇、乙二醇、正丙醇或2
‑
丙醇。
[0052]
本公开所述的“卤代烃类溶剂”是指一个或多个“卤素原子”取代“烷基”上的一个或多个氢原子所衍生的基团,具体实例包括但不限于:氯甲烷、二氯甲烷、氯仿或四氯化碳。
[0053]
本公开所述的“腈类溶剂”是指一个或多个“氰基”取代“烷基”上的一个或多个氢原子所衍生的基团,具体实例包括但不限于:乙腈或丙腈。
[0054]
本公开所述的“羧酸酯基”是指r’c(o)o
‑
或
‑
c(o)or’,其中r’是具有1
‑
6个碳原子的烷基,可以是但不限于甲基羧酸酯基、乙基羧酸酯基、正丙基羧酸酯基、异丙基羧酸酯基、正丁基羧酸酯基、异丁基羧酸酯基、仲丁基羧酸酯基、叔丁基羧酸酯基、正戊基羧酸酯基、异戊基羧酸酯基、叔戊基羧酸酯基、新戊基羧酸酯基、正己基羧酸酯基、异己基羧酸酯基或叔己基羧酸酯基。
[0055]
发明的有益效果
[0056]
本公开中,瑞格列汀或其可药用盐的制备方法相比于wo2009082881a所公开的方法,氮杂环上羧酸甲酯基团的引入在酰胺键形成之前,避免了大分子形成后溴代、羧酸酯取代的步骤,比wo2009082881a所公开的方法更加经济;另外避免了使用八羰基二钴插羰基,八羰基二钴价格昂贵,且难以放大化生产,因此目前本公开的瑞格列汀或其可药用盐的制备更加经济、节约,适合于工业化应用。
[0057]
本公开中3r
‑
氨基取代丁酰胺衍生物的制备方法中采用咪唑盐酸盐作为催化剂,相比于不加咪唑盐酸盐的情况反应时间大大缩短,更适合于工业化生产。
具体实施方式
[0058]
以下结合实施例用于进一步描述本公开,但这些实施例并非限制本公开的范围。
[0059]
本公开实施例中未注明具体条件的实验方法,通常按照常规条件,或按照原料或商品制造厂商所建议的条件。未注明具体来源的试剂,为市场购买的常规试剂。
[0060]
实施例1:
[0061]
步骤1、(r)
‑7‑
[3
‑
叔丁氧羰基氨基
‑4‑
(2,4,5
‑
三氟
‑
苯基)
‑
丁酰]
‑3‑
三氟甲基
‑
5,6,7,8
‑
四氢
‑
咪唑并[1,5
‑
a]吡嗪
‑1‑
羧酸甲酯
[0062][0063]
反应釜中抽入四氢呋喃(150kg),加入(r)
‑3‑
叔丁氧羰基氨基
‑4‑
(2,4,5
‑
三氟苯基)
‑
丁酸(15kg,45mol),搅拌溶解后加n,n'
‑
羰基二咪唑(7.7kg,47.4mol),咪唑盐酸盐(1.46kg,13.5mol),加热到48~56℃反应45~55min,加入3
‑
三氟甲基
‑
5,6,7,8
‑
四氢
‑
咪唑并[1,5
‑
a]吡嗪
‑1‑
羧酸甲酯(11.8kg,47.4mol),继续反应,4h开始取样(隔1h取一次),hplc监控反应液至中间态小于2%,反应结束,温度不超过56℃减压浓缩去大部分溶剂(剩余75~90kg),缓慢滴加至650kg 2~8℃的水中,搅拌析出固体,甩滤,固体加入200kg异丙醇加热至回流搅拌2.5~3h,冷却至15~25℃再析晶14~16h,析出固体,甩滤,干燥,得白色固体19.34kg,收率76.1%。
[0064]
步骤2、(r)
‑7‑
[3
‑
氨基
‑4‑
(2,4,5
‑
三氟
‑
苯基)
‑
丁酰]
‑3‑
三氟甲基
‑
5,6,7,8
‑
四氢
‑
咪唑并[1,5
‑
a]吡嗪
‑1‑
羧酸甲酯磷酸盐(瑞格列汀磷酸盐粗品)
[0065][0066]
在500l反应釜中加入160kg乙酸乙酯,冷却至10℃以下,控制温度<20℃下通入盐酸气13.1kg,然后加入步骤1所得的白色固体,20~30℃反应2.5~3h,先控制室温下(10~30℃)减压浓缩1~1.5h,再升温至45~55℃继续减压浓缩至干得油状物,加入210kg二氯甲
烷溶解,加碳酸氢钠溶液洗涤(129.3kg),水层ph=7
‑
8,水层用二氯甲烷提取一次(125kg),合并有机层,用纯化水洗涤一次(165kg),无水硫酸钠干燥,过滤,用二氯甲烷洗涤(20kg
×
2),控制热水浴进水管温度<45℃下减压浓缩至干,得油状物。
[0067]
将该油状产物用异丙醇(360kg)搅拌,控制温度15~30℃,15~30min加入配置好的磷酸异丙醇溶液(配制方法:85%磷酸溶于22.5kg异丙醇),搅拌1.5~2h,氮气保护下甩滤,异丙醇洗涤(15kg),滤饼用120kg异丙醇打浆1~1.5h,氮气保护下甩滤,异丙醇洗涤(15kg),控制进水管温度43~53℃真空干燥22~24h,得磷酸瑞格列汀粗品18.04kg,收率93.6%。
[0068]
实施例2(实施例1中步骤1对比实验):
[0069]
步骤1’、r)
‑7‑
[3
‑
叔丁氧羰基氨基
‑4‑
(2,4,5
‑
三氟
‑
苯基)
‑
丁酰]
‑3‑
三氟甲基
‑
5,6,7,8
‑
四氢
‑
咪唑并[1,5
‑
a]吡嗪
‑1‑
羧酸甲酯
[0070]
反应釜中抽入四氢呋喃(150kg),加入(r)
‑3‑
叔丁氧羰基氨基
‑4‑
(2,4,5
‑
三氟苯基)
‑
丁酸(15kg,45mol),搅拌溶解后加n,n'
‑
羰基二咪唑(7.7kg,47.4mol),加热到48~56℃反应45~55min,加入3
‑
三氟甲基
‑
5,6,7,8
‑
四氢
‑
咪唑并[1,5
‑
a]吡嗪
‑1‑
羧酸甲酯(11.8kg,47.4mol),48~56℃反应,hplc(高效液相色谱仪,agilent zorbax sb
‑
c18柱(4.6mm
×
250mm,5μm))检测64h反应基本完全,反应结束后,温度不超过56℃减压浓缩去大部分溶剂(剩余75~90kg),缓慢滴加入至650kg2~8℃的水中析出固体,甩滤,固体加入200kg异丙醇加热回流重结晶,冷却至15~25℃再析晶14~16h,析出固体,甩滤,热风循环干燥箱45~55℃干燥11~12h,得白色固体19.68,收率77.4%。
[0071]
步骤1和步骤1’中,加入3
‑
三氟甲基
‑
5,6,7,8
‑
四氢
‑
咪唑并[1,5
‑
a]吡嗪
‑1‑
羧酸甲酯后,hplc监测反应过程,随着反应时间的延长,原料、中间态物质、产物的含量变化如下表:
[0072][0073][0074]
可见,加入咪唑盐酸盐能够大大缩短反应时间。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1