一种α-琼胶酶基因及其编码酶的应用
一种
α
‑
琼胶酶基因及其编码酶的应用
技术领域
1.本发明涉及一种α
‑
琼胶酶基因及其编码酶的应用,属于基因工程和酶工程技术领域。
背景技术:
2.琼胶是一种由石花菜及其他红藻类植物其取出来的一种具有经济价值的海洋多糖。琼胶经过水解后生成聚合度为2~20的琼胶寡糖,具有水溶性好,生物利用度高等优点,可广泛应用于食品、药品和化妆品等领域。
3.琼胶寡糖具有许多独特的医疗保健功能,可作为功能性食品、药品和化妆品的原料,主要表现为:1)琼脂寡糖具有抗氧化作用,能够直接或通过提高抗氧化酶类的活性来清除活性氧自由基,还可以通过琼脂寡糖与自由基必须的金属离子螯合起到抑制氧化的效果。因此可以应用于抗疲劳等功能的保健食品中。2)琼脂寡糖能够抑制巨噬细胞和单核细胞中一氧化氮的产生量、前列腺素e2含量以及促炎症反应的细胞活性物质水平的提高,具有抗肿瘤、提高免疫力的功能。可以用于生产抗肿瘤、抗炎症、抗病毒等药品生产中。3)研究发现琼胶寡糖具有良好的保湿美白功效,能够抑制黑色素瘤细胞中酪氨酸酶活性,并且对细胞没有毒性。因此可以用作化妆品的优质原材料。4)琼脂寡糖具有一定的抑菌活性,能够抑制细菌生长。琼脂寡糖能够作为食品中良好的天然防腐剂,还可以降低食品热量。5)体内、体外实验证明新琼寡糖耐受消化酶的作用,可以改善肠道菌群结构,促进肠道内双歧杆菌和乳酸杆菌的增值,抑制致病菌的生长。其中高聚合度的琼胶寡糖抑菌效果优于低聚合度的琼胶寡糖。因此琼胶寡糖可以作为开发新型益生元制剂的原料。
4.近年来,我国对琼脂的开发规模较小,产品多限于作为化工和医药等原料出口的琼脂和琼脂粉,附加值低,易污染环境。为合理利用琼脂资源,生产琼胶寡糖等高附加值产品对防止资源浪费、增加经济效益、保护环境等具有重要意义。目前工业上主要利用酸水解和酶解两种方式制备琼胶寡糖,酸水解法效率高、产量大,但会产生大量副产物,存在琼胶寡糖分离提纯困难、具有安全隐患等问题;而琼胶酶酶解方法具有催化效率高、底物特异性强、反应条件温和等优点,是降解琼脂多糖的首选方式。但大多数利用酶法降解琼脂多糖的研究还处于实验室研究阶段,主要问题是产琼脂酶的菌株大多数来自于海洋,菌株产酶性状不稳定、产酶量低,使生产琼胶酶的成本高,价格昂贵,难以实现商业化应用。因此,寻找一种水解活力高,性状稳定的琼胶酶基因,并实现异源表达成为生产琼胶酶的最经济高效的方法。
5.琼胶酶分为α
‑
琼胶酶和β
‑
琼胶酶,其中α
‑
琼胶酶水解α
‑
1,3糖苷键生成琼寡糖,β
‑
琼胶酶水解β
‑
1,4糖苷键生成新琼寡糖。研究报道琼四糖和琼六糖相比于其他琼胶寡糖具有更好的抗氧化性能,但由于目前发现的琼胶酶绝大多数为β
‑
琼胶酶,仅有四个α
‑
琼胶酶的性能被挖掘和报道,且其稳定性、酶活和产物特异性均有待提高,因此琼四糖和琼六糖的大量工业化制备和应用收到了严重的限制。
6.国内外研究者一直在尝试对琼胶酶的异源表达,以期大幅提高其产量,突破天然
酶的分泌限制,而现有的研究主要集中于酶在大肠杆菌中的克隆表达,且主要定位于细胞质或周质空间,不利于酶的分离纯化及其在食品、医药等领域中的应用。即使是在枯草芽孢杆菌中分泌表达,分泌量也相对较低,因此,有必要建立并优化更安全、高效的琼胶酶食品级枯草芽孢杆菌分泌表达体系。
技术实现要素:
7.为了解决现有技术当中α
‑
琼胶酶来源稀少、表达量低、产物转换率低、特异性差等问题,本发明提供了一种编码α
‑
琼胶酶的基因,所述α
‑
琼胶酶的核苷酸序列如seq id no.1所示。
8.在本发明的一种实施方式中,所述α
‑
琼胶酶的基因是在核苷酸序列如seq id no.2所示α
‑
琼胶酶wt的基础之上优化得到的。
9.本发明还提供了一种携带上述α
‑
琼胶酶的基因的重组载体。
10.本发明还提供了一种携带上述α
‑
琼胶酶的基因,或上述重组载体的重组细胞。
11.本发明还提供了一种重组枯草芽孢杆菌,所述重组枯草芽孢杆菌含有上述基因,或上述重组载体。
12.在本发明的一种实施方式中,所述重组枯草芽孢杆菌以bacillus subtilis wb600、bacillus subtilis wb800或bacillus subtilis 168为表达宿主。
13.在本发明的一种实施方式中,所述重组枯草芽孢杆菌以pht01质粒、pht43质粒或pht304质粒为表达载体。
14.本发明还提供了一种制备琼四糖或琼六糖的方法,所述方法为:采用上述重组细胞,或上述重组枯草芽孢杆菌发酵制备得到α
‑
琼胶酶,利用α
‑
琼胶酶水解琼脂糖溶液获得琼四糖或琼六糖。
15.在本发明的一种实施方式中,所述方法为:将重组细胞或重组枯草芽孢杆菌接种至种子培养基中,制备得到种子液,将种子液接种至发酵培养基中进行发酵。
16.在本发明的一种实施方式中,将种子液按照2%~4%(v/v)的比例接种至发酵培养基中,在37℃下培养60~72h,将发酵液离心取上清液,即得α
‑
琼胶酶粗酶液。
17.在本发明的一种实施方式中,利用发酵所得的α
‑
琼胶酶粗酶液或经镍柱纯化后得到的纯酶于30~40℃水解0.25%~2%(w/w)的琼脂糖溶液制备琼四糖或琼六糖。
18.本发明还提供了上述基因,或上述重组载体,或上述重组细胞,或上述重组枯草芽孢杆菌,或上述方法在制备含有琼四糖或琼六糖的产品中的应用。
19.有益效果
20.(1)本发明提供了一种具有特定碱基序列的α
‑
琼胶酶,并且成功的采用食品安全菌株枯草芽孢杆菌对α
‑
琼胶酶进行异源表达,本发明的方法安全、高效,可应用于食品、药品的生产中,并且,采用本发明的方法,所表达的α
‑
琼胶酶粗酶液的催化活力可高达523.1u/mg。
21.(2)本发明提供的α
‑
琼胶酶具有较好的比酶活与热稳定性,且底物转化率也较高。
22.(3)本发明的α
‑
琼胶酶的琼胶转化率和产物纯度较高,经计算得到转化率可达约53%,其中琼四糖产量达0.34g/g,琼六糖产量达0.19g/g,可以有效提高稀有琼寡糖的产率,降低琼寡糖的生产加工成本,从而更具有工业应用价值。
wb600/pht01
‑
α
‑
aga
wt
。
41.实施例2:重组α
‑
琼胶酶的表达、分离、纯化
42.具体步骤如下:
43.(1)分别将实施例1制备得到的单菌落接种于50ml含有5μg/ml卡那霉素和5μg/ml赤霉素的lb液体培养基中,37℃、200rpm下摇瓶培养8~12h,制备得到种子液;
44.分别将上述制备得到的种子液按4%(v/v)的接种量转接至50ml含有5μg/ml卡那霉素和5μg/ml赤霉素的tb液体培养基中,30℃、200rpm下摇瓶培养60~72h,制备得到发酵液;
45.分别取30ml od600为6.0的发酵液在4℃、10000rpm下离心10min,取上清液,即为胞外粗酶液,α
‑
aga粗酶液的比酶活为:523.1u/mg;α
‑
aga
wt
粗酶液的比酶活为:360.4u/mg。
46.可见原始酶的粗酶液的酶活低于本发明提供的特定序列的酶活。
47.(2)采用镍柱对步骤(1)制备得到的重组α
‑
琼胶酶α
‑
aga和α
‑
aga
wt
进行纯化,平衡液(a液,ph 7.5)为500mm nacl+50mm tris
‑
hcl+20mm咪唑,洗脱液(b液,ph 7.5)为500mm nacl+50mm tris
‑
hcl+500mm咪唑。细胞液破碎离心后上清液调节ph至7.5,经0.45μm水系膜过滤后待纯化。在2ml/min流速下,用5~6个柱体积的缓冲液a平衡离子柱;上样,流速为2ml/min;之后先用6~8个柱体积的缓冲液a平衡离子柱,再采用15%的缓冲液b进行梯度洗脱,流速为2ml/min。根据洗脱峰收集对应洗脱液,置于透析袋中,在4℃条件下采用50mm、ph 7.5的tris
‑
hcl进行过夜透析,随后通过sds
‑
page蛋白电泳(结果如图1所示)及酶活测定的方式进行鉴定。据报道,重组α
‑
琼胶酶的计算分子量为158.88kda,与sds
‑
page估算分子量相符。
48.实施例3:重组α
‑
琼胶酶的最适ph及ph稳定性
49.分别检测实施例2制备得到的经纯化后的重组α
‑
琼胶酶α
‑
aga最适ph及ph稳定性,具体步骤如下:
50.(1)重组α
‑
琼胶酶的最适ph测定方法如下:分别采用50mm的柠檬酸钠缓冲液(ph3.0~6.0)、tris
‑
hcl缓冲液(ph 6.0~8.0)和甘氨酸
‑
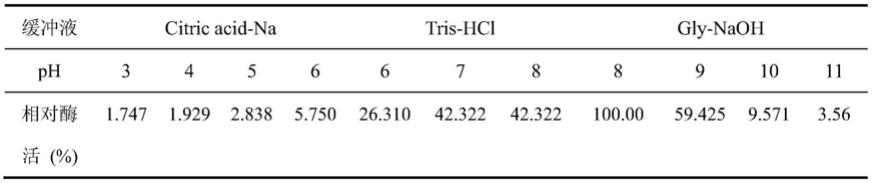
naoh缓冲液(ph 8.0~11.0)配制底物溶液,测定不同ph条件下的重组酶的酶活,以酶活最高者为100%,结果如表1和图2所示。
51.表1:不同ph条件下的相对酶活数据
[0052][0053]
(2)重组α
‑
琼胶酶的ph稳定性测定方法如下:分别采用50mm的柠檬酸钠缓冲液(ph3.0~6.0)、tris
‑
hcl缓冲液(ph 6.0~8.0)和甘氨酸
‑
naoh缓冲液(ph 8.0~11.0)配制底物溶液和稀释酶液,在4℃下放置6h后,测定其残余酶活力,以未保温酶液的酶活为100%,结果如表2和图3所示。
[0054]
表2:不同ph条件下放置6h后的相对酶活数据
[0055][0056]
重组α
‑
琼胶酶的最适ph和ph稳定性如图3所示。该酶在ph 8.0的gly
‑
naoh缓冲液中表现出最高的活力,且其在ph 6.0下稳定性最强,在ph 7.0
‑
10.0范围内相对活力均保持在60%以上,具有较好的ph稳定性。
[0057]
实施例4:重组α
‑
琼胶酶的应用
[0058]
由于原始酶α
‑
aga
wt
的酶活远低于优化后的α
‑
aga酶的酶活,因此,本实施例中采用优化后的α
‑
aga酶进行琼寡糖的生产制备;具体步骤如下:
[0059]
(1)分别配制浓度为0.25%(w/w)和0.5%(w/w)的琼脂糖溶液100g。
[0060]
(2)分别将浓度为0.25%(w/w)、0.5%(w/w)的琼脂糖溶液置于40℃水浴摇床中预热10min,分别得到反应体系1和反应体系2,随后分别向反应体系1和2中添加实施例2制备得到的纯酶液;添加量为10u/g,在40℃水浴摇床中反应1~24h,随后转移至沸水中灭酶20min,以终止反应;
[0061]
其中,用等量的tris
‑
hcl缓冲液替换酶液,作为空白对照。
[0062]
(3)待灭酶处理后,分别将反应体系1和2在10000rpm条件下离心10min,分别取上清液过0.22μm的水系膜去除杂质后,即可用高效液相色谱分析反应液中琼寡糖产物的种类和浓度。结果如表3所示:
[0063]
表3:不同底物浓度条件下产物的种类和浓度
[0064][0065]
色谱分析结果如图4(底物浓度为0.25%时琼四糖和琼六糖的产量)和图5(底物浓度为0.5%琼四糖和琼六糖的产量)所示,水解主产物为琼四糖(a4)和琼六糖(a6),且琼四糖所占比例较高;分别计算得到底物浓度为0.25%时总转化率可达约31%,底物浓度为0.5%总转化率可达约53%。
[0066]
对比例1:
[0067]
具体实施方式同实施例1~2,区别在于,调整宿主菌为枯草芽孢杆菌wb800和bs168,结果显示,制备得到的优化后的重组酶α
‑
琼胶酶α
‑
aga粗酶液的比酶活仅分别为:216.8u/mg和93.5u/mg。
[0068]
对比例2:
[0069]
具体实施方式同实施例1~2,区别在于,调整表达载体为pht43质粒和pht304质粒,结果显示,制备得到的优化后的重组酶α
‑
琼胶酶α
‑
aga粗酶液的比酶活仅分别为:130.2u/mg和174.9u/mg。
[0070]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1