一种低成本多能干细胞分化造血干细胞的培养基及培养方法与流程
1.本发明属于生物技术领域,涉及一种低成本多能干细胞分化造血干细胞的培养基及培养方法。
背景技术:
2.造血干细胞(hematopoietic stem cells,hscs)是一类多能干细胞,位于特殊的造血微环境,主要存在于骨髓中。能自我更新和多向分化为各种功能的血细胞,维持血液系统的建立和动态平衡。造血干细胞的这些重要特性以及造血干细胞移植在临床上的广泛应用,结合基因治疗和基因编辑技术的进步,使得基于造血干细胞治疗多种血液疾病和免疫疾病的基因治疗研究在近年来取得了很大的进展。
3.许多血液学家提出cd34细胞在人体的有效输注量为>5
×
10/kg,一些脐带血移植的权威们建议脐带血有核细胞的有效剂量为>3.7
×
10/其中cd34细胞含量按0 6%计算有22
×
10/kg。上述脐带血有核细胞和cd34细胞的有效剂量都是从临床实践中总结出来的。因此,获得大剂量的cd34细胞是必要的,而目前比较有效的培养基大都价格昂贵,大大提高了获得cd34细胞的成本,对于研究用或病患用都是一个很大的问题。
4.现有的干细胞培养基,价格高昂,导致了干细胞的培养成本较高;并且传统方法中的人多能干细胞诱导分化培养基中通常将多能干细胞与不同的基质细胞共同培养,如op9细胞等,直接定向诱导分化为造血细胞;然而方法中使用op9细胞具有未知风险,安全性低
技术实现要素:
5.本发明为了克服现有技术的不足,提供一种低成本多能干细胞分化造血干细胞的培养基及培养方法。
6.为了实现上述目的,本发明采用以下技术方案:一种低成本多能干细胞分化造血干细胞的培养基,包括第一阶段培养基和第二阶段培养基;
7.所述第一阶段培养基包括dmem/f12基础培养基、scf、rhg
‑
csf、vegf、pdgf、fgf2、nodal、亚硒酸钠、l
‑
抗坏血酸
‑2‑
磷酸酯镁盐、ab血清;所述第一阶段培养基中所述的scf、rhg
‑
csf、vegf、pdgf、fgf2、nodal的终浓度比为(1
‑
2)∶(1
‑
2)∶(0.5
‑
1)∶(1
‑
2)∶(1
‑
4)∶(1
‑
4);
8.所述第二阶段培养基包括rpmi
‑
1640基础培养基、chir99021、vegf、scf、il
‑
3、csf、tgfβ1、flt3l、epo、胰岛素以及ab血清;所述第二阶段培养基中所述的chir99021、vegf、scf、il
‑
3、csf、tgfβ1、flt3l、epo的终浓度比为(0.25
‑
1)∶(1
‑
2)∶(0.4
‑
1.6)∶(0.4
‑
1.6)∶(0.4
‑
1.6)∶(0.01
‑
0.1)∶(0.4
‑
1.6)∶(0.4
‑
1.6)。
9.可选的,所述的第一阶段培养基中scf的终浓度为50
‑
100ng/ml、rhg
‑
csf的终浓度为50
‑
100ng/ml、vegf的终浓度为10
‑
50mm/ml、pdgf的终浓度为50
‑
100ng/ml、fgf2的终浓度为50
‑
200ng/ml、nodal的终浓度为50
‑
200ng/ml、亚硒酸钠的终浓度为10
‑
100ug/ml、l
‑
抗坏血酸
‑2‑
磷酸酯镁盐的终浓度为50
‑
200ng/ml、ab血清的体积分数为10%;所述的第二阶段
培养基中chir99021的终浓度为1
‑
5um/ml、vegf的终浓度为50
‑
100ng/ml、scf的终浓度为20
‑
80ng/ml、il
‑
3的终浓度为20
‑
80ng/ml、csf的终浓度为20
‑
80ng/ml、tgfβ1的终浓度为0.5
‑
5ng/ml、flt3l的终浓度为20
‑
80ng/ml、epo的终浓度为20
‑
80ng/ml、胰岛素的终浓度为10
‑
50ug/ml、ab血清的体积分数为10%。
10.可选的,所述第一阶段培养基中,所述的scf、rhg
‑
csf、vegf、pdgf、fgf2、nodal的终浓度比为1∶1∶0.5∶1∶2∶2;所述第二阶段培养基中,所述的chir99021、vegf、scf、il
‑
3、csf、tgfβ1、flt3l、epo的终浓度比为0.04∶1.6∶1∶1∶1∶0.04∶1∶1。
11.可选的,所述第一阶段的培养基中scf的终浓度为80ng/ml、rhg
‑
csf的终浓度为80ng/ml、vegf的终浓度为80ng/ml、pdgf的终浓度为80ng/ml、fgf2的终浓度为100ng/ml、nodal的终浓度为100ng/ml、亚硒酸钠的终浓度为20ug/ml、l
‑
抗坏血酸
‑2‑
磷酸酯镁盐的终浓度为100ng/ml;所述第二阶段培养基中,chir99021的终浓度为2um/ml、vegf的终浓度为80ng/ml、scf的终浓度为50ng/ml、il
‑
3的终浓度为50ng/ml、csf的终浓度为50ng/ml、tgfβ1的终浓度为2ng/ml、flt3l的终浓度为50ng/ml、epo的终浓度为50ng/ml、胰岛素的终浓度为20ug/ml、ab血清的终浓度为10%。
12.本发明还公开了一种低成本多能干细胞分化造血干细胞的方法,包括以下步骤:s1:将多能干细胞置于aggrewell板中,并于权利要求1
‑
4任一项所述的第一阶段培养基中进行第一阶段的诱导分化成为拟胚体;
13.s2:将拟胚体置于权利要求1
‑
4任一项所述的第二阶段培养基中进行第二阶段的诱导分化。
14.可选的,将多能干细胞接种于aggrewell板进行拟胚体分化的第一阶段培养记为第0天,所述第一阶段的诱导分化自第0天开始至第4天结束,所述第二阶段的诱导分化自第4天开始至第12天结束。
15.可选的,所述第一阶段的诱导分化的第0天至第4天,接种时期使用第一阶段分化培养基,期间不换液;所述第二阶段的诱导分化的第4天将拟胚体转移至t75培养瓶中培养至第12天,转移时期加第二阶段分化培养基,期间不换液,自所述第二阶段的诱导分化起第4天开始,隔3天半量更换为新鲜的第二阶段培养基。
16.可选的,所述aggrewell板中多能干细胞的接种数量为每孔接种30万个细胞。
17.可选的,所述多能干细胞包括诱导多能干细胞、胚胎干细胞中的一种或两种。
18.综上所述:
19.1、本发明基于dmem/f12基础培养基进行改进,提高其功能性,使其可以代替stemlineⅱ培养基,价格成本可以降低10倍。
20.2、本发明避免了一些其他细胞系作为饲养诱导条件,使分化出的细胞更为安全,降低未知风险。
附图说明
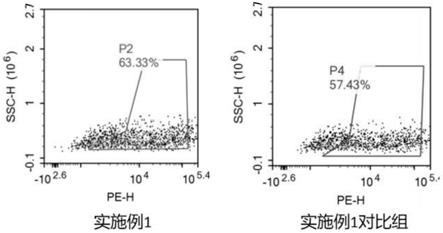
21.图1是流式检测实施例1及其对比组的cd34+阳性率的结果图;
22.图2是流式检测实施例2及其对比组的cd34+阳性率的结果图;
23.图3是流式检测阴性组的cd34+阳性率的结果图;
24.图4是实施例1及其对比组、实施例2及其对比组的阳性率柱状图。
具体实施方式
25.为了使本技术领域的人员更好的理解本发明方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的描述。
26.本实施例采用的细胞购于北京北纳创联生物技术研究院。
27.一种低成本多能干细胞分化造血干细胞的培养基及培养方法,采用细胞因子法诱导多能干细胞进行分化,所述多能干细胞包括诱导多能干细胞、胚胎干细胞中的一种或两种。
28.实施例1
29.本实施例提供细胞因子法诱导胚胎干细胞(es)分化成造血干细胞的培养基及方法。
30.本实施例采用的培养基包括第一阶段培养基、第二阶段培养基:
31.第一阶段培养基中,scf、rhg
‑
csf、vegf、pdgf、fgf2、nodal的终浓度比为1∶1∶0.5∶1∶2∶2,具体配方为:dmem/f12基础培养基中加入终浓度为80ng/ml的干细胞因子(stem cell factor,scf)、终浓度为80ng/ml的重组人粒细胞集落刺激因子(rhg
‑
csf)、终浓度为80ng/ml的vegf、终浓度为80ng/ml的pdgf、终浓度为100ng/ml的fgf2、终浓度为100ng/ml的nodal、终浓度为20ug/ml的亚硒酸钠、终浓度为100ng/ml的l
‑
抗坏血酸
‑2‑
磷酸酯镁盐、终浓度为10%的ab血清。
32.第二阶段培养基中chir99021、vegf、scf、il
‑
3、csf、tgfβ1、flt3l、epo的终浓度比为0.04∶1.6∶1∶1∶1∶0.04∶1∶1,具体配方为:e6基础培养基中加入终浓度为2μm的chir99021、终浓度为80ng/ml的vegf、终浓度为50ng/ml的干细胞因子(stem cell factor,scf)、终浓度为50ng/ml的白细胞介素
‑
3(il
‑
3)、终浓度为50ng/ml的csf、终浓度为2ng/ml的tgfβ1;终浓度为50ng/ml的flt3l、终浓度为50ng/ml的epo、终浓度为20ug/ml的胰岛素、终浓度为10%的ab血清。
33.本实施例采用的细胞因子法诱导胚胎干细胞(es)分化成造血干细胞的方法包括:
34.(1)用aars处理aggrewell 24孔板使aggrewell板适宜接种胚胎干细胞且确保不会贴壁并形成拟胚体;
35.(2)步骤(1)接种培养基使用第一阶段分化培养基,接种数量为每孔30万个细胞;
36.(3)接种当天记为第0天,在37℃、5%co2培养箱中培养4天,第4天在体视显微镜下挑选出成熟且状态较好的拟胚体,按照每150个拟胚体接种入t75培养瓶中,培养基使用第二阶段分化培养基,在37℃、5%co2培养箱中培养4天,此后隔3天半量换液以提高分化效率,在第12天收取造血干细胞。
37.为了做比较,本实施例还设置了对比组,对比组与本实施例的区别仅在于,仅采用如下配方的培养基进行第一次诱导分化:dmem/f12基础培养基中加入终浓度为40ng/ml的干细胞因子(stem cell factor,scf)、终浓度为40ng/ml的重组人粒细胞集落刺激因子(rhg
‑
csf)、终浓度为40ng/ml的vegf、终浓度为40ng/ml的pdgf、终浓度为50ng/ml的fgf2、终浓度为50ng/ml的nodal、终浓度为10ug/ml的亚硒酸钠、终浓度为50ng/ml的l
‑
抗坏血酸
‑2‑
磷酸酯镁盐、终浓度为10%的ab血清。
38.实施例2
39.本实施例是实施例1的变化例,变化之处仅在于多能干细胞的种类选用诱导多能
干细胞(ips)。
40.为了做比较,本实施例还设置了对比组,对比组与本实施例的区别仅在于,仅采用如下配方的培养基进行一次诱导分化:dmem/f12基础培养基中加入终浓度为40ng/ml的干细胞因子(stem cell factor,scf)、终浓度为40ng/ml的重组人粒细胞集落刺激因子(rhg
‑
csf)、终浓度为40ng/ml的vegf、终浓度为40ng/ml的pdgf、终浓度为50ng/ml的fgf2、终浓度为50ng/ml的nodal、终浓度为10ug/ml的亚硒酸钠、终浓度为50ng/ml的l
‑
抗坏血酸
‑2‑
磷酸酯镁盐、终浓度为10%的ab血清。
41.实施例1
‑
2的结果测试
42.cd34+阳性率的检测:取实施例1、实施例2及其对比组最终所得细胞,收集细胞到50ml离心管中1000r/min离心5min,弃上清后用1ml含2%(v/v)血清的pbs重悬,加入抗体cd34
‑
pe
‑
cy7,4℃孵育30min后用含2%血清的pbs洗一遍。然后以5
×
106/ml的密度重悬细胞,使用agilent novocyte流式仪细胞仪检测并分析其分化效率。在检测过程中,以普通es细胞为阴性组,即未进行造血诱导分化的细胞或者是虽进行分化实验但是并未用流式抗体染色的细胞。
43.结果实施例1及其对比组测试结果如图1、图4所示,流式细胞分析发现实施例1的cd34+阳性率上升到63.33%(其对比组为57.43%);实施例2及其对比组的测试结果如图2、图4所示,cd34+阳性率上升到49.18%(其对比组为30.74%),分化效率明显上升。阴性对比组见图3。
44.以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
45.显然,所描述的实施例仅仅本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1