重组酵母、构建方法和其在制备酪醇及衍生物中的应用与流程
重组酵母、构建方法和其在制备酪醇及衍生物中的应用
1.本案为申请号202010012886.7、申请日为2020年01月07日的分案申请
技术领域
2.本发明涉及重组酵母、构建方法和其在制备酪醇及衍生物中的应用,特别涉及一株通过外源性的果糖
‑6‑
磷酸盐磷酸酮酶(fructose
‑6‑
phosphate phosphoketolase,fxp)的表达基因导入酵母,以及利用该菌株高效生产酪醇及其衍生物的方法,属于微生物基因工程技术领域。
背景技术:
3.酪醇是天然的抗氧化剂,来源于橄榄油,是苯乙醇的一种衍生物。别名红景天苷元,是红景天的主要药用活性成分,是红景天苷、羟基酪醇的前体物质。可以保护细胞免受氧化伤害,是一种具有重要工业价值的酚类化合物,酪醇及其衍生物是多种有机化合物的合成前体,酪醇可被用于医药剂。酪醇的衍生物羟基酪醇是一种具有很强的抗氧化作用及多种生理医药功能,羟基酪醇的抗氧化性强于酪醇,同时可以合成很多聚合物,且没有已知毒性,在生物医药、功能食品等行业应用广泛,具有预防心血管、骨质缺乏等疾病的发生。目前,羟基酪醇的获得主要是从橄榄叶中提取,从植物中提取,成本高,占用大量的耕地。
4.化学法中利用苯乙醇合成法,大多先采用保护羟基,然后硝化、还原、重氮化、水解得到对羟基苯乙醇,收率为70%。苯乙醇价格高供应紧张,利用硝基甲苯合成,价格低廉但步骤较长,产率低,利用对羟基苯乙烯合成产率达到96%,纯度99%,产率和纯度都很高,具有一定的价值,但原料成本较高。化学法制备酪醇原料成本高且环境不友好,这些都直接制约了酪醇的工业化生产。因此,生物法合成酪醇及其衍生物已经成为研究热点。
5.酪醇(tyrosol)具有以下特征:化学名称为4
‑
(2
‑
hydroxyethyl)phenol,分子式为c8h
10
o2,分子量为138.164,cas号为501
‑
94
‑
0,结构式为
[0006][0007]
中国专利文献cn108753636a(申请号201810601213.8)公开了一种生产酪醇及羟基酪醇的酵母及构建方法,将pcaas和adh序列导入酵母by4741,得到生产酪醇的pcaas
‑
adh重组酵母;在所述pcaas
‑
adh重组酵母中导入pdc1基因敲除盒、tyra表达盒得到生产酪醇的pcaas
‑
adh
‑
δpdc1
‑
tyra重组酵母;将hpabc的dna序列导入pcaas
‑
adh
‑
δpdc1
‑
tyra重组酵母,得到生产羟基酪醇的pcaas
‑
adh
‑
hpabc
‑
δpdc1
‑
tyra重组酵母。在酵母by4741中构建酪醇或羟基酪醇生物合成途径,提高酪醇或羟基酪醇的产量。该技术虽然可以提高酵母中酪醇的产量,但酪醇产量仍然无法达到工业化生产的要求。受限于酵母中酪醇的合成受多种代谢途径的影响,且相关代谢途径并未完全研究清楚,因此,如何实现酪醇酵母发酵工业化仍然是目前亟需解决的技术难题。
技术实现要素:
[0008]
本发明针对现有技术的不足,提供重组酵母、构建方法和其在制备酪醇及衍生物中的应用。
[0009]
本发明的目的之一是在发明专利申请(申请号201810601213.8)的基础上,在酵母中表达来源于青春双岐杆菌(bifidobacterium adolescentis)菌种编号为atcc 15703的果糖
‑6‑
磷酸盐磷酸酮酶(fructose
‑6‑
phosphate phosphoketolase,ec 4.1.2.22)(氨基酸序列如genbank:baf39468.1所示,seq id no.1)或短双歧杆菌(bifidobacterium breve)bbri4的果糖
‑6‑
磷酸盐磷酸酮酶(fructose
‑6‑
phosphate phosphoketolase,ec 4.1.2.22)(氨基酸序列如genbank:knd53308.1所示,seq id no.2)的基因片段等,通过构建由果糖
‑6‑
磷酸催化生成酪醇生物合成重要前体物质赤藓糖
‑4‑
磷酸的新途径,提高酪醇的产率。
[0010]
本发明的目的之二是提供一种生产羟基酪醇的方法。
[0011]
本发明的目的之三是提供一种生产酪醇的酵母的构建方法。
[0012]
本发明的目的之四是提供所述一种生产酪醇的酵母或构建方法在生产酪醇中的应用。
[0013]
本发明的目的之五是提供所述一种生产酪醇的酵母或构建方法在生产羟基酪醇中的应用。
[0014]
为了解决以上技术问题,本发明的技术方案如下:
[0015]
重组酵母在生产酪醇中的应用,所述重组酵母为将外源性的果糖
‑6‑
磷酸盐磷酸酮酶的表达基因导入经过改造的酵母细胞中构建获得,所述经过改造的酵母细胞为具有经4
‑
磷酸赤藓糖和磷酸烯醇式丙酮酸合成酪醇代谢途径的酵母细胞。
[0016]
根据本发明优选的,所述经过改造的酵母细胞为将芳香醛合成酶和分支酸变位酶/预苯酸脱水酶整合后获得;或者所述经过改造的酵母细胞为将芳香醛合成酶整合后获得;
[0017]
根据本发明进一步优选的,所述芳香醛合成酶来源于香芹,酶的系统编号ec4.1.1.25;所述分支酸变位酶来源于大肠杆菌(e.coli),酶的系统编号ec1.3.1.12;所述预苯酸脱水酶来源于大肠杆菌(e.coli),酶的系统编号ec1.3.1.12,ec 5.4.99.5。
[0018]
根据本发明优选的,所述果糖
‑6‑
磷酸盐磷酸酮酶的表达基因来源于青春双岐杆菌(bifidobacterium adolescentis)、动物双歧杆菌(bifidobacterium animalis)、两歧双歧杆菌短双歧杆菌(bifidobacterium bifidum)、构巢曲霉(aspergillus nidulans)、短双歧杆菌(bifidobacterium breve)、乳酸双歧杆菌(bifidobacterium lactis)、丙酮丁醇梭菌(clostridium acetobutylicum)、长双歧杆菌(bifidobacterium longum)、齿双歧杆菌(bifidobacterium dentium)、肠系膜明串珠菌(leuconostoc mesenteroides)、摩恩格里艾恩斯双歧(bifidobacterium mongoliense)、类植物乳杆菌(lactobacillus paraplantarum)、胚牙乳杆菌(lactobacillus plantarum)、假长双歧杆菌(bifidobacterium pseudolongum)、热带假丝酵母(candida tropicalis)、新生隐球菌(cryptococcus neoformans)、钩虫贪铜菌(cupriavidus necator)、加德纳菌(gardnerella vaginalis)、腐生性酵母菌红酵母菌(rhodotorula glutinis)、禾本红酵母(rhodotorula graminis)、巴氏酵母(saccharomyces pastorianus)等。
glabrata)、德布尔有孢酵母(torulaspora delbrueckii)、汉斯德巴氏酵母菌(debaryomyces hansenii)、树干毕赤酵母(scheffersomyces stipites)、季也蒙毕赤酵母(meyerozyma guilliermondii)、长孢洛德酵母(lodderomyces elongisporus)、白假丝酵母菌(candida albicans)、拟平滑念珠菌(candida orthopsilosis)、似平滑念珠菌(candida metapsilosis)、都柏林酵母菌(candida dubliniensis)、葡萄牙棒孢酵母(clavispora lusitaniae)、耳念珠菌(candida auris)等。
[0039]
进一步优选的,所述酵母细胞为酿酒酵母,菌种编号为cicc1964;所述马克斯克鲁维酵母(kluyveromyces marxianus),菌种编号为nbrc1777。
[0040]
进一步优选的,所述步骤(2)中,经过改造的酵母细胞为将来源于香芹(petroselinum crispum)的芳香醛合成酶整合到酿酒酵母cicc1964的delta12位点,获得。
[0041]
根据本发明更优选的,所述步骤(2)中,经过改造的酵母细胞为将来源于香芹(petroselinum crispum)的芳香醛合成酶整合到酿酒酵母cicc1964的delta12位点,并将来源于大肠杆菌(e.coli)的分支酸变位酶/预苯酸脱水酶替换酿酒酵母cicc1964的pdc1基因,获得。
[0042]
进一步优选的,所述步骤(2)中,所述经过改造的酵母细胞为将来源于香芹(petroselinum crispum)的芳香醛合成酶整合到马克斯克鲁维酵母nbrc1777的delta12位点,获得。
[0043]
根据本发明更优选的,所述步骤(2)中,所述经过改造的酵母细胞为将来源于香芹(petroselinum crispum)的芳香醛合成酶整合到马克斯克鲁维酵母nbrc1777的delta12位点,并将来源于大肠杆菌(e.coli)的分支酸变位酶/预苯酸脱水酶替换马克斯克鲁维酵母nbrc1777的pdc1基因,获得。
[0044]
上述方法构建的高产酪醇的重组酵母。
[0045]
上述高产酪醇的重组酵母在发酵制备酪醇中的应用。
[0046]
根据本发明优选的,所述发酵的发酵培养基中至少含有葡萄糖、果糖、蔗糖之一或二者以上的组合与酪氨酸。
[0047]
上述高产酪醇的重组酵母在发酵制备羟基酪醇中的应用。
[0048]
根据本发明优选的,将上述高产酪醇的重组酵母通过发酵制备酪醇后,经过羟化酶反应获得羟基酪醇。
[0049]
根据本发明优选的,将上述高产酪醇的重组酵母经发酵所得酪醇,利用过表达4
‑
羟基苯乙酸羟化酶的大肠杆菌催化,获得羟基酪醇。
[0050]
根据本发明进一步优选的,所述的发酵的发酵培养基中至少含有葡萄糖、果糖、蔗糖之一或二者以上的组合与酪氨酸。
[0051]
本发明的有益效果:
[0052]
1、本发明首次公开了在酵母中表达过程中,果糖
‑6‑
磷酸(fructose
‑6‑
phosphate)在合成1,6
‑
二磷酸果糖(beta
‑
d
‑
fructose 1,6
‑
bisphosphate)的同时,被催化为赤藓糖
‑4‑
磷酸(erythrose
‑4‑
phosphate)和乙酰磷酸(acetyl
‑
phosphate),木酮糖
‑5‑
磷酸(xylulose
‑5‑
phosphate)被催化为甘油醛
‑3‑
磷酸(glyceraldehydes
‑3‑
phosphate)和乙酰磷酸,这改变了酵母中的碳代谢流量分布,增强酪醇生物合成重要中间物质的赤藓糖
‑4‑
磷酸的合成,优化了合成酪醇的代谢途径,提高酪醇及羟基酪醇等衍生物的产率;
[0053]
2、本发明将外源性的果糖
‑6‑
磷酸盐磷酸酮酶的表达基因导入经过改造的酵母细胞中,获得了一种重组酵母,该重组酵母可以提高酪醇的产率,并利用过表达4
‑
羟基苯乙酸羟化酶的大肠杆菌催化酪醇后,获得羟基酪醇。
[0054]
3、本发明提供了一种新型且环境友好型酪醇及羟基酪醇生物制备技术,为酪醇及羟基酪醇的大规模工业生产奠定了基础,具有重要的经济价值和社会效益。
附图说明
[0055]
图1为实施例1中所述的重组质粒pug6的结构图;
具体实施方式
[0056]
应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
[0057]
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本技术的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
[0058]
下面结合实施例对本发明进一步说明:
[0059]
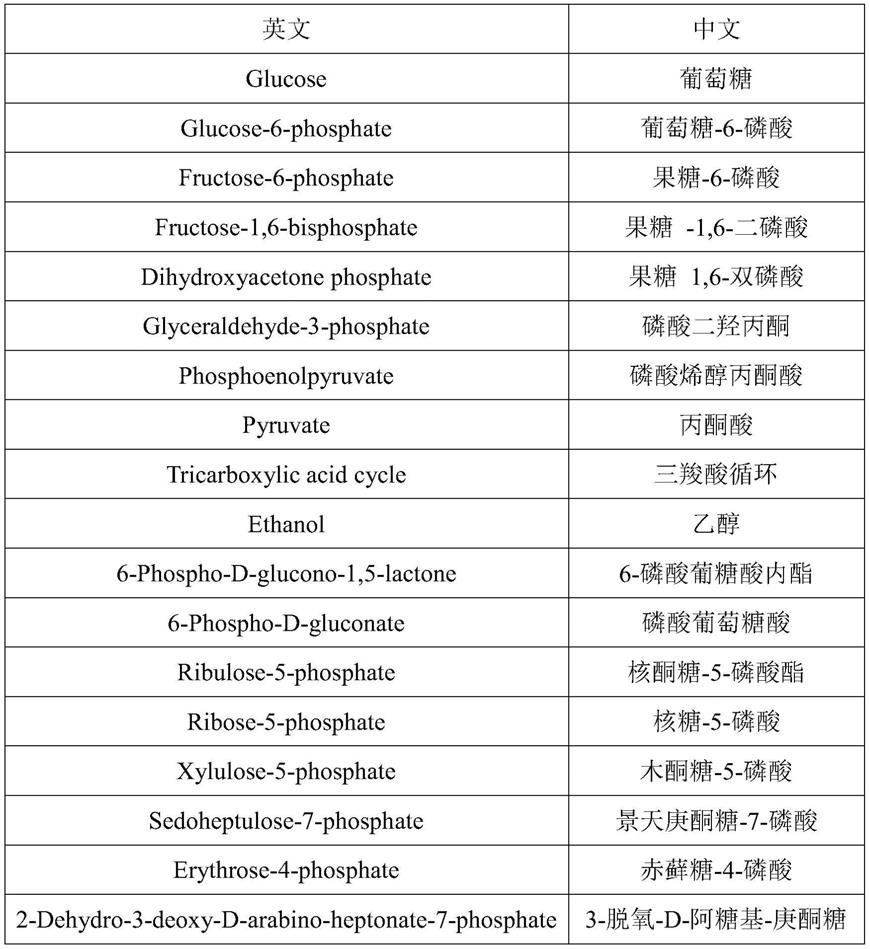
表1中英文名称的对照
[0060][0061][0062]
以下实施例中,大肠杆菌bl21和表达载体pet
‑
28a为市售常用。下列实施例中未注明具体条件的实验方法,按照常规条件进行,例如《分子克隆:实验室手册》中所述的条件,或按照相应生物学试剂的制造厂商所建议的条件。pcr扩增反应的反应程序可以为常规的
pcr扩增反应程序。
[0063]
酿酒酵母cicc1964,购自中国工业微生物菌种保藏管理中心,菌种编号cicc1964,为已知非保藏菌株;
[0064]
按照发明专利申请(申请号201810601213.8)的方法,将来源于香芹(petroselinum crispum)的芳香醛合成酶(aas,aromatic aldehyde synthase,ec4.1.1.25)整合到酿酒酵母cicc1964的delta12位点,并将来源于大肠杆菌(e.coli)的分支酸变位酶/预苯酸脱水酶(tyra,fused chorismate mutase t/prephenate dehydrogenase,ec1.3.1.12,ec 5.4.99.5)替换酿酒酵母cicc1964的pdc1基因,获得sc
‑
1菌株。
[0065]
实施例1
[0066]
bafxpk和bbfxpk表达盒的构建
[0067]
将seq id no.1和seq id no.2的氨基酸序列根据宿主酿酒酵母密码子偏好性进行密码子优化,获得seq id no.1和seq id no.2对应的优化后核苷酸序列seq id no.3和seq id no.4后,进行基因合成。选用引物对bafxpk
‑
f/bafxpk
‑
r和bbfxpk
‑
f/bbfxpk
‑
r,用vazyme公司的phanta max high
‑
fidelity dna聚合酶扩增获得目标基因果糖
‑6‑
磷酸盐磷酸酮酶的表达基因(bafxpk片段核苷酸序列如seq id no.3所示,bbfxpk片段核苷酸序列如seq id no.4所示)。以酿酒酵母cicc1964的基因组为模板,以引物对u
‑
f/u
‑
r和d
‑
f/d
‑
r pcr扩增上下游同源臂的dna片段,以引物对ptpi1
‑
f/ptpi1
‑
r和tgpm1
‑
f/tgpm1
‑
r扩增启动子tpi1和终止子gpm1片段。以带有遗传霉素(geneticin)抗性基因kanmx4(核苷酸序列如seq id no.24所示)的重组质粒pug6见附图1的dna为模板,以引物对g418
‑
f/g418
‑
r经pcr扩增抗性基因kanmx4的dna片段。琼脂糖凝胶电泳验证条带大小正确后切取条带,用omega凝胶提取试剂盒回收基因片段。pcr扩增引物如下:
[0068]
引物对bafxpk
‑
f/bafxpk
‑
r的序列为seq id no.13和seq id no.14;引物对bbfxpk
‑
f/bbfxpk
‑
r的序列为seq id no.15和seq id no.16;引物对u
‑
f/u
‑
r的序列为seq id no.5和seq id no.6;引物对d
‑
f/d
‑
r的序列为seq id no.7和seq id no.8;引物对ptpi1
‑
f/ptpi1
‑
r的序列为seq id no.9和seq id no.10;引物对tgpm1
‑
f/tgpm1
‑
r的序列为seq id no.11和seq id no.12;引物对g418
‑
f/g418
‑
r的序列为seq id no.17和seq id no.18;
[0069]
使用高保真性phanta max high
‑
fidelity dna聚合酶扩增目的基因片段,并保证每条片段都与相邻片段存在50bp的同源序列,pcr产物经凝胶电泳后使用dna片段胶回收试剂盒回收,并测定dna浓度。随后将获得的纯化后的带有同源序列的dna片段采用融合pcr的方法进行融合:
[0070]
(1)使用phanta max high
‑
fidelity dna聚合酶对片段进行连接。反应体系如表2所示:
[0071]
表2反应体系
[0072][0073]
将上述试剂加入pcr管中,反应条件如表3所示:
[0074]
表3反应条件
[0075][0076][0077]
(2)以步骤1的pcr反应产物作为pcr扩增模板,选用引物对yzaw
‑
f/yzaw
‑
r,用vazyme公司的phanta max high
‑
fidelity dna聚合酶扩增获得目标片段。琼脂糖凝胶电泳验证条带大小正确后切取条带,用omega凝胶提取试剂盒回收dna片段即bafxpk和bbfxpk表达盒的dna片段。pcr扩增引物如下:
[0078]
yzaw
‑
f的序列为seq id no.19;yzaw
‑
r的序列为seq id no.20;
[0079]
(3)将步骤2所获得的bafxpk和bbfxpk表达盒的dna片段,测序验证。
[0080]
实施例2
[0081]
bafxpk和bbfxpk异源表达菌株的构建,以酿酒酵母为例:
[0082]
采用peg/liac法转化酿酒酵母酪醇合成菌株cicc1964,通过在培养基中添加g418抗性进行筛选挑取单克隆,提取基因组,利用引物对yzaw
‑
f/yzaw
‑
r进行pcr验证,获得sc
‑
bafxpk和sc
‑
bbfxpk菌株。
[0083]
实施例3
[0084]
合成酪醇微生物的发酵,以酿酒酵母为例:
[0085]
在产酪醇的菌株cicc1964和sc
‑
bafxpk和sc
‑
bbfxpk的平板上挑取单克隆,接种到
5ml ypd液体培养基中,在30~32℃,200rpm条件下培养24h,转接到50ml ypd液体培养基中,初始接种od
600
为0.2,30℃,200rpm条件下培养12h后,转接到100ml ypd液体培养基中,初始接种od
600
为0.2,培养基中分别含有2%葡萄糖或者2%蔗糖或者2%葡萄糖和1%酪氨酸等碳源,培养24小时后,再次加入2%葡萄糖或者2%蔗糖或者2%葡萄糖和1%酪氨酸等碳源,共进行72小时发酵。采用文献(satoh et al.,journal of agricultural and food chemistry,60,979
‑
984,2012)报道的hplc法检测发酵液中酪醇的浓度。不同碳源培养条件下酪醇产量如表4所示。
[0086]
表4不同碳源下发酵72小时后酪醇的产量
[0087][0088][0089]
实施例4
[0090]
基因hpabc及大肠杆菌表达载体的获得方法
[0091]
将来源于大肠杆菌的4
‑
羟基苯乙酸羟化酶(hpabc,4
‑
hydroxyphenylacetate3
‑
hydroxylase,酶的系统编号ec 1.5.1.37)的dna序列基因簇在大肠杆菌中过表达,利用大肠杆菌全细胞将酪醇催化为羟基酪醇。
[0092]
所述4
‑
羟基苯乙酸羟化酶的氨基酸序列基因簇包括4
‑
羟基苯乙酸羟化酶(hpab)的氨基酸序列为seq id no.21,对应的核苷酸序列为seq id no.23;4
‑
羟基苯乙酸羟化酶(hpac)的氨基酸序列为seq id no.22,对应的核苷酸序列为seq id no.24。
[0093]
利用细菌基因组试剂盒提取大肠杆菌de3基因组作为模板,分别使用引物对hpab
‑
f/hpab
‑
r和hpac
‑
f/hpac
‑
r来扩增seq id no.23和seq id no.24,测序验证。hpab
‑
f的序列为seq id no.25;hpab
‑
r的序列为seq id no.26;hpac
‑
f的序列为seq id no.27;hpac
‑
r的序列为seq id no.28。
[0094]
以pet
‑
28a作为表达载体,培养含有pet
‑
28a空载体的大肠杆菌,利用细菌质粒提取试剂盒提取pet
‑
28a质粒,采用常规分子生物学方法,构建表达载体pethpabc(seq id no.29)。然后将pethpabc转化大肠杆菌表达型载体bl21,以卡那霉素为筛选标记,获得单克隆bl21
‑
pethpabc。
[0095]
摇瓶培养bl21
‑
pethpabc,使用1mm iptg诱导表达hpab/c的表达。
[0096]
将获得的bl21
‑
pethpabc菌培养液添加到实施例3的培养液中,反应3小时后,检测获得的羟基酪醇产量结果如表5所示:
[0097]
表5在表4所示的培养液中添加bl21
‑
pethpabc菌后混合3小时后羟基酪醇的产量
[0098][0099]
实施例5
[0100]
采用马克斯克鲁维酵母(kluyveromyces marxianus),菌种编号为nbrc1777,按照发明专利申请(申请号201810601213.8)的方法,将来源于香芹(petroselinum crispum)的芳香醛合成酶(aas,aromatic aldehyde synthase,ec4.1.1.25)整合到马克斯克鲁维酵母的delta12位点,并将来源于大肠杆菌(e.coli)的分支酸变位酶/预苯酸脱水酶(tyra,fused chorismate mutase t/prephenate dehydrogenase,ec1.3.1.12,ec 5.4.99.5)替换马克斯克鲁维酵母的pdc1基因,获得具有经4
‑
磷酸赤藓糖和磷酸烯醇式丙酮酸合成酪醇代谢途径的马克斯克鲁维酵母菌株。
[0101]
按照本发明实施例1
‑
2所述方法,将果糖
‑6‑
磷酸盐磷酸酮酶(fructose
‑6‑
phosphate phosphoketolase,ec 4.1.2.22)制备获得的km
‑
bafxp和km
‑
bbfxp菌株,不同之处在于,马克斯克鲁维酵母细胞的培养温度为42~49℃。
[0102]
实施例6
[0103]
采用来源于齿双歧杆菌(bifidobacterium dentium)的果糖
‑6‑
磷酸盐磷酸酮酶(bdfxp,genbank:baq26957.1),氨基酸序列如seq id no.30所示,按照实施例3和实施例4所述的方法进行,所用引物对bdfxp
‑
f/bdfxp
‑
r的序列为seq id no.32和seq id no.33;结果与实施例3和实施例4的相似,也提高了酪醇和羟基酪醇的产量。具体结果如下:
[0104]
表6不同碳源下发酵72小时后酪醇的产量
[0105][0106]
表7在表6所示的培养液中添加bl21
‑
pethpabc菌后混合3小时后羟基酪醇的产量
[0107][0108]
实施例7
[0109]
按照实施例1
‑
2所述的方法,将来源于香芹(petroselinum crispum)的芳香醛合
成酶(aas,aromatic aldehyde synthase,ec4.1.1.25)整合到酿酒酵母cicc1964的delta12位点,并且将如seq id no.4所示的果糖
‑6‑
磷酸盐磷酸酮酶(fructose
‑6‑
phosphate phosphoketolase,ec4.1.2.22)导入上述酵母中,获得sc
‑
bbfxpk
‑
aas菌株。结果与实施例3中sc
‑
bbfxpk菌株的酪醇产量相似。
[0110]
将获得的bl21
‑
pethpabc菌培养液添加到上述制得的含有酪醇的培养液中,反应3小时后,检测获得的羟基酪醇产量也和实施例4中所述sc
‑
bbfxpk菌株的产量相似。说明酵母中没有分支酸变位酶/预苯酸脱水酶(tyra,fused chorismate mutase t/prephenate dehydrogenase,ec1.3.1.12,ec 5.4.99.5)基因导入,也可以达到相近的酪醇和羟基酪醇产量;具体结果如表8和表9所示:
[0111]
表8不同碳源下发酵72小时后酪醇的产量
[0112][0113]
表9在表8所示的培养液中添加bl21
‑
pethpabc菌后混合3小时后羟基酪醇的产量
[0114][0115]
实施例8
[0116]
按照实施例6所述的方法,分别将来源于动物双歧杆菌(bifidobacterium animalis)的果糖
‑6‑
磷酸盐磷酸酮酶(baifxp,genbank:wp_052826255.1)氨基酸序列如seq id no.34所示,两歧双歧杆菌短双歧杆菌(bifidobacterium bifidum)的果糖
‑6‑
磷酸盐磷酸酮酶(bbifxp,genbank:wp_047289945.1)氨基酸序列如seq id no.35所示,乳酸双歧杆菌(bifidobacterium lactis)的果糖
‑6‑
磷酸盐磷酸酮酶(blafxp,genbank:cac29121.1)氨基酸序列如seq id no.36所示,长双歧杆菌(bifidobacterium longum)果糖
‑6‑
磷酸盐磷酸酮酶(blofxp,genbank:pwh09343.1)氨基酸序列如seq id no.37所示,摩恩格里艾恩斯双歧(bifidobacterium mongoliense)的果糖
‑6‑
磷酸盐磷酸酮酶(bmfxp,genbank:cac29121.1)氨基酸序列如seq id no.38所示,假长双歧杆菌(bifidobacterium pseudolongum)的果糖
‑6‑
磷酸盐磷酸酮酶(bpfxp,genbank:wp_034883174.1)氨基酸序列
如seq id no.39所示,构巢曲霉(aspergillus nidulans)的果糖
‑6‑
磷酸盐磷酸酮酶(anfxp,genbank:cbf76492.1)氨基酸序列如seq id no.40所示,丙酮丁醇梭菌(clostridium acetobutylicum)的果糖
‑6‑
磷酸盐磷酸酮酶(cafxp,genbank:khd36088.1)氨基酸序列如seq id no.41所示,肠系膜明串珠菌(leuconostoc mesenteroides)的果糖
‑6‑
磷酸盐磷酸酮酶(lmfxp,genbank:aav66077.1)氨基酸序列如seq id no.42所示,类植物乳杆菌(lactobacillus paraplantarum)的果糖
‑6‑
磷酸盐磷酸酮酶(lprfxp,genbank:alo04878.1)氨基酸序列如seq id no.43所示,胚芽乳杆菌(lactobacillus plantarum)的果糖
‑6‑
磷酸盐磷酸酮酶(lplfxp,genbank:kru19755.1)氨基酸序列如seq id no.44所示对应的基因片段转化改造的酿酒酵母;分别获得改造菌株sc
‑
baifxp,sc
‑
bbifxp,sc
‑
blafxp,sc
‑
blofxp,sc
‑
bmfxp,sc
‑
bpfxp,sc
‑
anfxp,sc
‑
cafxp,sc
‑
lmfxp,sc
‑
lprfxp,sc
‑
lplfxp;所述改造的酿酒酵母为将来源于香芹(petroselinum crispum)的芳香醛合成酶整合到酿酒酵母cicc1964的delta12位点。结果与实施例3和实施例4的相似,也提高了酪醇和羟基酪醇的产量。具体结果如表8和表9所示:
[0117]
表8不同碳源下发酵72小时后酪醇的产量
[0118][0119]
表9在表8所示的培养液中添加bl21
‑
pethpabc菌后混合3小时后羟基酪醇的产量
[0120][0121]
从以上的结果来看,当酵母细胞中表达以上外源性的果糖
‑6‑
磷酸盐磷酸酮酶时,虽然产量有所不同,和实施例3、实施例4和实施例5的来源于青春双岐杆菌、短双歧杆菌以及齿双歧杆菌的果糖
‑6‑
磷酸盐磷酸酮酶相比,产量较低,但是和出发菌株相比,酪醇和羟基酪醇的产量均有显著提高。
[0122]
基于实施例7的结果,发明人同时对以上果糖
‑6‑
磷酸盐磷酸酮酶对应的基因片段转化按照发明专利申请(申请号201810601213.8)的方法获得的sc
‑
1菌株,即:将来源于香芹(petroselinum crispum)的芳香醛合成酶(aas,aromatic aldehyde synthase,ec4.1.1.25)整合到酿酒酵母cicc1964的delta12位点,并将来源于大肠杆菌(e.coli)的分支酸变位酶/预苯酸脱水酶(tyra,fused chorismate mutase t/prephenate dehydrogenase,ec1.3.1.12,ec5.4.99.5)替换酿酒酵母cicc1964的pdc1基因获得;结果显示baifxp,bbifxp,blafxp,blofxp,bmfxp,bpfxp,anfxp,cafxp,lmfxp,lprfxp,lplfxp与实施例7中bbfxpk的结果类似,从而说明酵母中有没有分支酸变位酶/预苯酸脱水酶(tyra,fused chorismate mutase t/prephenate dehydrogenase,ec1.3.1.12,ec 5.4.99.5)基因的导入,对酪醇和羟基酪醇产量影响不大具有普遍性。
[0123]
结果分析
[0124]
通过上述结果本领域技术人员可以发现,当酵母细胞中表达外源性的果糖
‑6‑
磷酸盐磷酸酮酶时,可以显著提高酪醇的产量,并且该现象并非仅限于一种来源的果糖
‑6‑
磷酸盐磷酸酮酶和特异的酵母细胞,本领域技术人员通过本发明的技术教导可以预期,具有
经4
‑
磷酸赤藓糖和磷酸烯醇式丙酮酸合成酪醇代谢途径的酵母细胞中通过表达果糖
‑6‑
磷酸盐磷酸酮酶后,由于代谢外源性的果糖
‑6‑
磷酸盐磷酸酮酶的表达影响了酵母细胞的该糖代谢途径,从而促进了酪醇产物的生成,因此均能够产生本技术所述的技术效果。
[0125]
以上所述仅为本技术的优选实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1