一种生物合成乙醇的构建体,菌株以及生产乙醇的方法
1.本发明涉及生物技术领域,具体涉及一种生物合成乙醇的构建体,菌株以及生产乙醇的方法。
背景技术:
2.随着化石燃料的枯竭,可再生能源的发展受到了极大的关注。蓝藻(cyanobacteria)是一种可以进行厌氧型光合作用的大型单细胞原核生物,其光合作用并以水为电子受体进行放氧。使整个地球大气从无氧状态发展到有氧状态,从而孕育了一切好氧生物的进化和发展。蓝藻作为碳固定场所,可以固定大气中的co2。目前,利用工程蓝藻生产可再生生物燃料乙醇”,在可再生能源问题上受到越来越多的重视。集胞藻pcc6803(synechocystis sp)是一种单细胞球形蓝藻,能利用光能进行自养生长,又能利用葡萄糖进行异养生长。随着基因组全序列测定的完成,它简单遗传背景逐渐被人们所认识,并常被用作研究蓝藻生理特点和基因调控的模式生物。
3.集胞藻目前已被作为微生物细胞工厂,通过基因工程改造后已成功合成多种高价值分子产品,如乙醇,乙烯,丙酮,异戊二烯,异丁醇、中长链脂肪酸、脂肪醇、脂肪烃以及胞外多糖等重要物质。自从deng and coleman报告第一例乙醇基因工程产生于蓝藻pcc7942,在rbcls作为启动子的控制下表达了丙酮酸脱羧酶和乙醇运动发酵单胞菌脱氢酶,乙醇积累量达到约5mm(0.23g/l)。随后,dexter和fu证明可以在集胞藻pcc6803中产生生物乙醇,产量达到10mm(0.46g/l)。但从生物合成量的角度来说,目前利用集胞藻合成生物活性物质所获得的实际产量远低于理论目标产值。因此,优化集胞藻合成代谢途径的关键酶或基因及提高蓝藻的有效资源化利用率成为工业生产应用的重要瓶颈,其开发技术有待进一步研究。
技术实现要素:
4.有鉴于此,为了增加乙醇的生产能力,本发明提供了一种生物合成乙醇的构建体,菌株以及生产乙醇的方法。
5.为实现上述目的,本发明采用的技术方案为:本发明的一方面通过高效启动丙酮酸脱羧酶和nadph依赖型醛还原酶,并提高其活性,进而提高乙醇产量,实现利用蓝细菌高效合成生物乙醇的目的。
6.在本发明的另一个方面,在集胞藻pcc6803中构建一条高效合成生物乙醇的代谢途径,实现乙醇在集胞藻pcc6803体内的合成。
7.本发明提供了一种能高效产生乙醇的构建体,所述构建体包含与在蓝细菌中具有活性的启动子可操作的连接第一基因和第二基因;其中,第一基因为丙酮酸脱羧酶基因,其序列如seq id no.2所示,第二基因为nadph依赖型醛还原酶基因,其序列如seq id no.3;所述的具有活性的启动子是光强启动子pcpc560,其序列如seq id no.1所示。
8.进一步地,所述构建体中敲除了磷酸烯醇丙酮酸脱羧酶。
9.更进一步地,所述构建体在两端分别具有蓝细菌基因的上游片段和下游片段,从而所述构建体可以通过同源重组整合入蓝细菌基因组中所述蓝细菌基因所在的位置,所述蓝细菌基因的上游片段和下游片段为集胞藻pcc6803的slr0168基因的n
‑
末端序列和c
‑
末端序列,或集胞藻pcc6803的slr0301基因的n
‑
末端序列和c
‑
末端序列;所述slr0301基因的n
‑
末端序列如seq id no.4所示,slr0301基因的c
‑
末端序列如seq id no.5所示。
10.更进一步地,所述构建体还包含有用于筛选蓝细菌转化体的标记基因;所述标记基因包括但不限于,例如卡那霉素抗性基因(例如参见nc_003239.1),红霉素抗性基因(例如参见nc_015291.1)和壮观霉素抗性基因其序列如seq id no.7所示。此类标记基因是本领域技术人员熟知的。
11.本发明还提供了一种重组载体,其包含上述的构建体。
12.本发明还提供了一种包含上述构建体或重组载体的菌株。
13.本发明还提供了一种蓝细菌,所述蓝细菌是集胞藻pcc6803,其包含上述构建体或重组载体。
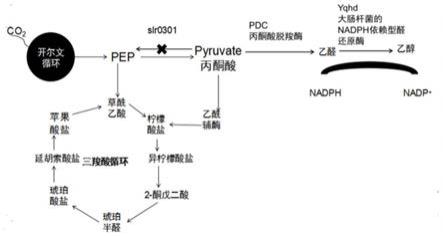
14.进一步地,所述蓝细菌通过基因手段使光强启动子pcpc560驱动丙酮酸脱羧酶及nadph依赖型醛还原酶的一个和/或多个基因位点表达。更进一步地,所述蓝细菌敲除磷酸烯醇丙酮酸合成途径。
15.本发明还提供了一种在蓝细菌中生产乙醇的方法,所述方法为将上述构建体导入集胞藻pcc6803中,培养后获得基因工程蓝藻,从培养物中获得乙醇。所述的集胞藻pcc6803中还包含用于筛选蓝细菌转化体的标记基因。
16.与现有技术相比,本发明的有益效果是:本发明使用基因工程技术将乙醇合成的外源关键功能基因引入到集胞藻pcc6803基因组中,以提高乙醇的生物合成产量。本发明利用超强启动性的光强启动子pcpc560驱动来源于运动发酵单胞菌的丙酮酸脱羧酶(pdc)和nadph依赖型醛还原酶yqhd基因在蓝细菌中一个和多个基因位点表达,利用分子技术首次对丙酮酸代谢反向的蓝藻内源途径进行敲除,包括敲除磷酸烯醇丙酮酸合成途径从而构建合成具有高乙醇产量的基因工程蓝藻。本发明利用同源双交换引入外源乙醇合成基因并选用超强启动子pcpc560来驱动外源乙醇合成基因的表达,首次成功地在集胞藻pcc6803中构建了一条高效合成生物乙醇的代谢途径,可提高乙醇合成前体丙酮酸含量,实现乙醇在集胞藻pcc6803体内的高效合成,具有良好的可行性。
附图说明
17.图1是生物合成乙醇的代谢途径流程图;图2是载体pmd0168的基本结构图;图3是质粒pet406的基本结构图;图4是质粒pet01的基本结构图;图5是质粒pet02的基本结构图;图6是质粒pet03的基本结构图;图7是外源乙醇合成基因的表达情况图;图8是乙醇的hplc检测图;
图9是乙醇生产曲线图;图10是工程菌株syn03与菌株syn02的乙醇产量对比图。
具体实施方式
18.下面将结合附图和实施例对本发明的实施方案进行详细描述,下列附图和实施例仅用于说明本发明,而不是对本发明的范围的限定。除非特别指明,否则本发明中所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
19.相关术语:在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。本文中所涉及的菌株培养,分子生物学,分子遗传学等操作步骤均为相应领域内广泛的常规步骤。同时为了更好地理解本发明,下面提供相关术语的定义和解释。
20.如本发明中所使用的“蓝细菌(cyanobacteria)”是一类光和自养的原核微生物,其能够利用太阳能固定二氧化碳。蓝细菌也称为蓝藻,在发明中,蓝细菌和蓝藻可以互换使用。本发明中所使用的蓝细菌为集胞藻pcc6803,购自于中科院水生生物研究所。
21.如本发明中所使用的“丙酮酸脱羧酶”(pyruvate decarboxylase pdc)能够催化由丙酮酸转化为乙醛的酶。
22.如本发明中所使用的“nadph依赖性醛还原酶”(nadph
‑
dependent aldehyde reductase yqhd)是一种能够催化由乙醛转化为乙醇的反应的酶并在转化过程中消耗nadph。
23.如本发明中所使用的pcpc560启动子是指集胞藻pcc6803基因组中编码催化光合作用中卡尔文循环的第一个反应的核酮糖
‑
1,5
‑
二磷酸羧化酶/加氧酶(ribulose
‑
1,5
‑
bisphosphate carboxylase/oxygenase,rubisco)的操纵子的启动子,其序列如seq id no.1所示,pcpc560启动子在蓝细菌中具有活性。
24.如本发明中所使用的slr0168基因(参见nc_954899)是集胞藻pcc6803基因组中编码一个未知蛋白的基因。大量的研究证明slr0168基因的缺失对蓝藻的生长活动没有影响。该基因所在位置是一个中性位点。
25.如本发明中所使用的slr0301基因(参见nc_92236)是集胞藻pcc6803基因组中编码磷酸烯醇式丙酮酸合成酶的基因,该基因的缺失会增加中间体丙酮酸的积累量。
26.如本发明中所使用的载体是指能够将dna片段(例如,目的基因)插入其中从而允许将dna片段转移到受者细胞中的一种核酸运载工具。当载体能使插入的dna片段所编码的蛋白获得表达时,载体也称为表达载体。载体可以通过转化,转导或者转染导入宿主细胞,使其携带的dna片段在宿主细胞中获得表达。载体是本领域技术人员公知的,包括但不限于:质粒、噬菌体、柯斯质粒等等。
27.如本发明中所使用的“同源重组”是指发生在非姐妹染色单体(sister chromatin)之间或同一染色体上含有同源序列的dna分子之间或分子之内的重新组合。
28.不受任何理论束缚,本发明认为,蓝藻产生乙醇的机制如下:蓝藻体内固碳经开尔文循环生成中间体丙酮酸,丙酮酸在丙酮酸脱羧酶的催化下变成乙醛,乙醛在nadph依赖性醛还原酶的作用下转化为乙醇。而野生型pcc6803内源表达乙醇脱氢酶,但表达量极低。同
时野生型pcc6803并不表达丙酮酸脱羧酶,因此,本发明提供一种生物合成乙醇的代谢途径;其代谢途径流程图如图1所示。本发明通过基因工程引入丙酮酸脱羧酶和nadph依赖型醛还原酶(yqhd)提高乙醇产量。本发明中使用的nadph依赖型醛还原酶将乙醛催化为乙醇的过程中同时消耗nadph。
29.实施例1:铜离子诱导子ppete质粒pet01的构建以sangon生物技术公司(中国上海)购买的pmd18
‑
t载体作为基础,在pmd18
‑
t上插入了slr0168上下游600bp同源臂,构建载体pmd0168,载体pmd0168的基本结构如图2所示。以提取的集胞藻pcc6803的基因组dna为模板,分别用引物slr0168up
‑
f(5
’‑
ggcatgccgagcggcaccacggggcaccaccgc
‑3’
)和slr0168up
‑
r(5
’‑
gacgcgtcggcgcacagcagcgtgcgacgtgtg
‑3’
)、slr0168dw
‑
f(5
’‑
ctctagagtgccactacctggcgtgccgctacc
‑3’
)和slr0168dw
‑
r(5
’‑
ggggitaccccgcatgaccagctgccgccccagc
‑3’
)扩增slr0168上下游600bp同源臂并克隆到pmd18
‑
t的sphi/mlui和xbai/kpni位点上。将壮观霉素基因克隆到质粒pmd0168上构建质粒pet406,质粒pet406的基本结构如图3所示。以生工优化后的壮观霉素基因为模板,用sp
‑
f(5
’‑
ccacgcgtaagcttggatccgctcacgcaactggtccagaa
‑3’
)和sp
‑
r(5
’‑
cgggagctcgaattctagagtgcttagtgcatctaacgc
‑3’
)引物扩增壮观霉素基因并克隆到载体pmd0168的xhoi/xbai位点上,以集胞藻pcc6803的基因组dna为模板,分别用引物ppete
‑
f(5
’‑
gctctagacaaggattcatagcggttgcccaatc
‑3’
)和ppete
‑
r(5
’‑
gctgcctaggattctggcgaaagggggatgtg
‑3’
)、trbcl
‑
f(5
’‑
cgcgtcgaccggtgtttggattgtcggagt
‑3’
)和trbcl
‑
r(5
’‑
ccgacgcgtaagcttccggtaattggtaaattgctgtc
‑3’
)扩增启动子和终止子基因并克隆到pet406的bamhi/sali和sali/hindiii位点上。根据集胞藻pcc6803的密码子偏好性,利用在线软件(http://www.jcat.de/)对运动型发酵单胞菌的丙酮酸羧化酶基因(pdc)和大肠杆菌的nadph依赖的醛还原酶基因(yqhd)的核苷酸序列进行优化,优化的序列由生工生物技术公司(中国上海)合成。分别以优化的合成菌株为模板,用引物pdc
‑
f(5
’‑
ccgagatctcatatgtcctacaccgtgggcacct
‑3’
)和pdc
‑
r(5
’‑
cgcggatcctgcagctcgagtctagattacaacaatttgttcacgggt
‑3’
),yqhd
‑
f(5
’‑
caaactcgagtctagatgaacaactttaacttgcacacccccac
‑3’
)和yqhd
‑
r(5
’‑
cggggtacctgcagttagcgggcggcttcgtatatacggc
‑3’
)扩增基因,并插入到pet407的ndei/bamhi和xbai/kpni位点,构建质粒pet01,质粒pet01的基本结构如图4所示。
30.实施例2:构建光强超强启动子pcpc560质粒pet02不同于质粒pet01,质粒pet02以集胞藻pcc6803的基因组dna为模板,分别用引物pcpc
‑
f(5
’‑
cgtctagaggatcccctgtagagaagagtccctg
‑3’
)和pcpc
‑
r(5
’‑
tttctcctcttttgaattaatctcctacttgactttatgag
‑3’
)、trbcl
‑
f(5
’‑
cgcgtcgaccggtgtttggattgtcggagt
‑3’
)和trbcl
‑
r(5
’‑
ccgacgcgtaagcttccggtaattggtaaattgctgtc
‑3’
)扩增启动子和终止子基因并克隆到pet406的bamhi/sali和sali/hindiii位点上获得pet408。根据集胞藻pcc6803的密码子偏好性,利用在线软件(http://www.jcat.de/)对运动型发酵单胞菌的丙酮酸羧化酶基因(pdc)和大肠杆菌的nadph依赖的醛还原酶基因(yqhd)的核苷酸序列进行优化。优化的序列由生工生物技术公司(中国上海)合成。分别以优化的合成菌株为模板,用引物pdc
‑
f和pdc
‑
r,yqhd
‑
f和yqhd
‑
r为引物扩增基因,并插入到pet408的ndei/bamhi和xbai/kpni位点,构建质粒pet02,质粒pet02的基本结构如图5所示。
31.实施例3:构建敲除磷酸烯醇丙酮酸合成途径的质粒pet03
以提取的集胞藻pcc6803的基因组dna为模板,分别用引物slr0301up
‑
f(5
’‑
acatgcatgcattaactcccgcagaaaggga
‑3’
)和slr0301up
‑
r(5
’‑
cgacgcgtcgacatcatgggtgcccacctcttca
‑3’
)、slr0301dw
‑
f(5
’‑
ctagtctagacggcttctccattggctccaat
‑3’
)和slr0301dw
‑
r(5
’‑
cgagctcggtaccgccctcaacctctccatttcc
‑3’
)扩增slr0301上下游600bp同源臂并克隆到pmd18
‑
t的sphi/mlui和xbai/kpni位点上。将壮观霉素基因克隆到质粒pmd0301上构建质粒pmd
‑
slr0301
‑
ω。同理构建pet03,质粒pet03的基本结构如图6所示,其核苷酸序列如seq id no.8所示。具体构建质粒和引物见表1所示。
32.表1.质粒和引物
实施例4:蓝藻的转化和转化子的筛选1、转化集胞藻pcc6803及抗性传代集胞藻pcc6803具有天然dna转化系统,可以进行自然转化,通过同源双交换的方式实现基因重组,并整合到基因组中,在本实施例中通过自然转化实现基因敲除的目的。具体的转化过程及抗性传代流程如下:用培养2
‑
3天的新鲜集胞藻pcc6803菌株,此时菌体的od
730
nm在0.6左右;取一定量的新鲜菌液,3500g,15min离心得到菌体细胞沉淀,去上清,得细胞沉淀;用适量的新鲜培养基重悬菌体沉淀,并分装至1.5ml无菌的离心管中;将纯化后的融合pcr产物加入到离心管中混匀,光照培养箱中培养5小时,每小时摇动一次;取200μl上述培养的细胞于相应的抗性平板上涂布均匀,倒置在培养箱中培养10天左右可得转化后的单克隆;无菌环境中,挑取单菌落在新的抗性平板上划线传代,长出新的单菌落后继续划线传代三至五代,直到采用菌落pcr方法验证得到目的基因被完全取代的敲除突变株。
33.2、菌株(藻株)、质粒培养集胞藻pcc6803在bg11培养液中培养,条件28~30℃和光照条件下(30μe/m2
·
s)静置培养。bg11培养液中另外含有10μg/ml的壮观霉素和5mm的葡萄糖,所有溶液均用去离子水配置制,根据需要添加不同浓度的铜离子。所有器皿均为塑料器皿。
34.e.coli dh5α在37℃lb培养基中培养,含有质粒的大肠杆菌菌株中加入相应的抗生素(壮观霉素、硫酸卡那霉素、氨苄青霉素工作浓度均为50μg/ml)。
35.经过上述步骤转化集胞藻pcc6803,构建得到以下菌株:野生型集胞藻pcc6803(葡萄糖耐受)。
36.syn01:通过质粒pet01转化至集胞藻pcc6803所得,由于质粒pet01中含有slr0168上下游600bp的同源序列,因此通过发生同源重组,通过双交换将pet01中slr0168上下游片段间的ppete
‑
spr
‑
pdc
‑
yqhd
‑
trbcl整合到集胞藻pcc6803中slr0168基因位点上。随后通过抗性筛选,将含有壮观霉素抗性的转化子进行培养并pcr验证,将验证正确的菌株编号为syn01。
37.syn02:通过质粒pet02转化至集胞藻pcc6803所得,质粒pet02中slr0168上下游片段间的pcpc560
‑
spr
‑
pdc
‑
yqhd
‑
trbcl整合到集胞藻pcc6803中slr0168基因位点上,验证正确的菌株保种并编号为syn02。slr0168上下游同源替换基因组,壮观霉素抗性基因与含有
由pcpc560强启动子驱动的来源于运动发酵单胞菌的丙酮酸脱羧酶pdc和大肠杆菌的nadph依赖型醛还原酶yqhd。最后trbcl终止子控制反应的终止。
38.syn03:通过质粒pet03转化至集胞藻pcc6803所得,pet03中slr0301上下游片段间的pcpc560
‑
spr
‑
pdc
‑
yqhd
‑
trbcl整合到集胞藻pcc6803中slr0301基因位点上,将验证正确的菌株保种并编号为syn03。
39.实施例5:经基因工程改造的蓝藻的乙醇产量1.实验步骤:(1)培养方式:利用相对封闭的塑料培养容器培养(避免cu
2+
影响)。装50ml bg11培养基(含前面所述的相应抗性和5mm的葡萄糖),初始接种突变株浓度为od730在1左右,条件28~30℃和光照条件下(30μe/m2
·
s)静置培养。
40.(2)乙醇的检测:每天从培养容器中取1ml培养液(混合均匀),于10000g离心2分钟分离上清于沉淀。上清液经0.22微米滤膜过滤。蓝藻沉淀经细胞破碎仪破碎(5min),破碎后使用去离子水洗涤并再次用0.22微米滤膜过滤。所有过滤后所得物经高效液相色谱仪(电位差检测器)检测乙醇含量并绘制曲线。
41.2.实验结果(1)syn001与syn002逆转录定量pcr比较从syn01和syn02中提取总rna,并进行逆转录定量pcr分析,以确定syn01和syn02中乙醇合成基因的表达水平。表2是逆转录定量pcr的结果表。
42.表2.逆转录定量pcr的结果如表2所示,用2
‑△△
ct
计算方法可以估计不同mrna分子的相对表达程度;
△
ct值越高,相应的mrna表达水平越低。在多次平行实验中,syn01的pdc和yqhd的平均
△
ct值为0.1,0.99。在syn02中,pdc和yqhd的平均
△
ct值分别为
‑
1.25,
‑
0.22。通过相应的算法,菌株syn02和syn01的pdc基因rna表达差异为2^
‑
(
‑
1.25
‑
0.1)
。菌株syn02和syn01的yqhd基因rna表达差异为2^
‑
(
‑
0.22
‑
0.99)
。
43.图7是外源乙醇合成基因的表达情况图;如图7可见,与syn01菌株相比,syn02菌株的pdc和yqhd基因表达增加了2.5倍和2.3倍。可见,超强启动子pcpc560能有效地提高产乙醇基因的表达。
44.(2)乙醇产量比较观察野生型pcc6803、syn01与syn02的生长状态,比较乙醇产量。进行乙醇测定试验,观察发现野生型pcc6803在14天的观察期内没有产生任何乙醇。用hplc检测标准样品,图8是乙醇的hplc检测图;如图8所示,在hplc图像中除了水峰外没有其他峰。乙醇峰出现在29分钟左右。根据峰面积确定乙醇值。根据三次平行实验,取平均值绘制乙醇生产曲线。图9
是乙醇生产曲线图;如图9所示,在od
730
达到1.12的第14天,syn01的最大乙醇产量为389mg/l。根据三次平行实验,在第14天,syn02的od
730
达到1.08时,其乙醇产量达到591.7mg/l。因此,syn02的乙醇产量约为syn01的1.5倍,而syn02和syn01的唯一区别是启动子。可见,强启动子促进了乙醇合成基因的表达,从而促进乙醇产量。
45.(3)对syn03结果的分析在糖酵解途径中,磷酸烯醇丙酮酸(pep)通过丙酮酸激酶转化为丙酮酸。同样可逆的,丙酮酸可以被pep合成酶(ppsa)催化转化为磷酸烯醇丙酮酸。在集胞藻pcc6803中,ppsa由slr0301基因编码。这意味着ppsa的失活是增加乙醇产量的一个很有吸引力的靶点。然而,到目前为止,还没有关于集胞藻中ppsa破坏对乙醇生产的潜在影响的实验证据。为了测试是否存在预料的情况,通过删除pep合成酶编码位点
‑
slr0301,构建了菌株syn03。通过将质粒含有slr0301基因敲除盒的质粒pbe03转化到集胞藻pcc6803中,构建了工程菌株syn03(δslr0301/pdc
‑
yqhd)。通过乙醇生产试验,比较工程菌株syn03与菌株syn02的乙醇产量。图10是工程菌株syn03与菌株syn02的乙醇产量对比图;如图10所示,syn03的乙醇产量与syn02的乙醇产量相比显著增加。在光自养生长7天后,其乙醇产量提高到600mg/l(od
730
≈0.64),菌株syn03的乙醇产量分别为syn02的1.3倍。这一结果表明,磷酸烯醇丙酮酸合成酶的催化失活导致前体丙酮酸的水平升高,进而促进乙醇的形成。
46.本发明通过比较菌株syn01、syn02与syn03这三种工程蓝藻的乙醇产量发现,以光强启动子pcpc560替换铜离子诱导子ppete(序列如seq id no.6所示),同时敲除磷酸烯醇丙酮酸合成途径的工程菌株syn03最终获得的乙醇产量最高,可以有效提高蓝藻合成乙醇的产量。
47.尽管本发明的具体实施方式已经得到详细的描述,本领域技术人员将会理解,根据已经公开的所有教导,可以对那些细节进行各种修改和替换,而不背离如广泛描述的本发明的精神或范围。本发明的全部范围由所附权利要求及其任何等同物给出。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1