1.本发明涉及一株可快速同时降解三种真菌毒素的黑曲霉及其应用,属于微生物技术领域。
背景技术:2.玉米赤霉烯酮(zearalenone,zen)主要污染玉米、小麦、大米、大麦、小米和燕麦等谷物。其中玉米的阳性检出率为45%,最高含毒量可达到2909mg/kg;小麦的检出率为20%,含毒量为0.364~11.05mg/kg。玉米赤霉烯酮的耐热性较强,110℃下处理1h才被完全破坏。
3.黄曲霉毒素b1(aflatoxin b1简写为afb1)是二氢呋喃氧杂萘邻酮的衍生物,含有一个双呋喃环和一个氧杂萘邻酮(香豆素)。黄曲霉毒素b1是已知的化学物质中致癌性最强的一种。黄曲霉毒素b1对包括人和若干动物具有强烈的毒性,其毒性作用主要是对肝脏的损害。
4.伏马菌素b1(fumonisin fb1)是一种霉菌毒素,是由串珠镰刀菌(fusarium moniliforme sheld)产生的水溶性代谢产物,是一类由不同的多氢醇和丙三羧酸组成的结构类似的双酯化合物。
5.目前,有大量微生物被证明可以用于降解某特定种类的真菌毒素,但是缺少一种可以用于同时降解多种真菌毒素(玉米赤霉烯酮、黄曲霉毒素b1、伏马菌素b1)的生物方法。并且目前生物降解真菌毒素的速度普遍较慢,例如记载于公开号为cn105838614b的中国发明专利当中的黑曲霉,降解zen达到99%需要5d,记载于公开号为cn103937681b的中国发明专利当中的黑曲霉,zen降解率达到89%需要3d,并且上述专利仅对一种毒素真菌起作用,因此,缺少一种可以快速降解多种真菌毒素的联合生物方法。
技术实现要素:6.为了解决现有技术当中缺少一种可以用于同时降解多种真菌霉素的生物方法,及现有的生物降解真菌霉素的速度较慢的问题,本发明提供了一株黑曲霉(aspergillus niger)m
‑
48,所述黑曲霉保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏日期为:2021年03月15日,保藏编号为cgmcc no.21468。
7.所述黑曲霉(aspergillus niger)m
‑
48是在采用高浓度afb1、fb1、zen的真菌毒素混合溶液对黑曲霉fs
‑
z1进行48h刺激诱变,并循环5次,比较各代的降解率进行筛选,选取降解率最高的菌株,将菌株送至基因公司测序,将测序结果在ncbi数据库中进行比对分析,发现与黑曲霉基因同源率高达99%,其18s rdna序列如seq id no.1所示,因此,得到的诱变菌株为黑曲霉,命名为黑曲霉(aspergillus niger)m
‑
48。
8.在本发明的一种实施方式中,所述黑曲霉(aspergillus niger)m
‑
48为食品级的酱醅中分离的黑曲霉fs
‑
z1诱变得到的,经检测,所述黑曲霉(aspergillus niger)m
‑
48不产伏马菌素。
9.本发明还提供了一种含有上述黑曲霉(aspergillus niger)m
‑
48的微生物菌剂。
10.在本发明的一种实施方式中,所述微生物菌剂中黑曲霉(aspergillus niger)m
‑
48的添加量至少为1
×
106cfu/ml。
11.本发明还提供了一种降解真菌霉素的方法,所述方法为,将上述黑曲霉(aspergillus niger)m
‑
48或上述微生物菌剂添加至含有真菌霉素的环境中,进行真菌霉素的降解。
12.在本发明的一种实施方式中,所述真菌霉素包括玉米赤霉烯酮、黄曲霉毒素、伏马菌素中的一种或多种。
13.在本发明的一种实施方式中,所述真菌霉素包括玉米赤霉烯酮、黄曲霉毒素b1、伏马菌素b1中的一种或多种。
14.在本发明的一种实施方式中,所述黑曲霉(aspergillus niger)m
‑
48的添加量至少为:1
×
106cfu/ml。
15.在本发明的一种实施方式中,本发明的降解真菌霉素的方法中,最佳的降解条件为:菌悬液浓度为1
×
106cfu/ml,降解温度28℃,摇床培养条件180rpm。
16.本发明还提供了一种可降解真菌霉素的产品,所述产品中含有上述黑曲霉(aspergillus niger)m
‑
48,或上述微生物菌剂。
17.在本发明的一种实施方式中,所述产品中,黑曲霉(aspergillus niger)m
‑
48的添加量至少为:1
×
106cfu/ml。
18.在本发明的一种实施方式中,所述真菌霉素包括玉米赤霉烯酮、黄曲霉毒素、伏马菌素中的一种或多种。
19.在本发明的一种实施方式中,所述真菌霉素包括玉米赤霉烯酮、黄曲霉毒素b1、伏马菌素b1中的一种或多种。
20.在本发明的一种实施方式中,所述产品为化学品。
21.本发明还提供了上述黑曲霉(aspergillus niger)m
‑
48,或上述微生物菌剂在制备含有降解真菌霉素的化学品中的应用。
22.在本发明的一种实施方式中,所述真菌霉素包括玉米赤霉烯酮、黄曲霉毒素、伏马菌素中的一种或多种。
23.本发明还提供了上述黑曲霉(aspergillus niger)m
‑
48,或上述微生物菌剂在食品、饲料领域中降解真菌霉素中的应用。
24.在本发明的一种实施方式中,所述真菌霉素包括玉米赤霉烯酮、黄曲霉毒素、伏马菌素中的一种或多种。
25.有益效果
26.(1)本发明提供了一株黑曲霉(aspergillus niger)m
‑
48,该黑曲霉对黄曲霉毒素b1(afb1)、黄曲霉毒素b1(fb1)、玉米赤霉烯酮(zen)三种真菌毒素同时具有较高的降解效率,其中,对afb1有95.78%的降解率,对黄曲霉毒素b1(fb1)具有99.36%的降解效率,对玉米赤霉烯酮zen具有96.32%的降解效率。
27.(2)本发明的黑曲霉(aspergillus niger)m
‑
48对afb1、fb1、zen三种真菌毒素具有较高的降解速度,对黄曲霉毒素b1(afb1)达到最大的降解率的时间为24h,对伏马菌素b1(fb1)达到最大降解效率的时间为24h,对玉米赤霉烯酮zen达到最大降解效率的时间为28h。
28.生物材料保藏
29.一株黑曲霉(aspergillus niger)m
‑
48,分类学命名为:黑曲霉aspergillus niger,已于2021年03月15日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.21468,保藏地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。
附图说明
30.图1:诱变过程中菌株对三种真菌毒素降解能力的变化;其中,a为:菌株对afb1降解率变化;b为:菌株对fb1降解率变化;c为:菌株对zen降解率变化。
31.图2:黑曲霉对三种真菌毒素的动态降解曲线;其中,a为:黑曲霉m
‑
48对afb1动态降解曲线;b为:黑曲霉m
‑
48对fb1动态降解曲线;c为:黑曲霉m
‑
48对zen动态降解曲线;d为:黑曲霉fs
‑
z1对afb1动态降解曲线;e为:黑曲霉fs
‑
z1对fb1动态降解曲线;f为:黑曲霉fs
‑
z1对zen动态降解曲线。
32.图3:黑曲霉(aspergillus niger)m
‑
48对三种真菌毒素降解能力的稳定性;其中,a为:黑曲霉m
‑
48对afb1降解能力的稳定性;b为黑曲霉m
‑
48对fb1降解能力的稳定性;c为黑曲霉m
‑
48对zen降解能力的稳定性。
具体实施方式
33.下述实施例中所涉及的afb1粉末、fb1粉末、zen粉末购自江苏维赛生物科技有限公司,下述实施例中黑曲霉fs
‑
z1记载于公开号为cn103937681b的中国发明专利当中。
34.下述实施例中所涉及的培养基如下:
35.pda液体培养基:马铃薯300g/l(从中提取浸出)粉,葡萄糖20g/l,最终ph=5.6
±
0.2。
36.pda固体培养基:在pdb液体培养基的基础上,添加5g/l琼脂。
37.下述实施例中所涉及的检测方法如下:
38.afb1、fb1、zen含量的检测方法:
39.采用高效液相检测afb1、fb1、zen含量,高效液相色谱条件:高效液相色谱种类:agilent technologies 1260 infinity;色谱柱:c18柱,柱长:150mm,内径:4.6mm;流动相:乙腈:水:甲醇=46:46:8;流速:1.0ml/min;检测波长:激发光波长:274nm,发射波长:440nm。
40.下述实施例中所涉及的对于真菌霉素的降解率的计算方法如下:(起始浓度
‑
残余浓度)/起始浓度
×
100%。
41.实施例1:黑曲霉(aspergillus niger)m
‑
48的获得
42.诱变方法:采用高浓度afb1、fb1、zen的真菌毒素混合溶液对黑曲霉fs
‑
z1进行48h刺激诱变,并循环5次,比较各代的降解率进行筛选,选取降解率最高的即为黑曲霉m
‑
48。
43.具体步骤如下:
44.1、准备无菌培养皿,在无菌操作台内(点燃台内酒精灯)倒入pda液体培养基,培养基量超过培养皿容量一半,制备5个空白平板。待其凝固后,进行倒置。
45.2、吸取冷冻管内菌液(黑曲霉fs
‑
z1)0.25ml于pda固体培养基上,利用涂布器涂布
均匀,在28℃培养箱内培养2
‑
3d。
46.3、待平板上长出黑曲霉,用棉签刮取孢子,在灭过菌的生理盐水中润洗,制作成菌孢子悬液,调节孢子悬液的浓度为106cfu/ml。
47.4、将调节好浓度的黑曲霉孢子悬液分装于2个20ml离心管中,每个离心管中孢子悬浮液10ml。
48.6、将每个离心管中加入三种毒素混合液,其中三种毒素混合液的配制方法为:10ml甲醇溶液+0.01mg zen粉末+0.01mg afb1粉末+0.01mg fb1粉末。
49.7、将离心管放入28℃,180rpm的摇床中摇床培养48h。
50.8、pda培养基灭菌,随后凝固后倒平板静置。
51.9、吸取含有毒素的孢子悬液1ml接种于平板上,加入1ml的毒素并涂布均匀。平板放入28℃培养箱中培养5天。
52.10、重复3
‑
9步骤5次,可得到第五代诱变菌株,从中挑选对三种真菌毒素降解率最高的菌株,将菌株送至基因公司测序。
53.培养条件:pda培养基,生理盐水(加0.05%吐温80),无菌离心管若干,无菌操作台,无菌棉签,无菌涂布器,真菌恒温培养箱,微生物培养摇床,fs
‑
z1黑曲霉悬液。
54.将测序结果在ncbi数据库中进行比对分析,发现与黑曲霉基因同源率高达99%,因此,得到的诱变菌株为黑曲霉,故将其命名为黑曲霉m
‑
48,并送至保藏中心保藏。
55.实施例2:黑曲霉(aspergillus niger)m
‑
48是否产毒的检测
56.具体步骤如下:
57.将实施例1的方法制备得到的黑曲霉m
‑
48孢子悬液接种在pdb液体培养基中,控制孢子终浓度为106cfu/ml,放入28℃,在180rpm摇床培养48h,采用高效液相色谱方法检测afb1、fb1、zen的含量,结果如表1所示:
58.表1:黑曲霉m
‑
48的产毒能力
[0059] afb1zenfb1含量(g/l)0.00
±
0.00(未检出)0.00
±
0.00(未检出)0.00
±
0.00(未检出)
[0060]
由于黑曲霉m
‑
48未检出任何真菌毒素成分,因此可以判断该黑曲霉m
‑
48为一种不产毒的安全真菌。
[0061]
实施例3:黑曲霉(aspergillus niger)m
‑
48降解三种真菌毒素
[0062]
具体步骤如下:
[0063]
(1)配制含有毒素的培养基:将20ml pdb液体培养基于真菌培养瓶中,向真菌培养瓶中分别加入afb1、fb1、zen三种毒素粉末,使培养基中afb1、fb1、zen三种毒素的终浓度均为0.5
×
10
‑3g/l,共培养48h;
[0064]
(2)将实施例1的方法,分别配制黑曲霉(aspergillus niger)m
‑
48和黑曲霉fs
‑
z1孢子悬液。
[0065]
(3)分别向步骤(1)制备得到的含有毒素的培养基中加入步骤(2)得到的黑曲霉(aspergillus niger)m
‑
48和黑曲霉fs
‑
z1孢子悬液,并分别控制培养基中黑曲霉(aspergillus niger)m
‑
48和黑曲霉fs
‑
z1孢子浓度均为1
×
106cfu/ml,分别得到反应体系;
[0066]
分别将反应体系放入28℃,180rpm的真菌摇床中培养,培养48h后取出相应样品,
利用氯仿进行提取,并采用高效液相色谱进行毒素含量检测,并计算降解率,结果如图1与表2所示。
[0067]
表2:黑曲霉对三种真菌毒素降解能力的检测
[0068] 黑曲霉fs
‑
z1的降解率黑曲霉m
‑
48的降解率afb172.24
±
0.03%95.78
±
1.32%fb173.41
±
0.01%99.36
±
0.23%zen73.11
±
0.19%96.32
±
0.76%
[0069]
结果表明,黑曲霉m
‑
48对三种真菌毒素降解能力与原菌株相比有了较大提升;相对于黄曲霉毒素b1(afb1),黑曲霉m
‑
48的降解率与原始菌株黑曲霉fs
‑
z1相比提高了32%;相对于黄曲霉毒素b1(fb1),黑曲霉m
‑
48的降解率与原始菌株黑曲霉fs
‑
z1相比提高了36%;相对于玉米赤霉烯酮(zen),黑曲霉m
‑
48的降解率与原始菌株黑曲霉fs
‑
z1相比提高了32%。
[0070]
实施例4:黑曲霉(aspergillus niger)m
‑
48降解真菌毒素的降解时间分析
[0071]
具体步骤如下:
[0072]
(1)配制含有毒素的培养基:配制pdb液体培养基20ml于真菌培养瓶中,向真菌培养瓶中分别加入afb1、fb1、zen三种毒素,使培养基中afb1、fb1、zen三种毒素的终浓度都为0.5
×
10
‑3g/l,共培养48h;
[0073]
(2)将实施例1的方法,分别配制黑曲霉(aspergillus niger)m
‑
48和黑曲霉fs
‑
z1孢子悬液。
[0074]
(3)分别向步骤(1)的含有毒素的培养基中加入步骤(2)得到的黑曲霉(aspergillus niger)m
‑
48和黑曲霉fs
‑
z1孢子悬液,并控制培养基中黑曲霉(aspergillus niger)m
‑
48和黑曲霉fs
‑
z1孢子浓度均为1
×
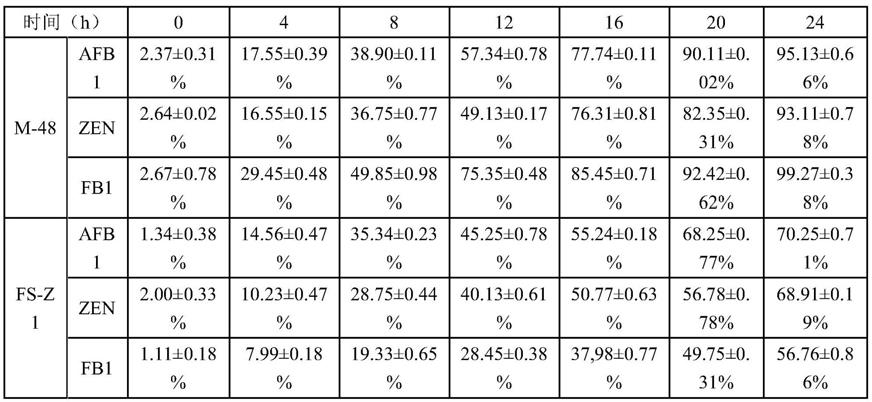
106cfu/ml;并分别放入28℃,180rpm的真菌摇床中培养,每隔4h,取出相应样品,利用氯仿进行提取,并采用高效液相色谱进行毒素含量检测,计算降解率,结果如表3~4所示如图2所示。
[0075]
表3:m
‑
48和fs
‑
z1降解过程对比
[0076][0077]
表4:m
‑
48和fs
‑
z1降解过程对比
[0078][0079][0080]
结果表明,m
‑
48对afb1在24h即可达到最大降解率(>96%),而对fb1在24h即可达到最大降解率(>98%),对zen在28h达到最大降解率(>96%)。
[0081]
实施例5:黑曲霉(aspergillus niger)m
‑
48的传代稳定性
[0082]
为了验证黑曲霉m
‑
48的传代稳定性,将菌株m
‑
48进行连续传5代培养,并且每一代菌株都进行对三种真菌毒素降解降解能力的检测,将降解率进行比较。具体步骤如下:
[0083]
分别取黑曲霉m
‑
48接种至pda培养基中,在28℃条件下培养7d,得到第一代g1种子液,将g1种子液接种至实施例3步骤(1)制备得到的含有毒素的培养基中,并分别调整培养基中黑曲霉(aspergillus niger)m
‑
48孢子悬液浓度均为1
×
106cfu/ml;并放入28℃,180rpm的真菌摇床中培养,培养48h后取出相应样品,利用氯仿进行提取,并采用高效液相色谱进行毒素含量检测,计算降解率。
[0084]
取黑曲霉m
‑
48第一代g1种子液,按照106cfu/ml的接种量将g1种子液接种至pda培养基中,在28℃条件下培养7d,得到第二代g1种子液,并按照上述方法计算降解率。
[0085]
按照上述方法传代六次,并分别计算降解率;结果如图3与表5所示。
[0086]
表5:传代过程中m
‑
48对三种真菌毒素降解能力的检测
[0087][0088]
结果表明,经过多次传代后,m
‑
48对三种真菌毒素的降解能力变化较小,因此具有较好的稳定性。
[0089]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范
围应该以权利要求书所界定的为准。
