LGALS3的表位肽及所述表位肽与热休克蛋白的复合物的制作方法
lgals3的表位肽及所述表位肽与热休克蛋白的复合物
技术领域
1.本发明涉及免疫学及肿瘤治疗领域。具体而言,本发明涉及蛋白lgals3的表位肽及其组合,由其所诱导的特异性免疫细胞,包含它们的肿瘤疫苗,及其用于预防或治疗肿瘤的用途。本发明还涉及所述表位肽与热休克蛋白形成的复合物,由其所诱导的特异性免疫细胞,包含它们的肿瘤疫苗,及其用于预防或治疗肿瘤的用途。
背景技术:
2.肝癌是指发生于肝脏的恶性肿瘤,包括原发性肝癌和转移性肝癌两种,其中原发性肝癌是临床上最常见的恶性肿瘤之一。在世界范围内男性癌症患者中,肝癌比例排第六,死亡率排在第二;在女性癌症患者中,肝癌比例排第七,死亡率排第六。2008年,全世界共有748,300个新增肝癌病例,有695,900例肝癌患者死亡。而这些新增肝癌病例和死亡病例中有一半在中国。肝癌发生率最高的区域主要在东亚,东南亚,中非和西非国家。亚洲部分地区和非洲撒哈拉以南地区之所以肝癌发生率较高,可能是因为这些地区hbv盛行,这些地区8%的居民慢性感染hbv,在发展中国家60%的肝癌患者感染过hbv。
3.胰腺癌是恶性程度极高的消化道肿瘤之一,其在全球的发病率和死亡率均在逐年升高。目前临床上治疗胰腺癌的方式主要包括手术切除、放化疗。由于胰腺癌发病隐匿、病情进展快、恶性程度高等特点,患者一经发现多处于癌症的中晚期,丧失手术机会,导致患者5年生存率不足6%。
4.半乳糖凝集素3(galectin-3,lgasl3)属凝集素家族,该家族成员对半乳糖呈较强亲和力。该蛋白n端具有富脯氨酸串联重复结构域和一个c端碳水化合物识别结构域。该蛋白可以通过n端结构域自结合,从而与多价糖配体结合。这种蛋白质定位于细胞外基质、细胞质和细胞核。该蛋白在许多细胞功能中发挥作用,包括凋亡,先天免疫,细胞粘附和t细胞调控。同时,越来越多的研究表明lgals3在肿瘤的发生及发展中起到关键作用,并促进肿瘤转移。在肝癌、脑胶质瘤和胰腺癌等高发癌症中,lgals3蛋白的表达均显著提升,同时lgals3的表达水平也与癌症患者的生存率直接相关。
5.热休克蛋白(heat shock protein,hsp)是一类在生物进化中高度保守且广泛存在于原核及真核生物中的蛋白质。hsp根据同源程度和分子量大小可分为hsp110、hsp90、hsp70、hsp60、hsp40、小分子hsp和泛素等多个亚家族。热休克蛋白(heat shock protein,hsp)gp96属于hsp90亚家族的成员,该蛋白是细胞内质网上含量最丰富的热休克蛋白。热休克蛋白gp96蛋白具有多肽结合特性,在内质网内其能接受来自tap复合体的多肽片段,协助将其组装至mhc i类分子,递呈于细胞膜上。不同组织来源的热休克蛋白gp96能携带有其来源组织内特异性表达的多肽片段。
技术实现要素:
6.本发明提供了蛋白lgals3的表位肽及其组合,由其所诱导的特异性免疫细胞。本发明还进一步提供了所述表位肽与热休克蛋白形成的复合物,由其所诱导的特异性免疫细
胞。
7.因此,在一个方面,本发明提供了一种分离的多肽,所述分离的多肽具有如seq id no:1或2所示的氨基酸序列。
8.在另一个方面,本发明提供了一种多肽组合物,所述多肽组合物包含选自下列的任意两种或三种多肽:seq id no:1、2和3任一项所示的多肽。
9.在某些实施方案中,所述多肽组合物含有的多肽的比例相同或不同。
10.在某些实施方案中,所述多肽组合物包含seq id no:1所示的多肽、seq id no:2所示的多肽和seq id no:3所示的多肽。
11.在某些实施方案中,所述多肽组合物中seq id no:1所示的多肽、seq id no:2所示的多肽和seq id no:3所示的多肽的质量比例为1:1:1至20:1:1,或1:1:1至1:20:1,或1:1:1至1:1:20。
12.在某些实施方案中,所述多肽组合物中seq id no:1所示的多肽、seq id no:2所示的多肽和seq id no:3所示的多肽的质量比例为1:1:1至5:1:1,或1:1:1至1:5:1,或1:1:1至1:1:5。
13.在某些实施方案中,所述多肽组合物中seq id no:1所示的多肽、seq id no:2所示的多肽和seq id no:3所示的多肽的质量比例为1:1:1,或5:1:1,或1:5:1,或1:1:5。
14.在某些实施方案中,所述多肽组合物含有的seq id no:1所示的多肽、seq id no:2所示的多肽和seq id no:3所示的多肽的比例为1:1:1。
15.在另一个方面,本发明提供了一种复合物,其由如前所述分离的多肽或者如前所述的多肽组合物与热休克蛋白形成。
16.在某些实施方案中,所述复合物是由如前所述分离的多肽或者如前所述的多肽组合物与热休克蛋白以自然吸附或热击方式形成。
17.在某些实施方案中,所述复合物是通过将如前所述分离的多肽或者如前所述的多肽组合物和热休克蛋白在体外混合而制备的。在某些实施方案中,所述混合在40-80℃(例如40-70℃,40-60℃,或50-60℃)下进行。在某些实施方案中,所述混合在55℃下进行。
18.在某些实施方案中,所述复合物是通过将如前所述分离的多肽或者如前所述的多肽组合物和热休克蛋白接触并置于55℃中10min,然后置于室温30min而制备的。
19.在某些实施方案中,所述热休克蛋白选自hsp70、hsp90、gp96、hsp110,以及它们的突变体或融合蛋白。
20.在某些实施方案中,所述热休克蛋白是gp96。在某些实施方案中,所述热休克蛋白具有如seq id no:6所示的氨基酸序列。
21.在某些实施方案中,所述复合物是通过将如前所述分离的多肽或者如前所述的多肽组合物与热休克蛋白按照下述质量比例在体外混合而制备:0.1:1至100:1(例如0.1:1至50:1,0.1:1至10:1,0.1:1至5:1,0.1:1至1:1,0.5:1至100:1,0.5:1至50:1,0.5:1至10:1,0.5:1至5:1,0.5:1至1:1,1:1至100:1,1:1至50:1,1:1至10:1,1:1至5:1),优选1:1、10:1或100:1。
22.在某些实施方案中,所述复合物具有免疫原性并且能够诱导针对表达lgals3的细胞(例如肿瘤细胞,例如胰腺癌或肝癌细胞)的特异性免疫应答。
23.在另一个方面,本发明提供了一种组合物,所述组合物包含至少2种(例如,2种,3
种,4种,5种,或更多种)如前所述的复合物。
24.在某些实施方案中,所述组合物中的热休克蛋白相同或不同。
25.在某些实施方案中,所述组合物具有免疫原性并且能够诱导针对表达lgals3的细胞(例如肿瘤细胞,例如胰腺癌或肝癌细胞)的特异性免疫应答。
26.在另一个方面,本发明提供了一种制备如前所述的复合物的方法,其其包括将如前所述分离的多肽或者如前所述的多肽组合物与热休克蛋白混合。
27.在某些实施方案中,如前所述分离的多肽或者如前所述的多肽组合物与热休克蛋白以自然吸附或热击方式形成复合物。
28.在某些实施方案中,所述复合物是通过将如前所述分离的多肽或者如前所述的多肽组合物和热休克蛋白在体外混合而制备的。在某些实施方案中,所述混合在40-80℃(例如40-70℃,40-60℃,或50-60℃)下进行。在某些实施方案中,所述混合在55℃下进行。
29.在某些实施方案中,所述方法包括:将如前所述分离的多肽或者如前所述的多肽组合物和热休克蛋白接触并置于55℃中10min,然后置于室温30min。
30.在某些实施方案中,所述热休克蛋白选自hsp70、hsp90、gp96、hsp110,以及它们的突变体或融合蛋白。
31.在某些实施方案中,所述热休克蛋白是gp96。在某些实施方案中,所述热休克蛋白具有如seq id no:6所示的氨基酸序列。
32.在某些实施方案中,所述方法包括:将如前所述分离的多肽或者如前所述的多肽组合物与热休克蛋白按照下述质量比例在体外混合:0.1:1至100:1(例如0.1:1至50:1,0.1:1至10:1,0.1:1至5:1,0.1:1至1:1,0.5:1至100:1,0.5:1至50:1,0.5:1至10:1,0.5:1至5:1,0.5:1至1:1,1:1至100:1,1:1至50:1,1:1至10:1,1:1至5:1),优选1:1、10:1或100:1。
33.在某些实施方案中,所述复合物具有免疫原性并且能够诱导针对表达lgals3的细胞(例如肿瘤细胞,例如胰腺癌或肝癌细胞)的特异性免疫应答。
34.在另一个方面,本发明提供了一种t细胞,其表达能够特异性识别半乳糖凝集素3(lgals3)或如前所述分离的多肽或者如前所述的多肽组合物的t细胞受体。
35.在某些实施方案中,所述t细胞由如前所述的复合物或如前所述的组合物刺激免疫细胞而获得。在某些实施方案中,所述免疫细胞包含pbmc或t淋巴细胞。
36.在某些实施方案中,所述刺激还包括使用免疫刺激性细胞因子(例如il-2)。
37.在某些实施方案中,所述t细胞是细胞毒性t淋巴细胞。
38.在某些实施方案中,所述t细胞能够特异性识别并杀伤表达lgals3的细胞(例如肿瘤细胞,例如胰腺癌或肝癌细胞)。
39.在另一个方面,本发明提供了一种制备如前所述的t细胞的方法,所述方法包括使用如前所述的复合物或如前所述的组合物刺激免疫细胞。在某些实施方案中,所述免疫细胞包含pbmc或t淋巴细胞。
40.在某些实施方案中,所述刺激还包括使用免疫刺激性细胞因子(例如il-2)。在某些实施方案中,所述免疫刺激性细胞因子为il-2。
41.在另一个方面,本发明提供了分离的核酸分子,其包含编码如前所述的分离的多肽的核苷酸序列。在某些实施方案中,所述分离的多肽具有如seq id no:1或2所示的氨基
酸序列。
42.在另一个方面,本发明提供了一种分离的核酸分子的组合,其包含编码如前所述的多肽组合物的核苷酸序列;所述多肽组合物包含选自下列的任意两种或三种多肽:seq id no:1、2和3任一项所示的多肽。在某些实施方案中,所述多肽组合物包含seq id no:1所示的多肽、seq id no:2所示的多肽和seq id no:3所示的多肽。
43.在另一个方面,本发明提供了载体,其包含如前所述的分离的核酸分子或如前所述的分离的核酸分子的组合。
44.在某些实施方案中,所述载体包含编码如前所述的分离的多肽或如前所述的多肽组合物的核苷酸序列。
45.在某些实施方案中,所述载体是病毒载体,例如慢病毒载体、逆转录病毒载体、腺病毒载体、腺相关病毒载体或杆状病毒载体。
46.在另一个方面,本发明提供了宿主细胞,其包含如前所述的分离的核酸分子或如前所述的分离的核酸分子的组合或如前所述的载体。
47.在另一个方面,本发明提供了药物组合物,其包含如前所述的分离的多肽、如前所述的多肽组合物、如前所述的复合物、如前所述的组合物、如前所述的t细胞、如前所述的分离的核酸分子、如前所述的分离的核酸分子组合、如前所述的载体或如前所述的宿主细胞,以及药学上可接受的载体和/或赋形剂。
48.在某些实施方案中,所述药物组合物是肿瘤疫苗。
49.在某些实施方案中,所述药物组合物包含佐剂。
50.在某些实施方案中,所述药物组合物还包含另外的治疗剂,例如抗肿瘤剂或免疫增强剂。
51.在某些实施方案中,所述抗肿瘤剂选自烷化剂、有丝分裂抑制剂、抗肿瘤抗生素、抗代谢物、拓扑异构酶抑制剂、酪氨酸激酶抑制剂、放射性核素剂、放射增敏剂、抗血管生成剂、细胞因子、免疫检查点抑制剂(例如,pd-1抗体、pd-l1抗体、ctla-4抗体、lag-3抗体或tim3抗体)。
52.在某些实施方案中,所述免疫增强剂选自免疫刺激性抗体(例如抗cd3抗体、抗cd28抗体、抗cd40l(cd154)抗体、抗41bb(cd137)抗体、抗ox40抗体、抗gitr抗体或其任意组合)或免疫刺激性细胞因子(例如il-2)。
53.在另一个方面,本发明提供了如前所述的分离的多肽、或如前所述的多肽组合物或如前所述的复合物、或如前所述的组合物或如前所述的t细胞在制备药物中的用途,所述药物用于在受试者中诱导针对表达lgals3的肿瘤的免疫应答、和/或在受试者中预防或治疗表达lgals3的肿瘤。
54.在某些实施方案中,所述表达lgals3的肿瘤选自结直肠癌、胰腺癌、胃癌、肺癌、子宫内膜癌、卵巢癌、多发性骨髓瘤、黑色素瘤、甲状腺癌、膀胱癌、前列腺癌、乳腺癌、头颈部癌或急性髓系白血病。
55.在某些实施方案中,所述t细胞来自所述受试者。
56.在某些实施方案中,所述受试者是人。
57.在某些实施方案中,所述受试者是hla-a2阳性。
58.在某些实施方案中,所述分离的多肽、多肽组合物、组合物或t细胞与另外的治疗
剂联合施用,例如同时、分开或相继施用。在某些实施方案中,所述另外的治疗剂是免疫刺激剂或抗肿瘤剂。
59.在某些实施方案中,所述表达lgals3的肿瘤中lgals3蛋白表达异常(例如,与健康受试者相比表达上升)。
60.在另一个方面,本发明提供了用于在受试者中诱导针对表达lgals3的肿瘤的免疫应答、和/或在受试者中预防或治疗表达lgals3的肿瘤的方法,所述方法包括向有此需要的受试者施用有效量的如前所述的分离的多肽、如前所述的多肽组合物、如前所述的复合物、如前所述的组合物、如前所述的t细胞、包含编码所述分离的多肽或多肽组合物的核苷酸序列的核酸分子或载体或宿主细胞、或如前所述的药物组合物。
61.在某些实施方案中,所述表达lgals3的肿瘤选自结直肠癌、胰腺癌、胃癌、肺癌、子宫内膜癌、卵巢癌、多发性骨髓瘤、黑色素瘤、甲状腺癌、膀胱癌、前列腺癌、乳腺癌、头颈部癌或急性髓系白血病、在某些实施方案中,所述受试者是人。
62.在某些实施方案中,所述受试者是hla-a2阳性。
63.在某些实施方案中,所述方法还包括向所述受试者施用另外的治疗剂,例如免疫增强剂或抗肿瘤剂。
64.在某些实施方案中,所述表达lgals3的肿瘤中lgals3蛋白表达异常(例如,与健康受试者相比表达上升)。
65.在某些实施方案中,所述方法包括:(1)提供来自受试者的免疫细胞(例如pbmc或t细胞);(2)将复合物或组合物与所述免疫细胞接触,以获得如前所述的t细胞;(3)将步骤(2)中获得的t细胞施用至所述受试者。
66.术语定义
67.在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的病毒学、生物化学、免疫学实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
68.如本文中所使用的,术语“lgals3(galectin-3)”又称为半乳糖凝集素3。半乳糖凝集素是一类糖粘合蛋白家族,具有多种生物学行为。其中,lgals3不仅与调节细胞的增殖、凋亡、粘附和迁移等细胞活动有有关,还参与免疫调节、肿瘤发生和转移等生理和病理活动。lgals3是本领域技术人员公知的,其序列可参见各种公共数据库,例如ncbi genbank数据库登录号:cag33178.1。
69.如本文中所使用的,术语“gp96”又称为grp94,是位于细胞内质网膜上的热休克蛋白90家族中的一员。gp96蛋白由n端结构域(n末端atp结合结构域)、m结构域(带电中间结构域)以及c端结构域(c末端同源二聚结构域)组成。gp96是本领域技术人员公知的,其序列可参见各种公共数据库,例如ncbi genbank数据库登录号:aah66656.1。
70.如本文中所使用的,术语“hsp70”是分子量约70kd的热休克蛋白,是热休克蛋白家族中组重要的一员,被称为主要热休克蛋白,包括分子量为68、72、73、75、78kda等的20多种蛋白。hsp70家族蛋白分子量相近,等电点ph5.2-6.3之间和相似的胰蛋白酶肽谱,在几乎所有生物的应激细胞中常被高度诱导,具有保护机体和细胞的功能。
71.如本文中所使用的,术语“hsp90”是分子量约90kd的热休克蛋白,是用于协同免疫
作用的一种蛋白质。其是热休克蛋白家族中组重要的一员,其分子量约为83-90kda。
72.如本文中所使用的,术语“hsp110”是分子量约110kd的热休克蛋白,是热休克蛋白家族中组重要的一员,其分子量约为100-110kda。
73.如本文中所使用的,术语“分离的”或“被分离的”指的是,从天然状态下经人工手段获得的。如果自然界中出现某一种“分离”的物质或成分,那么可能是其所处的天然环境发生了改变,或从天然环境下分离出该物质,或二者情况均有发生。例如,某一活体动物体内天然存在某种未被分离的多聚核苷酸或多肽,而从这种天然状态下分离出来的高纯度的相同的多聚核苷酸或多肽即称之为分离的。术语“分离的”或“被分离的”不排除混有人工或合成的物质,也不排除存在不影响物质活性的其它不纯物质。
74.如本文中所使用的,术语“载体(vector)”是指,可将多聚核苷酸插入其中的一种核酸运载工具。当载体能使插入的多核苷酸编码的蛋白获得表达时,载体称为表达载体。载体可以通过转化,转导或者转染导入宿主细胞,使其携带的遗传物质元件在宿主细胞中获得表达。载体是本领域技术人员公知的,包括但不限于:质粒;噬菌粒;柯斯质粒;人工染色体,例如酵母人工染色体(yac)、细菌人工染色体(bac)或p1来源的人工染色体(pac);噬菌体如λ噬菌体或m13噬菌体及动物病毒等。可用作载体的动物病毒包括但不限于,逆转录酶病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如sv40)。一种载体可以含有多种控制表达的元件,包括但不限于,启动子序列、转录起始序列、增强子序列、选择元件及报告基因。另外,载体还可含有复制起始位点。
75.如本文中所使用的,术语“宿主细胞”是指,可用于导入载体的细胞,其包括但不限于,如大肠杆菌或枯草菌等的原核细胞,如酵母细胞或曲霉菌等的真菌细胞,如s2果蝇细胞或sf9等的昆虫细胞,或者如纤维原细胞,cho细胞,cos细胞,nso细胞,hela细胞,bhk细胞,hek 293细胞或人细胞等的动物细胞。
76.如本文中所使用的,术语“受试者”包括但不限于各种动物,特别是哺乳动物,例如人。在某些实施方案中,所述受试者(例如人)患有自身免疫性疾病。
77.如本文中所使用的,术语“免疫细胞”是指具有一种或多种效应功能的免疫系统的任何细胞。免疫细胞典型地包括在免疫应答中起作用的细胞,它们通常具有造血的起源。术语“效应功能”指免疫细胞的特化功能,例如增强或促进对靶细胞的免疫攻击(例如对靶细胞的杀伤,或者抑制其生长或增殖)的功能或反应。例如,t细胞的效应功能,例如,可以是细胞溶解活性或者辅助或者包括细胞因子的分泌在内的活性。免疫细胞的实例包括t细胞(例如α/βt细胞和γ/δt细胞)、b细胞、天然杀伤(nk)细胞、天然杀伤t(nkt)细胞、肥大细胞和骨髓来源巨噬细胞等等。
78.如本文中所使用的,术语“药学上可接受的载体和/或赋形剂”是指,在药理学和/或生理学上与受试者和活性成分相容的载体和/或赋形剂,其是本领域公知的(参见例如remington's pharmaceutical sciences.edited by gennaro ar,19th ed.pennsylvania:mack publishing company,1995),并且包括但不限于:ph调节剂,表面活性剂,离子强度增强剂,维持渗透压的试剂,延迟吸收的试剂,稀释剂,佐剂,防腐剂,稳定剂等。例如,ph调节剂包括但不限于磷酸盐缓冲液。表面活性剂包括但不限于阳离子,阴离子或者非离子型表面活性剂,例如tween-80。离子强度增强剂包括但不限于氯化钠。维持渗
透压的试剂包括但不限于糖、nacl及其类似物。延迟吸收的试剂包括但不限于单硬脂酸盐和明胶。稀释剂包括但不限于水,水性缓冲液(如缓冲盐水),醇和多元醇(如甘油)等。佐剂包括但不限于铝佐剂(例如氢氧化铝),弗氏佐剂(例如完全弗氏佐剂)等。防腐剂包括但不限于各种抗细菌试剂和抗真菌试剂,例如硫柳汞,2-苯氧乙醇,对羟苯甲酸酯,三氯叔丁醇,苯酚,山梨酸等。稳定剂具有本领域技术人员通常理解的含义,其能够稳定药物中的活性成分的期望活性(例如对psd-95泛素化的抑制活性),包括但不限于谷氨酸钠,明胶,spga,糖类(如山梨醇,甘露醇,淀粉,蔗糖,乳糖,葡聚糖,或葡萄糖),氨基酸(如谷氨酸,甘氨酸),蛋白质(如干燥乳清,白蛋白或酪蛋白)或其降解产物(如乳白蛋白水解物)等。
79.如本文中所使用的,术语“治疗”是指,治疗或治愈疾病(例如自身免疫性疾病),延缓疾病的一种或多种症状的发作,和/或延缓疾病的发展。
80.如本文中所使用的,术语“有效量”是指,可以有效实现预期目的的量。例如,治疗有效量可以是有效地或足以治疗或治愈疾病(例如自身免疫性疾病),延缓疾病的一种或多种症状的发作和/或延缓疾病发展的量。这样的有效量可以由本领域技术人员或医生容易地确定,并且可以与预期目的、受试者的一般健康状况、年龄、性别、体重、待治疗的疾病的严重程度、并发症、施用方式等相关。这样的有效量的确定完全在本领域技术人员的能力范围内。
81.有益效果
82.本发明的蛋白lgals的三种多肽或其组合与热休克蛋白的复合物具有免疫原性并且能够诱导针对表达lgals3的细胞(例如肿瘤细胞,例如胰腺癌或肝癌细胞)的特异性免疫应答。进一步的,所述复合物能够诱导产生特异性免疫细胞,所述特异性免疫细胞能够杀伤表达lgals3的肿瘤细胞,进而能够预防或治疗表达lgals3的肿瘤。并且,所述蛋白lgals3的三种多肽及其组合可用于制备肿瘤疫苗,所述疫苗可用于预防或治疗表达lgals3的肿瘤。
83.下面将结合附图和实施例对本发明的实施方案进行详细描述,但是本领域技术人员将理解,下列附图和实施例仅用于说明本发明,而不是对本发明的范围的限定。根据附图和优选实施方案的下列详细描述,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。
附图说明
84.图1为本发明实施例1中昆虫表达的gp96的sds-page和western blot的鉴定结果。
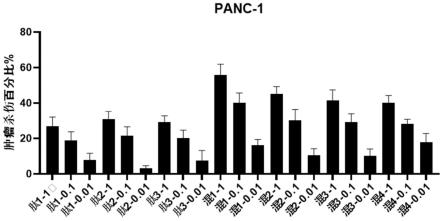
85.图2为本发明实施例2中三种多肽以及不同比例的混合多肽与gp96复合后活化的特异性ctl对胰腺癌细胞的杀伤结果。
86.图3为本发明实施例2中三种多肽按等比例混合与gp96复合后活化的特异性ctl和对照组(gp96刺激的人源t细胞)对panc-1细胞以及所述三种多肽共同孵育的t2细胞的杀伤结果。
87.图4为本发明实施例3中回输多肽-gp96复合物诱导的特异性t细胞的和对照组(gp96刺激的人源t细胞)对胰腺癌肿瘤体积的影响。
88.图5为本发明实施例4中三种多肽以及不同比例的混合多肽与gp96复合后活化的特异性ctl对于人肝癌细胞的杀伤结果。
89.图6为本发明实施例4中三种多肽按等比例混合与gp96复合后活化的特异性ctl和
对照组(gp96刺激的人源t细胞)对于人肝癌细胞以及所述三种多肽共同孵育的t2细胞的杀伤结果。
90.图7为本发明实施例5中回输多肽-gp96复合物诱导的特异性t细胞的和对照组(gp96刺激的人源t细胞)对肝癌肿瘤体积的影响。
91.序列信息
92.表1:本技术涉及的序列的信息描述于下面的表中。
93.94.具体实施方式
95.现参照下列意在举例说明本发明(而非限定本发明)的实施例来描述本发明。
96.本领域技术人员知晓,实施例以举例方式描述本发明,且不意欲限制本技术所要求保护的范围。实施例中的实验方法,如无特殊说明,均为常规方法。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。实施例中的定量实验,均设置三次重复实验,结果取平均值。
97.以下实施例中所涉及的实验材料来源如下:
98.裸鼠为北京维通利华实验动物有限责任公司产品;在实施例中简称小鼠。多肽由上海吉尔生化有限公司合成。
99.hepg2细胞(人肝癌细胞)购自atcc(美国菌种保藏中心),产品目录号为hb-8065
tm
。
100.panc-1(人胰腺癌细胞)购自中国医学科学院基础医学研究所基础医学细胞中心,细胞株资源编号为3111c0001ccc000023。
101.sf9细胞为invitrogen公司产品,产品目录号为11496-015。
102.cellfectin ii reagent为life technologies公司产品,产品目录号为10362-100。
103.质粒pfastbac
tm
1为invitrogen公司产品,产品目录号为10359-016。
104.gp96单克隆抗体为santa cruz公司产品,产品目录号为sc-56399。
105.辣根过氧化物酶标记的山羊抗大鼠的单克隆抗体为北京中杉金桥生物技术有限公司产品,产品目录号为zb-2307。
106.hitrap-q sepharose离子交换层析柱为ge公司产品,产品目录号为17-5053-01。
107.superdex 200 10/300gl分子筛层析柱为ge公司产品,产品目录号为17517501。
108.大肠杆菌dh10bac感受态细胞为北京原平皓生物技术有限公司产品,产品目录号为cl108-01。
109.insect-xpresstm protein-free insect cells medium with l-glutamine为lonza公司产品,产品目录号为12-730q。
110.bsa、pmsf、nahco3、mncl2、cacl2、nacl2、tris、甲基α-d-吡喃甘露糖苷均为sigma-aldrich公司产品,产品目录号分别为v900933、p7626、792519、v900197、793639、746398、t1378、m6882。
111.溶液a:溶质为1mm pmsf和30mm nahco3;溶剂为蒸馏水;ph值为7.4。
112.溶液b:溶质为2mm mncl2、2mm cacl2、500mm nacl和pmsf 1mm;溶剂为ph 7.4、20mm tris-hcl缓冲液。
113.溶液c:溶质为10%(质量体积比)甲基α-d-吡喃甘露糖苷、500mm nacl和1mm pmsf;溶剂为ph 7.4、20mm tris-hcl缓冲液。
114.清洗液:用蒸馏水将溶液b稀释至10倍体积。
115.cona琼脂糖凝胶柱为ge公司产品,产品目录号为17-0440-01,该柱的规格为1.6
×
2.5cm,填充介质为con a-sepharose 4b。
116.hitrap q阴离子交换柱为ge公司产品,产品目录号为17-1153-01,该柱的规格为0.7
×
2.5cm。
117.hrp标记的igg抗体为serotec公司产品,产品目录号为star117p。
[0118]1×
洗涤液为含0.1%(体积百分比)triton-x100的ph 7.4、0.01mol/l pbs缓冲液。
[0119]
50kd与3kd超滤管为merck millipore公司产品,产品目录号分别为ufc905096、ufc500324。
[0120]
实施例1:利用昆虫细胞表达重组gp96蛋白
[0121]
一、重组质粒pfastbac
tm
1-gp96的构建
[0122]
1.采用trizol法提取hepg2细胞的rna,然后进行反转录获得cdna。
[0123]
2.根据人gp96基因(genbank号为ay040226.1)的核苷酸序列,化学合成引物f1(seq id no:4)和r1(seq id no:5),其分别携带限制性内切酶ecorⅰ和xbaⅰ识别序列。
[0124]
3.完成步骤1和2后,以步骤1获得的cdna为模板,以步骤2合成的f1和r1为引物进行pcr扩增,得到pcr扩增产物,其包含编码热休克蛋白gp96的核苷酸序列。
[0125]
4.用限制性内切酶ecorⅰ和xbaⅰ双酶切pcr扩增产物,回收酶切产物。
[0126]
5.用限制性内切酶ecorⅰ和xbaⅰ酶切质粒pfastbac
tm
1,回收约4700bp的载体骨架。
[0127]
6.将酶切产物与载体骨架连接,得到连接产物。
[0128]
7.将步骤6获得的连接产物转化大肠杆菌dh10bac感受态细胞,得到重组大肠杆菌,然后提取该重组大肠杆菌的质粒,获得重组质粒pfastbac1-gp96。重组质粒pfastbac 1-gp96表达重组热休克蛋白gp96(以下简称rgp96),rgp96的氨基酸序列如seq id no:6所示。
[0129]
二、rgp96的表达
[0130]
1.将步骤一构建的重组质粒pfastbac1-gp96共转染sf9细胞(每1
×
106个sf9细胞约转染4μg重组质粒pfastbac1-gp96;共转染过程中,转染试剂为cellfectin ii reagent,培养基为insect-xpresstm protein-free insect cells medium with l-glutamine,27℃孵育72h,离心,上清液即为p1代病毒。
[0131]
2.将sf9细胞悬浮液1(含1
×
108个sf9细胞)27℃培养8~10h,得到培养细胞;然后向所述培养细胞中加入p1代病毒(剂量为0.05~0.1moi),27℃孵育72h,4000rpm离心5min,上清液即为p2代病毒。
[0132]
3.向sf9细胞悬浮液2(含1.6
×
108个sf9细胞)中加入p2代病毒(剂量为0.05~0.1moi),27℃、100~120rpm培养72h,4000rpm离心5min,上清液即为p3代病毒。
[0133]
以抗gp96单克隆抗体作为一抗,辣根过氧化酶标记的山羊抗大鼠的单克隆抗体作为二抗,对p3代病毒进行sds-page和western blot杂交,western blot杂交具体步骤参考文献:张悦鸣,段跃强,罗德炎,姚惠娟,王希良,李志奎.小鼠可溶性il-5α受体在bac-to-bac系统中的表达及其鉴定[j].中国生物制品学杂志,2013,26:5。sds-page和western blot杂交结果表明,rgp96蛋白在sf9细胞中成功被表达。
[0134]
三、rgp96蛋白的纯化
[0135]
1.向300ml的sf9细胞悬浮液3(含4.5
×
108个sf9细胞)中加入p3代病毒(剂量为5moi),27℃、100~120rpm培养72h,得到悬浮液。
[0136]
2.取所述悬浮液,7000rpm离心20min,获得上清液1。
[0137]
3.取所述上清液1,经0.22mm滤膜过滤,获得上样液。
[0138]
4.将所述上样液上样于hitrap-q sepharose离子交换层析柱(流速为1ml/min),然后先用5ml的ph 7.5、200mm的pbs缓冲液冲洗(流速为1ml/min);再用10ml的ph 7.5、300mm的pbs缓冲液冲洗(流速为1ml/min);最后用3ml的ph 7.5、600mm的pbs缓冲液冲洗(流速为1ml/min),收集过柱后溶液并采用截留分子量为50kd的超滤管进行超滤浓缩,得到1ml左右的浓缩液。所述浓缩液中即含有rgp96。
[0139]
5.将步骤4得到的浓缩液上样于superdex 200 10/300gl分子筛层析柱(流速为0.25ml/min),然后用ph 7.5、150mm的pbs缓冲液洗涤(流速为0.25ml/min),收集为9~12ml处的穿透液,进一步采用截留分子量为50kd的超滤管进行超滤浓缩,得到rgp96的溶液。采用bca法测定rgp96的溶液中的蛋白浓度,最后分装,贮存于-80℃。
[0140]
将步骤5得到的rgp96的溶液进行sds-page电泳分析和western blot杂交(以抗gp96单克隆抗体作为一抗,辣根过氧化酶标记的山羊抗大鼠的单克隆抗体作为二抗)。实验结果如图1所示,其中,泳道1为高分子量标准蛋白质marker,泳道2为rgp96的sds-page电泳结果,泳道3为rgp96的western blot杂交结果。图1的结果表明,rgp96的溶液显示单一分子量条带(如箭头所示),且对应的分子量与预期一致,即经上述步骤三中的步骤,rgp96被有
效表达和纯化。
[0141]
实施例2:多肽-gp96复合物诱导的特异性ctl对于人胰腺癌细胞的杀伤效应
[0142]
一、多肽-gp96复合物的制备
[0143]
分别化学合成seq id no:1-3所示的多肽,将每种多肽用dmso配制成浓度20mg/ml的多肽溶液,每种多肽取1mg并分别与1mg、0.1mg、0.01mg热休克蛋白gp96混合,用ph 7.4 0.01mol/l pbs缓冲液溶解至总体积4ml,然后于55℃热击10分钟,在室温冷却30分钟,最后用50kd超滤管洗去未结合的多肽,即得每种多肽分别与不同质量的gp96复合形成的gp96-多肽复合物,共9种,具体如下表2所示。
[0144]
表2.多肽与gp96复合物
[0145]
复合物名称使用的多肽多肽与gp96的质量比肽1-1seq id no:11:1肽1-0.1seq id no:110:1肽1-0.01seq id no:1100:1肽2-1seq id no:21:1肽2-0.1seq id no:210:1肽2-0.01seq id no:2100:1肽3-1seq id no:31:1肽3-0.1seq id no:310:1肽3-0.01seq id no:3100:1
[0146]
将seq id no:1-3所示的3种多肽按照4种不同质量比混合(具体比例如下表3所示),用dmso配制成浓度20mg/ml的多肽混合溶液,对于每种混合多肽的溶液,取含1mg多肽的混合溶液,将每种混合多肽溶液分别与1mg、0.1mg、0.01mg热休克蛋白gp96混合,用ph 7.4 0.01mol/l pbs缓冲液溶解至总体积4ml,然后于55℃热击10分钟,在室温冷却30分钟,最后用50kd超滤管洗去未结合的多肽,即得4种不同混合比例的混合多肽分别与不同质量的gp96复合形成的gp96-多肽复合物,共12种,具体如下表3所示。
[0147]
表3.多肽与gp96复合物
[0148][0149]
二、人源肿瘤特异性效应细胞的制备
[0150]
1.使用人淋巴细胞分离液(购自cellgro,货号:25-072-ci)分离hla-a2阳性志愿者的抗凝新鲜全血,获得外周血单个核细胞(pbmc),用含10%胎牛血清(购自gibco,货号:10099-141-fbs)的rpmi-1640完全培养基(购自gibco,货号:12633012)调整细胞浓度为1.0
×
106个/ml,接种于24孔板,每孔1ml。
[0151]
2.次日每组分别加入上述制备的多肽-gp96复合物至终浓度为10μg/ml,单独添加gp96蛋白组作为阴性对照。
[0152]
3.第三天每孔加入il-2(购自peprotech公司,目录号:212-12)至终浓度为50u/ml,每2-3天半量换液并补充il-2至终浓度为50u/ml。
[0153]
4.分别于第七天、第十四天进行第二轮、第三轮多肽-gp96复合物/gp96刺激,次日加入il-2至终浓度为50u/ml。
[0154]
5.第三轮刺激后3天,得到效应细胞ctl。
[0155]
三、胰腺癌细胞特异性杀伤效应的检测
[0156]
检测所用靶细胞:人胰腺癌细胞系panc-1(hla-a2表达阳性),三种多肽按照1:1:1的质量比例共同孵育的t2细胞(hla-a2表达阳性)、经孵育的t2细胞呈递所述多肽。
[0157]
使用非放射性细胞毒性检测(购自promega,目录号:g1780)进行细胞毒活性检测,主要步骤如下(详见试剂盒使用说明书):
[0158]
1.实验组:以panc-1细胞、三种多肽按照1:1:1的质量比例共同孵育的t2细胞作为靶细胞,接种靶细胞数目为5
×
103/孔,按照效靶比为5:1、10:1或20:1的比例加入上述效应细胞,效应细胞以50μl/孔接种于96孔培养板中,终体积100μl。
[0159]
此外另设效应细胞自发ldh释放组,用来校准效应细胞自发释放出来的ldh(各组效应细胞以50μl/孔加入96孔板,补充50μl含5%胎牛血清的rpmi-1640培养基至终体积100μl)。靶细胞自发ldh释放组,用来校正靶细胞自发释放出来的ldh(各组靶细胞以50μ1/孔加入96孔板,补充50μl含5%胎牛血清的rpmi-1640培养基至终浓度100μl)。靶细胞最大ldh释放组,用来计算时作为确定100%的ldh释放的参照(细胞上样同靶细胞自发释放组)。体积校正对照组,用来校正由于加入裂解液引起的体积变化(加入含5%胎牛血清的rpmi-1640培养基100μl)。培养基背景对照组,用来校正由培养基中血清产生的ldh活性以及酚红造成的背景吸收(加入含5%胎牛血清的rpmi-1640培养基100μl)。
[0160]
2.细胞接种后,250g离心4min,接着于37℃培养箱中孵育4h;在收获上清前45min,向靶细胞最大ldh释放组中加入裂解液(10
×
),10μl/孔;接着使用250g离心4min,收获上清。
[0161]
3.转移50μ1上清至酶标板中,用检测缓冲液配制底物,将配好的底物50μ1/孔加到酶标板中,盖好平板,室温避光反应30min,向每孔加入50μl终止液,1h内于酶标仪检测490nm吸光值od。
[0162]
4.计算细胞杀伤率
[0163]
杀伤率(%)=[(实验组od值-效应细胞自发释放组od值-靶细胞自发释放组od值)/(靶细胞最大释放组od值-靶细胞自发释放组od值)]
×
100%
[0164]
实验结果如图2所示,在效靶比为20:1的条件下,多肽与gp96的21种复合物活化的ctl均具有肿瘤杀伤活性,而未加多肽的对照(仅含有gp96)对肿瘤细胞的杀伤小于7%。三种多肽按照质量1:1:1的比例混合并与gp96复合后活化的ctl对肿瘤细胞的杀伤效率高达15%-60%;并且,多肽混合物与gp96按照质量比1:1混合时活化的ctl对肿瘤细胞的杀伤效率高达40%-60%。综上,三种多肽本身等比例混合并其混合物与gp96等比例复合活化的ctl对肿瘤细胞的杀伤效率最高。其中,在效靶比为5:1、10:1或20:1的条件下,三种多肽本身按等比例混合,并其混合物与gp96等质量比例复合后(如表3中混1-1所示复合物)活化的ctl对肿瘤细胞杀伤结果如图3所示,结果表明三种多肽-gp96复合物活化的ctl对胰腺癌细胞有明显的杀伤作用,而gp96活化的ctl作为对照组基本没有杀伤活性。
[0165]
实施例3:多肽-gp96复合物诱导的特异性ctl对胰腺癌的治疗作用
[0166]
取20只6-8周龄的雌性裸鼠,每只尾静脉回输107个多肽-gp96复合物诱导的特异性t细胞(0.5ml),多肽-gp96复合物为三种多肽按等比例混合并与gp96等质量比例复合形成的复合物(如表3中混1-1所示复合物);回输后3天,所有小鼠皮下分别接种5
×
106个panc-1胰腺癌细胞;肿瘤接种后第2天将小鼠分成两组,每组10只,分别进行如下处理:
[0167]
第一组:尾静脉回输多肽-gp96复合物活化的人t淋巴细胞,免疫三次(每次0.5ml),单次回输剂量为107个/只;
[0168]
第二组:尾静脉回输gp96刺激的人源t细胞,免疫三次(每次0.5ml),单次免疫剂量为单次回输剂量为107个/只;
[0169]
以上两组中:接种肿瘤细胞后第2,3,4天分别回输3次。从第一天回输开始,每天观
察肿瘤生长情况,记录肿瘤大小,按以下公式计算肿瘤体积:v=ab2/2(v—体积,a—肿瘤长径,b—肿瘤短径)。肿瘤体积变化见图4,结果表明三种多肽-gp96复合物诱导的ctl可明显抑制胰腺癌肿瘤的生长。
[0170]
实施例4:多肽-gp96复合物诱导的特异性ctl对于人肝癌细胞的杀伤效应
[0171]
一、多肽-gp96复合物制备同实施例2
[0172]
二、人源肿瘤特异性效应细胞的制备见实施例2
[0173]
三、肝癌细胞特异性杀伤效应的检测
[0174]
检测所用靶细胞:人肝癌细胞hepg2(hla-a2表达阳性),所述三种多肽按照1:1:1的质量比例共同孵育的t2细胞(hla-a2表达阳性)、经孵育的t2细胞呈递所述多肽。
[0175]
检测方法同实施例2,实验组按对应比例为5:1、10:1或20:1的比例加入效应细胞与靶细胞,同时设立效应细胞自发释放组、靶细胞自发释放组、靶细胞最大释放组、背景对照组、体积校正对照组。37℃条件下孵育4h后加入细胞裂解液,收获上清做ldh检测。
[0176]
实验结果如图5所示,在效靶比为20:1的条件下,多肽与gp96的21种复合物活化的ctl均具有肿瘤杀伤活性,而未加多肽的对照(仅含有gp96)对肿瘤细胞的杀伤小于7%。三种多肽按照质量1:1:1的比例混合并与gp96复合后活化的ctl对肿瘤细胞的杀伤效率高达15%-60%;并且,多肽混合物与gp96按照质量比1:1混合时活化的ctl对肿瘤细胞的杀伤效率高达40%-60%。综上,三种多肽本身等比例混合并其混合物与gp96等比例复合活化的ctl对肿瘤细胞的杀伤效率最高。其中,在效靶比为5:1、10:1或20:1的条件下,三种多肽本身按等比例混合并其混合物与gp96等质量比例复合后(如表3中混1-1所示复合物)活化的ctl对肿瘤细胞杀伤结果如图6所示,结果表明三种多肽-gp96复合物活化的ctl对肝癌细胞有明显的杀伤作用,而gp96活化的ctl作为对照组基本没有杀伤活性。
[0177]
实施例5:多肽-gp96复合物诱导的特异性ctl对肝癌模型的治疗作用
[0178]
取20只6-8周龄的雌性裸鼠,每只尾静脉回输107个多肽-gp96复合物诱导的特异性t细胞(0.5ml),多肽-gp96复合物为三种多肽按等比例混合并与gp96等质量比例复合形成的复合物;回输后3天,所有小鼠皮下分别接种5
×
106个hepg2肝癌细胞;肿瘤接种后第2天将小鼠分成两组,每组10只,分别进行如下处理:
[0179]
第一组:尾静脉回输多肽-gp96复合物活化的人t淋巴细胞,免疫三次(每次0.5ml),单次回输剂量为107/只;
[0180]
第二组:尾静脉回输gp96刺激的人源t细胞,免疫三次(每次0.5ml),单次免疫剂量为单次回输剂量为107个/只;
[0181]
以上两组中:接种肿瘤细胞后第2,3,4天分别回输3次。从第一天回输开始,每天观察肿瘤生长情况,记录肿瘤大小,按以下公式计算肿瘤体积:v=ab2/2(v—体积,a—肿瘤长径,b—肿瘤短径)。肿瘤体积变化见图7,结果表明三种多肽-gp96复合物诱导的ctl可明显抑制肝癌肿瘤的生长。
[0182]
尽管本发明的具体实施方式已经得到详细的描述,但本领域技术人员将理解:根据已经公布的所有教导,可以对细节进行各种修改和变动,并且这些改变均在本发明的保护范围之内。本发明的全部分为由所附权利要求及其任何等同物给出。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1