水稻铜胁迫响应基因OsCORK1及其编码蛋白与应用
水稻铜胁迫响应基因oscork1及其编码蛋白与应用
技术领域
1.本发明属于基因工程技术领域,具体涉及水稻铜胁迫响应基因oscork1及其编码蛋白与应用。
背景技术:
2.水稻是世界上仅次于玉米的第二大粮食作物,亦是我国的第一大粮食作物,全国约60%的人以大米为主食。然而,近年来随着经济社会的飞速发展和人民生活水平的提高,农业生产中的重金属污染已经成为不容回避且亟待解决的问题。重金属污染会严重影响植物的正常生长发育,导致稻米产量下降,品质降低。受重金属污染的稻米被人们食用后会导致重金属在身体内积累,长期食用会导致精神系统及免疫系统紊乱,严重威胁人们生命健康安全。
3.铜是植物生长发育所必须的微量元素,对植物的正常生长发育不可或缺,广泛参与植物体内的多种代谢反应,对于提高作物产量、改善作物品质都有重要意义。然而,过多的铜积累也严重抑制植物正常生长发育,特别是根系生长,极端情况下可造成植物死亡。因此,研究植物对重金属胁迫的应答,挖掘关键基因对治理重金属污染十分重要。类受体蛋白激酶(receptor-like kinase,rlk)是植物体内一类最大的基因家族,广泛参与植物生长发育的多个过程,如生物胁迫和非生物胁迫等。然而,关于植物rlk响应重金属胁迫信号,参与调控重金属污染的生物学功能却未见报道。
技术实现要素:
4.本发明的目的在于提供一种水稻铜胁迫响应基因,oscork1基因。
5.本发明的第二个目的在于提供水稻铜胁迫响应蛋白,oscork1蛋白。
6.本发明的第三个目的在于提供上述oscork1基因的克隆引物。
7.本发明的第四个目的在于提供含有上述oscork1基因的表达盒、重组载体、重组细胞或重组菌。
8.本发明的第五个目的在于提供上述oscork1基因或oscork1蛋白的应用。
9.为了实现上述目的,本发明采用以下技术方案:
10.水稻铜胁迫响应基因,所述基因为oscork1基因,其核苷酸序列如seq id no:1所示,或其编码蛋白的氨基酸序列如seq id no:2所示。
11.水稻铜胁迫响应蛋白,所述蛋白为oscork1蛋白,其氨基酸序列如seq id no:2所示。
12.本发明提供了水稻铜胁迫响应基因及其编码蛋白,该基因来源于水稻,命名为oscork1(copper related receptor-like kinase 1),所编码的相应蛋白命名为oscork1。oscork1基因序列全长为1992bp,外显子cds序列全长为1767bp,编码588个氨基酸。
13.克隆上述oscork1基因的引物,所述引物的核苷酸序列如seq id no:3-4所示。
14.含有如权利要求1所述的oscork1基因的表达盒、重组载体、重组细胞或重组菌。
15.使用本发明所提供的oscork1基因构建重组表达载体导入入植物细胞,获得改善的水稻铜胁迫响应植株过程中,在其转录起始核苷酸前可加上任何一种组成型启动子、增强启动子或诱导型启动子。为了便于对转基因植物或转基因植物细胞进行鉴定及筛选,可对所使用的载体进行适当加工,如加入可选择性标记(gus基因、gfp、yfp和荧光素酶基因等)或具有抗性的抗生素标记基因(抗潮霉素,抗除草剂basta等基因)。为了转基因植物释放的安全性,在构建植物表达载体时也可不携带任何标记基因,在苗期进行特定pcr分子标记筛选。含有本发明oscork1基因的表达载体可通过显微注射、根癌农杆菌介导或基因枪等常规生物学方法转化植物细胞或组织,并将转化的植物组织培育成植株。
16.上述oscork1基因或oscork1蛋白的应用,为以下任一所示:
17.1)在提高水稻铜胁迫抗性中的应用;
18.2)在水稻铜胁迫抗性品种选育中的应用;
19.3)在降低水稻生产中的重金属污染方面的应用,所述重金属为铜。
20.优选的,通过对oscork1基因进行敲除,获得对铜胁迫抗性提高的植株。
21.优选的,通过crispr-cas9对oscork1基因进行敲除。
22.进一步优选的,还包括如下步骤:提取oscork1基因敲除突变体基因组dna进行pcr扩增,并对扩增产物进行测序鉴定基因突变类型;其中,所述pcr扩增的引物的核苷酸序列如seq id no:5-6所示。
23.本发明取得的有益效果:
24.本发明提供了水稻铜胁迫响应基因oscork1基因及其编码的蛋白,并进一步提供了oscork1基因或蛋白在提高水稻铜胁迫抗性或在水稻铜胁迫抗性品种选育中的应用。本发明通过构建crispr/cas9-oscork1敲除载体,利用农杆菌介导法转化水稻,获得oscork1敲除突变体;并通过试验证明敲除oscork1基因的水稻突变体经10μm cuso4处理后,突变体的cu积累量较野生型对照显著降低(p<0.01),可显著改善植株的耐铜性;且突变体地上长度、根长及鲜重较野生型长或大(p<0.05),表明降低oscork1基因的表达可显著增强水稻对铜胁迫的抗性。oscork1基因为水稻耐铜分子育种提供了优良的候选基因,在水稻抗逆育种及降低农业生产中的重金属污染方面具有良好的应用前景。
附图说明
25.图1为oscork1基因的克隆;
26.图2为oscork1编码蛋白的结构域预测;
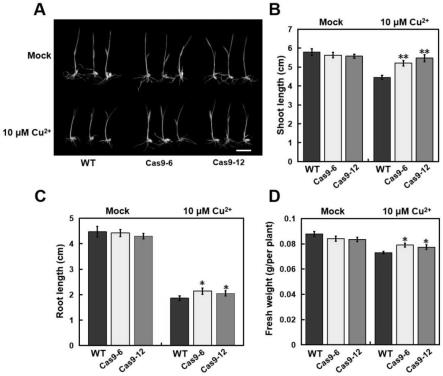
27.图3为oscork1基因的表达模式分析;
28.图4为oscork1基因的crispr/cas9靶标序列位点分析;
29.图5为cas9-oscork1敲除水稻突变体材料的测序分析;
30.图6为10μm cu
2+
处理两周龄oscork1敲除水稻突变体和野生型对照kitaake幼苗3d的铜含量分析;
31.图7为oscork1功能缺失突变体的铜胁迫抗性分析;
32.图中,a为wt与oscork1功能缺失突变体在10μm cu
2+
处理后表型;b为wt与oscork1功能缺失突变体在10μm cu
2+
处理后地上部长度比较;c为wt与oscork1功能缺失突变体在10μm cu
2+
处理后主根长度比较;d为wt与oscork1功能缺失突变体在10μm cu
2+
处理后鲜重比
较。
33.图8为cas9-oscork1敲除水稻突变体材料种oscork1基因表达量分析。
具体实施方式
34.下面结合具体实施方式对本发明作进一步描述,但本发明的保护范围并不仅限于此;以下实施例中所涉及的仪器设备如无特别说明,均为常规仪器设备;所涉及的试剂如无特别说明,均为市售常规试剂;所涉及的试验方法,如无特别说明,均为常规方法。
35.实施例1 oscork1基因的克隆
36.(1)野生型水稻日本晴的rna提取
37.取适量新鲜水稻日本晴幼叶组织样品放置于装有钢珠的2ml rnaase-free离心管中,液氮速冻1-2分钟,置于预冷的植物组织研磨器中进行充分研磨至匀浆状。加入1ml trizol
tm
试剂,漩涡震荡15s,充分混匀,冰上静置10min;4℃,12,000rpm离心10min;吸取约600μl上清液于新的1.5ml rnaase-free离心管中,加入200μl氯仿,上下翻转充分混匀,室温静置3-5min;4℃,12,000rpm离心15min,离心后液体分三层:有机相、中间层和无色上层水相,总rna溶于水相;吸取500μl无色上层水相于新的1.5ml rnaase-free离心管中,加入等体积预冷的异丙醇,上下翻转混匀,放入-20℃冰箱沉淀30min以上;4℃,12,000rpm离心10min,弃上清,加入1ml rnaase-free ddh2o配置的75%乙醇洗涤沉淀2次;弃上清,并放入超净工作台中风干残留无水乙醇;加入50μl rnaase-free ddh2o溶解rna,得到溶液即为总rna溶液,测定rna浓度并记录。
38.(2)rna反转录为cdna
39.cdna第一链的合成采用tiangen公司的反转录试剂盒fastking rt kit(with gdnase),操作步骤参照说明书进行,rna逆转录的总反应体系为20μl,具体步骤如下:
40.在200μl rnaase-free离心管中依次加入1μg总rna,2μl 5
×
gdna buffer,加入补足10μl;轻弹充分混匀,短暂离心,置于42℃水浴锅内孵育3min,取出后迅速冰浴;随后向上述离心管中依次加入10
×
king rt buffer 2μl,fastking rt enzyme mix 1μl,fq-rt primer mix 2μl,最后加入入rnaase-free ddh2o补足20μl,轻弹充分混匀,短暂离心;42℃水浴锅内孵育15min,最后95℃,3min;最后用rnaase-free ddh2o稀释至200μl,得到的cdna置于-80℃保存备用。
41.(3)基因克隆
42.以获得的日本晴cdna为模版,利用takara公司的高保真酶和基因特异引物(oscork1-f:atgtctccactcgacggc;oscork1-r:attgttgcctaatactattt tttca)进行基因克隆。
43.pcr克隆体系(50μl):
44.注意体系中模版cdna浓度<200ng/50μl。
[0045][0046]
pcr扩增程序:
[0047]
退火温度根据引物设定,退火温度60℃,时间5s;延伸时间2min。
[0048][0049][0050]
扩增完毕,将得到的pcr产物进行琼脂糖凝胶电泳,结果如图1所示,片段大小1767bp,泳道1、2为两个重复。
[0051]
将得到的目的条带进行琼脂糖凝胶回收,得到纯化的目的片段,测序验证。oscork1基因的核苷酸序列如seq id no:1所示,其编码蛋白的氨基酸序列如seq id no:2所示。
[0052]
图2为oscork1编码蛋白的结构域预测,oscork1在n端有一个lectin结构域,在c端有一个pkinase结构域。
[0053]
实施例2 crispr/cas9-oscork1载体构建
[0054]
采用crispr-cas9系统对oscork1基因进行敲除,主要是利用前期实验室保存的crispr-cas9载体,构建oscork1基因特定突变位点的crispr-cas9-oscork1载体,将构建成功的载体转入野生型水稻进行遗传转化,从而对oscork1基因进行编辑,而后将得到的水稻苗进行测序,比对得知oscork1基因的突变位点。
[0055]
(1)pam序列设计
[0056]
利用测序验证的目的基因核苷酸序列,在目的基因的cds中,找到靠近atg端的适合的pam序列(即ngg类型)。图4为oscork1敲除位点示意图。pam序列前20个碱基即为引物f的序列(cas9-oscork1-f:ggcagaccagagcagcgaccacat),注意引物f的序列不要横跨外显子区域;引物r序列(cas9-oscork1-r:aaacatgtggtcgctgctctggtc)即为引物f的反向互补序列;合成引物时需在引物前添加相应酶切位点,f引物前需加ggca,r引物前需加aaac。
[0057]
(2)中间载体sgrna的构建
[0058]
首先对中间载体进行酶切和胶回收。
[0059]
sgrna酶切体系(50μl):
[0060][0061]
其次将设计好的引物f和r稀释到100μm/l,利用pcr仪将两条链连接获得目的片段。程序设定为:37℃5min,95℃5min,ramp down to 25℃,5℃/min。
[0062]
引物f和r的连接体系(10μl):
[0063][0064]
最后将目的片段稀释200倍,进行中间载体sgrna的连接,25℃连接5min。转化dh5α,利用u3-f引物(u3f:agcacaggacaggcgtcttct)和r引物(cas9-oscork1-r:aaacatgtggtcgctgctctggtc)进行菌落pcr,摇菌,送测序得到正确得中间载体。
[0065]
目的片段和sgrna连接体系(10μl):
[0066][0067]
(3)cas9-oscork1终载体的构建
[0068]
将测序正确得中间载体和cas9终载行进lr重组,25℃反应1h;加入1μl proteinase k,37℃反应10min,终止反应。加入连接液4℃过夜,转化db3.1;利用u3-f和r引物进行菌落pcr,摇菌,测序验证阳性cas9-oscork1载体。
[0069]
lr重组体系(10μl):
[0070][0071]
实施例3 oscork1敲除突变体
[0072]
将测序验证阳性的cas9-oscork1载体利用农杆菌介导的方法转化水稻,将t0代oscork1敲除转基因植株进行单株取样,提取基因组dna;利用pam序列设计包含pam序列的鉴定引物300bp左右;鉴定引物序列为f:5
’‑
cctgtcaccctatccgtcaa-3’,r为5
’‑
aaccatcggctcggtgac-3’,以野生型水稻kitaake品种作为对照,对oscork1敲除突变体转基因材料进行pcr扩增,扩增片段为250bp左右,扩增产物切胶回收后测序。
[0073]
测序结果如图5所示,获得了3种不同类型的oscork1敲除突变体:cas9-6株系为缺少一个单碱基a的纯合突变体(agtgggaccagagcagcgacc-catcg),cas9-12为缺少两个碱基a和c的纯合突变体(agtgggaccagagcagcgacc
‑‑
atcg),cas9-16株系为插入一个单碱基a的纯合突变体(agtgggaccagagcagcgaccaacatcg)。
[0074]
实施例4实时荧光定量pcr的方法检测oscork1基因表达量
[0075]
取不同时期的水稻组织样品(图3oscork1基因的表达模式分析)或不同材料的水稻组织样品(图8cas9-oscork1敲除水稻突变体材料种oscork1基因表达量分析),在液氮中速冻后于-80℃的超低温冰箱中保存样品。水稻总rna的提取及rna反转录步骤见实施例1中1、2,将得到的cdna产物稀释10倍用于荧光定量qrt-pcr。使用qpcr master mix试剂盒(promega)来配置实时定量pcr体系[qpcr-f(10μm),0.4μl;qpcr-r(10μm),0.4μl;qpcr master mix,10μl;cdna模板,5μl;rnaase-free water,4.2μl],使用cfx96real-time系统(bio-rad)进行实时荧光定量pcr。利用2-δδc(t)
方法计算平均相对基因表达水平(livak&schmittgen,2001)。所有反应均进行三个生物学重复和三个技术重复,且osactin1为内源参考基因。
[0076]
结果如图3和图8所示,图3为oscork1基因的表达模式分析,由图3可知,基因oscork1的表达量在幼苗期在地上部表达较高,成熟期在根系和叶片中表达较高。图8为cas9-oscork1敲除水稻突变体材料种oscork1基因表达量分析,由图8可知在cas9-oscork1敲除水稻突变体材料的两个株系中,基因oscork1的表达量与野生型(kitaake)中相比明显降低。
[0077]
实施例5 oscork1敲除突变体铜胁迫条件下铜含量测定
[0078]
为测定oscork1基因功能缺失对水稻铜积累的影响,以野生型水稻kitaake品种作为对照,选定2种不同类型的敲除材料:cas9-6和cas9-12。正常培养14天后,10μm cuso4处理,处理3天后整株烘干测定cu含量。
[0079]
称取烘干的oscork1敲除转基因材料和野生型对照样品0.3-0.5g于聚四氟乙烯消
解内罐,加硝酸5ml浸泡过夜。盖好内盖,旋紧不锈钢外套,放入恒温干燥箱,160℃保持4h,在箱内自然冷却至室温,打开后加热赶酸至近干,将消化液吸入25ml容量瓶中,用少量硝酸溶液(1%)洗涤内罐和内盖3次,洗液合并至容量瓶中并用1%硝酸定容至刻度,混匀备用。同时做试剂空白试验。试液上机测定铜元素含量。
[0080]
结果如图6所示,在正常培养情况下,野生型和转基因水稻相比,体内cu积累量并无明显差异;但在cuso4处理下,敲除突变体体内cu积累量较野生型对照明显降低,降幅达19%-30%左右,统计分析为显著差异(p<0.01)。
[0081]
实施例6 oscork1敲除突变体铜胁迫条件下表型分析
[0082]
为测定oscork1基因功能缺失对水稻铜胁迫抗性的影响,以野生型水稻kitaake品种作为对照,选定2种不同类型的敲除材料:cas9-6和cas9-12。种子萌发后,10μm cuso4处理一周,进行表型及分析。
[0083]
结果如图7所示,在正常培养情况下,野生型和转基因水稻相比,地上长度、根长及鲜重无明显差异;但在cuso4处理下,oscork1敲除突变体地上长度、根长及鲜重较野生型长或大(p<0.05),表明降低oscork1基因的表达可显著增强水稻对铜胁迫的抗性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1