一种复合微生态制剂及其在提高肠道短链脂肪酸中的应用
1.本发明属于微生物利用益生元技术领域,具体涉及一种复合微生态制剂及其在提高肠道短链脂肪酸中的应用。
背景技术:
2.短链脂肪酸(short chain fatty acids,scfa),是由1~6个碳原子组成的有机脂肪酸。在人体内可由非消化性碳水化合物经结肠微生物发酵后产生,主要包括乙酸、丙酸、丁酸、乳酸等。国内外研究表明,低聚糖具有预防便秘、结肠癌、肿瘤、糖尿病、冠心病等功效,特别是具有调节肠道微生态平衡的作用。肠道益生菌可通过发酵低聚糖产scfa调节肠道健康,发酵低聚糖可产出相对于其他碳源底物更高含量的scfa或调节某类scfa的含量,例如低聚木糖可使益生菌的数量显著增加,并促进有益scfa的形成。功能性低聚糖不能被人体消化吸收,但可以选择性地增殖肠道内的一些共生菌,并产生有益于肠道健康的短链脂肪酸,对功能性低聚糖的利用被认为是益生菌一项重要的新特性,但是现有技术中不同的功能性低聚糖与不同微生物混合饲养动物,对动物体内提高的短链脂肪酸种类、那个部位的短链脂肪酸提高都是无法预料的。
3.中国专利文献cn107058170a(申请号:201710074474.4)公开了一株高效利用低聚木糖的乳酸片球菌bbc
‑
1及其应用,该发明提供一种由乳酸片球菌bbc
‑
1和低聚木糖组成饲料添加剂,该产品能进一步提高乳酸菌的应用效果,提高盲肠中短链脂肪酸的含量,该发明中表明低聚木糖同乳酸片球菌的配合使用,却降低了肉鸡盲肠中乳酸的含量,低聚木糖同乳酸菌的添加,有提高食糜中乙酸含量的趋势,低聚木糖同乳酸片球菌配伍使用,可以显著的提高食糜中丁酸含量,低聚木糖及乳酸片球菌的添加,对食糜中总酸含量没有显著影响。而本发明涉及的复合微生态制剂能够使小鼠盲肠中乙酸盐、丙酸盐、丁酸盐和总短链脂肪酸的浓度增加。
4.中国专利文献cn112175872a(申请号:202011081771.x)公开了一种鼠李糖乳杆菌及其制剂、应用,该发明公开的鼠李糖乳杆菌可提高体内的低聚糖转化率,促进肠道中的短链脂肪酸的生成,鼠李糖乳杆菌可以利用低聚糖,并公开了灌胃鼠李糖乳杆菌的小鼠粪便中的总短链脂肪酸、乙酸、丙酸、异丁酸、正丁酸的产量均普遍提高,以鼠李糖乳杆菌zk002组提高幅度最大,而鼠李糖乳杆菌atcc7469组粪便中总短链脂肪酸含量略少于zk002组,四类短链脂肪酸中丙酸的变化最为明显。本发明涉及的复合微生态制剂能够使小鼠盲肠中乙酸盐、丙酸盐、丁酸盐和总短链脂肪酸的浓度增加,乙酸盐的变化最为明显。
5.木聚糖是一种多聚五碳糖,由β
‑
1,4木糖苷键连接起来,并带有多种取代基,是半纤维素的主要成分,如何开发和利用木聚糖是利用半纤维素生物质资源的关键。木聚糖酶是可以将木聚糖降解成低聚木糖和木糖的水解酶。人们早在60年代就开始了对木聚糖酶的研究,从不同来源的微生物中分离得到了大量不同性质的木聚糖酶,而不同来源的木聚糖酶在底物特异性、降解产物和一些其他特性上有很大的差异。完全水解木聚糖需要多种酶的共同作用,其中起重要作用的是β
‑
1,4内切木聚糖酶。生物酶法催化有高效和环境友好的
优点,在工业应用中正在取代化学催化法。木聚糖酶主要应用在纺织、食品、饲料、造纸、木质纤维素生物质转化等工业方面。近年来,利用木聚糖酶来生产低聚木糖备受关注。低聚木糖作为新世纪以来备受关注和称赞的超级益生元,具有增强免疫力、降低血压血脂、调节肠道菌群、改善食品风味的优质功能。
6.大肠杆菌表达系统作为发展最早的表达系统,与其他表达系统相比应用最为广泛,已经成为分子生物学研究及产业发展的重要工具。由于大肠杆菌表达系统具有遗传背景清楚,基因表达水平高,抗污染能力强及培养周期短的特点和优势,目前仍然在基因表达技术中占有相当重要的地位。利用大肠杆菌表达的外源蛋白通常位于胞内,这为目的蛋白的分离纯化增加了难度。目前,已有多个木聚糖酶在大肠杆菌中进行了异源表达,进一步利用纯化后的酶来降解木聚糖。但是现有技术中主要集中在大肠杆菌体内,不分泌到大肠杆菌胞外,不能实现菌体同步生长和发酵生产低聚木糖。
7.目前在大肠杆菌异源表达木聚糖酶的研究中,多以胞内表达为主,通过超声破碎法与纯化后获得胞内木聚糖酶,但是会导致木聚糖酶相对活性降低。
技术实现要素:
8.针对现有技术的不足,本发明提供了一种复合微生态制剂及其在提高肠道短链脂肪酸中的应用。
9.本发明以菌体同步生长和发酵生产低聚木糖,可以使酶活不会因稳定性降低、并充分水解木聚糖生产低聚木糖。
10.本发明的技术方案如下
11.一种复合微生态制剂,组分包括:低聚木糖、乳酸菌;
12.所述乳酸菌为:短小乳杆菌、屎肠球菌、乳酸片球菌或魏斯氏菌种的一种或两种以上。
13.根据本发明优选的,上述复合微生态制剂,组分包括:低聚木糖、乳酸菌;
14.所述乳酸菌为:短小乳杆菌、屎肠球菌、乳酸片球菌或魏斯氏菌种的一种或两种以上;
15.所述微生态制剂中乳酸菌的含量≥2
×
108cfu/g;低聚木糖的质量分数为35
‑
40%。
16.上述复合微生态制剂在生产短链脂肪酸中的应用。
17.上述复合微生态制剂在饲养动物中的应用。
18.根据本发明优选的,上述复合微生态制剂在提高动物体内短链脂肪酸总量、乙酸、丙酸、丁酸含量中的应用。
19.根据本发明优选的,所述复合微生态制剂在提高动物肠道内短链脂肪酸总量、乙酸、丙酸、丁酸含量的应用。
20.进一步优选的,所述复合微生态制剂在提高动物盲肠内短链脂肪酸总量、乙酸、丙酸、丁酸含量的应用。
21.根据本发明优选的,上述所述动物为哺乳动物。
22.上述复合微生态制剂饲养动物的方法,包括如下步骤:
23.所述微生态制剂在饲养动物饲料中的添加量为≥2%。
24.一种木聚糖酶,所述木聚糖酶的氨基酸序列如seq id no.1所示。
25.上述木聚糖酶的密码子优化后的核苷酸序列如seq id no.2所示。
26.一种含有上述木聚糖酶的基因工程菌ⅰ,所述基因工程菌ⅰ包括:上述木聚糖酶的密码子优化后的核苷酸序列如seq id no.2所示。
27.上述基因工程菌ⅰ的构建方法,包括如下步骤:将基因序列seq id no.2连接到表达载体pet22b(+)上得到重组质粒,然后将重组质粒转化到大肠杆菌bl21(de3)中得到重组表达菌株bl21(de3)/pet22b(+)
‑
xyl。
28.一种含有上述木聚糖酶的基因工程菌ⅱ,所述基因工程菌ⅱ中包括:上述木聚糖酶的密码子优化后的核苷酸序列如seq id no.2所示、分泌前导序列的核苷酸序列如seq id no.3所示。
29.上述基因工程菌ⅱ的构建方法,包括如下步骤:将基因序列seq id no.3连接到基因序列seq id no.2的n端,并将连接基因序列连接到表达载体pet22b(+)上得到重组质粒,然后将重组质粒转化到大肠杆菌bl21(de3)中得到重组表达菌株bl21(de3)/pet22b(+)
‑
fae20
‑
xyl。
30.上述基因工程菌ⅰ和/或基因工程菌ⅱ在生产低聚木糖中的应用。
31.本发明的有益效果
32.本发明主要针对乳酸菌添加剂的现有技术问题,采用了同步生长发酵的方式生产低聚木糖,配置筛选出的乳酸菌组成复合微生态制剂,用以改善肠道短链脂肪酸含量,改善肠道健康。
33.社会效益及经济效益:
34.1、主要应用对象:本发明所述复合微生态制剂,适用于益生元制剂配制中。
35.2、应用效益:添加由多种乳酸菌和低聚木糖配置的复合添加剂,使得盲肠短链脂肪酸含量显著提高。
36.3、推广价值:与传统的乳酸菌添加剂不同,本发明提供的复合微生态制剂其在盲肠内能够进一步促进乳酸菌增殖,较单一的乳酸菌添加剂,能更好增加肠道内短链脂肪酸含量,尤其是对乙酸含量的提高,更好的发挥益生作用,改善肠道健康。
附图说明
37.图1为本发明提供的木聚糖酶xyl与fae20
‑
xyl的sds
‑
page测试结果图;
38.图2为本发明提供的木聚糖酶xyl与fae20
‑
xyl纯化后的sds
‑
page测试结果图;
39.图3为本发明提供的木聚糖酶xyl与fae20
‑
xyl在不同ph值下酶活测定结果图;
40.图4为本发明提供的木聚糖酶xyl与fae20
‑
xyl在不同温度下酶活测定结果图;
41.图5为本发明提供的木聚糖酶xyl与fae20
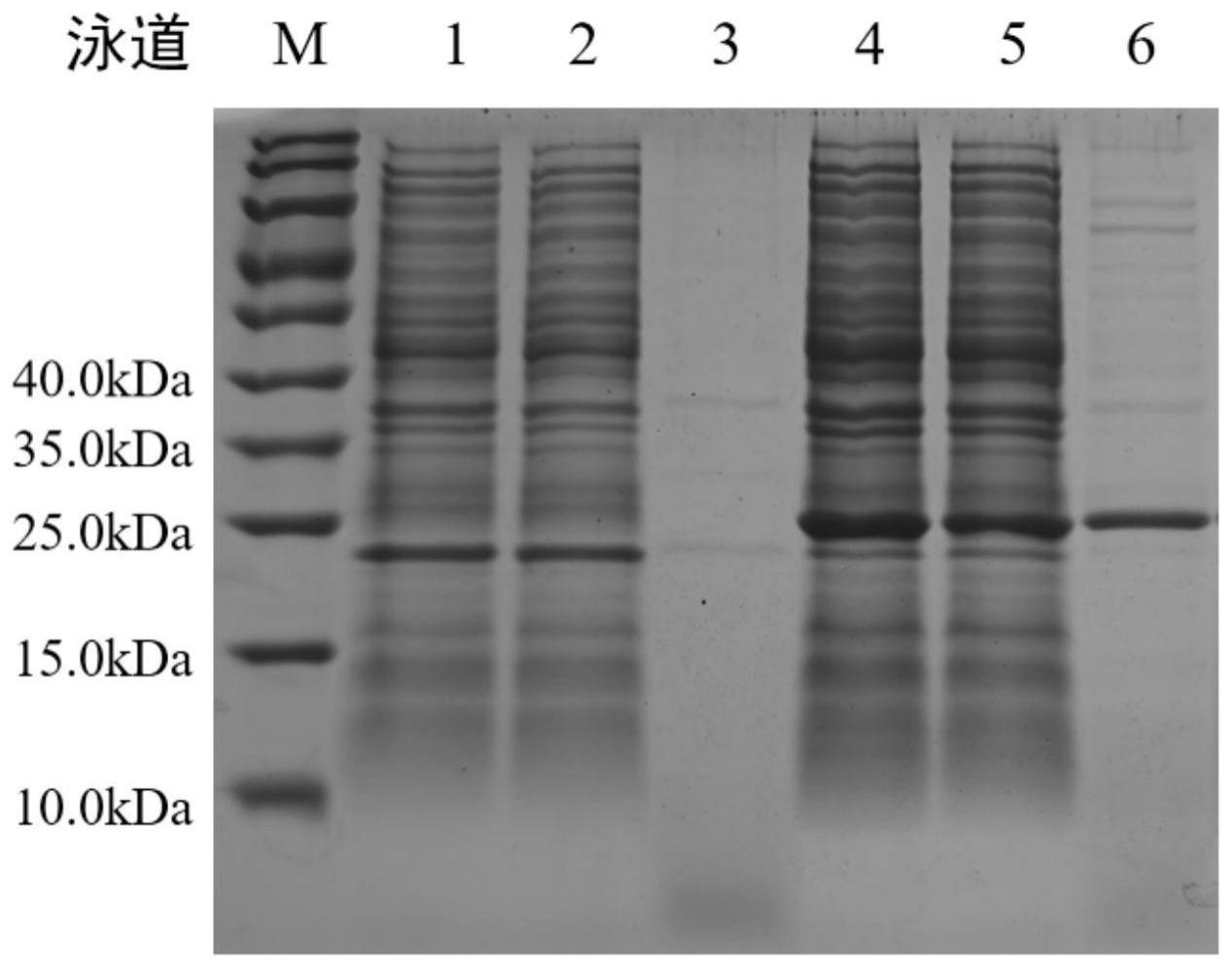
‑
xyl在不同ph下稳定性测定结果图;
42.图6为本发明提供的木聚糖酶xyl与fae20
‑
xyl在不同温度下稳定性测试结果图;
43.图7为本发明提供的木聚糖酶fae20
‑
xyl的4
‑
72h胞内与胞外相对酶活变化测定结果图;
44.图8为本发明提供的木聚糖酶fae20
‑
xyl的4
‑
72h木聚糖发酵液上清还原糖含量变化测定结果图;
45.图9为本发明提供的木聚糖酶fae20
‑
xyl木聚糖发酵液上清薄层层析结果图;
46.图10为本发明提供的低聚木糖培养乳酸菌时对其生长的影响结果图;
47.图11为本发明提供的低聚木糖培养乳酸菌时对ph的影响结果图;
48.图12为本发明提供的低聚木糖培养不同乳酸菌时寡糖利用率的薄层层析图。
具体实施方式
49.下面结合具体实施例对本发明作进一步说明,但本发明的保护范围不局限于此。
50.生物材料的来源
51.本发明所使用的微生物菌种来源:大肠杆菌xl1
‑
blue、大肠杆菌bl21(de3)、短小乳杆菌、屎肠球菌、乳酸片球菌、魏斯氏菌、植物乳杆菌、约氏乳杆菌、鼠李糖乳杆菌、副干酪乳杆菌、格氏乳杆菌、干酪乳杆菌、德式乳杆菌、嗜酸乳杆菌、清酒乳酸杆菌、卷曲乳杆菌、乳酸乳球菌、香肠乳杆菌、费氏乳杆菌、粪肠球菌、戊糖片球菌和发酵乳杆菌来源于实验室菌种库,也可以在现有的菌种保藏中心购买同种菌替代。
52.实施例1
53.芽孢杆菌来源的新型木聚糖酶基因序列(genbank:agn35000.1)经大肠杆菌密码子偏好性优化后,获得优化后的木聚糖酶基因序列如seq id no.2所示,所述木聚糖酶的氨基酸序列如seq id no.1所示。
54.重组表达菌株bl21(de3)/pet22b(+)
‑
xyl构建具体方法如下:
55.使用引物0
‑
xyl
‑
f与引物0
‑
xyl
‑
r将木聚糖酶xyl基因序列seq id no.2扩增后,使用试剂盒进行产物纯化。通过使用同源重组法连接到载体pet22b(+)上,连接产物转化到大肠杆菌xl1
‑
blue中,用试剂盒提取质粒,获得重组表达质粒。最后转化至大肠杆菌de3感受态,获得重组表达菌株bl21(de3)/pet22b(+)
‑
xyl。
56.重组表达菌株bl21(de3)/pet22b(+)
‑
fae20
‑
xyl构建具体方法如下:
57.使用引物xyl
‑
f与引物xyl
‑
r将木聚糖酶xyl基因序列seq id no.2扩增后,使用试剂盒进行产物纯化。fae20信号肽序列通过引物fae20
‑
f与引物fae20
‑
r扩增,并在fae20信号肽序列的3’端加入bamhi位点。同样使用上述方法进行产物纯化。通过重叠拼接pcr法,fae20信号肽序列添加在木聚糖酶n端,并使用同源重组法连接到载体pet22b(+)上,连接产物转化到大肠杆菌xl1
‑
blue中,用试剂盒提取质粒。最后转化至大肠杆菌bl21(de3)感受态,获得重组表达菌株bl21(de3)/pet22b(+)
‑
fae20
‑
xyl。
58.引物序列,见表1:
59.表1
[0060][0061]
pcr扩增体系(50μl)组成:
[0062]
20μl去离子h2o;
[0063]
25μl 2
×
taq plus master mixⅱ;
[0064]
2μl上游引物;
[0065]
2μl下游引物;
[0066]
1μl模板。
[0067]
pcr扩增程序:
[0068]
预变形:95℃3min;
[0069]
变性:95℃30s;
[0070]
退火:52.6℃30s;
[0071]
延伸:72℃1min;
[0072]
终延伸:72℃5min;
[0073]
4℃保存;
[0074]
变性、退火、延伸重复30个循环。
[0075]
实施例2
[0076]
由实施例1构建的重组表达菌株bl21(de3)/pet22b(+)
‑
xyl和重组表达菌株bl21(de3)/pet22b(+)
‑
fae20
‑
xyl,37℃下培养至od600为0.5~0.6后,加入iptg继续在37℃下诱导24h。将菌液在10000rpm,4℃下离心5min,取上清制备胞外蛋白样品。将菌体离心后重悬在磷酸盐缓冲液中进行超声破碎(400w,破碎4s,暂停4s)20min,将细胞破碎液12000rpm离心5min,取细胞破碎液与离心上清分别制备全细胞蛋白样品与胞内蛋白样品。用于10%sds
‑
page分析。分析结果如图1所示,泳道1
‑
3分别为木聚糖酶xyl全细胞蛋白样品、胞内蛋白样品、胞外蛋白样品;泳道4
‑
6分别为木聚糖酶fae20
‑
xyl全细胞蛋白样品、胞内蛋白样品、胞外蛋白样品。由图1可以看出重组菌株bl21(de3)/pet22b(+)
‑
fae20
‑
xyl较bl21(de3)/pet22b(+)
‑
xyl的木聚糖酶胞外可溶性分泌明显提高。
[0077]
将bl21(de3)/pet22b(+)
‑
xyl与bl21(de3)/pet22b(+)
‑
fae20
‑
xyl菌株37℃下培养至od600为0.5~0.6后,加入iptg在16℃下诱导24h。将菌液在10000rpm,4℃下离心5min,弃上清。将离心菌体重悬在binging缓冲液中进行超声破碎(400w,破碎4s,暂停4s)20min,将细胞破碎液12000rpm离心5min后取上清,经过0.22μm滤膜过滤。在8~10℃的温度环境下,将上清液通过histrap亲和层析柱后,使用elution缓冲液在梯度洗脱层析柱上的重组蛋白,得到纯化的木聚糖酶xyl与fae20
‑
xyl,用于10%sds
‑
page分析与木聚糖酶活性测定,分析结果如图2所示,泳道1为木聚糖酶xyl纯化蛋白样品、泳道2为木聚糖酶fae20
‑
xyl纯化蛋白样品。
[0078]
实施例3
[0079]
木聚糖酶酶活测定方法:
[0080]
将1%的木聚糖底物与适当稀释后的酶液反应10min后,用3,5
‑
二硝基水杨酸(dinitrosalicylic acid,dns)法测定还原糖(以木糖计)。通过标准曲线计算还原糖量和相应的酶活性。具体测定步骤如下:
[0081]
(1)木糖标准品溶液的制备
[0082]
将木糖按照0.1、0.25、0.5、1、2.5、5g/l浓度配置成标准品溶液
[0083]
(2)木糖标准曲线的测定:
[0084]
取洁净干燥ep管,标号并设置平行,每管加入150μl的ph7磷酸盐缓冲液,再加入50μl各浓度木糖溶液与150μl dns试剂,沸水浴5min后静置至室温。
[0085]
取200μl至96孔板,使用酶标仪测定562nm处吸光值。
[0086]
根据测得吸光值及相对应的参考品浓度c(g/ml),求得线性回归方程:
[0087]
a=kc+b
[0088]
其中k为标准曲线斜率,b为截距,a为吸光度,c为浓度(g/ml)。
[0089]
计算公式:
[0090]
c=n
×
(a+0.0021)/0.711
[0091]
其中c为样品测定浓度,n为样品稀释倍数,a为吸光度,0.0021为截距,0.711为标准曲线斜率。
[0092]
(3)最适ph测定
[0093]
将木聚糖酶xyl与fae20
‑
xyl在ph值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0和11.0的缓冲液(ph 3~5缓冲液由mcilvaine缓冲液制备,ph6~8缓冲液由磷酸盐缓冲液制备,ph 9~11的缓冲液由甘氨酸
‑
氢氧化钠(50mm)缓冲液制备)中,于37℃温度下,分别通过上述dns法测定酶活,以测得的最高酶活值设定为100%,计算其他各ph反应区间的相对酶活。
[0094]
各ph反应区间的相对酶活的计算结果如图3所示。由图3可知,实施例2制备的木聚糖酶xyl、fae20
‑
xyl在ph值为6~9区间都具有较高的活性,其最适ph为8.0。
[0095]
(4)最适反应温度测定
[0096]
将木聚糖酶xyl与fae20
‑
xyl分散在ph值7.0的缓冲液体系中,分别于25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃和65℃温度下,通过上述dns法测定酶活,以测得的最高酶活值设定为100%,计算其他各温度反应区间的相对酶活,结果如图4所示,木聚糖酶xyl与fae20
‑
xyl最适反应温度为50℃。
[0097]
(5)ph稳定性测定
[0098]
将木聚糖酶xyl与fae20
‑
xyl在不同ph(ph值为3~11)的缓冲液体系中,于25℃温度下孵育1h后,在50℃、ph值为8.0的条件下,通过上述dns法测定酶活,以测得的最高酶活值设定为100%,计算其他各ph反应区间的相对酶活,结果如图5所示,木聚糖酶xyl与fae20
‑
xyl在ph7时稳定性最好。
[0099]
(6)温度稳定性测定
[0100]
将木聚糖酶xyl与fae20
‑
xyl在ph 8.0的缓冲液体系中,分别置于40℃、45℃和50℃温度下孵育1h后,在50℃、ph值为8.0的条件下,通过上述dns法测定酶活,以测得的最高酶活值设定为100%,计算其他各ph反应区间的相对酶活,结果如图6所示。
[0101]
由图6可知,实施例2制备的木聚糖酶xyl与fae20
‑
xyl在最适反应温度50℃下孵育1h后保持约30%的酶活。
[0102]
实施例4
[0103]
由实施例3的步骤(6)结果可知,木聚糖酶fae20
‑
xyl在最适反应温度的温度稳定性较差,所以采用同步生长和发酵的方式,即将不同质量浓度木聚糖(1%~5%)作为底物,添加至lb培养基,再接种菌株。分别发酵4
‑
72h后,12000rpm离心5min后,分别取上清通过dns法测定酶活并计算还原糖含量,再进行薄层层析分析(薄层层析硅胶板购自merck公司)。薄层层析所用的展开剂为正丁醇:异丙醇:乙酸:水=7:5:2:4(体积比),展开三次。条带显影剂为0.018%二甲苯溶于丙酮:苯胺:磷酸=50:1:5(体积比),喷洒显影剂后将薄层板置于100℃、5min。
[0104]
分析结果如图7所示,fae20
‑
xyl诱导4
‑
72h时胞内与胞外相对酶活的变化。
[0105]
分析结果如图8所示,fae20
‑
xyl在添加不同质量浓度木聚糖(1
‑
5%)的lb培养4
‑
72h发酵液上清中还原糖含量的变化。测得质量浓度4%木聚糖浓度的48h发酵液上清的还原糖含量为8.79
±
0.10g/l。
[0106]
分析结果如图9所示,图9中:泳道1为10mg/ml的木糖溶液,泳道2
‑
10分别为发酵0h、4h、8h、12h、24h、36h、48h、60h和72h水解产物。
[0107]
由图8、9可知,木聚糖酶fae20
‑
xyl在48h即可有效地将木聚糖充分水解为2~4个残基的木聚寡糖。
[0108]
将木聚糖以4%的最佳底物浓度添加至lb培养基,与重组木聚糖酶fae20
‑
xyl表达菌株进行同步诱导发酵48h,10000rpm离心10min后收集上清,测得还原糖含量为8.79
±
0.10g/l。
[0109]
实施例5
[0110]
将木聚糖以实施例4中的同步发酵方法发酵48h后,离心取上清,以同等体积加入2
×
无糖mrs培养基,制得以低聚木糖为碳源的特殊mrs培养基用于乳酸菌培养。将乳酸菌以体积比2%的相同的接种浓度转接入制备的特殊mrs培养基,37℃静置培养,分别测定在培养24h后的od600与ph变化,结果如图10、图11所示。将各乳酸菌菌液离心后取上清进行tlc板薄层层析与hplc分析,结果分别如图12所示。
[0111]
分析结果如图12所示,图12中:泳道1为未接菌的含低聚木糖的特殊mrs培养基作为空白对照,泳道2
‑
21分别为短小乳杆菌、屎肠球菌、乳酸片球菌、魏斯氏菌、植物乳杆菌、约氏乳杆菌、鼠李糖乳杆菌、副干酪乳杆菌、格氏乳杆菌、干酪乳杆菌、德式乳杆菌、嗜酸乳
杆菌、清酒乳酸杆菌、卷曲乳杆菌、乳酸乳球菌、香肠乳杆菌、费氏乳杆菌、粪肠球菌、戊糖片球菌和发酵乳杆菌37℃静置培养24h后的菌液离心后上清。由实施例5分析可知,短小乳杆菌、屎肠球菌、乳酸片球菌与魏斯氏菌等四种菌株可高效利用低聚木糖而产酸。
[0112]
实施例6
[0113]
将筛选的四种乳酸菌分别制备微生态制剂,微生态制剂中乳酸菌的含量为2
×
108cfu/g;低聚木糖的质量分数为35%。
[0114]
将小鼠随机分为对照组和实验组,具体如下:
[0115]
对照组:普通饲料;
[0116]
实验组:微生态制剂(短小乳杆菌+低聚木糖)+普通饲料;
[0117]
微生态制剂(屎肠球菌+低聚木糖)+普通饲料;
[0118]
微生态制剂(乳酸片球菌+低聚木糖)+普通饲料;
[0119]
微生态制剂(魏斯氏菌+低聚木糖)+普通饲料。
[0120]
对比组1:微生态制剂中乳酸片球菌的含量为2
×
108cfu/g;低聚木糖的质量分数为20%;
[0121]
微生态制剂(短小乳杆菌+低聚木糖)+普通饲料。
[0122]
对比组2:微生态制剂中乳酸片球菌的含量为2
×
108cfu/g;低聚木糖的质量分数为50%;
[0123]
微生态制剂(短小乳杆菌+低聚木糖)+普通饲料。
[0124]
对比组3:微生态制剂中乳酸片球菌的含量为2
×
108cfu/g;不含低聚木糖;
[0125]
微生态制剂(短小乳杆菌)+普通饲料。
[0126]
实验组、对比组1、对比组2中微生态制剂按质量分数2%添加到普通饲料中,对照组和实验组连续饲喂小鼠21天,饲喂方式为饲料灌胃,然后收集饲喂21天的小鼠盲肠,测定盲肠中的短链脂肪含量变化;盲肠短链脂肪酸浓度(乙酸、丙酸和丁酸等)通过气相色谱与液相色谱进行定量分析,分析结果见表2。
[0127]
表2
[0128]
[0129][0130]
利用本发明涉及的微生态制剂饲喂小鼠后,可以明显提高小鼠盲肠中总短链脂肪酸与乙酸、丙酸、丁酸的含量,对盲肠中乙酸含量的提高尤为明显,由实验组微生态制剂(乳酸片球菌+低聚木糖)与对比组1和对比组2可以看出,虽然乳酸片球菌与低聚木糖制备的微生态制剂都可以提高小鼠盲肠中总短链脂肪酸与乙酸、丙酸、丁酸的含量,但是实验组中的提高效果显著优于对比组1和对比组2;由实验组微生态制剂(乳酸片球菌+低聚木糖)与对比组3可以看出,乳酸片球菌与低聚木糖制备的微生态制剂对于提高小鼠盲肠中总短链脂肪酸与乙酸、丙酸、丁酸的含量显著优于乳酸片球菌单独使用,有表2中的实验数据可以看出,其中短小乳杆菌与低聚木糖的总体作用效果最显著。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1