一种长尾宽宿主谱链霉菌强裂解性噬菌体及其在防治马铃薯疮痂病药物中的应用
本发明属于微生物技术领域,具体涉及一种长尾宽宿主谱链霉菌强裂解性噬菌体及其在防治马铃薯疮痂病药物中的应用。
背景技术:
马铃薯疮痂病是由病原链霉菌(s.scabies、s.galilaeus、s.bobili等)引起的植物性病害,其危害马铃署块茎,导致块茎表面出现近圆形至不定形木栓化疮痂状淡褐色病斑或斑块,手摸质感粗糙;通常病斑仅限于皮层,有时匍匐茎也可受害,使被害薯块质量和产量降低,不耐贮藏,且病薯外观不雅,商品品级大为下降。虽然通过实施合理布局、推广抗病品种、种薯处理、切刀消毒、建立种薯田、中耕培土、喷药保护等综合防治措施,能使马铃薯细菌性病害得到有效控制,但多个环节的处理一方面加大了劳动强度,使产业成本居高不下;另一方面,农药的大量使用造成了超级抗药菌的出现和环境的严重污染以及商品薯农药残留超标等多种问题,故为了支撑国家马铃薯主粮化战略及马铃薯产业的健康发展,亟需研制高效、安全、环保的用于马铃薯细菌病害防控的新技术及新药剂。
噬菌体是感染细菌、真菌、藻类、放线菌或螺旋体等微生物的病毒的总称,在数目上超出细菌十倍左右。目前,噬菌体有望作为抗菌剂替代抗生素和农药以解决日益严重的病原细菌耐药性问题;同时,由于噬菌体具备特异性强、易于分离和增值、遗传毒性低、耐受食品加工环境等特点,也被期望作为一种理想的生物防腐剂或检测手段用于诸多领域。噬菌体增殖快,定殖病原宿主后,就不需要再次补充噬菌体。病原菌感染了相应的某种噬菌体后,可能会像患了恶性肿瘤一样,无法治愈,这样就可以把原来不属于某个地方的相应的病害根除,维持当地原有的生态环境。相比于采用农药控制病害的扩展和蔓延,不论是从环境友好性,还是减少生产成本方面来说,噬菌体是一种更好生物防治方法。
技术实现要素:
为了解决现有技术存在的以上问题,本发明提供了一种安全、有效、无污染的噬菌体及其在防治马铃薯疮痂病药物中的应用。所述噬菌体属于长尾噬菌体科,对宽宿主谱链霉菌具有较强的裂解性,效价高。
本发明所采用的技术方案为:
一种长尾宽宿主谱链霉菌强裂解性噬菌体,保藏编号为cctccm2021379,保藏单位为中国典型培养物保藏中心。
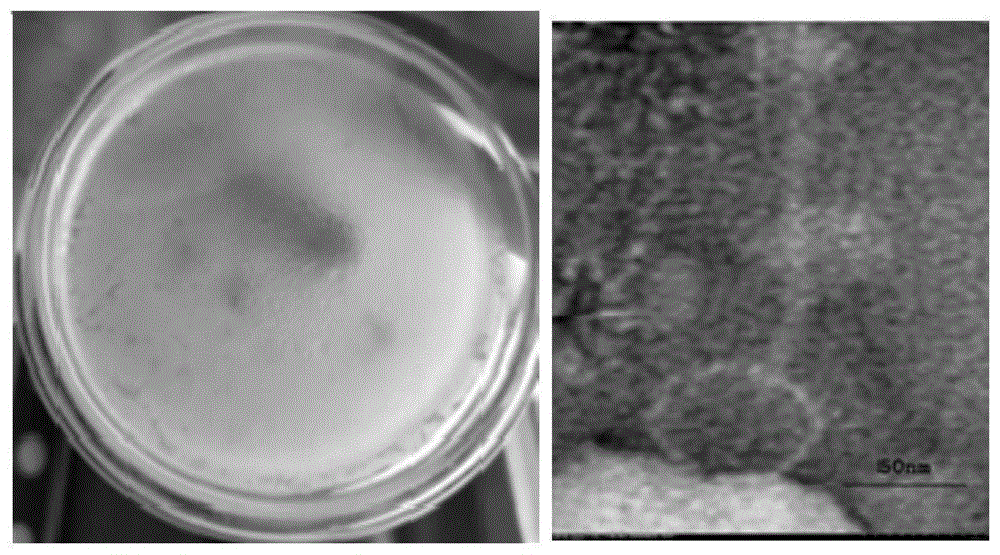
所述噬菌体具有呈多面体的头部结构和无收缩性的尾部,头部直径约64±7nm,尾部长约196±8nm,所述噬菌体属于长尾噬菌体科。
所述噬菌体在ph为2-10范围内具有活性,所述噬菌体在30℃-80℃时活性稳定,大于80℃则失活。
所述噬菌体的潜伏期为20min,爆发期为60min。
所述噬菌体在moi为0.01时,其效价为1.47×107。
所述的长尾宽宿主谱链霉菌强裂解性噬菌体的分离纯化方法,具体如下:
(1)样品前处理:
将有病斑的马铃薯表皮部位刮下来进行研磨后,加入蒸馏水,30℃、170rmp震荡培养6-8h后取上清液,将上清液4000r/min离心10min后过滤,得到含有噬菌体的样液;
(2)准备宿主菌:
将平板上生长良好的链霉菌单菌落接种于高氏液体培养基中,以170r/min、30℃培养至对数生长早期,备用;
(3)噬菌体的增殖分离
取10ml含有噬菌体的样液加入到30ml高氏一号液体培养基中,并加入1ml处于对数期生长早期的宿主菌菌悬液,加入一定量的氯化钙,充分混匀后使体系的氯化钙终浓度为10mmol/l,30℃、170r/min震荡培养过夜,得到培养液在4℃、10000r/min离心10min,收集上清液后过滤,得到噬菌体富集液;
在无菌超净台中吸取100μl的宿主菌液均匀地涂在高氏固体培养基平板上,静置15min,接着吸取sm液稀释10-1000倍的噬菌体富集液100μl到涂了宿主菌液的平板上,将其均匀涂布,静置15min后倒置培养,过夜,形成噬菌斑;
(4)噬菌体的纯化
用无菌的牙签挑取大小均匀且透亮的单一噬菌斑放置于1ml的sm液中,30℃、170r/min震荡培养后过滤,滤液进行经无菌sm液稀释103-106倍后,继续涂板,按照以上的操作进行纯化,重复多次,得到纯化后的噬菌斑;
挑取均匀透亮单一的噬菌斑置于sm液中,经过震荡培养过滤后,得到纯化噬菌体溶液。
步骤(2)中,所述链霉菌为s.scabies、s.galilaeus、s.bobili中的任意一种。
步骤(4)中,噬菌体溶液置于4℃进行保存,每半年复苏一次。
步骤(4)中,将噬菌体溶液与60%的甘油以1:2的比例混合后,放入到冻存管在-80℃长期保存,定期复苏。
所述的长尾宽宿主谱链霉菌强裂解性噬菌体在制备防治马铃薯疮痂病药物中的应用。
本发明具体如下有益效果:
本发明所述的长尾宽宿主谱链霉菌强裂解性噬菌体,属于长尾噬菌体科,对宽宿主谱链霉菌具有较强的裂解性,效价高。本发明所述的长尾宽宿主谱链霉菌强裂解性噬菌体用于防治马铃薯疮痂病,安全性好,效果好,无污染。噬菌体防治马铃薯疮痂病的实验结果表明:对照组结痂病变覆盖率平均为28.5%左右,相比之下,噬菌体处理组的块茎后代的病变覆盖率仅为3.5%,显著降低(p<0.05)。此外,通过噬菌体处理,每个块茎的损伤类型和损伤数量也显著减少(p<0.05)。噬菌体处理和未处理的块茎在块茎重量、大小或数量上没有显著差异。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1是本发明所述噬菌体
图2是本发明所述噬菌体
图3是本发明所述噬菌体
图4是本发明所述噬菌体
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施病例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
实施例1
本发明所述噬菌体的分离纯化方法,具体如下:
(1)样品前处理:
将有病斑的马铃薯表皮部位刮下来进行研磨后,加入50ml蒸馏水,置于250ml锥形瓶中,30℃、170rmp震荡培养6-8h后取上清液,将上清液4000r/min离心10min后用0.22μm微孔滤器过滤,得到含有噬菌体的样液;
(2)准备宿主菌:
将平板上生长良好的链霉菌单菌落接种于100ml高氏液体培养基中,以170r/min、30℃培养至对数生长早期,备用;
(3)噬菌体的增殖分离
取10ml含有噬菌体的样液加入到30ml高氏一号液体培养基中,并加入1ml处于对数期生长早期的宿主菌菌悬液,加入一定量的氯化钙,充分混匀后使体系的氯化钙终浓度为10mmol/l,30℃、170r/min震荡培养过夜,得到培养液在4℃、10000r/min离心10min,收集上清液后用0.22μm微孔滤器过滤,得到噬菌体富集液;
在无菌超净台中吸取100μl的宿主菌液均匀地涂在高氏固体培养基平板上,静置15min,接着吸取sm液稀释10-1000倍的噬菌体富集液100μl到涂了宿主菌液的平板上,将其均匀涂布,静置15min后倒置培养,过夜,形成噬菌斑;
(4)噬菌体的纯化
用无菌的牙签挑取大小均匀且透亮的单一噬菌斑放置于1ml的sm液中,30℃、170r/min震荡培养后过滤,滤液进行经无菌sm液稀释103-106倍后,继续涂板,按照以上的操作进行纯化,重复多次,得到纯化后的噬菌斑;
挑取均匀透亮单一的噬菌斑置于sm液中,经过震荡培养过滤后,得到纯化噬菌体溶液;
(5)噬菌体的保存
将噬菌体溶液置于4℃冰箱,可长期保存,每半年复苏一次。将噬菌体溶液与60%的甘油以1:2的比例混合后,放入到冻存管在-80℃长期保存,定期复苏。
将所述噬菌体命名为
实施例2
噬菌体的效价以及最佳感染复数测定
1、对马铃薯疮痂链霉菌噬菌体的效价进行测定:
噬菌体效价是指每毫升样品中具有侵染性噬菌体的数量。噬菌体效价的计算公式如下:
噬菌体效价(pfu/ml)=噬菌斑个数×稀释倍数/噬菌体液体积。
吸取100μl的宿主菌液,平板涂布后静置至干,吸取经无菌sm液稀释103-106倍的噬菌体液100μl涂布在铺满宿主菌的平板中,30℃倒置培养,观察平板上噬菌斑的数量,试验重复3次,每次设3个平行。
2、噬菌体的最佳感染复数测定
感染复数(multiplicityofinfection,moi)是指初始感染时加入的噬菌体数量与宿主菌数量的比值。按感染复数为100、10、1、0.1、0.01、0.001、0.0001分别加入100ul的宿主菌和100ul噬菌体于高氏液体培养基中,30℃、170rpm震荡培养,用0.22um的滤器进行过滤,得到纯净的噬菌体液。将噬菌体液做10-1至10-9梯度稀释,利用平板涂布法对噬菌体进行滴度测定,滴度最高的感染复数即为最佳感染复数。试验重复3次,每次设置3个平行。
具体如表1所示。
表1-噬菌体
结果显示,噬菌体
实施例3
利用噬菌体(命名为
将分离到的34株能引起疮痂病的链霉菌进行平板划线,挑取形态良好的单一菌落进行菌液培养。取100μl培养至对数生长早期的菌液涂布到琼脂平板,待菌液干了,用移液枪移取10μl的噬菌体液原液点样在平板上,点样时注意每滴噬菌体液原液之间的间隔,待点滴的溶液完全干透,倒置在30℃的培养箱培养。次日观察平板的菌苔上是否有噬菌斑的出现,如果出现噬菌斑即表明该噬菌体可裂解该菌。具体如下表2所示。
表2-噬菌体
结果显示,所述噬菌体
实施例4
温度和ph对噬菌体稳定性的影响:
取效价达到108的噬菌体液1ml,放置在灭过菌的ep管中,放置于不同温度的水浴锅中,1h后取出立即放于冰浴中冷却,利用平板涂布法分别测定30℃、40℃、50℃、60℃、70℃、80℃、90℃、100℃下的噬菌体效价。试验重复3次,每次设置3个平行。
配置好ph为1-12的sm液,将其装于无菌的ep管,30℃水浴30min至温度平衡。将效价达到108的噬菌体液每次吸取100ul加入到900ul的不同ph的sm液中,水浴锅30℃水浴1h,取出ep管,利用平板涂布法测定噬菌体样液在不同ph下的效价。试验重复3次,设置3个平行。
结果显示:所述噬菌体
实施例5
噬菌体的一步生长曲线测定:
将噬菌体与宿主菌按照最佳感染复数混合,30℃、170rpm震荡吸附15min,10000rpm离心10min,弃尽上清,用新鲜的液体培养基重悬,重复洗涤2-3次,除去没有吸附的噬菌体。加入15ml高氏液体培养基充分混匀,迅速放置于震荡培养箱中,30℃、170r/min培养。从0时开始隔一定间隔,每10min连续取样,无菌过滤后,利用平板涂布法测定上清液中噬菌体的效价。绘制一步生长曲线,以噬菌体效价为纵坐标,取样时间为横坐标。试验重复3次,每次设置3个平行。结果如图4所示,噬菌体
实施例6
噬菌体对马铃薯疮痂病的防治:
选取100粒直径在2cm左右患有疮痂病的种薯,随机分为2组。一组将患病种薯浸泡于效价为1×107噬菌体悬浮液中24小时,温度为25℃,另一组做同样处理,只是噬菌体悬浮液于浸泡前121℃下高压灭菌20min。将浸泡过的种薯以相同深度种植于聚苯乙烯泡沫盒中,泡沫盒可以自由渗漏水,盒中土壤经60℃蒸汽灭菌1h,每个泡沫盒种植5株,每组10个重复。将泡沫盒置于22℃±2℃温室中,种植后两周之内每天浇水,两周后减少浇水次数。60d后收获子代块茎,对每个马铃薯子代块茎的疮痂损伤进行计数,以损伤表面积和损伤类型的百分比来评估严重程度。病变表面积(%)按0-6的等级评定如下:0,无病变;1,≤10%;2,11–20%;3,21–30%;4,31–40%;5,41–50%;6,50%。损伤类型按0-4的等级评定如下:0,无损伤;1、浅表病灶;2、稍隆起或稍凹陷的病灶;3、凹陷性病变;4、深度凹陷病灶。检查每株植物的重量、大小和块茎数量,以确定两组之间的差异。
结果如表3所示。
表3-链霉菌噬菌体
从表3可以看出:对照组结痂病变覆盖率平均为28.5%左右,相比之下,噬菌体处理组的块茎后代的病变覆盖率(3.5%)显著降低(p<0.05)。此外,通过噬菌体处理,每个块茎的损伤类型(疮痂类型)和损伤数量(疮痂斑数)也显著减少(p<0.05)。噬菌体处理和未处理的块茎在块茎重量、大小或数量上没有显著差异
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。
- 还没有人留言评论。精彩留言会获得点赞!