抑制核盘菌的miRNA及其应用
抑制核盘菌的mirna及其应用
技术领域
1.本发明属于植物分子生物学领域,具体涉及一个抑制核盘菌的mirna及其应用。
背景技术:
2.核盘菌(sclerotinia sclerotiorum(lib.)de bary)是一种典型的死体营养型、寄主范围广泛的丝状植物病原真菌,分布范围覆盖95个国家及地区,可侵染600多种植物,其中包括一些重要农作物,如大豆,油菜,向日葵,芸薹属蔬菜等。在适宜条件下,核盘菌可迅速侵染寄主植物产生菌核病。植物对核盘菌的抗性体现为基础抗性,目前为止仍未找到核盘菌的致病基因及植物中对应的抗病基因,因此寄主植物的抗菌核病育种进展缓慢。目前生产上主要通过一些农业措施和化学药剂来防治菌核病,但效果不稳定,并且存在环境污染及抗药性等问题。开展可抑制核盘菌的生物小分子物质研究,进而指导寄主植物的生产实践,对实现植物的安全稳产有重要意义。
3.植物非寄主抗性是自然界广泛存在的抗病系统,具有持久性和广谱性,对作物抗病育种有重要的应用价值。对于核盘菌而言,水稻是其非寄主植物之一。根据对水稻与油菜接种核盘菌前和接种后的小rna测序(srna
‑
seq)及转录组测序(rna
‑
seq)联合分析,鉴定到1个水稻特异的、响应核盘菌诱导的mirna,该mirna可靶向核盘菌基因。根据其成熟mirna序列特征,将其归属于mir169家族,是该家族一个新成员,本发明将其编号为os
‑
mir169y。mir169基因家族是植物界所发现的较大的mirna基因家族,多数成员具有调控植物生长发育及对逆境产生响应的功能。然而os
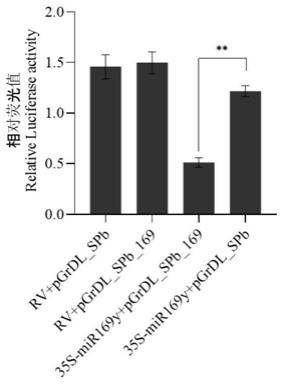
‑
mir169y是一个新成员,其功能及靶基因并未有任何报道。本发明对该os
‑
mir169y进行抑菌功能研究,并开发其用于寄主植物的抗性提高的途径,可为寄主植物的菌核病抗性改良提供基础。
技术实现要素:
4.本发明的目的是提供os
‑
mir169y成熟mirna及其应用。
5.首先,本发明提供os
‑
mir169y,其为成熟mirna,序列如seq id no.1所示。
6.本发明还提供编码所述的os
‑
mir169y的前体,其核苷酸序列如seq id no.2所示。
7.本发明还提供含有所述os
‑
mir169y的过表达载体,宿主细胞和工程菌。
8.本发明还提供所述os
‑
mir169y靶向核盘菌基因并抑制核盘菌的用途。
9.本发明还提供所述os
‑
mir169y在调控寄主植物菌核病抗性中的用途。
10.本发明从水稻中鉴定到了1个与核盘菌抗性相关的os
‑
mir169y,经双荧光素酶报告系统检测,os
‑
mir169y可靶向核盘菌ssrpl19基因,利用基因工程手段构建了os
‑
mir169y的核盘菌过表达载体,将其转入野生型核盘菌中超量表达,能抑制核盘菌的菌丝生长,降低致病力,延缓菌核形成时间。利用基因工程手段构建了os
‑
mir169y的植物过表达载体,将其转入野生型拟南芥中超量表达,能有效提高拟南芥菌核病抗性。
11.本发明为核盘菌寄主植物的抗性改良提供了很好的应用前景。
附图说明
12.图1是os
‑
mir169y与靶基因ssrpl19碱基结合情况预测结果。
13.图2是双荧光素酶活检测os
‑
mir169y与ssprl19互作的结果。四组数据依次为:mir169y空载菌液+pgrdl_spb菌液,mir169y空载菌液+pgrdl_spb_169菌液,35s
‑
mir169y菌液+pgrdl_spb_169菌液,35s
‑
mir169y菌液+pgrdl
‑
spb菌液。**表示p<0.01。
14.图3是os
‑
mir169y同源基因在物种间的系统发育分析。os
‑
mir169y成熟序列与其近缘物种及其他植物的序列相比,序列差异明显,表明了该序列的特异性。实心圆表示预测到mirna与ssprl19存在靶向关系。物种拉丁名缩写:aly
‑
arabidopsis lyrata;ath
‑
arabidopsis thaliana;aof
‑
asparagus officinalis;bdi
‑
brachypodium distachyon;bju
‑
brassica juncea;bra
‑
brassica rapa;can
‑
capsicum annuum;ccl
‑
citrus clementina;cmo
‑
cucurbita moschata;csi
‑
citrus sinensis;esa
‑
eutrema salsugineum;fan
‑
fragaria ananassa;fex
‑
fraxinus excelsior;fsy
‑
fagus sylvatica;ghi
‑
gossypium hirsutum;hbr
‑
hevea brasiliensis;hsy
‑
hibiscus syriacus;mac
‑
musa acuminata;nbe
‑
nicotiana benthamiana;ogl
‑
oryza glaberrima;oni
‑
oryza nivara;oru
‑
oryza rufipogon;osa
‑
oryza sativa;pda
‑
phoenix dactylifera;peu
‑
populus euphratica;ptr
‑
populus trichocarpa;qro
‑
quercus robur;sit
‑
setaria italica;sla
‑
silene latifolia;sly
‑
solanum lycopersicum;spe
‑
solanum pennellii;spi
‑
solanum pimpinellifolium;stu
‑
solanum tuberosum;tae
‑
triticum aestivum;zma
‑
zea mays。
15.图4是os
‑
mir169y在核盘菌中超量表达的载体pef1
‑
os
‑
mir169y菌检结果。不同泳道代表不同的单克隆,扩增片段为402bp的单克隆即为os
‑
mir169y的过表达载体pef1
‑
os
‑
mir169y。
16.图5是核盘菌os
‑
mir169y过表达转化子的pcr和荧光定量pcr鉴定结果。pcr鉴定共筛选出7个402bp条带的阳性转化子(a图),所有转化子的os
‑
mir169y表达量均高于野生型菌株(b图)。
17.图6是os
‑
mir169y过表达的转基因核盘菌表型。os
‑
mir169y过表达的2个转基因菌株ef1
‑
mir169y
‑
1和ef1
‑
mir169y
‑
1,其菌丝生长速度显著低于wt(a图),培养10天后仍无菌核形成(b图),培养25天可产生菌核(c图),接种油菜叶片菌斑面积小于wt(d图),接种油菜茎秆的菌斑长度显著小于wt(e图),表明os
‑
mir169y过表达的转基因核盘菌,其菌丝生长速度和致病力显著下降、菌核形成延缓。
18.图7是os
‑
mir169y在拟南芥中超量表达的载体pbinglyred3
‑
os
‑
mir169y菌检结果。不同泳道代表不同的单克隆,扩增片段为222bp的单克隆即为os
‑
mir169y的过表达载体pbinglyred3
‑
os
‑
mir169y。
19.图8拟南芥os
‑
mir169y超量表达株系的pcr和荧光定量pcr鉴定结果。pcr鉴定共筛选出4个222bp条带的阳性转化子(a图),其中2个纯合株系的os
‑
mir169y表达量均高于野生型拟南芥col
‑
0和转入空载(ev)的拟南芥(b图)。
20.图9是超量表达os
‑
mir169y拟南芥的菌核病抗性鉴定结果。接种24h后转基因拟南芥叶片上菌斑表现比野生型wt小(a图),测定后超量表达os
‑
mir169y的拟南芥平均菌斑面积显著小于野生型wt(b图),**表示p<0.01。
具体实施方式
21.以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如sambrook等分子克隆实验手册(sambrook j&russell dw,molecular cloning:a laboratory manual,2001),或按照制造厂商说明书建议的条件。
22.实施例1 os
‑
mir169y与核盘菌ssrpl19基因的靶向关系验证
23.靶基因预测
24.使用patmatch_v1.2软件来进行小rna和靶基因的互补配对,再通过程序筛选预测得到最终结果,其筛选的条件需同时满足:小rna与靶基因的靶向互补关系中,最多可允许出现4个错配(g
‑
u配对算0.5个错配);不允许发生连续的错配;小rna的5'端(2~12的位置中)不允许碱基错配;小rna/target的10~11的位置,不允许碱基错配;小rna/target的mirna 5'端1~12位最多允许2.5个错配;小rna/target的mfe(最小自由能)必须大于或等于mirna与靶基因完美结合mfe的60%(图1)。
25.双荧光报告系统载体构建
26.以pgrdl_spb质粒为模板,以t
‑
f/169
‑
l19r、169
‑
l19f/t
‑
r为引物(引物序列t
‑
f:5'
‑
cgccggtgaacttcccgccg
‑
3',t
‑
r:5'
‑
ctggattttggttttaggaat
‑
3',169
‑
l19f:5'
‑
gtcgacccaagccaagaaggctgccctgcagtcgccatgcgg
‑
3',169
‑
l19r:5
’‑
ggcagccttcttggcttgggtcgacaaggaattcttacacgg
‑3’
),分别扩增位于luc基因下游的两个片段,将克隆所得的片段分别命名为片段1、片段2,替换的靶位点序列包含在169
‑
l19f/169
‑
l19r中。扩增出的片段1、片段2胶回收后,按照摩尔比1:1进行混合,以混合物为模板,t
‑
f/t
‑
r为引物进行融合pcr,反应体系为:2μl片段1,2μl片段2,25μl 2
×
taq mix,2μl t
‑
f(10μm),2μl t
‑
r(10μm),17μl dd h2o,反应程序为94℃,5min;94℃,30s;60℃,30s;72℃,1min;30个循环,72℃,5min;16℃,10min。将融合pcr所得产物胶回收,连接t载体。连接产物转化大肠杆菌后,挑取单克隆用t
‑
f/t
‑
r为引物进行菌检并测序,测序比对结果正确的菌液提取质粒后,sal i/spe i双酶切获得含有靶位点的目的片段,同时sal i/spe i双酶切pgrdl_spb质粒获得线性化的载体骨架,将上述载体和目的片段通过t4 dna连接酶连接,连接产物转化大肠杆菌感受态细胞,挑取适当数量的单克隆进行菌检,用于菌检的引物为:t
‑
f/t
‑
r。
27.转化农杆菌感受态
28.挑选一个菌检正确的菌液提取质粒,将该质粒命名为pgrdl_spb_169,所提质粒转化农杆菌感受态细胞。步骤如下:取
‑
80℃保存的gv3101(psoup)农杆菌感受态细胞于冰水浴中融化;无菌条件下,向感受态细胞中加入100ng~1μg质粒dna轻轻混匀,冰水浴中静置5min;将离心管置于液氮中速冻5min;然后快速将离心管置于37℃水浴中保持5min,此过程勿晃动水面;将离心管放回冰水浴中,冰浴5min;无菌条件下加入800μl无抗生素lb液体培养基,于28℃摇床振荡培养2~3小时;5000rpm离心5min收菌体,留100μl左右上清,轻轻吹打重悬菌体,取适量菌液,涂布于相应抗生素的lb平板上,于28℃培养箱中倒置培养过夜。
29.烟草瞬时共表达
30.将带有重组质粒的农杆菌在lb液体培养基中(含kan/rif)28℃,200rpm过夜培养;将培养好的农杆菌液转入50ml无菌离心管中,低温高速离心机4℃,4000rpm离心10min,弃上清;向离心管中加入适量烟草侵染悬浮液并吹打沉淀,使菌体悬浮起来,分光光度计测量od 600=0.6~1.2,0.8最佳,室温放置2h,彻底悬浮菌液;取1000x(x=0.8/所测od值)微升
菌液至2ml离心管中,4000rpm离心10min后弃上清,加入1ml的悬浮液重新悬浮菌体;按照以下四组设计方案:荧光素酶质粒pgrdl_spb菌液+35s空载质粒菌液、质粒pgrdl_spb菌液+35s
‑
mir169y菌液、质粒pgrdl_spb_169菌液+35s空载质粒,质粒pgrdl_spb_169+35s
‑
mir169y质粒,按照前者:后者体积比=1:10混合菌液,终体积1ml;选取生长一个月左右的本氏烟(4~5叶期)进行注射,注射前要充分吸水使其气孔张开,用1ml注射器,以叶脉为界限一片叶子注射两个伤口,1ml打3片叶子并用马克笔圈出侵染部位,每组菌液注射三片叶子;将处理过的烟草做好标记,暗培养12h后放回培养箱正常管理。
31.双荧光素酶活性检测
32.注射菌液2~3天后进行测量,在马克笔圈出的范围内剪取叶片(≤25mg)放入1.5ml离心管中,加入干净的钢珠,放入液氮中冷冻,并用打样机打碎;在震碎的烟草组织中加入100μl 1
×
cell lysis buffer(细胞裂解液)混匀,室温放置5
‑
10min(如果荧光素酶表达水平过低,可适当减少裂解液用量以提高蛋白浓度);12000rpm离心2分钟,吸取20μl上清于2ml离心管中,加入100μl平衡至室温的luciferase substrate迅速混匀,用发光检测仪检测firely luciferase报告基因活性;在以上反应液中加入100μl新鲜配置的renilla底物工作液,迅速混匀后用发光检测仪检测renilla luciferase报告基因活性,renilla luciferase作为校正转染效率的内参,消除孔间细胞数量和转染效率的差异。
33.经patmatch_v1.2软件对os
‑
mir169y与核盘菌ssrpl19基因进行靶向关系预测,两者存在互作关系,os
‑
mir169y和靶基因的互补配对情况见图1。通过双荧光素酶活检测,确认了os
‑
mir169y与核盘菌ssrpl19基因的互作,其结果见图2。进一步,将os
‑
mir169y的成熟序列与已知的mirna序列对比和系统进化树分析,该序列与其他同源mirna差异明显,表明了os
‑
mir169y的特异性(图3)。
34.实施例2 os
‑
mir169y的核盘菌转基因载体pef1
‑
os
‑
mir169y构建
35.人工合成os
‑
mir169y的前体序列(序列如seq id no.2),将生物公司返回的含有该序列的质粒进行ecor v单酶切,另外用ecor v单酶切pef1载体质粒,两者酶切体系均为:2μl ecor v,5μl质粒dna(1000ng/μl),5μl 10x fastdigest buffer,38μl ddh2o,均在pcr仪中37℃孵育1h,酶切产物经1%琼脂糖凝胶电泳分离,切取目的片段大小(os
‑
mir169y前体序列为118bp,pef1载体约为9000bp)的胶块于1.5ml离心管中,用琼脂糖凝胶回收试剂盒进行回收。对线性化pef1载体进行去磷酸化处理,反应体系为:1μl quick cip,5μlbuffer,2μl dna(1000ng/μl),12μl ddh2o。反应条件为37℃,30min;80℃,2min。将上述胶回收获得的前体序列和去磷酸化后的线性化pef1载体通过t4 dna连接酶进行连接,连接体系为:3μl胶回收产物,3μl pef1载体,1μl t4 dna ligase,3μl ddh2o。pcr仪中22℃连接1h。将上述连接产物转化大肠杆菌感受态细胞,挑取适当数量的单克隆于含有对应抗性的lb液体培养基(添加amp,100mg/ml)中,37℃摇床200rpm培养6~8个小时后进行菌液pcr检测,引物为gy2f/gy2r(gy2f:5
’‑
ctggacttcacttttgcctct
‑3’
,gy2r:5
’‑
ctcttggacatatccctctgg
‑3’
),pcr体系为:2μl菌液,12.5μl 2
×
taq mix,2μl gy2 f(10μm),2μl gy2r(10μm),6.5μl ddh2o,反应程序为:94℃,5min;94℃,30s;58℃,30s;72℃,30s;30个循环,72℃,5min;16℃,end。将扩增片段为402bp的克隆菌液进行扩大培养,所得菌液提取质粒,即为os
‑
mir169y的过表达载体pef1
‑
os
‑
mir169y(图4)。
36.实施例3转基因载体pef1
‑
os
‑
mir169y转入核盘菌
37.核盘菌原生质体的制备
38.将核盘菌菌株
‘
1980’接种到铺有玻璃纸的土豆葡萄糖(pda)培养基上培养36h,在超净工作台刮取1~2皿菌丝于100ml pdb培养基中,22℃150rpm摇床震荡培养36h;培养好的菌丝用300目大小的网筛过滤得到菌丝体,用0.8mmgso4洗涤菌丝体两次;将菌丝体挑入酶解液中,30℃150rpm摇床中酶解2~3h,期间抽取1ml酶解液在计数板上观察酶解情况;用灭菌漏斗过滤酶解后的溶液,4000rpm,4℃离心10min,沉淀即为核盘菌原生质体;将上述沉淀用2~5ml 0.8m mgso4溶液清洗两次,4 000rpm,4℃离心10min,弃上清液;原生质体悬浮液吹打悬浮沉淀,分装于1.5ml离心管中,每管100μl;将制备好的核盘菌原生质体保存于
‑
80℃低温冰箱中,备用。
39.peg介导的原生质体转化
40.将载体pef1
‑
os
‑
mir169y质粒单酶切线性化后利用peg介导的原生质体转化的方式转化核盘菌菌株1980,具体步骤如下:质粒单酶切后进行胶回收,向胶回收产物中分别加入2μl亚精胺和2μl肝素钠;将上述混合物加入制备好的100μl原生质体中,冰浴40min;向离心管中加入1ml ptc轻柔混匀,切勿吹打震荡,25℃处理30min;将上述混合液加入配置好的rm底部培养基中(培养基温度不可过高,以手背触摸培养基瓶身不烫手为宜),轻轻晃动培养基,混匀后迅速倒在培养皿中,每皿约20ml左右,于22℃培养箱中倒置培养;培养16h后,重新打开培养皿倒入5ml左右含潮霉素200μg/l的rm顶部培养基,顶部培养基要均匀的覆盖在底部上;22℃培养箱中正置培养约4~5d,即可在在顶部培养基表面长出肉眼可见的菌落。用接种针挑取从顶部培养基表面生长出来的单菌落于含潮霉素(100μg/ml)的pda培养基上,22℃培养箱中倒置暗培养1天。选取在潮霉素(100μg/ml)抗性的pda培养基上生长正常的菌丝转移至新的潮霉素(200μg/ml)抗性的pda培养基中进行筛选,将培养基中潮霉素浓度提高为300μg/ml进行最终的筛选。将经过3次筛选的单菌落进行编号,即获得具有稳定潮霉素抗性的转化子。
41.实施例4 os
‑
mir169y的转基因核盘菌筛选
42.将经过潮霉素抗性筛选的转化子接种到铺有玻璃纸的pda培养基上,22℃培养36h,刮取菌丝于装有钢珠的2ml离心管,立即置于液氮中,采用ctab法提取核盘菌dna,以核盘菌1980为对照,用引物gy2f/gy2r(gy2f:5
’‑
ctggacttcacttttgcctct
‑3’
,gy2r:5
’‑
ctcttggacatatccctctgg
‑3’
)进行pcr扩增,筛选产物为402bp的个体作为阳性转化子。另外,收集菌丝用trnzol法提取其总rna,用北京全式金生物技术有限公司生产的mirna first
‑
strand cdna synthesis supermix进行mirna反转录试剂(加尾法),体系如下:5μl total mirna,1μlmirna rt enzyme mix,10μl 2
×
ts mirna reaction mix,4μl rnase
‑
free water,反应程序为:37℃,1h。反转录cdna后进行荧光定量pcr检测,以ssu6为内参(引物为at
‑
u6f:5
′‑
cgataaaattggaacgatacag
‑3′
;universal mirna
‑
r:5
′‑
gatcgcccttctacgtcgtat
‑3′
),检测转化子中os
‑
mir169y的表达量(引物rt
‑
mir169 f:5
′‑
ggcagtctccttggctaga
‑3′
;universal mirna
‑
r:5
′‑
gatcgcccttctacgtcgtat
‑3′
)。pcr反应程序为:94℃预变性5min;94℃20s,56℃20s,72℃20s,41个循环,接着,采集溶解曲线:将温度调至60℃,90s,预溶解;接着以1.0℃/s速度升温,每升温1℃保温5s,直至95℃。经pcr检测,共筛选出7个402bp大小条带的阳性转化子(图
5a),荧光定量pcr显示7个转化子的os
‑
mir169y表达量均高于野生型菌株(图5b)。
43.实施例5 os
‑
mir169y的转基因核盘菌表型鉴定
44.根据实施例4中荧光定量pcr结果,选取阳性转化子ef1
‑
mir169y
‑
1与ef1
‑
mir169y
‑
2进行后续的表型鉴定。将野生型核盘菌菌株1980(wt)及阳性转化子在普通pda培养基上活化,用直径为6mm的打孔器沿菌丝边缘打孔,将新鲜的菌丝块转移至新的pda培养基中央(20ml/皿),置于22℃霉菌培养箱中培养,每隔12h采用十字交叉法测量其生长直径,取平均值计算生长面积s(按圆形计算,单位cm2)和生长面积变化度d
s
,d
s
(%)=100*(s
转化子
‑
s
wt
)/s
wt
。实验重复5次,每个处理5皿/重复。将上述完成生长速度测定的核盘菌在22℃霉菌培养箱中继续培养,培养10天时观察菌核形成情况。
45.在pda上培养36h的菌丝边缘用6mm打孔器打取菌丝块,在油菜6
‑
9叶期之间,采用离体叶片接种法接种于油菜中双11号的倒三叶,每个菌株每次接种5片叶片,每个叶片接种2个菌丝块,接种后置于22
±
1℃、湿度>85%条件下。接种48h后采用十字交叉法测量菌斑长径a和短径b,采用公式s=π*a*b/4计算叶片发病面积,病斑面积变化度d
s
(%)=100*(s
转化子
‑
s
wt
)/s
wt
。实验重复5次。
46.在pda上培养36h的菌丝边缘用6mm打孔器打取菌丝块,在油菜成熟前2周,采用离体茎秆接种法接种于油菜中双11号茎秆节间平整部位,每个菌株每次接种5个茎秆,每个茎秆上接种3个菌丝块,中间间隔15cm,接种后置于22
±
1℃、湿度>85%条件下,96h后统计菌斑长度l,计算病斑长度变化度d
l
(%)=100*(l
转化子
‑
l
wt
)/l
wt
。实验重复5次。
47.经表型鉴定,培养36h的os
‑
mir169y过表达转化子菌丝生长面积相对于wt减小了48.8%(s
ef1
‑
mir169y
‑1=15.05
±
1.34cm2,s
ef1
‑
mir169y
‑2=16.09
±
2.13cm2,s
wt
=30.42
±
0.71cm2)(p<0.01)(图6a);培养10天后,os
‑
mir169y过表达转化子则尚未形成菌丝团结构(图6b),培养25天后,os
‑
mir169y过表达转化子的菌核体积较小,单粒干重显著小于wt(w
ef1
‑
mir169y
=0.13g,w
wt
=0.17g)(p<0.05)(图6c);致病力检测发现,接种mir169y过表达转化子的病斑面积较wt减小了33.1%(s
oe
‑
mir169y
‑1=2.88
±
0.44cm2,s
oe
‑
mir169y
‑2=2.95
±
0.44cm2,s
wt
=4.36
±
0.72cm2)(p<0.01)(图6d),接种mir169y过表达转化子的病斑长度较wt减小了47.0%(l
oe
‑
mir169y
‑1=2.96
±
0.30cm,l
oe
‑
mir169y
‑2=2.60
±
0.36cm,l
wt
=5.25
±
0.31cm)(p<0.01)(图6e)。综合上述结果,os
‑
mir169y过表达的转基因核盘菌,其菌丝生长速度和致病力显著下降、菌核形成延缓。
48.实施例6 os
‑
mir169y的植物转基因载体pbinglyred3
‑
os
‑
mir169y构建
49.将生物公司返回的含有mir169y前体序列的质粒及pbinglyred3质粒用xba i/xho i双酶切,琼脂糖电泳后胶回收,胶回收产物用t4 dna连接酶连接并转化大肠杆菌,挑取适当数量的单克隆进行菌检,引物组合为qw586f/qw586r(qw586f:5
’‑
cgcacaatcccactatcctt
‑3’
;qw586r:5
’‑
aaaagacaaaagtggggtag
‑3’
),菌检条带为222bp的菌液提取质粒,将该质粒转入农杆菌用于拟南芥遗传转化。其中涉及的双酶切、胶回收、连接、菌检等操作同实施例2。根据上述步骤,本发明将pcr扩增片段为222bp的克隆菌液进行扩大培养,所得菌液提取质粒,即为os
‑
mir169y的过表达载体pbinglyred3
‑
os
‑
mir169y(图7)。
50.实施例7转基因载体pbinglyred3
‑
os
‑
mir169y转入拟南芥
51.将农杆菌菌液在含有kan(50mg/l)rif(25mg/l)、str(25mg/l)的lb液体培养基中
培养,28℃,200rpm过夜培养;将培养好的农杆菌液转入50ml无菌离心管中,低温高速离心机4℃,4000rpm离心10min,弃上清;向离心管中加入适量侵染悬浮液吹打沉淀,使菌体悬浮起来,分光光度计将侵染液od600调节至0.8~1.0;在人工气候培养箱中种植的野生型拟南芥col
‑
0,待盛花期,去掉已经完成受精的荚果后,将拟南芥花序浸泡于侵染液中轻轻晃动30s,取出后将拟南芥用保鲜膜覆盖保湿,暗培养24h后转移至培养箱正常培养,待拟南芥成熟后收获种子。
52.实施例8 os
‑
mir169y的转基因拟南芥筛选
53.将侵染后收获的拟南芥种子用红色激发光照射,挑选呈现红色荧光的种子为t0代,t0代种子种植后单株收获得到t1种子,将每个单株的种子再次进行照射筛选,选出发红色荧光:不发光的种子数量=3:1株系的种植下一代,每个株系种植20株左右,t2代收获的种子中全部发红色荧光的植株即为该株系的纯合植株。
54.取转化的拟南芥和野生型拟南芥(阴性对照)苗期叶片用ctab法粗提dna,并其进行pcr鉴定,所使用引物组合为qw586f/qw586r(qw586f:5
’‑
cgcacaatcccactatcctt
‑3’
;qw586r:5
’‑
aaaagacaaaagtggggtag
‑3’
),具有222bp扩增片段的为转基因阳性植株。
55.取阳性转基因纯合植株幼嫩叶片1
‑
2片装入有钢珠的2ml无rnase的离心管,立即放入液氮,用trnzol法提取总rna,利用加尾法进行mirna反转录,转录步骤同实施例4。反转录合成cdna后进行荧光定量pcr检测,以at
‑
u6为内参(引物为at
‑
u6f:5
′‑
cgataaaattggaacgatacag
‑3′
;universal mirna
‑
r:5
′‑
gatcgcccttctacgtcgtat
‑3′
),检测转基因拟南芥中os
‑
mir169y的表达量(引物为rt
‑
mir169f:5
′‑
ggcagtctccttggctaga
‑3′
;universal mirna
‑
r:5
′‑
gatcgcccttctacgtcgtat
‑3′
),pcr反应程序为同实施例4。
56.经pcr鉴定,共获得4个阳性植株(图8a),目前分离出2个纯和株系(35s
‑
mir169y
‑
1、35s
‑
mir169y
‑
2),荧光定量pcr检测出2个转基因株系的os
‑
mir169y表达量均高于野生型拟南芥col
‑
0(wt),其中35s
‑
mir169y
‑
1中mir169y的表达量为wt的30.88倍、35s
‑
mir169y
‑
2中mir169y表达量为wt的20.65倍(图8b)。
57.实施例9 os
‑
mir169y的转基因拟南芥表型鉴定
58.苗期选取拟南芥生长状态一致的叶片作为接种材料,用直径为2mm的打孔器在核盘菌野生型菌株培养36h的菌丝边缘打取菌丝块,采用活体接种方式,将长有菌丝的一面贴合于拟南芥叶片表面,22℃保湿培养,接种24h后,以接种点为圆心采用十字交叉的方法测量病斑直径大小,计算病斑面积,计算方法同实施例5。实验重复3次,每个株系每次至少接种5苗。
59.对拟南芥的表型鉴定结果发现,接种24h后转基因株系35s
‑
mir169y
‑
1和35s
‑
mir169y
‑
2的发病面积分别为0.52
±
0.15cm2,0.73
±
0.21cm2,显著小于野生型col
‑
0(1.03
±
0.23cm2)(p<0.01),os
‑
mir169y超量表达的转基因株系菌斑面积分别减小了52.5%和32.1%(图9)。
60.虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1