一种分离红树林根际土壤放线菌的培养基及其应用
本发明涉及微生物领域,特别是涉及一种分离红树林根际土壤放线菌的培养基及其应用。
背景技术:
红树林具有丰富的资源,特别是放线菌资源。红树林生长在热带、亚热带海岸的潮间带,其生活环境具有高温、高湿、高盐和营养丰富等特点。独特的海洋环境造就了其各种各样的生态系统,被誉为“海上森林”。
放线菌是一类具开发经济价值天然活性物质的重要微生物资源,海洋放线菌由于特殊的生存环境,通常具有其他普通土壤中分离出的放线菌所不具有的特征。目前,大部分放线菌均是采集陆地的各种土壤中,但是现有技术认为,用常规分离方法从环境样品中获取微生物纯培养物重复性非常高,也很难再分离到新物种。而放线菌可以产生多种具有生物活性的次级代谢产物,而一直备受关注,但是目前用普通的分离方法筛选到的菌株大部分都是已知菌和常见菌,这给当前活性物质的筛选带来了极大的困难。目前国内外对放线菌分离方法的研究主要集中在样品的预处理,抑制剂的选择和培养基成分的改变等方面。而设计多种分离培养基等选择性分离技术对放线菌进行纯培养研究,以期发现新菌种或其他可以产生新颖活性物质的放线菌,初步构建药用放线菌资源库,为后续新颖结构先导化合物的发现奠定基础,是微生物领域长期的研究任务和难点。
技术实现要素:
本发明的目的是提供一种分离红树林根际土壤放线菌的培养基及其应用,以解决上述现有技术存在的问题,填补了国内外针对海洋的特殊环境没有一种培养基适合多种高盐、高湿、高温环境放线菌的培养分离问题,为放线菌资源的开发提供菌种支撑具有广泛的应用价值。
为实现上述目的,本发明提供了如下方案:
本发明提供一种分离红树林根际土壤放线菌的培养基,包括以下组分:葡萄糖,酵母粉,麦芽粉、海带汁、琼脂以及水。
优选的是,所述培养基包括以下重量份的组分:葡萄糖0.4-0.45份,酵母粉0.1-0.45份,麦芽粉0.5-3.8份、海带汁0.1-2.5份、琼脂1.2-1.8份以及水80-100份。
优选的是,所述培养基包括以下重量份的组分:葡萄糖0.4份,酵母粉0.4份,麦芽粉1份、海带汁1份、琼脂1.5份以及水100份。
本发明还提供根据所述的分离红树林根际土壤放线菌的培养基在分离高盐、高湿或高温环境中放线菌中的应用。
本发明还提供根据所述的分离红树林根际土壤放线菌的培养基的制备方法,包括以下步骤:
步骤1:取配方量的酵母粉、葡萄糖、麦芽粉以及琼脂,与水溶解,混合均匀,并调节ph值;
步骤2:按照配方量加入海带汁,分装、密封,然后高温灭菌;
步骤3:降温至45-50℃,倒平板,冷却凝固后密封。
优选的是,步骤1所述ph值为7.2-7.4。
优选的是,步骤2所述高温灭菌的条件为:120℃灭菌20min。
本发明公开了以下技术效果:
现有技术中报道的经典培养基,分离放线菌种类都比较单一,最多也只能分离到6个属13个不同种的放线菌,本发明提供的分离红树林根际土壤放线菌的培养基与现有技术相比,分离放线菌结果为22个属,63个种,适合高温、高湿、高盐的特殊环境放线菌的分离。因此,本发明可以为解决现有技术培养基分离放线菌遇到的“瓶颈”提供解决的方案,并且可以提供新的放线菌菌株以及丰富放线菌菌种的种类和资源库,同时也填补了国内外针对海洋的特殊环境没有一种培养基适合多种高盐、高湿、高温环境放线菌的培养分离问题,为放线菌资源的开发提供菌种支撑具有广泛的应用价值。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
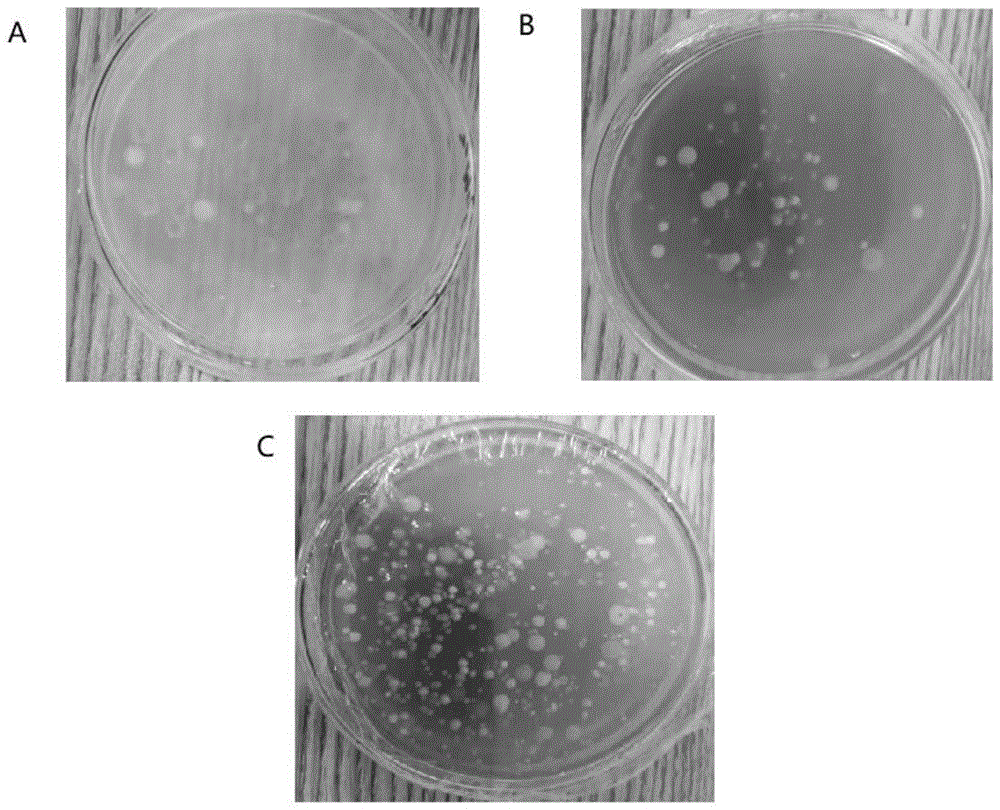
图1为不同培养基培养放线菌的形态;a:未加海带汁的m1培养基;b:加了5ml海带汁的m7培养基;c:加了15ml海带汁的m11培养基;
图2为实施例6构建的系统进化树;a:m1培养基(未加海带汁)分离菌株6个代表性属的系统发育树,注:分支点上的数值表示构建系统发育树1000次分析所得值,标尺0.02进化距离;b:m7培养基(未加海带汁)分离菌株9个代表性属的系统发育树,注:分支点上的数值表示构建系统发育树1000次分析所得值,标尺0.02进化距离;c:m11培养基(加15ml海带汁)分离菌株22个代表性属的系统发育树,注:分支点上的数值表示构建系统发育树1000次分析所得值,标尺0.1进化距离。
具体实施方式
现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本申请说明书和实施例仅是示例性的。
关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
以下实施例所用海带汁的制备方法为:购买华珍海带,准确称取1g海带于100ml蒸馏水中,煮沸30min,冷却后备用。
实施例1分离高盐环境放线菌的培养基的制备
取配方量1g酵母粉、1g葡萄糖、5g麦芽粉以及12g琼脂,加入0ml海带汁,蒸馏水加至1000ml;将配方中各成分混合均匀,调节至7.2-7.4,将培养基分装300ml至锥形瓶500ml中;将分装好的培养基于121℃高压灭菌20分钟后倒平板,冷却凝固后密封,作为分离红树林根际土壤放线菌分离培养基。
实施例2分离高盐环境放线菌的培养基的制备
取配方量葡萄糖2.5g、酵母粉2.5g、麦芽粉5g以及琼脂13g,加入5ml海带汁,蒸馏水加至1000ml;将配方中各成分混合均匀,调节至7.3,将培养基分装300ml至锥形瓶500ml中;将分装好的培养基于121℃高压灭菌20分钟后倒平板,冷却凝固后密封,作为分离红树林根际土壤放线菌分离培养基。
实施例3分离高盐环境放线菌的培养基的制备
取配方量葡萄糖4g,酵母粉4g,麦芽粉10g以及琼脂15g,加入10ml海带汁,蒸馏水加至1000ml;将配方中各成分混合均匀,调节至7.4,将培养基分装300ml至锥形瓶500ml中;将分装好的培养基于121℃高压灭菌20分钟后倒平板,冷却凝固后密封,作为分离红树林根际土壤放线菌分离培养基。
实施例4分离高盐环境放线菌的培养基的制备
取配方量葡萄糖4g、酵母粉3g、麦芽粉25g以及琼脂15g,加入15ml海带汁,蒸馏水加至1000ml;将配方中各成分混合均匀,调节至7.4,将培养基分装300ml至锥形瓶500ml中;将分装好的培养基于121℃高压灭菌20分钟后倒平板,冷却凝固后密封,作为分离红树林根际土壤放线菌分离培养基。
实施例5分离高盐环境放线菌的培养基的制备
取配方量葡萄糖4.5g、酵母粉4.5g、麦芽粉38g以及琼脂18g,加入25ml海带汁。蒸馏水加至1000ml;将配方中各成分混合均匀,调节至7.4,将培养基分装300ml至锥形瓶500ml中;将分装好的培养基于121℃高压灭菌20分钟后倒平板,冷却凝固后密封,作为分离红树林根际土壤放线菌分离培养基。
实施例6分离红树林根际土壤放线菌的培养基的供试土样
红树林根际土壤样品采自位于广东省湛江市的雷州半岛红树林自然保护区。样品采集后立即装入无菌的封口袋并置于车载冰箱。运抵实验室后于4℃保存备用。实验对13份样品进行分离模型的研究。
实施例7从土壤中分离红树林土壤根际放线菌的效果比较
新鲜土样置于无菌平皿中室温条件下自然风干,用无菌研钵研磨成粉面状。称取5g土样于45ml无菌水中溶解,28℃180r/min摇床振荡45min;吸取1ml土壤悬液至9ml无菌水中,各取0.2ml分别涂布于实施例1-5五种分离培养基平板上,置恒温培养箱28℃培养。
(1)菌落的分离与保存
培养2–4周后,根据菌落特征初步排重,挑取单菌落于isp2固体培养基(葡萄糖0.4份,酵母粉0.4份,麦芽粉1份、琼脂1.5份以及水100份)上进行分区划线菌落纯化,直至得到纯培养物。将长势良好的纯化菌株转接至本发明制备的培养基(斜面培养基),置4℃保存;同时用20%甘油作为保护剂–80℃保藏。
结果如图1所示,土壤菌悬液接种到培养基后,在经典报道的isp2培养基种,菌落较少,单一(图1a),但在本发明的分离培养基上(加了5ml和15ml的海带汁),菌落多样,杂菌少(图1b、c)。以上实验说明:本发明能够有效从土壤菌群中分离到多样性的放线菌,是有效的分离红树林土壤放线菌培养基。
(2)分离所得放线菌菌株的初步鉴定
选用放线菌菌株的鉴定方法在现有技术中常见,通过挑取适量纯化好的放线菌菌体,提取基因组,扩增其并送样测序详细过程如下。将测序所得序列在上进行相似性比对,将菌株鉴定到属或种。
具体步骤如下:
i、菌株dna的提取
采用chelex-100法提取基因组dna。用灭菌竹签挑取绿豆大小的纯菌加入到装有50μl5%chelex-100的无菌ep管中,沸水煮15min;待冷却至室温后以12000r/min(离心半径5cm)离心5min,取2μl上清液至另一无菌0.5mlep管备用。
ii、菌株基因序列扩增
以提取的放线菌dna为模板,以细菌通用引物27f和1492r为引物pcr扩增放线菌16srrna基因(登录号:mw724535-mw724623)。
上游引物27f:5′-agagtttgatcmtggctcag-3′;
下游引物1492r:5′-ggttaccttgttacgactt-3′。
反应体系(50μl):2×easytaqsupermix25μl,引物1(27f10μmol/l)1.5μl,引物2(1492r10μmol/l)1.5μl,dna模板2.0μl,无菌水2.0μl。
反应程序:95℃预变性5min,94℃变性1min,55℃退火1min,72℃延伸2min,共30个循环;72℃后延伸10min。
iii、产物的纯化和测序
采用琼脂糖凝胶回收试剂盒纯化菌株扩增产物,由上海生物工程有限公司进行测序。
iv、菌种分离结果以及菌株系统进化分析
结果如表1所示,经典的isp2培养基(表1中m1)仅能分离出6个属13个不同种的放线菌,而添加海带汁之后明显能分离更多种属的放线菌,添加5ml海带汁时,能分离出9个属25个种;添加15ml海带汁时,能分离出23个属63个种。
表1不同培养基分离放线菌的种属结果分析
将测序所得16srrna序列进行ncbi的blast或ezbiocloud对比,从中查找相似性较高且已发表的菌株作为参比。用mega7.0软件进行多序列比对,将生成的文件用邻接法一构建系统进化树。采用bootstrap法,重复1000次取样,分析进化树拓扑结构稳定性。
结果如图2所示,添加海带汁的培养基分离的放线菌种属明显要多于不添加海带汁的培养基分离的放线菌。
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!