一种能特异性识别曲霉属、青霉属和镰刀菌属的引物探针组合及其应用
本发明涉及食品安全生物技术领域,特别涉及一种能特异性识别曲霉属、青霉属和镰刀菌属的引物探针组合及其应用。
背景技术:
随着经济的发展和消费水平的提高,坚果食品正在逐渐成为人们日常消费品,同时消费者对于坚果食品的品质需求也不断提升。然而近年来,市场监管抽查坚果类食品中霉菌超标的现象屡见不鲜,导致了食品工业的经济损失,并给消费者带来了潜在的健康风险。霉菌是丝状真菌的俗称,被霉菌污染的食品中易产生有毒的代谢霉菌毒素,可以引起人体急性或慢性中毒,损害机体的肝脏、肾脏、神经组织、造血组织及皮肤组织等,同时由于其产生孢子的能力,很容易在空气中分散,在食品加工链中的任何时间或阶段出现。其中坚果中常见的霉菌有曲霉属、青霉属和镰刀菌属,如何在生产前期快速检测霉菌成为行业内亟需解决的热点问题。
目前检测霉菌常用的方法为传统培养法和生化检测技术。传统培养法即国标法-gb4789.15-2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》,传统培养法结果准确、但检测周期较长,且操作步骤繁琐,不适合快速、高效检测的需求。生化检测技术即通过霉菌在生长和繁殖的过程中所产生的代谢产物与特定底物之间的特异性反应来进行种类和数量的检测。常用的检测方法有快速测试片法和atp生物发光技术检测法。该类方法操作简单,成本低廉,但检测结果准确性欠佳。
pcr检测具有检测耗时短、灵敏度高、特异性强等优点,但提高其检测结果的准确性和特异性是生物学检测的难点和重点之一。此外,pcr检测无法达到定量,只能停留在定性的阶段。同时检测过程中开盖导致的气溶胶污染会造成检测结果的假阳性。在pcr产物鉴定环节,琼脂糖凝胶电泳所使用的染色剂剧毒,同时制胶的浓度以及时间都会影响最终的检测结果,这对操作人员的技术提出了很高的要求。
技术实现要素:
针对现有技术的不足,本发明提供了一种能特异性识别曲霉属、青霉属和镰刀菌属的引物探针组合及其应用。本发明以曲霉属、青霉属和镰刀菌属为靶标,通过dnaman软件比对序列,oligo7等软件设计通用引物,在确定引物通用性的基础上设计特异性探针进行qpcr试验,得到曲霉属、青霉属和镰刀菌属的扩增曲线及标准曲线,实现坚果中所含曲霉属、青霉属和镰刀菌属的定性和定量检测。
本发明的技术方案如下:
一种能特异性识别曲霉属、青霉属、镰刀菌属的引物探针组合,所述引物为能特异性识别曲霉属、青霉属、镰刀菌属的通用引物,包含上游引物和下游引物,上游引物的核苷酸序列如seqidno.1所示,下游引物的核苷酸序列如seqidno.2所示;所述探针包括曲霉属分子信标探针、青霉属分子信标探针及镰刀菌属分子信标探针。
进一步地,所述曲霉属分子信标探针的核苷酸序列如seqidno.3所示。
进一步地,所述青霉属分子信标探针的核苷酸序列如seqidno.4所示。
进一步地,所述镰刀菌属分子信标探针的核苷酸序列如seqidno.5所示。
进一步地,所述探针的核苷酸序列的5’端标记有荧光识别基团,3’端标记有荧光淬灭基团。
进一步地,所述荧光识别基团为fam、vic、ned中的一种或多种;所述荧光淬灭基团为dabcyl、bhq1、bhq2中的一种或多种。
一种试剂盒,包括所述的引物探针组合。
进一步地,所述试剂盒对曲霉属的检测限为2.5*10-2ng/ml,检测线性范围为2.5*10-2~1.2*102ng/ml;对青霉属的检测限为8.7*10-3ng/ml,检测线性范围为8.7*10-3~93ng/ml;对镰刀菌属的检测限为5.6*10-3ng/ml,检测线性范围为5.6*10-3~110ng/ml。
一种所述试剂盒的应用,所述试剂盒用于同时检测坚果中的曲霉属、青霉属和镰刀菌属。
进一步地,使用所述试剂盒同时检测坚果中的曲霉属、青霉属和镰刀菌属的方法,包括以下步骤:
(1)不同菌属扩增曲线的建立:
分别提取曲霉属、青霉属与镰刀菌属标准样品基因组,加入引物探针组合,配置20μlqpcr体系,设置qpcr程序进行扩增实验,通过检测样品中所含菌属在退火阶段的荧光响应,得到每种菌属的扩增曲线;
(2)曲霉属、青霉属与镰刀菌属标准曲线的建立:
分别配置不同浓度的曲霉属、青霉属与镰刀菌属的标准品基因组,加入引物探针组合,配置20μlqpcr体系,设置qpcr程序进行扩增实验,通过检测不同浓度标准品溶液在退火阶段的荧光响应,分别建立与曲霉属、青霉属及镰刀菌属对应的标准曲线;
(3)坚果中所含曲霉属、青霉属与镰刀菌属的检测:
将坚果样品预处理后,置于液体培养基培养,取培养基中的菌丝液氮破碎,将破碎后的组织,通过试剂盒法提取样品基因组,加入引物探针组合,配置20μlqpcr体系,设置qpcr程序进行扩增实验,通过检测坚果样品在退火阶段的荧光响应,判断所含菌属,通过不同ct值,结合对应的标准曲线计算出坚果中所含曲霉属、青霉属及镰刀菌属基因组浓度。
本发明有益的技术效果在于:
(1)本发明通过在ncbi的基因序列库中比对不同菌属基因序列,在保守位点处设计曲霉属、青霉属和镰刀菌属通用引物,确保其具有检测坚果中常见霉菌的通用性。
(2)本发明通过对坚果中常见的曲霉属、青霉属和镰刀菌属进行不同菌属的分子信标探针设计,确保其具有检测坚果中曲霉属、青霉属和镰刀菌属的特异性。
(3)本发明对坚果中不同菌属进行dna提取、qpcr扩增,实现多重定性、定量分析,操作简便快速,整个检测过程可在数小时内完成。
(4)本发明检测过程中全程不开盖,避免了普通pcr检测开盖导致的气溶胶污染;使用荧光检测代替染色剂,检测过程更加安全。
附图说明
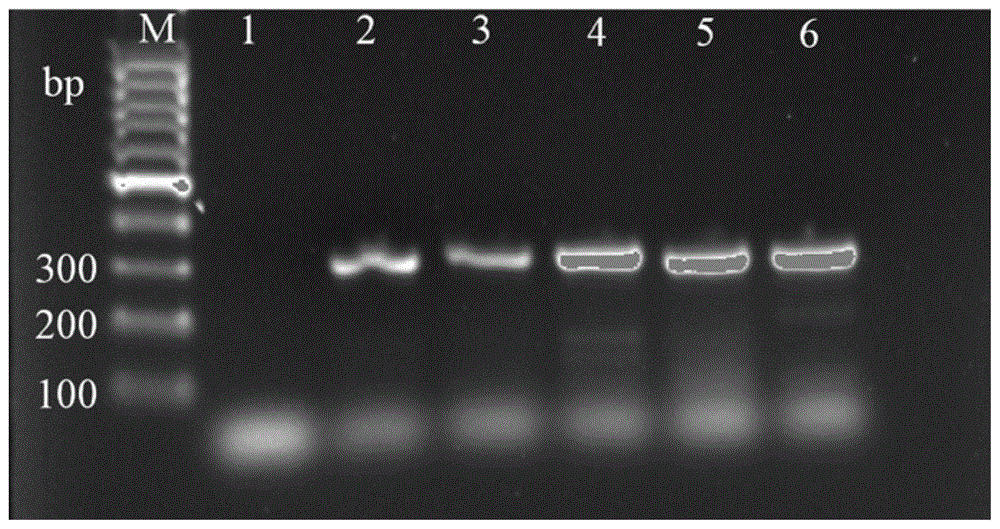
图1为本发明所要检测的霉菌的特异性pcr扩增图。
图中:泳道1为10kbpladdermarker;泳道2为黑曲霉(aspergillusnigercicc2487);泳道3为黄曲霉(aspergillusflavuscicc2219);泳道4为集峰曲霉(aspergillusnomiusaccc32558);泳道5为鲜绿青霉(penicilliumviridicatumcicc4029);泳道6为尖孢镰孢(fusariumoxysporumcicc41029)。
图2为本发明实施例2曲霉属真菌的扩增曲线图。
图3为本发明实施例2青霉属真菌的扩增曲线图。
图4为本发明实施例2镰刀菌属真菌的扩增曲线图。
图5为本发明实施例2曲霉属真菌单重qpcr灵敏度检测及标准曲线。
图6为本发明实施例2青霉属真菌单重qpcr灵敏度检测及标准曲线。
图7为本发明实施例2镰刀菌属真菌单重qpcr灵敏度检测及标准曲线。
图8为本发明实施例3曲霉属真菌多重qpcr灵敏度检测及标准曲线。
图9为本发明实施例3青霉属真菌多重qpcr灵敏度检测及标准曲线。
图10为本发明实施例3镰刀菌属真菌多重qpcr灵敏度检测及标准曲线。
图11为本发明实施例3混合菌属多重qpcr特异性检测图。
图中:a:黑曲霉、鲜绿青霉和尖孢镰孢混合dna;b:集峰曲霉、鲜绿青霉和尖孢镰孢混合dna;c:黄曲霉、鲜绿青霉和尖孢镰孢混合dna;d:黑曲霉、黄曲霉和集峰曲霉混合dna。
图12为本发明实施例4坚果中曲霉属、青霉属和镰刀菌属的检测结果图。
具体实施方式
下面结合附图和实施例,对本发明进行具体描述。
本发明包括但不限于以下实施例,凡在本发明的精神和原则下进行的任何等同替换或者拒不改进,都将视为在本发明的保护范围之内。
下述实施例中,引物和探针是由上海生工生物工程技术服务有限公司合成:
上游引物的核苷酸序列为(如seqidno.1所示):
5’-ggcatcgatagagaacgcagc-3’
下游引物的核苷酸序列为(如seqidno.2所示):
5’-cctacctgactcgaggtcaac-3’
曲霉属分子信标探针的核苷酸序列为(如seqidno.3所示):
5’-cgtccgatcctcaggcgtatggacg-3’
青霉属分子信标探针的核苷酸序列为(如seqidno.4所示):
5’-cgtcagtgtgttggcgcccgtctgacg-3’
镰刀菌属分子信标探针的核苷酸序列为(如seqidno.5所示):
5’-cgtcgccgttaaacccacacttctgacgacg-3’
所述曲霉属、青霉属及镰刀菌属分子信标探针的核苷酸序列的5’端均结合有荧光识别基团,3’端均结合有荧光淬灭基团,所述荧光识别基团为fam、vic、ned中的一种或多种,所述荧光淬灭基团为dabcyl、bhq1、bhq2中的一种或多种。
本发明所用的曲霉属、青霉属及镰刀菌属具体为黑曲霉(aspergillusnigercicc2487)、黄曲霉(aspergillusflavuscicc2219)、鲜绿青霉(penicilliumviridicatumcicc4029)、尖孢镰孢(fusariumoxysporumcicc41029)均购自中国工业微生物菌种保藏管理中心,集峰曲霉(aspergillusnomiusaccc32558)购自中国农业微生物菌种保藏管理中心。
实施例1引物和探针的设计和验证
(1)采用试剂盒法提取上述供试菌株基因组dna,具体方法如下:
取液体培养基中黄曲霉的菌丝,在液氮中将真菌组织研磨粉碎;取不多于50mg磨碎的真菌组织,放入1.5ml微量离心管中;加400μllebuffer和4μl的20mg/mlrnasea,并混合均匀;于65℃温浴30min,期间每隔10min涡旋振荡离心管;加入130μldabuffer,混合均匀后于冰浴中放置5min;于14000xg离心3min;将上清液转移到一个新的1.5ml离心管;加750μl的ebindingbuffer,并混合均匀;将混合液体转移到spincolumn,于6000xg离心1min,并弃去接液管中液体;向spincolumn中加入500μl的gbindingbuffer,于10000xg离心30s,并弃去接液管中液体;spincolumn中加入600μl的washbuffer,于10000xg离心30s,并弃去接液管中液体并重复此步骤一次;再次将spincolumn于10000xg离心1min,并将spincolumn转移至一个新的1.5ml离心管;向spincolumn中加入100μl至200μlelutionbuffer,并于室温温育1min;于12000xg离心1min,并弃去spincolumn,1.5ml离心管中含有黄曲霉dna,于-20℃保存,同理得到黑曲霉、集峰曲霉、鲜绿青霉及尖孢镰孢菌的dna,于-20℃保存。
(2)引物和探针的设计
通过dnaman软件对曲霉属、青霉属及镰刀菌属的its(intemaltranscribedspacer)序列进行比对,寻找曲霉属、青霉属及镰刀菌属共有的保守序列进行通用引物设计。在ncbi数据库中比对相应序列的特异性,通过nupack比对二级结构,调整茎部碱基序列使探针呈现茎环结构,最后比对退火温度使得探针在退火阶段能够先于引物结合到靶标序列上,得到曲霉属、青霉属及镰刀菌属特异性探针。
(3)引物和探针的验证
引物的验证:
pcr反应体系50μl,包括5μl10×pcrbuffer(含mg2+),4μldntp,0.4μltaqdna聚合酶(上海生工生物工程技术服务有限公司),上游引物和下游引物各1μl,步骤(1)提取的曲霉属、青霉属及镰刀菌属的混合dna模板5μl,33.6μl无菌超纯水。扩增程序为:94℃变性5min后进入循环,94℃1min、57℃45s、72℃45s,共30个循环。将2.5μlpcr产物用1%琼脂糖凝胶电泳,经gelred染色后于紫外灯下根据条带大小判定结果。如果能特异性扩增出300bp长度产物,即可判断设计引物可用于相应菌属检测,pcr扩增结果见图1。
探针验证:
qpcr反应体系20μl,包括qpcrprobemix10μl(购自上海碧云天生物技术有限公司),10μm引物各0.6μl和10μm探针0.4μl(由上海生工生物工程技术服务有限公司合成),验证曲霉属时,采用曲霉属探针,验证青霉属时,采用青霉属探针,验证镰刀菌属时,采用镰刀菌属探针,步骤(1)所提取的曲霉属、青霉属及镰刀菌属的混合dna2μl,6.4μl无菌超纯水。扩增程序为:95℃变性3min;95℃15s,60℃退火30s,72℃延伸30s,总共40个循环,在退火阶段检测荧光。
本申请设计的引物和探针的核苷酸序列如下:
上游引物的核苷酸序列为(如seqidno.1所示):
5’-ggcatcgatagagaacgcagc-3’
下游引物的核苷酸序列为(如seqidno.2所示):
5’-cctacctgactcgaggtcaac-3’
曲霉属分子信标探针的核苷酸序列为(如seqidno.3所示):
5’-cgtccgatcctcaggcgtatggacg-3’
青霉属分子信标探针的核苷酸序列为(如seqidno.4所示):
5’-cgtcagtgtgttggcgcccgtctgacg-3’
镰刀菌属分子信标探针的核苷酸序列为(如seqidno.5所示):
5’-cgtcgccgttaaacccacacttctgacgacg-3’
所述曲霉属、青霉属及镰刀菌属分子信标探针的核苷酸序列的5’端均结合有荧光识别基团,3’端均结合有荧光淬灭基团,所述荧光识别基团为fam、vic、ned中的一种或多种,所述荧光淬灭基团为dabcyl、bhq1、bhq2中的一种或多种。
实施例2单重实时qpcr检测
(1)提取基因组
按照实施例1步骤(1)所述的方法分别提取黑曲霉、黄曲霉、集峰曲霉、鲜绿青霉以及尖孢镰孢基因组。所得黑曲霉基因组的浓度为7.2ng/μl;黄曲霉浓度为7.2ng/μl;集峰曲霉基因组浓度为6.9ng/μl;鲜绿青霉基因组浓度为3.3ng/μl;尖孢镰孢菌基因组浓度为14ng/μl。
(2)单重qpcr体系及扩增曲线的建立
曲霉属qpcr体系及扩增曲线的建立:
qpcr反应体系20μl,包括qpcrprobemix10μl(购自上海碧云天生物技术有限公司),10μm引物各0.6μl和10μm曲霉属探针0.4μl(由上海生工生物工程技术服务有限公司合成)组成的引物探针试剂盒,上述5种霉菌混合基因组dna2μl,6.4μl无菌超纯水。
扩增程序为:95℃变性3min;95℃15s,60℃30s,72℃30s,总共40个循环,在退火阶段检测荧光,得到扩增曲线。每次实验做3个平行实验。
检测结果如图2所示,当仅使用曲霉属探针时,只有黑曲霉、黄曲霉和集峰曲霉存在扩增曲线,鲜绿青霉及尖孢镰孢菌没有获得扩增曲线,因此,该单重qpcr体系对曲霉属具有优异的特异性。
青霉属qpcr体系及扩增曲线的建立:
将qpcr体系中的曲霉属探针改为青霉属探针,其他参数同曲霉属qpcr体系,如图3所示,此时仅能得到鲜绿青霉的扩增曲线,因此,该单重qpcr体系对青霉属具有优异的特异性。
镰刀菌属qpcr体系及扩增曲线的建立:
将qpcr体系中的曲霉属探针改为镰刀菌属探针,其他参数同曲霉属qpcr体系,如图4所示,此时仅能得到尖孢镰孢菌的扩增曲线,因此,该单重qpcr体系对镰孢菌属具有优异的特异性。
(3)标准曲线的建立
曲霉属标准曲线的建立:
qpcr反应体系20μl,包括qpcrprobemix10μl(购自上海碧云天生物技术有限公司),10μm引物各0.6μl和10μm曲霉属探针0.4μl(由上海生工生物工程技术服务有限公司合成)组成的引物探针试剂盒,不同浓度的步骤(1)提取的黑曲霉、鲜绿青霉和尖孢镰孢菌混合基因组dna2μl,6.4μl无菌超纯水。所述不同浓度是将步骤(1)提取的黑曲霉、鲜绿青霉和尖孢镰孢菌混合基因组dna的浓度按照10倍梯度稀释得到8个稀释浓度,每个浓度3个平行。
扩增程序为:95℃变性3min;95℃15s,60℃退火30s,72℃30s,总共40个循环,在退火阶段检测荧光,根据浓度与荧光强度建立标准曲线。
所得曲霉属的灵敏度及标准曲线如图5所示,标准曲线为y=-3.25x+20.92,r2=0.9974,扩增效率为e=10-1/k-1=10-1/-3.2501-1=2.031,e%=e*100%=103.1%。在黑曲霉基因组浓度为10-4ng/μl仍能检测阳性,具有很强的检测灵敏度,同时可用于定量分析。
青霉属标准曲线的建立:
将qpcr体系中的曲霉属探针改为青霉属探针,其他参数同曲霉属qpcr体系,按照曲霉属标准曲线的建立方法,进行青霉属标准曲线的建立。
图6为青霉属单重qpcr灵敏度及标准曲线,由图6可知,青霉属的标准曲线为y=-3.45x+25.48,r2=0.9991,扩增效率e%=95.0%,在鲜绿青霉基因组浓度为10-3ng/μl仍能检测阳性,具有很强的检测灵敏度,同时可用于定量分析。镰刀菌属标准曲线的建立:
将qpcr体系中的曲霉属探针改为镰刀菌属探针,其他参数同曲霉属qpcr体系,按照曲霉属标准曲线的建立方法,进行镰刀菌属标准曲线的建立。
图7为镰刀菌属真菌单重qpcr灵敏度及标准曲线,由图7可知,镰刀菌属的标准曲线为y=-3.36x+20.08,r2=0.9932,扩增效率e%=98.4%,在尖孢镰孢基因组浓度为10-4ng/μl仍能检测阳性,具有很强的检测灵敏度,同时可用于定量分析。
实施例3多重实时pcr检测
(1)提取基因组
按照实施例1步骤(1)所述的方法分别提取黑曲霉、黄曲霉、集峰曲霉、鲜绿青霉以及尖孢镰孢基因组。所得黑曲霉基因组的浓度为7.2ng/μl;黄曲霉浓度为7.2ng/μl;集峰曲霉基因组浓度为6.9ng/μl;鲜绿青霉基因组浓度为3.3ng/μl;尖孢镰孢菌基因组浓度为14ng/μl。
(2)多重实时qpcr体系及扩增曲线的建立
qpcr反应体系20μl,包括qpcrprobemix10μl(购自上海碧云天生物技术有限公司),10μm引物各0.6μl和10μm曲霉属探针0.4μl、10μm青霉属探针0.4μl、10μm镰孢菌属探针0.4μl(由上海生工生物工程技术服务有限公司合成)组成的引物探针试剂盒,dna2μl,6.4μl无菌超纯水。其中,dna分别为黑曲霉、鲜绿青霉和尖孢镰孢混合dna;集峰曲霉、鲜绿青霉和尖孢镰孢混合dna;黄曲霉、鲜绿青霉和尖孢镰孢混合dna;黑曲霉、黄曲霉和集峰曲霉混合dna。
扩增程序为:95℃变性3min;95℃15s,60℃退火30s,72℃30s,总共40个循环,在退火阶段检测荧光。
建立的多重qpcr体系能够检测出黑曲霉、鲜绿青霉和尖孢镰孢混合dna;集峰曲霉、鲜绿青霉和尖孢镰孢混合dna;黄曲霉、鲜绿青霉和尖孢镰孢混合dna;黑曲霉、黄曲霉和集峰曲霉混合dna。检测结果如图11所示,当体系中存在多个目标菌属基因组时,能够扩增出各自的目的片段,并产生相应的荧光信号。
(3)标准曲线的建立
qpcr反应体系20μl,包括qpcrprobemix10μl(购自上海碧云天生物技术有限公司),10μm引物各0.6μl和10μm曲霉属探针0.4μl、10μm青霉属探针0.4μl、10μm镰孢菌属探针0.4μl(由上海生工生物工程技术服务有限公司合成)组成的引物探针试剂盒,不同浓度的步骤(1)提取的黑曲霉、鲜绿青霉和尖孢镰孢菌混合基因组dna2μl,6.4μl无菌超纯水。所述不同浓度是将步骤(1)提取的黑曲霉、鲜绿青霉及尖孢镰孢菌混合基因组dna的浓度按照10倍梯度稀释成8个浓度,每个浓度3个平行。
扩增程序为:95℃变性3min;95℃15s,60℃退火30s,72℃30s,总共40个循环,在退火阶段检测荧光。通过检测不同dna浓度菌属在退火阶段的荧光响应,分别建立与曲霉属、青霉属及镰刀菌属对应的标准曲线。
图8为曲霉属真菌多重qpcr灵敏度检测及标准曲线,由图可知,曲霉属标准曲线为y=-3.62x+21.38,r2=0.9937,扩增效率e%=88.9%,x为lg(ng/pcr体系),y为ct值,检测线性范围为2.5×10-2-1.2×102ng/ml。
图9为青霉属真菌多重qpcr灵敏度检测及标准曲线。如图9所示,青霉属检测的标准曲线为y=-3.49x+21.46,r2=0.9922,扩增效率e%=93.5%,x为lg(ng/pcr体系),y为ct值,检测线性范围为8.7×10-3-93ng/ml。
图10为本发明实施例3镰刀菌属真菌多重qpcr灵敏度检测及标准曲线。如图10所示,镰刀菌属检测的标准曲线为y=-3.39x+19.07,r2=0.9949,扩增效率e%=97.1%,x为lg(ng/pcr体系),y为ct值,检测线性范围为5.6×10-3-110ng/ml。
实施例4样品检测
(1)样品处理
取25g样品坚果,加入225ml灭菌水中,振荡10min,取200μl振荡后的溶液加入到100ml马铃薯液体培养基中,28℃培养40h。
(2)样品dna提取
取步骤(1)培养基中的菌丝,按照实施例1步骤(1)的方法提取样品基因组dna。
(3)坚果样品qpcr体系建立及检测
qpcr反应体系20μl,包括qpcrprobemix10μl(购自上海碧云天生物技术有限公司),10μm引物各0.6μl和10μm曲霉属探针0.4μl、10μm青霉属探针0.4μl、10μm镰孢菌属探针0.4μl(由上海生工生物工程技术服务有限公司合成)组成的引物探针试剂盒,步骤(2)提取的基因组dna2μl,6.4μl无菌超纯水。
扩增程序为:95℃变性3min;95℃15s,60℃退火30s,72℃30s,总共40个循环,在退火阶段检测荧光。通过不同ct值,结合对应的标准曲线计算出坚果中所含曲霉属、青霉属及镰刀菌属基因组浓度。检测结果如图12所示,坚果中存在曲霉属和青霉属的扩增条带,显示曲霉和青霉为主要污染菌,坚果中曲霉属含量为8.29ng/μl,青霉属为4.67ng/μl,镰刀菌属未检出。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>江南大学
<120>一种能特异性识别曲霉属、青霉属和镰刀菌属的引物探针组合及其应用
<130>1
<160>5
<170>patentinversion3.3
<210>1
<211>21
<212>dna
<213>上游引物序列
<400>1
ggcatcgatagagaacgcagc21
<210>2
<211>21
<212>dna
<213>下游引物序列
<400>2
cctacctgactcgaggtcaac21
<210>3
<211>25
<212>dna
<213>曲霉属分子信标探针序列
<400>3
cgtccgatcctcaggcgtatggacg25
<210>4
<211>27
<212>dna
<213>青霉属分子信标探针序列
<400>4
cgtcagtgtgttggcgcccgtctgacg27
<210>5
<211>31
<212>dna
<213>镰刀菌属分子信标探针序列
<400>5
cgtcgccgttaaacccacacttctgacgacg31
- 还没有人留言评论。精彩留言会获得点赞!