一种使用谷氨酸棒杆菌生产谷氨酸的方法与流程
1.本技术属于生物发酵工程技术领域,具体涉及一种谷氨酸棒杆菌发酵产酸过程中干扰菌膜形成的处理方法。
背景技术:
2.细胞膜是生物细胞的最重要的、也是最基本结构组成部分之一,作为一种主要由磷脂构成的富有弹性的半透性膜,其主要功能是选择性地交换物质、吸收营养物质、排出代谢物、分泌与运输蛋白质等,而这些功能发挥均与磷脂分子的形成密度具有直接关联性。
3.细胞膜的结构和成分与细胞的功能有很大关系,正常的生理条件下,细胞膜的结构及表面受体、离子通道等维持一定相对稳定的比例和组成。但在受到外界生物、化学、物理等条件刺激后,细胞膜的结构及组成成分会发生明显改变,进而导致各种生理反应的发生。
4.谷氨酸棒杆菌(corynebacterium glutamicum)属于革兰氏阳性细菌,是近几十年来氨基酸发酵工业的一种主要生产菌,生产中应用极为广泛。根据其发酵过程,可分为四个阶段:适应期、对数增长期、平衡期、衰亡期。其发酵过程中,在不同底物、不同浓度情况下,也会导致细胞膜结构、尤其是磷脂的变化和形成有所不同。
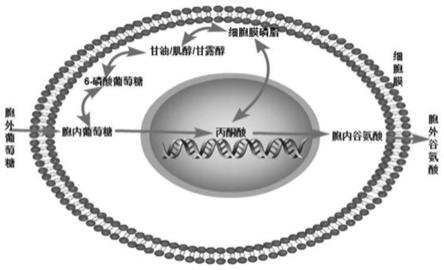
5.已有研究认为,谷氨酸发酵代谢过程中,当胞外葡萄糖浓度超过一定范围时,在向主方向代谢的同时,也代谢产生乳酸、甘油、肌醇、甘露醇等副产物;而甘油、肌醇、甘露醇等副产物,也是形成细胞膜磷脂的主要原料,进而菌膜的形成会阻碍代谢所产谷氨酸向胞外的分泌。
6.基于上述机理,如何尽可能的将原料更为充分的转化为谷氨酸、并使其充分的分泌到胞外,是提高谷氨酸棒杆菌产酸水平的主要的技术改进思路。
7.目前,谷氨酸产生菌主要有二种:生物素缺陷型菌和温度敏感型菌。对于生物素缺陷型来说,关键是控制发酵培养中的生物素亚适量只够菌体生长所需,当发酵液中生物素被耗尽,菌体再繁殖一倍,细胞膜结构就被破坏,谷氨酸能够顺利分泌出来;对于温度敏感型菌来说,长菌阶段控制温度在较低水平(32
‑
34℃),当菌体生长到一定浓度,提高发酵温度。由于该种菌控制细胞膜合成的基因发生突变,对温度敏感,当温度提高后,菌体翻倍后生长停止,细胞膜结构不完整,造成谷氨酸的大量积累。以上两种生产菌株是通过调节生物素和温度,最终促使细胞膜结构不完整,实现谷氨酸的分泌与积累,思路与方法均与本发明有显著的不同。
技术实现要素:
8.基于特定谷氨酸棒杆菌菌株的,本技术目的提供一种生产谷氨酸的谷氨酸棒杆菌菌株。
9.所述谷氨酸棒杆菌菌株,该菌株是谷氨酸棒杆菌(corynebacterium glutamicum)fm19
‑
007菌株,保藏编号为cgmcc no.18678;所述保藏信息可参见中国专利公开号
cn111925953a的专利申请中。
10.本技术另一目的是提供一种利用所述谷氨酸棒杆菌菌株生产谷氨酸的方法。
11.本技术还有一目的是提供所述谷氨酸棒杆菌菌株和七叶灵在生产谷氨酸方面的用途。
12.为达到上述目的,本技术采取如下技术方案:
13.一种生产谷氨酸的方法,包括:在所述的谷氨酸棒杆菌菌株发酵产酸过程中加入七叶灵。
14.其中在发酵产酸的适应期、对数增长期、平衡期、衰亡期中的一个或多个阶段加入七叶灵;优选在衰亡期加入。
15.优选地,相对于发酵液,添加七叶灵的量为0.02
‑
0.15g/ml,更优选0.04
‑
0.12g/ml。
16.所述的生产谷氨酸的方法,还包括下述步骤:制备种子液、制备发酵液。
17.具体地,谷氨酸棒杆菌发酵生产谷氨酸的方法,包括如下步骤:
18.(一)制备种子液
19.取所保藏谷氨酸棒杆菌菌株的菌落,调整菌体量为(1
‑
3)
×
106个/ml,摇床(80
‑
135次/分)振荡培养至od值(波长650mm)达到0.8以上(培养温度为27~32℃,优选为29℃恒温培养);
20.种子培养基组成:
21.种子培养基:初糖(葡萄糖)1
‑
30g/l;硫酸镁0.4g/l;硫酸亚铁0.01g/l;硫酸锰0.01g/l;尿素12g/l;肉松10g/l;豆浓0.8g/l(以全氮计);消泡剂0.0005%;ph值7.3。
22.灭菌:用1000ml的量筒量取500ml培养基装入2000ml灭菌后的三角瓶中,将瓶口包好,放入灭菌锅122℃灭菌25min,冷却后放入洁净工作台备用。
23.种子培养:取菌体量为(1
‑
3)
×
106个/ml接种到上述灭菌冷却后放入三角瓶中,旋转式摇床培养。转速135转/min,温度31.5℃。培养至od值(波长650mm)达到0.8以上(培养温度为27~32℃,优选为29℃恒温培养);时间大约培养10h。
24.以1l种子液为例,29℃条件下发酵至od值0.8,大致需要培养10小时。
25.(二)制备发酵液
26.将步骤(一)中种子液接种到发酵培养基中(接种体积比10%),在28~32℃条件下进行发酵培养(优选30℃恒温发酵),当od值达到1.0以上时,按照不同发酵阶段进行不同处理;
27.具体而言:
28.适应期(从od值1.0开始至4h):调整发酵温度34
‑
35℃;
29.对数增长期(从发酵4h至12h):调整发酵温度35
‑
37℃;
30.平衡期(从发酵12h至24h):调整发酵温度37
‑
38℃;
31.衰亡期(从发酵24h至40h):调整发酵温度39
‑
40℃;
32.发酵过程中,在不同发酵阶段分别添加七叶灵以调节细胞膜相关组成成分含量;
33.所述七叶灵,为6,7
‑
二羟基香豆素的6
‑
β
‑
d
‑
葡糖基衍生物,也叫七叶苷、秦皮甲素,添加浓度为0~0.12g/ml;
34.优选在平衡期或衰亡期添加,添加浓度为0.04~0.12g/ml(优选为0.08g/ml);
35.发酵培养基成分组成:
36.发酵培养基:初糖(葡萄糖):40g/l;kh2po4:3g/l;mgso4:1g/l;feso4:0.02g/l;mnso
4 0.02g/l;tn(豆浓)0.8g/l(以全氮计);ph:7.3+0.05;温度33
‑‑
38.5℃.时间40小时。
37.以1l发酵液为例,30℃条件下发酵至od值1.0约需要培养40小时。
38.优选地,利用细胞活性能作为判定指标:
39.细胞活性能测定(v
a
):发酵液预处理:用可调微量移液器吸取0.5ml发酵液于1.5ml小离心管中,8000r
·
p
·
m高速离心分层,上清液倒出,下层固形物部分(菌体)用于测菌体活性能。把处理过的菌体,加入细胞分析仪专用的稀释液,用微量移液管把样品注入样品槽,仪器自动显示结果。
40.适应期(从v
a
值1.0~2.5):调整发酵温度34
‑
35℃;
41.对数增长期(从v
a
值2.5~8.0):调整发酵温度35
‑
37℃;
42.平衡期(从v
a
值8.0~8.5):调整发酵温度37
‑
38℃;
43.衰亡期(从v
a
值8.5~3.0):调整发酵温度39
‑
40℃;
44.发酵过程中,全程摇床振荡培养(摇床转速150
‑
200次/分),全程控制发酵液ph=6.9~7.2(优选控制在7.1左右)。
45.本发明的机理以及优势:
46.谷氨酸棒杆菌发酵生产的根本目的是把有限的原料尽量都转化为谷氨酸,并分泌到细胞外,进而提高产量。基于发酵产酸的机理,可从两种技术思路进行改进:
47.(1)抑制支路代谢6
‑
磷酸葡萄糖
→
甘油、肌醇、甘露醇等副产物
→‑
细胞膜磷脂,促进向主路代谢丙酮酸
→
胞内氨基酸方向进行;但这种技术思路受限于菌株的生理特性本身影响,因此改进难度较大;
48.(2)谷氨酸发酵过程中,如果胞内谷氨酸浓度太高,反馈抑制情况下,会降低谷氨酸产量,因此,此时如果能够提高细胞膜的通透性,促使胞内谷氨酸及时分泌到细胞外,则可促使谷氨酸代谢路径的稳定进行。
49.(3)基于上述技术思路和对谷氨酸棒杆菌生理代谢的长期研究,发明人创造性的将七叶灵添加到谷氨酸棒杆菌的发酵液中。实际应用结果表明,七叶灵的添加,有效干扰了细胞生长代谢过程中细胞膜磷脂形成所需相关代谢副产物的形成和含量,促使了谷氨酸代谢通路的持久和稳定转化,缓解了发酵产物所引起反馈抑制难题,有效调节了非积累型细胞向积累型细胞转变所需时间,最终明显提高了谷氨酸产量。初步实验结果表明,七叶灵的使用可使谷氨酸产率由现有的14.5%左右提高到22%以上,提升率可达50%左右,表现出较好的改进效果。
附图说明
50.图1为谷氨酸棒杆菌产酸机理示意图;
51.图2为细胞膜完整性观察图。
实施例
52.下面通过实施例对本发明作进一步说明。应该理解的是,本发明实施例所述方法仅仅是用于说明本发明,而不是对本发明的限制,在本发明的构思前提下对本发明制备方
法的简单改进都属于本发明要求保护的范围。除非有特别说明,实施例中用到的所有原料和溶剂均为市售相应纯度产品。
53.实验试剂及材料:
54.七叶灵,纯度≥97%,北京索莱宝科技有限公司
[0055][0056][0057]
实验装置:
[0058]
细胞分析仪cyto analysis 2000北京康普递恩生物工程技术有限公司
[0059]
sba
‑
50型谷氨酸
‑
葡萄糖双功能分析仪山东科学院生物研究所
[0060]
skw
‑
3型华勃氏微量呼吸仪(检压管2500rmb,)上海科技大学机电厂
[0061][0062]
检测方法:
[0063]
(1)谷氨酸含量的测定方法(酶电极法):采用自动分析谷氨酸的生物传感器(sba
‑
50型谷氨酸
‑
葡萄糖双功能分析仪山东科学院生物研究所)进行测定,具体而言:
[0064]
首先,对仪器进行定标,即:用微量进样器准确吸取谷氨酸-葡萄糖混合标准溶液(100mg/100ml)25μl(标准溶液谷氨酸葡萄糖的含量分别为100mg/100ml),吸取后,用滤纸清洁擦去针头外粘附的样液;然后,迅速注入反应池中,待显示打印结果后,按动定标键(calibrate),使仪器显示器两侧的l
‑
谷氨酸和葡萄糖显示值分别为100;重复上述操作,使误差不超过
±
1%;
[0065]
具体测定样品时:待指示灯(inject)亮后,准确吸取稀释好的样液25μl,用滤纸擦去针头外粘附的样液,迅速注入反应池中,20s后,显示器两侧将分别显示出l
‑
谷氨酸和葡萄糖的百分含量,并自动打印结果;测定完成后,冲洗反应池,恢复至零位,以备下次测定使用。
[0066]
(2)细胞膜的提取
[0067]
将细胞悬液(实际测定中,发酵培养液不用稀释)以1000g离心20分钟,弃去上清,保留沉淀;用tris低渗液重悬沉淀,4℃、超声(超声功率1000w、时间30min)破膜;
[0068]
将破膜后的重悬液4℃、1000g离心20分钟,取上清;将上清4℃、10000g离心20分钟,弃去上清保留沉淀,即为细胞膜(可重复此步骤一次);
[0069]
最后,将细胞膜沉淀在labconco冷冻真空干燥器中干燥。
[0070]
(3)细胞膜磷脂组分的高效液相色谱法测定
[0071]
将所获得的干燥细胞膜加入5mltris
‑
hcl缓冲液制成悬浮液;
[0072]
取2ml悬浮液加入1ml chcl3‑
ch3oh(2:1,v:v),振摇1分钟;再加蒸馏水1ml,混匀后3000g离心10分钟;液体分层,取下清液,真空浓缩仪中干燥后
‑
20℃备用;
[0073]
高效液相色谱法测定时(lc
‑
80chromini高效液相色谱仪,上海伍丰科学仪器有限公司),测定参数为:
[0074]
流速1.0ml/min,检测波长205nm,检测灵敏度0.05aufs,柱压3.4mpa;
[0075]
重复测量3次,结果取平均值;
[0076]
测定对象主要为细胞膜的主要组分:pc(磷脂酰胆碱即卵磷脂)、pe(磷脂酰乙醇胺即脑磷脂)、ps(磷脂酰丝氨酸)及pi(磷脂酰肌醇)值。
[0077]
(4)细胞膜的完整性观察:
[0078]
用电子显微镜技术(ts
‑
17扫描电子显微镜,韩国mirero)对细胞膜的纯度及膜结构进行观察、拍照,评估细胞膜的完成性。
[0079]
实施例1:本技术所述谷氨酸棒杆菌菌株fm19
‑
007的制备
[0080]
具体制备过程可参见中国专利公开号为cn111925953a的申请中。
[0081]
实施例2:利用本技术所述谷氨酸菌株生产谷氨酸
[0082]
(一)制备种子液
[0083]
取斜面保藏培养的谷氨酸棒杆菌菌株fm19
‑
007的菌落,调整菌体量为(1
‑
3)
×
106个/ml,制悬液0.2毫升,以此作为一级种子液,摇床转速100次/分,29℃培养至od值达到0.8左右,大约需要9小时左右;
[0084]
(二)制备发酵液
[0085]
将步骤(一)中种子液接种到发酵培养基中,接种比例10%,在30℃条件下进行发酵培养,当od值达到1.0左右时,大约需要1h,按照不同发酵阶段进行不同处理;
[0086]
具体而言:
[0087]
适应期(从od值1.0开始至4h):调整发酵温度34℃;
[0088]
对数增长期(从发酵4h至12h):调整发酵温度36℃;
[0089]
平衡期(从发酵12h至24h):调整发酵温度38℃;
[0090]
衰亡期(从发酵24h至40h):调整发酵温度40℃;
[0091]
发酵过程中,全程摇床振荡培养,摇床转速180次/分,全程控制发酵液ph=7.1左右。
[0092]
发酵过程中,对不同发酵阶段添加不同含量的七叶灵,通过检测细胞膜中相关磷脂组分含量情况以及检测最终产酸情况,评价七叶灵对于细胞膜形成的干扰影响情况。具体结果统计汇总如下。
[0093]
表1谷氨酸发酵过程中七叶灵不同添加时间与添加量对磷脂组成及产酸影响情况
[0094][0095]
备注:
↓
表示产酸率下降;
↑
表示产酸率提高。
[0096]
对上表数据进行分析,可以看出:
[0097]
就七叶灵添加时机而言,从对数增长期开始添加七叶灵,均有利于提高产酸量,但衰亡期添加效果明显最好;
[0098]
而就七叶灵添加量而言,不超过0.08g/ml的用量是较为合适的,过高用量的七叶灵反倒容易阻碍产酸率的进一步提高。
[0099]
结合图2的细胞膜完整度的观察结果,可以看出,在发酵培养基中添加七叶灵,导致形成了磷脂合成不足的不完全的细胞膜,与检测结果是磷脂含量较低相对应;磷脂是形成细胞膜的主要成分,磷脂含量低说明形成的细胞膜不完整;达到控制磷脂细胞膜的形成或阻碍细胞壁正常的生物合成目的,从而有利于谷氨酸向主产物代谢方向进行的目的,最终提高产酸率。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1